Sabrina Bergeron-Wolff1,2,, Pharm.D., M.Sc., Christine Bouffard1,3, Pharm.D., M.Sc.
Reçu le 1er octobre 2014; Accepté après révision par les pairs le 9 mars 2015
Titre : Comparison of pregabalin with pramipexole for restless legs syndrome. N Engl J Med 2014;370:621-311.
Auteurs : Allen RP, Chen C, Garcia-Borreguero D, Polo O, DuBrava S, Miceli J et coll.
Commanditaires : Cette étude a été financée par Pfizer, qui a participé à la rédaction du protocole et de l'article.
Cadre de l’étude : Le syndrome des jambes sans repos, aussi connu sous le nom de la maladie de Willis-Ekbom, est un désordre neurologique commun. Globalement, il toucherait de 5 à 15 % de la population2–4. La population québécoise serait encore plus touchée, avec une prévalence possible de 20 %4. Le syndrome des jambes sans repos toucherait deux fois plus de femmes que d’hommes3,4. Il se caractérise par un besoin irrépressible de bouger les jambes dans certaines situations d’immobilité, principalement la nuit, qui peut être décrit comme une sensation inconfortable ou déplaisante. L’activité peut habituellement soulager cette sensation. Dans environ 20 % des cas, les symptômes peuvent également atteindre d’autres parties du corps, ce qui est généralement le signe d’une maladie plus sévère. La grande majorité des patients vont se plaindre d’un sommeil de mauvaise qualité, parce que les symptômes les empêchent de s’endormir ou les réveillent. La pathophysiologie du syndrome des jambes sans repos n’est pas bien comprise. Elle comprendrait une plus faible concentration de fer, d’où l’utilisation d’un traitement par suppléments de fer, ou une implication du système dopaminergique, en raison de l’efficacité des agonistes dopaminergiques dans le traitement de ce trouble et de l’aggravation possible des symptômes observée avec l’utilisation de neuroleptiques (antagonistes dopaminergiques)2. Les agents dopaminergiques représentent la classe pharmacologique la plus étudiée pour le traitement du syndrome des jambes sans repos. L’American Academy of Sleep Medicine considère les agonistes dopaminergiques, tel que le pramipexole et le ropinirole, comme le standard de traitement pour ce syndrome5. Les principales limites à l’utilisation de ces agents sont le syndrome de dysrégulation dopaminergique (comportements compulsifs ou dépendances) ainsi que le phénomène d’augmentation, caractérisé par une augmentation de l’intensité des symptômes, l’apparition des symptômes plus tôt dans la journée et l’atteinte de nouvelles parties du corps2,3. Ce phénomène paradoxal lié au traitement apparaîtrait habituellement après plusieurs mois de traitement6. La fréquence de ce phénomène pourrait atteindre 33 % après 30 mois de traitement par des agents tels que le pramipexole7. Les gabapentinoïdes, soit la prégabaline et la gabapentine, représentent une nouvelle voie récemment étudiée pour traiter le syndrome des jambes sans repos. Selon une mise à jour des lignes directrices de pratique clinique publiée en 2012 par l’American Academy of Sleep Medicine, la prégabaline est efficace pour traiter les cas modérés à sévères. Cependant, à cette époque, le niveau d’évidence de données probantes était jugé faible5. Les données probantes reposent principalement sur les travaux de deux auteurs. Les résultats d’Allen et coll. suggèrent qu’une dose de 123,9 mg par jour procure 90 % de l’efficacité maximale pour la réduction des symptômes7. En 2010, Garcia-Borreguero et ses collaborateurs ont démontré que la prégabaline à une dose moyenne de 337 mg par jour était efficace pour réduire la sévérité des symptômes, en plus d’améliorer la qualité du sommeil8. L’innocuité à long terme de la prégabaline ainsi que la dose optimale à utiliser restent à déterminer. L’étude présentée dans ce présent article apporte quelques données probantes supplémentaires.
Protocole de recherche : Essai comparatif à double insu et à répartition aléatoire, multicentrique (102 sites aux États-Unis et en Europe), qui s’est déroulé entre décembre 2008 et juin 2011. Il s’agit d’une étude de supériorité de la prégabaline comparativement au placebo en ce qui concerne l’objectif primaire et de non-infériorité pour l’objectif secondaire qui consiste à comparer la prégabaline au pramipexole. Si les résultats démontraient une non-infériorité, une analyse de supériorité était réalisée. Le projet a été approuvé par le comité d’éthique de chaque site.
Patients : Pendant deux ans et demi, l’étude a évalué des adultes d’un âge égal ou supérieur à 18 ans qui étaient atteints d’un syndrome des jambes sans repos de stade modéré à sévère. Tous les patients ont donné leur consentement libre et éclairé. L’étude excluait les personnes atteintes d’une forme de syndrome des jambes sans repos attribuable à d’autres troubles (p. ex. insuffisance rénale chronique [IRC], anémie ferriprive) ou atteints de toute autre maladie cliniquement significative (p. ex. insuffisance cardiaque, hypothyroïdie). À noter que l’étude excluait également les patients qui répondaient au placebo durant la semaine de run-in. De plus, les médicaments pouvant modifier l’architecture du sommeil ou les manifestations nocturnes, tels que les neuroleptiques, les hypnotiques, les sédatifs, les antidépresseurs, les opioïdes et les barbituriques, étaient sevrés avant la répartition aléatoire. Les principaux critères d’inclusion et d’exclusion se retrouvent dans le tableau I.
Tableau I Critères d’admissibilité (liste non exhaustive)1
Interventions : Avant la répartition aléatoire, les patients cessaient de prendre toute médication pour le syndrome des jambes sans repos pendant au moins une semaine ou cinq demi-vies (la période la plus longue des deux). Par la suite, les patients recevaient un placebo pendant une autre semaine en simple insu. Cette période avait pour but d’exclure les patients qui répondaient au placebo. Ensuite, les patients inclus dans l’étude étaient répartis aléatoirement dans l’un des trois bras actifs, pour recevoir soit de la prégabaline à raison de 300 mg par jour (75 mg du jour 1 à 5; 150 mg du jour 6 à 10; puis 300 mg), soit du pramipexole à raison de 0,25 mg par jour (0,125 mg du jour 1 à 5; puis 0,25 mg) soit du pramipexole à raison de 0,5 mg par jour (0,125 mg du jour 1 à 5; 0,25 mg du jour 5 à 10; puis 0,5 mg). Pendant les douze premières semaines, les patients du quatrième bras recevaient un placebo. Après la douzième semaine, les patients du groupe placebo étaient de nouveau répartis aléatoirement dans un des bras thérapeutiques actifs. Cette deuxième phase de l’intervention se déroulait jusqu’à un total de 52 semaines. Les médicaments devaient être pris entre une et trois heures avant le coucher.
Points évalués : Cette étude comportait trois objectifs primaires. Le premier objectif était de comparer la diminution du score mesuré sur l’échelle International Restless Legs Syndrome Study Group Rating Scale (IRLS) entre l’inclusion du patient à l’étude et la semaine 12 dans le groupe prégabaline comparativement au placebo. L’IRLS est une échelle validée5. Le tableau II offre une description de cette échelle.
Tableau II International Restless Legs Syndrome Study Group Rating Scale 9,a
Le deuxième objectif était de comparer la proportion de patients des groupes prégabaline et placebo qui signalaient une amélioration notable ou très notable de leurs symptômes à la semaine 12, selon le score obtenu sur l’échelle Clinical Global Impression of Improvement CGI-I. Cette échelle subjective simple de zéro à sept évalue l’évolution de la maladie comparativement à l’état de référence. Les échelles IRLS et CGI-I sont les mesures d’efficacité les plus utilisées dans les études sur le traitement du syndrome des jambes sans repos. Le troisième objectif était de comparer le nombre de patients présentant une augmentation des symptômes à la semaine 40 ou 52 dans les groupes prégabaline ou pramipexole.
Les objectifs secondaires de l’étude étaient de comparer l’efficacité (diminution du score IRLS) à court terme (12 semaines) et à long terme (40 ou 52 semaines) de la prégabaline et du pramipexole, ainsi que l’innocuité de chaque traitement. Les objectifs secondaires incluaient notamment trois paramètres rapportés par le patient pendant les douze premières semaines : douleur dans les membres (grâce à une échelle analogique de la douleur), qualité de vie avec le syndrome des jambes sans repos (grâce à un questionnaire validé) et sommeil (grâce à un questionnaire subjectif sur le sommeil). L’examen des effets secondaires rapportés et des épreuves de laboratoires anormales a permis d’évaluer l’innocuité de chaque traitement. De plus, à chaque visite, les patients devaient remplir le Columbia Suicide Severity Rating Scale qui permettait de détecter l’apparition d’idéations suicidaires. Selon les calculs de puissance statistique, une taille d’échantillon de 750 patients était nécessaire pour réaliser les tests statistiques prévus pour l’analyse des objectifs primaires et secondaires.
Résultats : Un total de 1 379 personnes ont été abordées, mais seulement 731 répondaient aux critères d’inclusion et ont été réparties aléatoirement. Parmi celles-ci, 719 ont réellement reçu au moins une dose des traitements à l’étude. Ces 719 personnes étaient incluses dans l’analyse en intention de traiter. Les auteurs estiment que les caractéristiques des groupes au début de l’étude étaient similaires (voir tableau III).
Tableau III Caractéristiques des patients au début de l’étude 1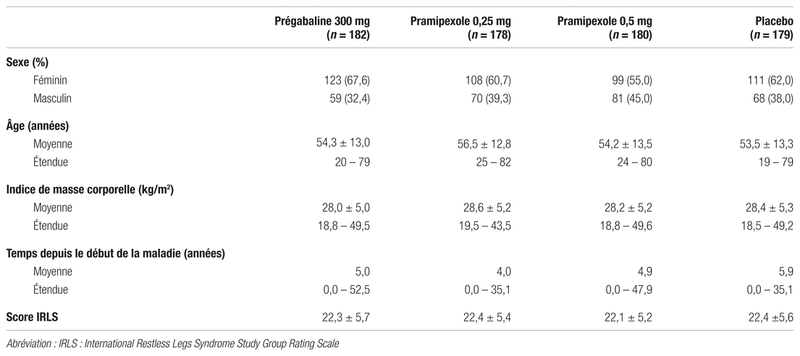
À la fin de la douzième semaine, la réduction du score IRLS était plus importante pour les patients du groupe prégabaline que pour ceux du groupe placebo, avec une différence statistiquement significative de −4,5 points (intervalle de confiance à 95 % [IC 95 %] : −5,9 à 3,2; p<0,001). La proportion de patients qui ont rapporté une amélioration notable ou très notable des symptômes était plus importante dans le groupe prégabaline que dans le groupe placebo (respectivement 71,4 % et 46,8 %; p<0,001). Le tableau IV présente les résultats des mesures de ces deux paramètres d’efficacité pour les quatre bras thérapeutiques. Pour les patients ayant reçu un des traitements actifs pendant toute la durée de l’étude, soit 52 semaines, le phénomène d’augmentation s’observait davantage pour les patients qui avaient reçu le pramipexole (respectivement 6,6 % et 9,0 % dans les groupes pramipexole 0,25 mg et 0,5 mg, par rapport à 1,7 % dans le groupe prégabaline). Le phénomène d’augmentation ne s’est avéré statistiquement significatif que pour la comparaison avec le groupe pramipexole 0,5 mg (p<0,001).
Tableau IV Résultats par rapport aux objectifs primaires et secondaires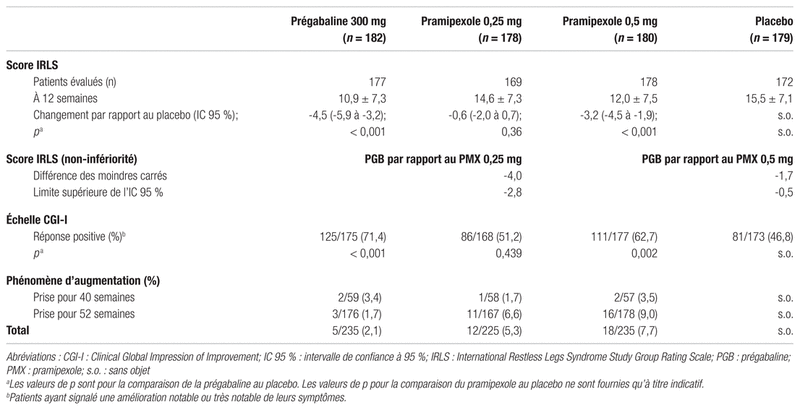
En ce qui concerne l’évaluation de la non-infériorité (voir tableau IV), la réduction du score IRLS à 12 semaines était plus importante avec la prégabaline qu’avec le pramipexole, quelle que soit la dose de ce dernier (0,25 mg ou 0,5 mg). Étant donné que les bornes supérieures des intervalles de confiance sont inférieures à zéro, les auteurs concluent à la supériorité de la prégabaline pour cet objectif. À noter que la non-infériorité pour ce même paramètre a également été observée à 52 semaines.
Les scores obtenus sur les échelles de la douleur et de la qualité de vie se sont améliorés à 12 semaines pour les patients des groupes prégabaline et pramipexole 0,5 mg. En comparant les valeurs obtenues au début de l’étude et à 12 semaines dans les groupes de traitements actifs et le groupe placebo, on note une plus grande amélioration de plusieurs mesures du sommeil avec la prégabaline qu’avec le pramipexole. Ces mesures du sommeil comprennent notamment les éveils nocturnes, la qualité du sommeil et le temps total de sommeil. Toujours par rapport au placebo, les observations montrent une réduction plus marquée du temps de latence du sommeil avec le pramipexole qu’avec la prégabaline.
Le taux d’arrêt du traitement pour cause d’effets secondaires était plus bas dans les groupes pramipexole que dans le groupe prégabaline (18,5 % pour la dose de 0,25 mg et 23,9 % pour la dose de 0,5 mg, par rapport à 27,5 % pour la prégabaline). Les effets secondaires les plus fréquemment rapportés avec la prégabaline étaient les étourdissements (21,4 %), la somnolence (17,6 %), la fatigue (12,6 %) et les céphalées (12,1 %), tandis que ceux les plus fréquemment associés au pramipexole 0,5 mg étaient les céphalées (19,4 %), les nausées (14,4 %) et la fatigue (12,2 %). La majorité (94 %) des effets secondaires rapportés était d’intensité légère à modérée. Onze cas d’idées suicidaires ont été observés, six dans le groupe prégabaline et cinq dans les groupes pramipexole.
Le traitement du syndrome des jambes sans repos repose aussi bien sur des mesures non pharmacologiques que sur la pharmacothérapie. Par contre, l’usage de médicaments semble plus répandu que la mise en route de thérapies physiques ou comportementales5. La prégabaline représente ainsi une solution de rechange intéressante à l’arsenal thérapeutique limité du syndrome des jambes sans repos. Globalement, cette étude d’Allen et coll. présente une bonne validité interne, mais sa validité externe est discutable.
L’étude possède une méthodologie solide et un nombre considérable de patients y a participé, quoique la taille d’échantillon obtenue fût légèrement inférieure à celle calculée pour la puissance statistique. De plus, le choix des mesures d’efficacité était adéquat. En effet, le IRLS et le CGI-I sont les deux outils de mesure les plus utilisés dans les études sur le traitement du syndrome des jambes sans repos. Le choix du comparateur actif est également adéquat, sachant que le pramipexole semble plus efficace que le ropinirole10. Cette étude démontre que la prégabaline est supérieure au placebo pour l’amélioration du score IRLS à 12 semaines et qu’elle est associée à une plus faible augmentation des symptômes que le pramipexole 0,5 mg après 52 semaines.
Les résultats de l’étude laissent entendre que le phénomène d’augmentation des symptômes serait iatrogénique et lié à l’usage des médicaments dopaminergiques, puisqu’il s’observait plus fréquemment dans le groupe pramipexole que dans le groupe prégabaline. Ainsi, ce phénomène ne serait pas uniquement dû à l’évolution naturelle de la maladie. Le phénomène d’augmentation serait également proportionnel à la dose de l’agent dopaminergique ainsi qu’à la durée du traitement.
Le seuil de non-infériorité était établi à trois points sur l’échelle IRLS. Une méta-analyse de 2008 rapportait que la différence de score IRLS entre les agonistes dopaminergiques et le placebo devait être égale ou supérieure à 3,16 pour percevoir un changement clinique10,11. La différence de −4,5 points observée sur l’échelle IRLS entre la prégabaline et le placebo semble donc représenter un gain cliniquement significatif.
Cette étude présente certaines limites. Pour commencer, les raisons des exclusions ne sont pas fournies. Il est donc difficile de juger s’il y a eu une influence quelconque des expérimentateurs ou des cliniciens sur le recrutement. De plus, l’étude n’a pas évalué certains facteurs confondants, comme l’exercice physique dont l’efficacité est pourtant reconnue6. De surcroît, l’étude n’a pas rapporté l’observance du traitement médicamenteux. L’augmentation des doses de prégabaline était également très rapide, avec une dose de départ de 75 mg et l’atteinte de la dose cible de 300 mg à 10 jours. Cela peut expliquer en partie la fréquence des effets secondaires rapportés et le taux élevé d’abandon thérapeutique. En effet, les taux d’arrêt du traitement médicamenteux observés dans cette étude étaient supérieurs à ceux obtenus dans les études de mise en marché, mais les types d’effets secondaires étaient ceux attendus12,13. En outre, l’exclusion des patients qui avaient bien répondu au placebo dans la semaine précédant la répartition aléatoire est discutable, puisque l’effet placebo est très important dans le traitement de cette affection. Une méta-analyse publiée en 2008 montre en effet que le placebo serait associé à un taux de réponse de 40 % et à une diminution du score IRLS de 1,48 points14. Toutefois, cette variable aurait affecté tous les bras de traitement dans le même sens, en supposant que la répartition aléatoire ait bien fonctionné. Malgré tout, l’inclusion d’un bras placebo dans l’étude a permis de considérer la portée de l’effet placebo. Pour terminer, Pfizer, fabricant de la prégabaline, finançait l’étude et a participé à la rédaction du protocole et de l’article.
Malgré les résultats positifs de cette étude, la dose de prégabaline employée est difficilement généralisable à la population souffrant du syndrome des jambes sans repos. En effet, le syndrome des jambes sans repos est souvent associé à une insuffisance rénale ou à une forte urémie, et il affecterait entre 25 et 40 % des patients sous dialyse4,15. Étant donné qu’en pratique, la dose maximale prescrite aux personnes âgées est généralement inférieure à la dose adulte afin de minimiser les effets néfastes de la prégabaline sur le système nerveux central, l’éventail de doses diminue considérablement en cas d’insuffisance rénale associée à un âge avancé16,17. Il est important de noter que cette étude excluait les patients souffrant d’insuffisance rénale chronique et que la population de l’étude avait un âge moyen d’environ 54 ans. Il aurait été intéressant d’inclure dans l’étude la dose de 150 mg de prégabaline, qui avait également fait preuve d’une bonne efficacité dans une étude du même auteur en 20107.
Pour conclure, cette étude a démontré une efficacité statistiquement supérieure et cliniquement significative de la prégabaline par rapport au placebo. Elle a également fait preuve d’une supériorité de la prégabaline face au pramipexole 0,25 mg, mais pas face au pramipexole 0,5 mg. De plus, la prégabaline a été associée à une incidence plus faible du phénomène d’augmentation comparativement au pramipexole. Toutefois, la prégabaline a présenté un plus lourd profil d’effets secondaires, qui n’est pas sans risques. Cette étude met donc en évidence une nouvelle option dans l’arsenal thérapeutique du syndrome des jambes sans repos pour des patients nécessitant une individualisation de la thérapie.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et les collaborateurs. Une autorisation écrite a été obtenue de ces personnes.
1. Allen RP, Chen C, Garcia-Borreguero D, Polo O, DuBrava S, Miceli J et coll. Comparison of pregabalin with pramipexole for restless legs syndrome. N Engl J Med 2014;370:621–31.
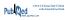
2. Ferini-Strambi L, Marelli S. Pharmacotherapy for restless legs syndrome. Expert Opin Pharmacother 2014;15:1127–38.
3. Rios Romenets S, Postuma RB. Treatment of restless legs syndrome. Curr Treat Options Neurol 2013;15:396–409.
4. Allen RP, Earley CJ. Restless legs syndrome: a review of clinical and pathophysiologic features. J Clin Neurophysiol 2001;18:128–47.
5. Aurora RN, Kristo DA, Bista SR, Rowley JA, Zak RS, Casey KR et coll. Update to the AASM Clinical Practice Guideline: the treatment of restless legs syndrome and periodic limb movement disorder in adults—an update for 2012: practice parameters with an evidence-based systematic review and meta-analyses. Sleep 2012;35:1037–62.
6. Garcia-Borreguero D, Ferini-Strambi L, Kohnen R, O’Keeffe S, Trenkwalder C, Hogl B et coll. European guidelines on management of restless legs syndrome: report of a joint task force by the European federation of neurological societies, the European neurological society and the European sleep research society. Eur J Neurol 2012;19:1385–96.
7. Allen R, Chen C, Soaita A, Wohlberg C, Knapp L, Peterson BT et coll. A randomized, double-blind, 6-week, dose-ranging study of pregabalin in patients with restless legs syndrome. Sleep Med 2010;11:512–9.
8. Garcia-Borreguero D, Larrosa O, Williams AM, Albares J, Pascual M, Palacios JC et coll. Treatment of restless legs syndrome with pregabalin: a double-blind, placebo-controlled study. Neurology 2010;74:1897–904.
9. Walters AS, LeBrocq C, Dhar A, Hening W, Rosen R, Allen RP et coll. International Restless Legs Syndrome Study Group. Validation of the International Restless Legs Syndrome Study Group Rating Scale for restless legs syndrome. Sleep Med 2003;4:121–32.
10. Quilici S, Abrams KR, Nicolas A, Martin M, Petit C, Lleu PL et coll. Meta-analysis of the efficacy and tolerability of pramipexole versus ropinirole in the treatment of restless legs syndrome. Sleep Med 2008;9:715–26.
11. Allen RP. Minimal clinically significant change for the International Restless Legs Syndrome Study Group Rating Scale in clinical trials is a score of 3. Sleep Med 2013;14:1229.
12. Pfizer. Monographie de la prégabaline (Lyrica). Kirkland, Québec. Octobre 2014.
13. Boehringer Ingelheim. Monographie du pramipexole (Mirapex). Burlington, Ontario. Novembre 2012.
14. Fulda S, Wetter TC. Where dopamine meets opioids: a meta-analysis of the placebo effect in restless legs syndrome treatment studies. Brain 2008;131:902–17.
15. Fondation canadienne du rein. Quelques faits au sujet du syndrome des jambes sans repos (SJSR). [en ligne] http://www.kidney.ca/document.doc?id=724 (site visité le 18 juin 2014).
16. Merle L, Laroche ML, Dantoine T, Charmes JP. Predicting and preventing adverse drug reactions in the very old. Drugs Aging 2005;22:375–92.
17. Bressler R, Bahl JJ. Principles of drug therapy for the elderly patient. Mayo Clin Proc 2003;78:1564–77.
PHARMACTUEL, Vol. 48, No. 4, 2015