Stéphanie St-Pierre-Vigneault1,2,3,, Pharm.D., M.Sc., Judith Pilon1,2,4, Pharm.D., M.Sc., Narimen Bouchaala1,2,4, Pharm.D., M.Sc.
1Résidente en pharmacie au moment de la rédaction de l’article, Hôpital Cité de la santé, Laval (Québec) Canada;
2Candidate à la Maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
3Pharmacienne, CSSS les Eskers de l’Abitibi - Hôpital Amos, Amos (Québec) Canada;
4Pharmacienne, CSSS du Sud-Ouest-Verdun - Hôpital Verdun, Verdun (Québec) Canada
Reçu le 14 octobre 2014; Accepté après révision par les pairs le 9 mars 2015
Titre : Effect of vitamin E and memantine on functional decline in Alzheimer’s disease : The TEAM-AD VA cooperative randomized trial. JAMA 2014;311:33-441.
Auteurs : Dysken MW, Sano M, Asthana S, Vertrees JE, Pallaki M, Llorente M et coll.
Commanditaires : Le Veterans Affairs Cooperative Studies Program; l’Institut de Recherche Forest a fourni la mémantine et son placebo; la société DSM Nutritional Products a fourni l’huile de DL-α-tocopheryl acétate (vitamine E synthétique) et les fonds pour acheter l’huile de soja des industries Arista.
Cadre de l’étude : La prise de 2 000 UI/jour de vitamine E, ou alpha-tocophérol, qui est une vitamine liposoluble antioxydante, a démontré un certain avantage à ralentir la progression de la démence de type Alzheimer (DA) des patients atteints d’une démence modérément grave (score de 0 à 17 au Mini-Mental State Examination [MMSE])2. Par contre, une dose de 2 000 UI/jour de vitamine E ne s’est pas montrée supérieure au placebo pour prévenir l’apparition d’une DA pour les patients atteints d’un trouble cognitif léger3.
La mémantine, un antagoniste des récepteurs N-méthyl-D-aspartate (NMDA), a montré son efficacité thérapeutique pour les cas de DA modérée à graves, mais les données actuelles ne permettent pas de recommander son utilisation dans le cas d’une DA légère à modérée4,5. L’étude présentée vise à évaluer l’efficacité et l’innocuité de la vitamine E et de la mémantine, seuls ou en association, pour des patients atteints de DA légère à modérée traités avec un inhibiteur de l’acétylcholinestérase (IAChE).
Protocole de recherche : Il s’agit d’un essai clinique à répartition aléatoire, contrôlé par placebo, multicentrique, à double insu, avec quatre bras parallèles. La répartition aléatoire était stratifiée selon le centre et la répartition se faisait selon un modèle 1:1:1:1. L’étude a été approuvée par le comité d’éthique de chaque centre médical et le comité des droits humains du centre de coordination.
Patients : Les sujets ont été recrutés entre août 2007 et mars 2012 dans 14 centres médicaux américains pour vétérans. Pour être inclus dans l’étude, les patients devaient avoir reçu un diagnostic de DA probable avec un score MMSE situé entre 12 et 26 inclusivement, et prendre un IAChE depuis au moins quatre semaines. Les participants demeuraient à domicile et recevaient l’aide de soignants. L’étude excluait les patients qui souffrent d’une démence non Alzheimer, d’une dépression majeure, d’un délirium ou d’une maladie systémique pouvant interférer avec la participation à l’étude. De même, l’espérance de vie des patients devait excéder un an. Les autres critères d’exclusion étaient la prise de vitamine E ou d’amantadine dans les deux dernières semaines avant le début de l’étude, ou la prise de mémantine dans les quatre dernières semaines avant le début de l’étude.
Interventions : L’étude a réparti les sujets de façon aléatoire dans l’un des quatre groupes suivants : vitamine E et placebo, placebo et mémantine, vitamine E et mémantine, double placebo. La répartition se faisait à l’insu des patients, des soignants et des chercheurs. Les patients recevaient la vitamine E sous forme de DL-α-tocophenyl acétate à raison de 1 000 UI deux fois par jour. La dose de mémantine était titrée sur quatre semaines puis maintenue à une posologie de 10 mg deux fois par jour. Les sujets avec une clairance de la créatinine inférieure à 30 ml/min recevaient une dose de mémantine de 5 mg deux fois par jour. L’étude permettait d’autres dosages de mémantine et de vitamine E selon la tolérance des participants.
Points évalués : L’objectif primaire était une mesure de l’efficacité du traitement selon l’échelle Alzheimer’s disease cooperative study/activities of daily living (ADCS-ADL), qui permet d’évaluer le déclin fonctionnel sur une échelle de 0 à 78 (plus le score est faible, plus l’atteinte est importante).
Les objectifs secondaires d’efficacité étaient les résultats obtenus sur les échelles suivantes : le MMSE, pour évaluer la fonction cognitive et la gravité de la DA; l’ADAS-cog (Alzheimer disease assessment scale – cognitive subscale), pour évaluer les fonctions cognitives (mémoire, langage, praxie); le NPI (12-item neuropsychiatric inventory), pour évaluer les problèmes psychologiques et comportementaux; le CAS (caregiver activity survey), pour évaluer le temps investi par le soignant; la dependence scale, pour évaluer le niveau de dépendance fonctionnelle des sujets.
Les patients et leurs soignants recevaient une visite d’évaluation tous les six mois. En tout, la période de suivi durait entre six mois et quatre ans. Une grande variation dans la période de suivi est observée en raison des pertes au suivi en cours d’étude, notamment en raison du taux de mortalité important dans la population étudiée.
L’innocuité du traitement a été évaluée à chaque visite et les effets indésirables graves ont été codifiés selon le medical dictionary for regulatory activities. Une attention particulière a été portée aux effets indésirables qui avaient été observés lors d’études antérieures utilisant de fortes doses de vitamine E, notamment les chutes, les syncopes et l’insuffisance cardiaque.
Les chercheurs ont questionné les patients et les soignants sur l’observance au traitement et prélevé un échantillon sanguin au cours d’un examen annuel afin de mesurer les concentrations plasmatiques de vitamine E et de mémantine. On considérait que l’observance au traitement était raisonnable lorsque les concentrations sériques augmentaient d’au moins 1,3 fois par rapport à la valeur de base pour la vitamine E et d’au moins 6 μg/dl en valeur absolue pour la mémantine.
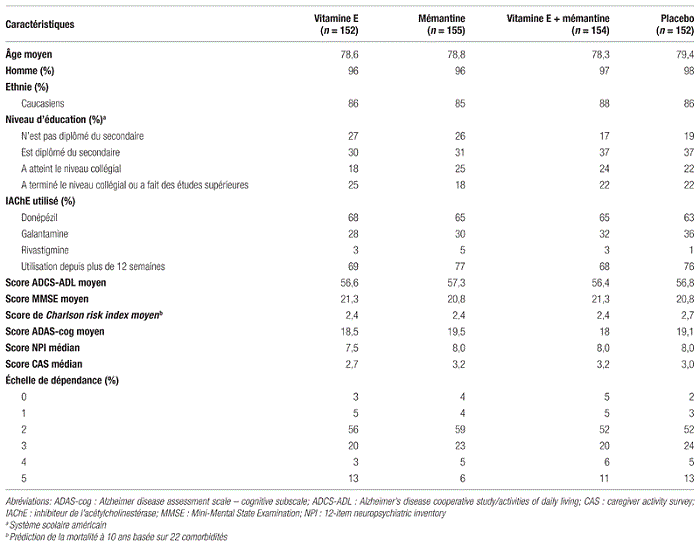
Résultats : Les chercheurs ont réparti de façon aléatoire 613 patients dans les quatre bras de l’étude. Les quatre groupes étaient similaires au début de l’étude. Le tableau I résume les caractéristiques des patients inclus dans l’étude. La grande majorité des patients étaient des hommes caucasiens, âgés en moyenne de 78,8 ans, avec un score ADCS-ADL de 56,8 et un score MMSE de 21,0.
Tableau I Caractéristiques des patients inclus dans l’étude
Aucune donnée de suivi n’a été obtenue pour 52 patients. Le tableau II présente les résultats des 561 patients restants. De plus, parmi les 613 patients inclus dans l’étude, 256 (42 %) ont été perdus au suivi, principalement en raison d’un décès (128) et d’un retrait de consentement (77). Les quatre groupes ont perdu un nombre similaire de patients au suivi.
Tableau II Changement moyen des scores sur les échelles associées aux objectifs primaires et secondaires, par rapport aux valeurs observées au début de l’étude
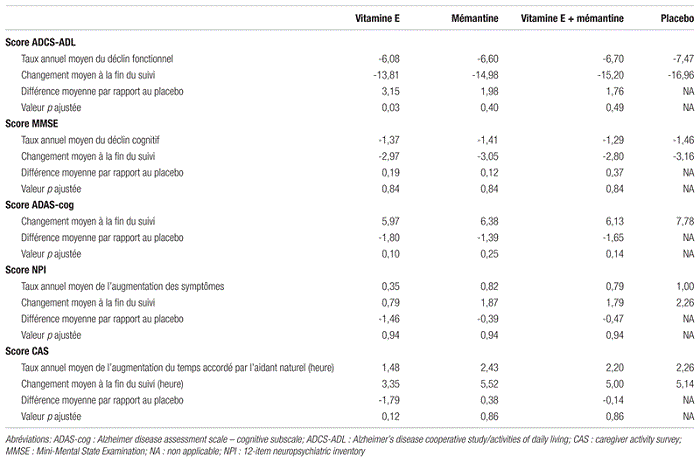
En ce qui concerne l’objectif primaire, seule la vitamine E a permis de réduire la progression de la maladie mesurée selon l’échelle ADCS-ADL, avec une différence statistiquement significative de 3,15 unités (intervalle de confiance [IC] à 95 %:0,92–5,39;p=0,03) par rapport au placebo, ce qui correspond à un délai de progression de 6,2 mois. Même si certains cliniciens considèrent qu’une variation de deux unités est cliniquement significative, aucun consensus n’existe à ce sujet. Aucune autre mesure n’a montré de différence significative après ajustement des analyses. Les résultats ne montrent aucune différence statistiquement significative pour le groupe mémantine et une interaction négative pour l’association de mémantine et de vitamine E.
En ce qui concerne les objectifs secondaires, y compris les mesures cognitives (scores MMSE et ADAS-cog), les analyses ajustées ne révèlent aucune différence significative entre le traitement à la vitamine E ou à la mémantine et le placebo. La comparaison de l’effet de la vitamine E à celui de la mémantine sur le score CAS montre que le nombre quotidien moyen d’heures de soins était inférieur de 2,17 heures dans le groupe prenant de la vitamine E (IC 95 %:0,63–3,71). Cependant, l’étude n’était pas conçue pour comparer la mémantine à la vitamine E.
Les résultats n’ont trouvé aucune différence statistiquement significative entre les groupes sur le plan de l’innocuité. Le nombre de certains effets secondaires graves, comme des chutes, des saignements, une pneumonie et des infections urinaires, était plus grand dans les groupes thérapeutiques que dans le groupe double placebo, mais ces différences n’étaient pas statistiquement significatives.
Les soignants ont estimé que l’observance au traitement était inférieure à 70 % dans tous les groupes. La mesure des concentrations sériques a révélé une observance légèrement supérieure (vitamine E : 82 % pour la monothérapie et 74 % pour les thérapies combinées; mémantine : 70 % aussi bien pour la monothérapie que pour les thérapies combinées).
L’étude est intéressante puisqu’elle évalue un traitement à la mémantine ou à la vitamine E pour des patients atteints d’une DA légère à modérée qui prennent déjà des IAChE. Les résultats peuvent paraître décevants, puisque seule la monothérapie de vitamine E à haute dose a démontré un avantage statistiquement significatif en ce qui concerne la progression des incapacités fonctionnelles telles que mesurées sur l’échelle ADCS-ADL. Cette échelle mesure des capacités fonctionnelles qui peuvent cependant être sensibles à des facteurs autres que la DA, comme l’âge ou les comorbidités. Dans cette étude, les comorbidités des patients sont résumées sous forme de score global (comorbidity disease index) et la nature des comorbidités demeure inconnue, ce qui réduit les retombées des résultats. Les résultats comparant la vitamine E au placebo sur les autres échelles ne sont pas significatifs. En effet la vitamine E avait un effet positif sur l’échelle fonctionnelle, mais cet effet ne s’est pas fait ressentir en ce qui a trait au temps que les aidants accordaient aux soins (évalué à l’aide de l’échelle CAS).
Les résultats de l’étude mettent en évidence un manque d’efficacité de la mémantine. Cette observation est en accord avec les données décrites dans la documentation scientifique, qui précisent que la mémantine offre surtout un avantage aux patients dont la DA est à un stade modéré à grave4,6.
L’association de vitamine E et de mémantine a eu moins d’effet que chacun des agents en monothérapie. Les auteurs n’ont pas réussi à expliquer ce mécanisme d’interaction négative.
L’étude démontre que l’utilisation de fortes doses de vitamine E pour la population en question ne semble pas augmenter le risque de décès toutes causes confondues, contrairement aux résultats d’une méta-analyse7. Ces résultats en matière d’innocuité sont donc rassurants, bien que l’étude n’ait pas été conçue pour démontrer une différence à cet égard.
Cette étude présente certaines forces, comme celle d’être un essai clinique à répartition aléatoire, contrôlé par placebo et à double insu. La durée de suivi est supérieure à celle de plusieurs autres études similaires et plusieurs instruments validés ont servi à mesurer les objectifs. En plus du score MMSE traditionnel, l’étude a également mesuré la capacité fonctionnelle ainsi que le niveau de dépendance des patients par rapport à leurs aidants. Les chercheurs se sont véritablement assurés à conserver le double insu tout au long de l’étude et ils ont pris des mesures pour valider l’observance des participants.
Les limites de l’étude étaient le recrutement, qui s’est avéré plus difficile que prévu, conduisant à une révision du protocole de recherche. Les chercheurs avaient déterminé que la taille d’échantillon devait être de 840 sujets pour obtenir une puissance de 90 % et détecter quatre points de différence sur l’échelle ADCS-ADL sur une période de 2,5 années. En cours d’étude, le nombre de patients a été réduit à 600, avec un prolongement du suivi à trois ans selon les recommandations du comité de surveillance et de suivi. Les raisons justifiant ces changements, outre le recrutement difficile, étaient une perte au suivi plus importante que prévue et une observance sous-optimale (65–68 %). Cependant, le tout est mal décrit. La taille de l’échantillon et la durée de suivi visées n’ont finalement pas été atteintes, ce qui réduit la puissance de l’étude.
De plus, jusqu’à 42 % des sujets n’ont pas complété l’étude, ce qui soulève plusieurs interrogations : les quatre groupes thérapeutiques étaient-ils toujours comparables à la fin de l’étude? Les autres traitements auraient-ils autrement atteint un niveau statistiquement significatif? Cette forte perte au suivi a sans aucun doute influé sur les résultats de l’étude.
La validité externe de l’étude est limitée, car la population analysée était composée majoritairement de vétérans caucasiens et de sexe masculin. L’étude manquait également de détails sur certains critères d’exclusion, comme la définition de « maladie interférant avec la participation à l’étude ». De plus, certains facteurs indépendants ont pu contribuer aux effets positifs observés, comme le suivi téléphonique régulier, la présence d’un soignant pour tous les sujets et l’appui d’une équipe médicale. Ces conditions favorables à l’amélioration sont difficiles à reproduire de manière consistante dans la réalité. Enfin, l’échelle ADCS-ADL est très peu utilisée en pratique et elle est sensible à d’autres comorbidités qui peuvent avoir une influence sur les résultats. Les cliniciens se servent surtout du score MMSE pour faire un choix thérapeutique et en évaluer l’efficacité.
L’étude a mis en évidence un effet positif sur les capacités fonctionnelles, mais les différentes limites de l’étude diminuent les répercussions cliniques de l’essai et ne permettent pas de recommander de façon générale un ajout de vitamine E pour les patients souffrant de DA légère à modérée. Le mécanisme d’action présumé de la vitamine E sur la DA reste imprécis. Une meilleure compréhension du processus neurodégénératif permettra peut-être de concevoir de nouvelles molécules efficaces pour traiter cette maladie.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et collaborateurs pour les commentaires reçus lors de la rédaction de cet article. Une autorisation écrite a été obtenue de ces personnes.
1. Dysken MW, Sano M, Asthana S, Vertrees JE, Pallaki M, Llorente M et coll. Effect of vitamin E and memantine on functional decline in Alzheimer disease: The TEAM-AD VA Cooperative Randomized Trial. JAMA 2014;311:33–44.

2. Sano M, Ernesto C, Thomas RG, Klauber MR, Schafer K, Grundman M et coll. A controlled trial of selegiline, alpha-tocopherol, or both as treatment for Alzheimer’s disease. N Eng J Med 1997;336:1216–22.
3. Petersen RC, Thomas RG, Grundman M, Bennett D, Doody R, Ferris S et coll. Vitamin E and donepezil for the treatment of mild cognitive impairment. N Eng J Med 2005;352:2379–88.
4. Reisberg B, Doody R, Stöffler A, Schmitt F, Ferris S, Möbius HJ. Memantine in moderate-to-severe Alzheimer’s disease. N Eng J Med 2003;348:1333–41.
5. Schneider LS, Dagerman KS, Higgins JPT, McShane R. Lack of evidence for the efficacy of memantine in mild Alzheimer’s disease. Arch Neurol 2011;68:991–8.
6. Moore A, Patterson C, Lee L, Vedel I, Bergman H. Fourth Canadian consensus conference on the diagnosis and treatment of dementia. Can Fam Phys 2014;60:433–8.
7. Miller ER III, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LJ, Guallar E. Meta-analysis: High-dosage vitamin E supplementation may increase all-cause mortality. Ann Intern Med 2005;142:37–46.
PHARMACTUEL, Vol. 48, No. 3, 2015