
Denis Dao1,2,3,, Pharm.D., M.Sc., Zinquon Ngan2,4,5, Pharm.D., M.Sc., Mohammad El-Sakkary2,3,4, B. Pharm, M.Sc., BCOP
1Résident en pharmacie, Centre hospitalier de l’Université de Montréal, Montréal (Québec) Canada;
2Candidat à la Maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
3Pharmacien, Hôpital général Juif Sir Mortimer B. Davis Montréal (Québec) Canada;
4Résident en pharmacie, Centre universitaire de santé McGill, Montréal (Québec) Canada;
5Pharmacien, Centre universitaire de santé McGill Hôpital Royal Victoria (CUSM), Montréal (Québec) Canada
Reçu le 24 octobre 2014; Accepté après révision par les pairs le 8 février 2015
Titre : Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 compared with glycopyrronium and tiotropium (SPARK): a randomised, double-blind, parallel-group study. Lancet Respir Med 2013;1:199-2091.
Auteurs : Wedzicha JA, Decramer M, Ficker JH, Niewoehner DE, Sandström T, Fowler Taylor A et coll.
Commanditaires : Novartis Pharma AG a commandité l’étude et a subventionné les ressources professionnelles de rédaction médicale.
Cadre de l’étude : La maladie pulmonaire obstructive chronique (MPOC) est la quatrième cause de mortalité au Canada2. Selon les nouvelles lignes directrices de la Global Initiative for Chronic Obstructive Lung Disease (GOLD) publiées en 2014, l’association d’un corticostéroïde inhalé (CSI) avec un bêta agoniste à longue durée d’action (BALA) représente l’un des traitements de première intention pour les patients qui ont une MPOC de stade C ou D et au moins deux exacerbations annuelles de la maladie (ou au moins une nécessitant une hospitalisation)3. L’association d’un anticholinergique à longue durée d’action (ACLA) et d’un BALA représente une autre option thérapeutique pour ces mêmes stades. Plusieurs études ont démontré l’efficacité des BALA et des ACLA en monothérapie pour réduire les taux d’exacerbations et améliorer la qualité de vie4,5. L’association de deux bronchodilatateurs à longue durée d’action qui possèdent des mécanismes d’action différents serait plus efficace que l’usage d’un seul pour améliorer la qualité de vie6. Même si l’association d’un BALA avec un ACLA est une pratique courante dans le but d’améliorer la dyspnée et la tolérance à l’effort des patients atteints d’une MPOC, il existe peu de données probantes sur l’efficacité d’une telle association pour diminuer les exacerbations aiguës de la MPOC (EAMPOC). L’objectif de cet essai clinique était de déterminer si l’utilisation d’un dispositif combinant deux bronchodilatateurs à longue durée d’action était supérieure à celle d’un dispositif ne contenant qu’un seul bronchodilatateur à longue durée d’action pour diminuer le nombre d’EAMPOC modérées ou sévères pour les patients atteints d’une MPOC stable sévère ou très sévère (voir tableau I).
Tableau I Sévérité de la MPOC et risque d’EAMPOC selon les critères GOLD

Protocole de recherche : Étude clinique multicentrique à répartition aléatoire, à double insu, avec trois groupes de traitement non contrôlés par placebo : le QVA149 (glycopyrronium et indacatérol), le glycopyrronium et le tiotropium. Le groupe tiotropium ne fonctionnait pas à l’insu des patients et des chercheurs, contrairement aux autres groupes de traitement. La répartition aléatoire a été stratifiée selon le statut tabagique (actuel ou ancien) et l’usage de corticostéroïdes inhalés.
Les auteurs ont déterminé qu’il fallait une taille d’échantillon de 2 198 patients traités pendant une moyenne de 17 mois (3 112 patients-années) pour obtenir une puissance de 84 % à détecter une réduction de 20 % du taux annualisé d’EAMPOC dans le groupe QVA149 comparativement au groupe recevant une monothérapie de glycopyrronium (alpha = 0,05, test bilatéral).
Lors d’une journée de recrutement préliminaire, les chercheurs ont ajusté au besoin la pharmacothérapie de la MPOC. L’usage des CSI se poursuivait durant l’étude. Les BALA, les ACLA et la théophylline étaient supprimés au moins sept jours avant la sélection des participants à l’étude. Ces derniers entraient ensuite dans une période de sélection de 14 jours durant laquelle ils se soumettaient à des tests respiratoires de base. Les patients recevaient un journal de bord électronique qu’ils devaient remplir deux fois par jour afin d’y consigner leurs symptômes et leur usage de bronchodilatateur à courte durée d’action (BACA). Les patients admissibles à l’étude étaient ensuite répartis aléatoirement selon un rapport 1:1:1 pour une durée de traitement de 64 semaines. Une prolongation de la période d’étude à 70 ou 76 semaines a été spécifiée a priori dans le protocole si le nombre d’EAMPOC spécifié au préalable n’était pas atteint; dans ce cas, l’équipe de recherche obtenait un deuxième consentement éclairé du patient.
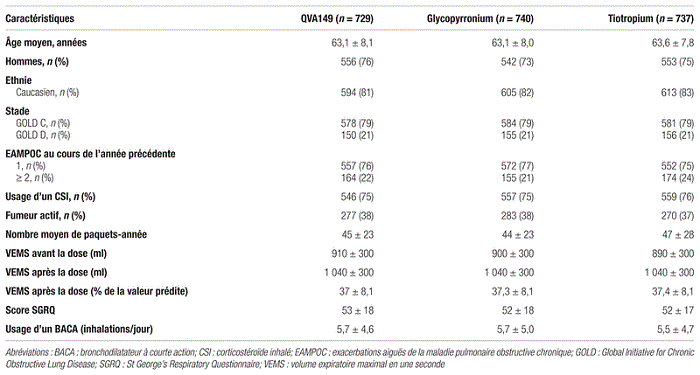
Patients : Pour être inclus dans l’étude, les patients devaient être d’un âgé égal ou supérieur à 40 ans et avoir reçu un diagnostic de MPOC à un stade III ou IV selon les critères GOLD de 2008. De plus, leur volume expiratoire maximal en une seconde (VEMS) après la prise d’un bronchodilatateur devait être inférieur à 50 % de la valeur prédite et leur rapport VEMS/capacité vitale forcée devait être inférieur à 0,70. Au cours des 12 derniers mois, les patients devaient avoir eu au moins un épisode d’EAMPOC ayant nécessité la prise d’un corticostéroïde systémique ou d’un antibiotique. Enfin, les patients devaient être fumeurs ou anciens fumeurs (antécédents d’au moins 10 paquets-années).
L’étude a automatiquement exclu les patients souffrant d’une EAMPOC nécessitant un traitement antibiotique, un corticostéroïde par voie orale ou intraveineuse ou une hospitalisation dans les six semaines précédant la période de recrutement préliminaire ou durant la période de recrutement. Elle a également exclu les patients qui ont présenté un épisode d’EAMPOC durant la période de recrutement (préliminaire ou non) ainsi que ceux qui ont contracté une infection des voies respiratoires dans les quatre semaines précédant la période de recrutement préliminaire. Enfin, l’étude a exclu les patients asthmatiques et ceux ayant besoin d’une utilisation chronique d’oxygénothérapie. Les caractéristiques démographiques des patients sont décrits au tableau II.
Tableau II Caractéristiques démographiques et cliniques des patients inclus dans l’étude
Interventions : Les patients ont été répartis de façon aléatoire dans les trois groupes de traitement suivants : QVA149 (indacatérol 110 ug et glycopyrronium 50 ug), glycopyrronium 50 ug ou tiotropium 18 ug. Tous les traitements étaient administrés une fois par jour le matin, avec l’appareil BreezhalerMD pour les deux premiers groupes et avec l’appareil HandihalerMD pour le groupe tiotropium. Deux fois par jour, les patients devaient remplir leur journal électronique, qui leur demandait d’appeler la clinique en cas de symptômes d’EAMPOC. Un suivi téléphonique des symptômes de MPOC et de l’observance quant à la tenue du journal de bord avait lieu toutes les deux semaines.
Points évalués : L’objectif primaire de cette étude était de démontrer la supériorité du QVA149 par rapport au glycopyrronium pour réduire le taux annualisé d’EAMPOC modérées ou sévères. Le principal objectif secondaire était de démontrer la supériorité de QVA149 par rapport au tiotropium pour réduire le taux annualisé d’EAMPOC modérées ou sévères.
Une exacerbation était définie par les critères d’Anthonisen, à savoir la présence de deux des symptômes majeurs (dyspnée, expectorations purulentes ou augmentation du volume des expectorations) pendant au moins deux jours consécutifs ou la progression d’un symptôme majeur avec un symptôme mineur (mal de gorge, rhume, fièvre sans autre cause, toux, respiration sifflante) pendant au moins deux jours consécutifs7,8.
Sur l’échelle de la sévérité, une EAMPOC était classifiée en légère si elle ne nécessitait pas la prise de corticostéroïdes par voie systémique ou d’antibiotiques; en modérée si elle nécessitait un traitement avec un corticostéroïde par voie systémique et/ou un antibiotique; en sévère si elle nécessitait une hospitalisation ou un séjour au service des urgences pour une durée de plus de 24 heures. Les autres paramètres secondaires de l’étude étaient la qualité de vie (mesurée d’après le score total obtenu au questionnaire St George’s Respiratory Questionnaire [SGRQ]), l’usage de BACA, le VEMS avant la dose de médicament et les effets indésirables. Les patients utilisaient leur journal de bord électronique pour consigner leurs symptômes d’exacerbations et l’utilisation de BACA. Un comité externe passait en revue les EAMPOC et les décès.
Résultats : Au total, 2 224 patients provenant de 362 centres de 27 pays différents ont été répartis de façon aléatoire dans les trois groupes de traitement. En ce qui concerne l’objectif primaire, le taux annualisé d’EAMPOC modérée à sévère était de 0,84 (intervalle de confiance à 95 % [IC 95 %]:0,75–0,94) pour le groupe QVA149 et de 0,95 (IC 95 %:0,85–1,06) pour le groupe glycopyrronium. Le traitement au QVA149 a réduit de 12 % et de façon statistiquement significative le taux annualisé d’EAMPOC modérée à sévère par rapport au traitement au glycopyrronium (rapport de risque [RR]:0,88;IC 95 %:0,77–0,99;p=0,038).
En ce qui concerne l’objectif secondaire principal, le taux annualisé d’EAMPOC était de 0,93 (IC 95 %:0,83–1,04) pour le groupe tiotropium. Le traitement au QVA149 a réduit de 10 % le taux annualisé d’EAMPOC modérée à sévère par rapport au traitement au tiotropium, mais ce résultat n’était pas statistiquement significatif (RR:0,90;IC 95 %:0,79–1,02;p=0,096).
Les résultats obtenus n’ont pas montré de différence statistiquement significative en ce qui concerne la fréquence des effets indésirables dans les trois groupes. Les autres résultats sont présentés dans les tableaux III et IV.
Tableau III Résumé des résultats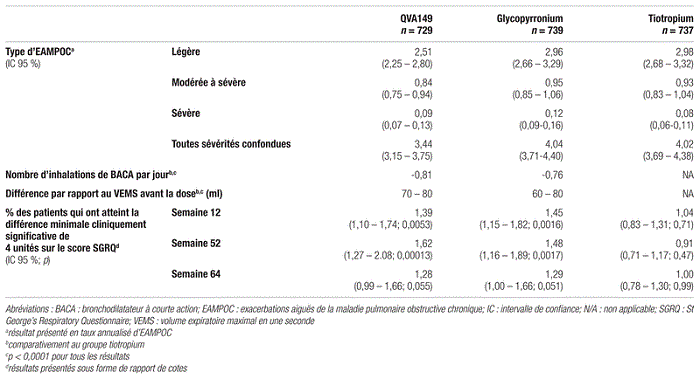
Tableau IV Risque relatif des taux annualisés d’EAMPOC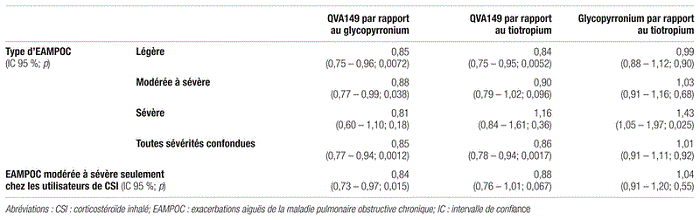
L’étude SPARK démontre que le QVA149, un double BALA, est supérieur au glycopyrronium seul (objectif primaire), mais pas au tiotropium seul (objectif secondaire) en ce qui concerne la réduction du nombre d’exacerbations modérées ou sévères de la MPOC. L’association d’indacatérol et de glycopyrronium dans la formulation du QVA149 réduit le nombre de dispositifs à utiliser. Il faut cependant nuancer les résultats de l’étude. Dans l’étude SPARK, la supériorité du QVA149 par rapport au traitement standard n’est pas convaincante. Pour la réduction des exacerbations modérées ou sévères, le QVA149 n’est pas supérieur au tiotropium. Selon les résultats de l’étude GLOW2 comparant le glycopyrronium, le tiotropium et un placebo, le glycopyrronium et le tiotropium avaient des effets observés comparables15. Cependant, l’étude GLOW2 n’a pas comparé directement le glycopyrronium au tiotropium, et donc l’équivalence d’efficacité ne demeure qu’une extrapolation. L’étude SPARK n’offre pas non plus de comparaison directe, mais les résultats extrapolés suggèrent que le tiotropium serait plus efficace que le glycopyrronium. Ces résultats peuvent également être attribués au fait que le traitement des patients par le tiotropium ne se faisait pas à l’insu, ce qui introduisait donc un biais de classification différentiel, et ces patients n’étaient pas inclus dans l’analyse primaire de l’étude. Même si le QVA149 est plus efficace que le glycopyrronium, il n’est pas plus efficace que le tiotropium, qui est depuis longtemps l’ACLA de choix.
Il est également important de remarquer que même si le QVA149 permet de réduire le nombre d’exacerbations annuelles comparé au glycopyrronium et au tiotropium, il n’améliore pas la qualité de vie des patients au-delà d’un an de façon cliniquement significative. Dans les premiers mois de traitement, une légère amélioration significative de la qualité de vie est observée (augmentation du score SGRQ), mais après 64 semaines de traitement la différence d’amélioration entre les trois groupes thérapeutiques n’est pas statistiquement significative. Il faut souligner que la perte de patients ayant quitté prématurément l’étude a pu influencer les résultats observés à 64 semaines.
L’étude n’a pas fait état de l’observance des traitements. Une étude rétrospective a démontré que l’utilisation d’un seul dispositif améliore l’observance par rapport à l’utilisation de multiples dispositifs16. Étant donné que l’appareil du QVA149 (Ultibro BreezhalerMD) est le même que celui du glycopyrronium et de l’indacatérol, il n’offre aucun avantage d’utilisation aux patients ayant des difficultés à manipuler le dispositif BreezhalerMD. Le dispositif BreezhalerMD est cependant préférable au dispositif HandihalerMD et peut donc être proposé aux patients qui désirent cesser d’utiliser le HandihalerMD16.
Le QVA149 (Ultibro BreezhalerMD) coûte 89 $ au Québec et s’avère donc moins onéreux qu’un achat séparé de chacune de ses composantes (117 $)17. L’Ultibro BreezhalerMD a été ajouté à la section « Médicaments d’exception » de la Liste de médicaments de la Régie de l’assurance maladie du Québec au mois de février 2015.
Malgré ses lacunes, l’étude présente également plusieurs forces. Même si le recrutement était lent, les chercheurs ont réussi à avoir une taille d’échantillon suffisamment grande pour atteindre la puissance désirée pour détecter une différence statistiquement significative. Les groupes étaient comparables au moment du recrutement, mais aucune information sur les populations n’est disponible après les pertes au suivi.
Le QVA149 ne devrait pas être le médicament de premier choix pour les patients atteints d’une MPOC de stade C à D selon les critères GOLD, mais il devrait plutôt être réservé à une population particulière de patients. Par exemple, il représenterait un choix intéressant si on désire combiner un BALA à un ACLA pour traiter une MPOC stable qui ne répond pas bien à un ACLA seul. Puisque le coût de ce médicament combiné est moins élevé que celui des deux agents achetés séparément, l’utilisation du QVA149 permet de réduire le nombre de dispositifs ainsi que le coût du traitement.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique (PHA62102) de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables. Une autorisation écrite a été obtenue de ces personnes.
1. Wedzicha JA, Decramer M, Ficker JH, Niewoehner DE, Sandström T, Taylor AF et coll. Analysis of chronic obstructive pulmonary disease exacerbations with the dual bronchodilator QVA149 compared with glycopyrronium and tiotropium (SPARK): a randomised, double-blind, parallel-group study. Lancet Respir Med 2013;1:199–209.
2. Statistique Canada. Principales causes de décès, population totale, selon le groupe d‘âge et le sexe, Canada. [en ligne] http://www5.statcan.gc.ca/cansim/a26?lang=eng&retrLang=eng&id=1020561&paSer=&pattern=&stByVal=1&p1=1&p2=37&tabMode=dataTable&csid= (site visité le 11 juin 2014).
3. Global initiative for chronic obstructive lung disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease 2014. [en ligne] http://www.goldcopd.org (site visité le 11 juin 2014).
4. Mills EJ, Druyts E, Ghement I, Puhan MA. Pharmacotherapies for chronic pulmonary obstructive pulmonary disease : a multiple treatment comparison meta-analysis. Clin Epidemiol 2011;3:107–29.
5. Rodrigo CJ, Nannini LJ. Tiotropium for the treatment of stable chronic obstructive pulmonary disease: a systematic review with meta-analysis. Pulm Pharmacol Ther 2007;20:495–502.
6. Karner C, Cates CJ. Long-acting beta(2)-agonist in addition to tiotropium versus either tiotropium or long-acting beta(2)-agonist alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012;4:CD008989.

7. Seemungal TA, Donaldson GC, Paul EA, Bestall JC, Jeffries DJ, Wedzicha JA. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998;157:1418–22.
8. Anthonisen NR, Manfreda J, Warren CP, Hershfield ES, Harding GK, Nelson NA. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;106:196–204.
9. Vogelmeier C, Hederer B, Glaab T, Schmidt H, Rutten-van Mölken MP, Beeh KM et coll. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med 2011;364:1093–1103.
10. Tashkin DP, Celli B, Senn S, Burkhart D, Kesten S, Menjoge S et coll. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008;359:1543–54.
11. Aaron SD, Fergusson D, Marks GB, Suissa S, Vandemheen KL, Doucette S et coll. Counting, analysing and reporting exacerbations of COPD in randomised controlled trials. Thorax 2008;63:122–8.
12. Niewoehner DE, Rice K, Cote C, Paulson D, Cooper JA Jr, Korducki L et coll. Prevention of exacerbations of chronic obstructive pulmonary disease with tiotropium, a once-daily inhaled anticholinergic bronchodilator: a randomized trial. Ann Intern Med 2005;143:317–26.
13. Seemungal TA, Donaldson GB, Paul EA, Bestall JC, Jeffries DJ, Wedzicha JA. Effect of exacerbation on quality of life in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 1998;157:1418–22.
14. Jones PW, Quirk FH, Baveystock CM. The St George’s respiratory questionnaire. Respir Med 1991;85(Suppl B):25–31.
15. Kerwin E, Hébert J, Gallagher N, Martin C, Overend T, Alagapan VK et coll. Efficacy and safety of NVA237 versus placebo and tiotropium in patients with COPD: the GLOW2 Study. Eur Respir J 2012;40:1106–1114.
16. Yu AP, Guérin A, Ponce de Leon D, Ramakrishnan K, Wu EQ, Mocarski M et coll. Therapy persistence and adherence in patients with chronic obstructive pulmonary disease: multiple versus single long-acting maintenance inhalers. J Med Econ 2011;14:486–96.
17. Institut national d’excellence en santé et services sociaux. Avis au ministre pour la mise à jour des listes de médicaments. Février 2015. [en ligne] https://www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/F%C3%A9vrier_2015/_AvisMinistre_Innovateurs_WEB_2015_02.pdf (site visité le 8 février 2015).
PHARMACTUEL, Vol. 48, No. 3, 2015