Myrna Abou-Karam1,2,3,, B.Pharm., M.Sc., Corina Mollica1,2,4, Pharm.D., M.Sc., Dariane Racine1,2,5, Pharm.D., M.Sc.
Reçu le 27 octobre 2014; AcceptÃĐ aprÃĻs rÃĐvision par les pairs le 5 juin 2015
Titre : Antimicrobial prophylaxis for children with vesicoureteral reflux. N Engl J Med 2014;370:2367-761.
Auteurs : Hoberman A, Greenfield SP, Mattoo TK, Keren R, Mathews R, Pohl HG et coll. Pour le groupe d'ÃĐtude RIVUR.
Commanditaires : L'ÃĐtude a été commanditÃĐe par le National Institute of Diabetes and Digestive and Kidney Diseases, par le National Institutes of Health ainsi que par le Clinical and Translational Science Awards du National Center for Research Resources.
Cadre de lâÃĐtude : Le reflux vÃĐsico-urÃĐtÃĐral (RVU) se caractÃĐrise par un flot rÃĐtrograde de lâurine de la vessie vers les voies urinaires supÃĐrieures2. Le RVU est frÃĐquemment associÃĐ aux infections urinaires en pÃĐdiatrie. Une mÃĐta-analyse rapporte une prÃĐvalence du RVU dâenviron 30 % chez les enfants avec une infection urinaire3. Le RVU augmenterait le risque quâune infection des voies urinaires basses atteigne les voies urinaires supÃĐrieures, ce qui augmenterait le risque de pyÃĐlonÃĐphrite. Les enfants qui contractent une pyÃĐlonÃĐphrite risquent davantage dâavoir des cicatrices rÃĐnales, et selon lâÃĐtendue de ces derniÃĻres, il pourrait en rÃĐsulter une atteinte permanente de la fonction rÃĐnale4. La gravitÃĐ du RVU est catÃĐgorisÃĐe en cinq grades (I à V), le grade I ÃĐtant lâatteinte la plus lÃĐgÃĻre (reflux dans lâuretÃĻre non dilatÃĐ, sans atteinte du bassinet) tandis que le grade V correspond à lâatteinte la plus importante (dilatation extrÊme de lâuretÃĻre, du bassinet et des calices)5. La rÃĐsolution spontanÃĐe du RVU est frÃĐquente vers lâÃĒge de quatre à cinq ans6. Pour les RVU de grade I et II, les taux de rÃĐsolution spontanÃĐe sont respectivement dâenviron 90 % et 80 % aprÃĻs cinq ans2. Le traitement chirurgical nâest donc envisagÃĐ que dans certains cas. Dans les autres cas, le traitement mÃĐdical est prÃĐconisÃĐ et comprend lâantibioprophylaxie, les mesures dâhygiÃĻne mictionnelle et pÃĐrinÃĐale ainsi que le traitement des troubles associÃĐs (dysfonction vÃĐsicale, constipation)5. Lâobjectif dâune antibioprophylaxie pour les enfants avec un RVU serait de prÃĐvenir lâapparition de cicatrices rÃĐnales en stÃĐrilisant lâurine6. Toutefois, les donnÃĐes probantes qui dÃĐmontreraient lâavantage dâune telle stratÃĐgie sont manquantes, bien que lâantibioprophylaxie soit utilisÃĐe en pratique. En 2011, lâAmerican Academy of Pediatrics a publiÃĐ des lignes directrices contenant une compilation des donnÃĐes sur lâutilisation dâune prophylaxie pour prÃĐvenir les rÃĐcurrences dâinfections urinaires fÃĐbriles et de pyÃĐlonÃĐphrites. Aucun avantage statistiquement significatif de lâantibioprophylaxie nâa pu Être dÃĐmontrÃĐ chez les enfants ÃĒgÃĐs de deux à vingt-quatre mois sans RVU ou avec un RVU de grade I à IV7. Lâutilisation dâune antibioprophylaxie en prÃĐsence dâun RVU est donc un sujet de controverse depuis plusieurs annÃĐes, puisque ses avantages restent thÃĐoriques ÃĐtant donnÃĐ les importantes limites mÃĐthodologiques et les rÃĐsultats variables des ÃĐtudes sur le sujet. Il existe aussi des prÃĐoccupations quant au risque dâinobservance thÃĐrapeutique et au fait que lâantibioprophylaxie puisse favoriser lâÃĐmergence de rÃĐsistances. Cette ÃĐtude ÃĐtait donc attendue pour clarifier le rÃīle de lâantibioprophylaxie chez les enfants avec un RVU6,8,9.
Protocole de recherche : Il sâagit dâun essai multicentrique à rÃĐpartition alÃĐatoire, contrÃīlÃĐ avec groupe placebo, à double insu et comportant un suivi sur deux ans. La rÃĐpartition alÃĐatoire a ÃĐtÃĐ effectuÃĐe en blocs permutÃĐs avec une stratification des sujets selon le site de recrutement. LâÃĐtude sâest dÃĐroulÃĐe dans 19 sites aux Ãtats-Unis. Les auteurs avaient calculÃĐ quâun ÃĐchantillon de 300 enfants dans chaque groupe ÃĐtait nÃĐcessaire pour dÃĐtecter une rÃĐduction des rÃĐcurrences dâinfections urinaires fÃĐbriles ou symptomatiques de 20 % (groupe placebo) à 10 % (groupe trimÃĐthoprime-sulfamÃĐthoxazole [TMP-SMX]) sur deux ans. La puissance de lâÃĐtude ÃĐtait de 80 % et lâerreur alpha associÃĐe ÃĐtait de 0,05.
Patients : Entre juin 2007 et mai 2011, lâÃĐtude a recrutÃĐ des enfants ÃĒgÃĐs de 2 à 71 mois avec un diagnostic de RVU de grade I à IV aprÃĻs un premier ou un deuxiÃĻme ÃĐpisode dâinfection urinaire fÃĐbrile ou symptomatique (infection initiale). Une cystographie mictionnelle a permis de confirmer le diagnostic de RVU pour tous les participants. Tous les parents ou tuteurs ont donnÃĐ leur consentement. Le tableau I prÃĐsente les critÃĻres dâinclusion et dâexclusion de lâÃĐtude.
Tableau IâCritÃĻres dâinclusion et dâexclusion
Interventions : Les sujets ont ÃĐtÃĐ rÃĐpartis de façon alÃĐatoire pour recevoir soit un placebo, soit une suspension de 3 mg/kg de trimÃĐthoprime et 15 mg/kg de sulfamÃĐthoxazole, une fois par jour pendant deux ans. Les deux formulations ÃĐtaient presque identiques sur le plan de la couleur, de lâodeur, du goÃŧt et de la texture. Le suivi se faisait par tÃĐlÃĐphone tous les deux mois pour ÃĐvaluer la prÃĐsence dâeffets indÃĐsirables, lâobservance du traitement et lâÃĐtat de santÃĐ de lâenfant. De plus, tous les six mois pendant deux ans, une visite de suivi permettait de recueillir les informations relatives aux objectifs primaires et secondaires de lâÃĐtude10. Lâanalyse statistique principale ÃĐtait en intention de traiter.
Points ÃĐvaluÃĐs : Lâobjectif primaire ÃĐvaluÃĐ ÃĐtait la rÃĐcurrence dâinfections urinaires fÃĐbriles ou symptomatiques. Les critÃĻres diagnostiques communs des infections urinaires fÃĐbriles et symptomatiques ÃĐtaient la dÃĐtection dâune pyurie par lâanalyse urinaire et la mise en ÃĐvidence dâune infection par un seul microorganisme prouvÃĐe par culture.
Lâinfection urinaire ÃĐtait considÃĐrÃĐe fÃĐbrile lorsque le sujet prÃĐsentait, en plus des deux critÃĻres prÃĐcÃĐdents, une tempÃĐrature corporelle supÃĐrieure ou ÃĐgale à 38 °C. Lâinfection urinaire symptomatique se distinguait par la prÃĐsence de symptÃīmes dans les 24 heures suivant ou prÃĐcÃĐdant le prÃĐlÃĻvement de lâÃĐchantillon dâurine. Les ÃĐchantillons dâurine ÃĐtaient prÃĐlevÃĐs par cathÃĐtÃĐrisme ou aspiration sus-pubienne chez les sujets incontinents. Pour les autres participants, il sâagissait dâun ÃĐchantillon propre dâune miction.
La rÃĐcurrence ÃĐtait dÃĐfinie comme une infection avec un nouveau microorganisme ou comme une infection qui survient soit plus de 14 jours aprÃĻs la fin dâun traitement appropriÃĐ dâune infection urinaire, soit aprÃĻs une culture urinaire nÃĐgative.
LâÃĐtude ÃĐvaluait plusieurs objectifs secondaires. Dâabord, une scintigraphie permettait de dÃĐtecter la prÃĐsence de cicatrices rÃĐnales. Le test ÃĐtait effectuÃĐ au moment de la rÃĐpartition alÃĐatoire, à 12 mois, à 24 mois, ainsi que quatre mois aprÃĻs un ÃĐchec thÃĐrapeutique. Deux pÃĐdiatres spÃĐcialistes en mÃĐdecine nuclÃĐaire ÃĐvaluaient la gravitÃĐ de lâatteinte. Un ÃĐchec thÃĐrapeutique ÃĐtait dÃĐfini comme la survenue de deux rÃĐcurrences dâinfections urinaires fÃĐbriles, dâun total de quatre rÃĐcurrences symptomatiques ou fÃĐbriles, de la prÃĐsence de nouvelles cicatrices rÃĐnales ou de lâaggravation de cicatrices rÃĐnales existantes à la scintigraphie de 12 mois. Des tests de rÃĐsistance de Escherichia coli (E. coli) au TMP-SMX sur des ÃĐcouvillons rectaux ont permis de dÃĐterminer la rÃĐsistance aux antibiotiques au dÃĐbut de lâÃĐtude, à 24 mois et lors dâun ÃĐchec thÃĐrapeutique. Les microorganismes responsables des rÃĐcurrences ont ÃĐgalement fait lâobjet de tests de rÃĐsistance aux antibiotiques. Enfin, lâanalyse des bouteilles du mÃĐdicament à lâÃĐtude retournÃĐes aux investigateurs et les entrevues lors des suivis ont permis dâÃĐvaluer lâobservance du traitement10.
RÃĐsultats : AprÃĻs lâapplication des critÃĻres dâinclusion et dâexclusion, 1 426 sujets ÃĐtaient admissibles à lâÃĐtude, parmi les 10 871 ÃĐvaluÃĐs. Le consentement a ÃĐtÃĐ obtenu pour 607 sujets et ceux-ci ont ÃĐtÃĐ rÃĐpartis alÃĐatoirement comme suit : 302 dans le groupe TMP-SMX et 305 dans le groupe placebo. Soixante-seize participants du groupe TMP-SMX et 91 participants du groupe placebo ont cessÃĐ de prendre le mÃĐdicament à lâÃĐtude, mais lâanalyse a tout de mÊme inclus ces personnes. Le tableau II rÃĐsume les caractÃĐristiques de base des participants. La majoritÃĐ des patients ÃĐtaient inclus à lâÃĐtude aprÃĻs une premiÃĻre infection urinaire et cette derniÃĻre ÃĐtait fÃĐbrile dans 85,8 % des cas. LâÃĒge mÃĐdian ÃĐtait de 12 mois et le sexe fÃĐminin ÃĐtait prÃĐdominant. Les grades II et III ÃĐtaient les grades de RVU les plus frÃĐquents. Quasiment la totalitÃĐ des participants (96,4 %) nâavait aucune cicatrice rÃĐnale au dÃĐbut de lâÃĐtude. Les caractÃĐristiques de la population ÃĐtaient semblables dans les deux groupes. Pour ce qui est de lâobservance du traitement, 76,9 % des parents ont administrÃĐ le mÃĐdicament à lâÃĐtude au moins 75 % du temps et 85,2 % lâont administrÃĐ au moins 50 % du temps. Les auteurs nâont pas trouvÃĐ de diffÃĐrence du taux dâobservance thÃĐrapeutique entre les deux groupes.
Tableau IIâCaractÃĐristiques de la population au dÃĐbut de lâÃĐtudea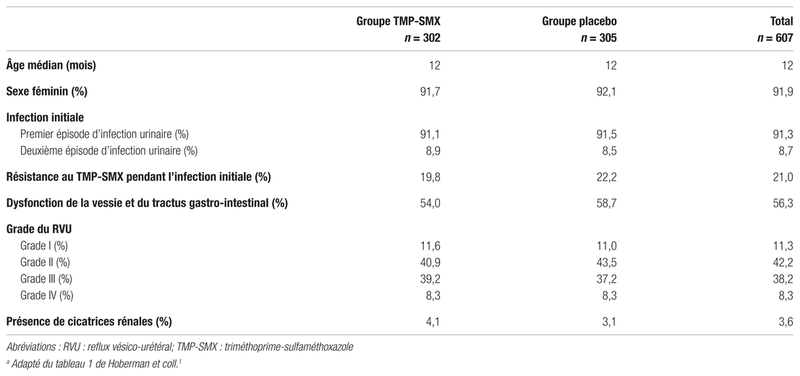
Le tableau III rÃĐsume les rÃĐsultats obtenus. En ce qui concerne lâobjectif primaire, lâanalyse initiale en intention de traiter considÃĐrait que les participants perdus au suivi avaient eu une rÃĐcurrence. Cette analyse a dÃĐmontrÃĐ une diminution statistiquement significative du taux de rÃĐcurrences dans le groupe TMP-SMX par rapport au groupe placebo (25,5 % c. 37.4 %; p=0,002), avec un risque relatif (RR) de 0,68 (intervalle de confiance à 95 % [IC 95 %]:0,53â0,87). Selon cette analyse, le nombre de sujets à traiter (NNT) est de huit (IC 95%:5â16). Une analyse de sensibilitÃĐ en intention de traiter, qui considÃĐrait que les participants perdus au suivi nâavaient pas eu lâÃĐvÃĐnement, a ÃĐgalement dÃĐmontrÃĐ une diminution statistiquement significative du nombre de rÃĐcurrences dans le groupe prophylaxie comparativement au groupe placebo (RR=0,55; IC 95 %:0,38â0,78; NNT=8). La deuxiÃĻme analyse de sensibilitÃĐ, une analyse per protocole qui excluait les participants perdus au suivi, a ÃĐgalement montrÃĐ un plus faible pourcentage de rÃĐcurrences pour le groupe TMP-SMX que pour le groupe placebo (RR=0,54; IC 95 %:0,38â0,77; NNT=8). Les auteurs concluent que la prophylaxie diminue le risque de rÃĐcurrences de 50 % (rapport de risque instantanÃĐ de 0,5; IC 95 %:0,34â0,74). Ils rapportent aussi que le dÃĐlai entre lâentrÃĐe des participants dans lâÃĐtude et un taux de frÃĐquence de 10 % de rÃĐcurrences ÃĐtait de 336 jours pour le groupe TMP-SMX comparativement à 106 jours pour le groupe placebo.
Tableau IIIâPrincipaux rÃĐsultatsa
Les chercheurs ont ÃĐgalement effectuÃĐ plusieurs analyses de sous-groupes pour ÃĐtudier le risque de rÃĐcurrences. Selon les rÃĐsultats de ces analyses, la prophylaxie bÃĐnÃĐficiait davantage aux enfants ayant eu une infection initiale fÃĐbrile quâà ceux ayant eu une infection initiale symptomatique (p=0,04), ainsi quâaux enfants qui avaient une dysfonction de la vessie et du tractus gastro-intestinal au moment de leur inclusion dans lâÃĐtude (p=0,02).
Aucune diffÃĐrence significative nâa ÃĐtÃĐ observÃĐe entre les groupes en ce qui concerne lâincidence des cicatrices rÃĐnales (p=0,55), des cicatrices rÃĐnales graves (p=0,37) et des nouvelles cicatrices (p=0,94). La proportion de sujets ayant subi un ÃĐchec thÃĐrapeutique dans le groupe placebo ÃĐtait presque le double de celle observÃĐe dans le groupe prophylaxie (p=0,035; NNT=23). La proportion de sujets dont la premiÃĻre rÃĐcurrence dâinfection urinaire ÃĐtait associÃĐe à la prÃĐsence dâun microorganisme rÃĐsistant ÃĐtait plus importante dans le groupe TMP-SMX que dans le groupe placebo. Le microorganisme rÃĐsistant le plus frÃĐquemment identifiÃĐ lors dâune premiÃĻre rÃĐcurrence ÃĐtait E. coli (19 des 26 infections avec un microorganisme rÃĐsistant dans le groupe TMP-SMX et 11 des 17 infections avec un microorganisme rÃĐsistant dans le groupe placebo). Le taux de rÃĐsistance de E. coli lors dâune premiÃĻre rÃĐcurrence ÃĐtait significativement plus ÃĐlevÃĐ dans le groupe TMP-SMX.
En ce qui concerne les effets indÃĐsirables, lâÃĐtude nâa relevÃĐ aucune diffÃĐrence significative entre les groupes. Le pourcentage dâhospitalisation ou de visites au service des urgences nâÃĐtait pas significativement diffÃĐrent entre les deux groupes.
Â
LâÃĐtude RIVUR est la premiÃĻre ÃĐtude à rÃĐpartition alÃĐatoire contrÃīlÃĐe par placebo, à double insu, qui porte sur lâantibioprophylaxie chez les enfants atteints de RVU. En plus de son protocole de recherche, lâÃĐtude comporte plusieurs autres forces qui reprÃĐsentent des ÃĐlÃĐments positifs pour la validitÃĐ interne : le nombre important de sujets, les analyses par intention de traiter, la prÃĐsence de critÃĻres prÃĐcis et adÃĐquats pour lâÃĐvaluation de lâobjectif primaire, ainsi que la prÃĐcision des intervalles de confiance pour ce dernier. Les auteurs ont aussi considÃĐrÃĐ lâeffet de plusieurs variables potentiellement confondantes dans lâanalyse de leur objectif primaire. Par ailleurs, la dose de TMP-SMX utilisÃĐe dans lâÃĐtude (3 mg/kg de trimÃĐthoprime) semble plus ÃĐlevÃĐe que celles utilisÃĐes dans les autres ÃĐtudes qui se sont penchÃĐes sur le sujet (0,5 à 2 mg/kg de trimÃĐthoprime)13â17. La durÃĐe du suivi de deux ans ÃĐtait lâune des plus longues parmi les ÃĐtudes à rÃĐpartition alÃĐatoire publiÃĐes, qui se limitaient à un suivi entre un et deux ans13â18.
LâÃĐtude RIVUR dÃĐmontre que lâantibioprophylaxie peut prÃĐvenir les rÃĐcurrences dâinfections urinaires. Ce rÃĐsultat est intÃĐressant puisquâil peut se traduire par une diminution des visites mÃĐdicales, des hospitalisations, et de lâabsence parentale au travail. Ainsi, la diminution du fardeau de la maladie pourrait influencer la dÃĐcision des parents dâopter pour des traitements chirurgicaux invasifs de RVU. Par contre, lâobjectif thÃĐrapeutique principal de lâantibioprophylaxie reste de prÃĐvenir une atteinte rÃĐnale chronique. Cette ÃĐtude nâa pas rÃĐussi à dÃĐmontrer un avantage de lâantibioprophylaxie en ce qui concerne le taux de cicatrices rÃĐnales, ce qui soulÃĻve des doutes sur les avantages à long terme de ce traitement. Cependant, cet objectif ÃĐtait ÃĐvaluÃĐ de façon secondaire et il est donc possible que lâÃĐtude ne fut pas suffisamment puissante pour dÃĐtecter une diffÃĐrence entre les deux groupes. De plus, le suivi de deux ans ÃĐtait possiblement trop court pour ÃĐvaluer les effets de lâantibioprophylaxie à long terme. Les avantages de cette intervention sont dâautant plus discutables lorsquâon ajoute lâaugmentation des infections urinaires causÃĐes par des bactÃĐries rÃĐsistantes dans le groupe traitÃĐ. Les lignes directrices de lâAmerican Academy of Pediatrics publiÃĐes en 2011 ne se prononcent pas sur lâutilisation de lâantibioprophylaxie puisque son efficacitÃĐ nâavait pas encore ÃĐtÃĐ bien dÃĐmontrÃĐe7. En fait, les ÃĐtudes à rÃĐpartition alÃĐatoire publiÃĐes antÃĐrieurement sur le sujet avaient rapportÃĐ des rÃĐsultats contradictoires. En ce qui concerne le risque de dÃĐvelopper des rÃĐcurrences dâinfections urinaires, certaines de ces ÃĐtudes rapportaient une rÃĐduction de ce risque tandis que dâautres ne montraient pas dâavantages significatifs dâune antibioprophylaxie13â18. En 2014, une revue de la documentation scientifique qui portait sur les ÃĐtudes antÃĐrieures publiÃĐes sur le sujet a conclu que les donnÃĐes en faveur de lâutilisation dâune antibioprophylaxie ne sont concluantes que pour les jeunes enfants, particuliÃĻrement de sexe fÃĐminin, souffrant dâun RVU de grade avancÃĐ19. De son cÃītÃĐ, la SociÃĐtÃĐ canadienne de pÃĐdiatrie a publiÃĐ des recommandations en 2015 qui prennent en considÃĐration les rÃĐsultats de lâÃĐtude RIVUR12. Cette organisation ne recommande pas lâutilisation systÃĐmatique de lâantibioprophylaxie, quoique cette pratique reste, selon elle, envisageable pour les enfants avec un RVU de grade IV ou V12. Malheureusement, lâÃĐtude RIVUR fournit peu dâinformations sur lâeffet de lâantibioprophylaxie en fonction de chacun des grades de RVU. Il reste donc à cibler les patients qui bÃĐnÃĐficieraient le plus de ce traitement. Une ÃĐtude prospective publiÃĐe en 2013 dÃĐmontre une augmentation du risque de rÃĐcurrences dâinfections urinaires chez les enfants souffrant dâune premiÃĻre infection urinaire à un jeune ÃĒge, ceux ayant une premiÃĻre infection par un microorganisme autre que E. coli et ceux avec un RVU bilatÃĐral ou de haut grade, ou compliquÃĐ par une hydronÃĐphrose20. Il serait intÃĐressant de considÃĐrer ces variables dans de futurs essais à rÃĐpartition alÃĐatoire.
Du cÃītÃĐ des faiblesses, une proportion importante de sujets a cessÃĐ de prendre le mÃĐdicament à lâÃĐtude et certains participants ont ÃĐtÃĐ perdus au suivi. Les auteurs nâont pas clairement indiquÃĐ les raisons des pertes au suivi. De plus, comme dans toute ÃĐtude se basant sur un taux dâobservance thÃĐrapeutique signalÃĐ par les sujets, un biais dâexposition peut exister. En effet, les auteurs sont incapables dâavoir la certitude que tous les sujets du groupe TMP-SMX ont vraiment reçu le traitement prophylaxique. Si lâobservance rÃĐelle sâavÃĐrait moindre que celle signalÃĐe, lâÃĐtude aurait alors sous-ÃĐvaluÃĐ lâeffet de la prophylaxie. En outre, en ce qui concerne la validitÃĐ externe de lâÃĐtude, les critÃĻres dâinclusion et dâexclusion ÃĐtaient trÃĻs stricts (seulement 13 % des sujets dÃĐpistÃĐs ÃĐtaient admissibles à lâÃĐtude), ce qui limite considÃĐrablement lâapplicabilitÃĐ des rÃĐsultats dans un contexte rÃĐel. En plus, la majoritÃĐ des sujets ÃĐtaient de sexe fÃĐminin et souffraient de RVU de grade II et III. Pour terminer, lâÃĐtude ÃĐvaluait seulement un antibiotique, ce qui signifie que les rÃĐsultats ne peuvent pas sâappliquer à des agents autres que le TMP-SMX.
LâÃĐtude RIVUR dÃĐmontre quâune antibioprophylaxie au TMP-SMX pendant deux ans permet de rÃĐduire de façon significative le taux de rÃĐcurrences dâinfection urinaire fÃĐbrile ou symptomatique pour les patients en bas ÃĒge avec un RVU de grade I à IV. Il est ÃĐvident que la diminution des rÃĐcurrences symptomatiques dâinfection urinaire limiterait les morbiditÃĐs et le fardeau social associÃĐs à la maladie, dâautant plus quâun NNT de huit pour prÃĐvenir une rÃĐcurrence dâinfection urinaire fÃĐbrile ou symptomatique sur deux ans reprÃĐsente un avantage clinique tangible. Toutefois, les avantages à long terme restent thÃĐoriques, ÃĐtant donnÃĐ quâil nâest pas prouvÃĐ que la prÃĐvention des infections urinaires protÃĻge contre le risque dâapparition de cicatrices rÃĐnales, ni que lâantibioprophylaxie rÃĐduit ce risque. Lâinobservance du traitement et le risque de rÃĐsistance aux antibiotiques sont ÃĐgalement des prÃĐoccupations reliÃĐes à lâutilisation de lâantibioprophylaxie5.
Pour conclure, lâÃĐtude RIVUR apporte des donnÃĐes intÃĐressantes pour appuyer lâutilisation de lâantibioprophylaxie pour certains enfants atteints de RVU. Il faudra toutefois dâautres ÃĐtudes pour valider les effets à long terme dâune antibioprophylaxie et pour cibler les patients souffrant de RVU qui pourraient le plus en bÃĐnÃĐficier.
Aucun financement en relation avec le prÃĐsent article nâa ÃĐtÃĐ dÃĐclarÃĐ par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de lâICMJE pour la divulgation de conflits dâintÃĐrÊts potentiels. Les auteurs nâont dÃĐclarÃĐ aucun conflit dâintÃĐrÊts actuel ou potentiel en relation avec le prÃĐsent article.
Cet article a ÃĐtÃĐ rÃĐalisÃĐ dans le cadre du cours Communication scientifique de la FacultÃĐ de pharmacie de lâUniversitÃĐ de MontrÃĐal. Les auteurs en remercient les responsables et les collaborateurs ainsi que Pascal BÃĐdard, pharmacien au CHU Sainte-Justine, pour les commentaires reçus lors de la rÃĐdaction de cet article. Une autorisation ÃĐcrite a ÃĐtÃĐ obtenue de ces personnes.
1.âHoberman A, Greenfield SP, Mattoo TK, Keren R, Mathews R, Pohl HG et coll. Antimicrobial prophylaxis for children with vesicoureteral reflux. N Engl J Med 2014;370:2367â76. Â Â
    Â
    Â
 Â
2.âElder JS, Peters CA, Arant Jr BS, Ewalt DH, Hawtrey CE, Hurwitz RS et coll. Pediatric vesicoureteral reflux guidelines panel summary report on the management of primary vesicoureteral reflux in children. J Urol 1997;157:1846â51. Â Â
    Â
 Â
3.âSargent MA. Opinion: what is the normal prevalence of vesicoureteral reflux? Pediatr Radiol 2000;30:587â93. Â Â
    Â
 Â
4.âChang SL, Shortliffe LD. Pediatric urinary tract infections. Pediatr Clin North Am 2006; 53:379â400. Â Â
    Â
 Â
5.âGauthier M, Barrieras D, Clermont MJ. Reflux vÃĐsical-urÃĐtÃĐral. Dans Turgeon J, Bernard-Bonnin AC, Gervais P, Ovetchkine P, Gauthier M, rÃĐdacteurs. Dictionnaire de thÃĐrapeutique pÃĐdiatrique Weber. 2e ÃĐdition. MontrÃĐal : GaÃŦtan Morin ÃĐditeur; 2008. p. 1104â9.
6.âWald ER. Vesicoureteral reflux: the role of antibiotic prophylaxis. Pediatrics 2006;117:919â22. Â Â
    Â
 Â
7.âSubcommittee on Urinary Tract Infection, Steering Committee on Quality Improvement and Management. Urinary tract infection: Clinical practice guideline for the diagnosis and management of the initial UTI in febrile infants and children 2 to 24 months. Pediatrics 2011;128:595â610. Â Â
    Â
 Â
8.âDemÃĻde D, Cheikhelard A, Hoch M, Mouriquand P. MÃĐdecine factuelle et reflux vÃĐsico-urÃĐtÃĐral. Ann Urol 2006;40:161â74. Â Â
 Â
9.âWald E. Urinary tract infections in infants and children: a comprehensive overview. Curr Opin Pediatr 2004;16:85â8. Â Â
    Â
 Â
10.âHoberman A, Greenfield SP, Mattoo TK, Keren R, Mathews R, Pohl HG et coll. Protocole de lâÃĐtude: Antimicrobial prophylaxis for children with vesicoureteral reflux. N Engl J Med 2014; matÃĐriel supplÃĐmentaire.
11.âLe groupe de travail sur les infections urinaires du CHU Sainte-Justine. Prise en charge des infections urinaires. [en ligne] http://www.urgencehsj.ca/protocoles/infection-urinaire/ (site visitÃĐ le 16 mai 2015).
12.âSociÃĐtÃĐ canadienne de pÃĐdiatrie. La prophylaxie antibiotique pour les enfants ayant des infections urinaires rÃĐcurrentes. Documents de principes et points de pratique. [en ligne] http://www.cps.ca/fr/documents/position/prophylaxie-antibiotique-infections-urinaires-recurrentes (site visitÃĐ le 16 mai 2015).
13.âBrandstrÃķm P, EsbjÃķrner E, Herthelius M, Swerkersson S, Jodal U, Hansson S. The Swedish reflux trial in children: III. Urinary tract infection pattern. J Urol 2010;184:286â91. Â Â
    Â
 Â
14.âCraig JC, Simpson JM, Williams GJ, Lowe A, Reynolds GJ, McTaggart SJ et coll. Antibiotic prophylaxis and recurrent urinary tract infection in children. N Engl J Med 2009;361:1748â59. Â Â
    Â
 Â
15.âRoussey-Kesler G, Gadjos V, Idres N, Horen B, Ichay L, Leclair MD et coll. Antibiotic prophylaxis for the prevention of recurrent urinary tract infection in children with low grade vesicoureteral reflux: results from a prospective randomized study. J Urol 2008;179:674â9. Â Â
 Â
16.âPennesi M, Travan L, Peratoner L, Bordugo A, Cattaneo A, Ronfani L et coll. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonephritis and renal scars? A randomized, controlled trial. Pediatrics 2008;121:e1489â94. Â Â
    Â
 Â
17.âGarin EH. Clinical significance of primary vesicoureteral reflux and urinary antibiotic prophylaxis after acute pyelonephritis: a multicenter, randomized, controlled study. Pediatrics 2006;117:626â32. Â Â
    Â
 Â
18.âMontini G, Rigon L, Zucchetta P, Fregonese F, Toffolo A, Gobber D et coll. Prophylaxis after first febrile urinary tract infection in children? A multicenter, randomized, controlled, noninferiority trial. Pediatrics 2008;122:1064â71. Â Â
    Â
 Â
19.âBrandstrÃķm P, Hansson S. Long-term, low-dose prophylaxis against urinary tract infections in young children. Pediatr Nephrol 2015;30:425â32. Â Â
 Â
20.âPark S, Song SH, Lee C, Kim JW, Kim KS. Bacterial pathogens in first febrile urinary tract infection affect breakthrough infections in infants with vesicoureteral reflux treated with prophylactic antibiotics. Urology 2013;81:1342â5. Â Â
    Â
 Â
PHARMACTUEL, Vol. 48, No. 4, 2015