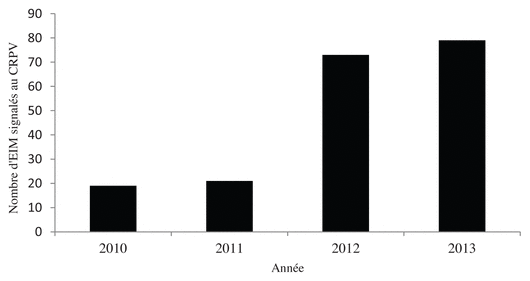
Figure 1 Nombre annuel d’effets indésirables médicamenteux signalés au centre régional de pharmacovigilance par notre centre hospitalier
Abréviations : CRPV : centre régional de pharmacovigilance; EIM : effets indésirables médicamenteux
Thomas Ameye1, Jérémy Perron1, Alain Adehossi2, Pharm.D., Emilie Guillocheau2, Pharm.D., Bénédicte Schmit2, Pharm.D.
Reçu le 12 décembre 2014: Accepté après révision par les pairs le 17 janvier 2015
Résumé
Objectif : Le but de cette étude est d’instaurer une culture de pharmacovigilance chez les soignants de notre centre hospitalier, en les aidant à signaler les effets indésirables médicamenteux au centre régional de pharmacovigilance.
Description de la problématique : En juin 2012, nous avons mis en place un système de pharmacovigilance proactive afin de remédier au faible taux de déclaration des effets indésirables médicamenteux au sein de notre établissement. Ainsi, un interne en pharmacie prend régulièrement contact avec les soignants de 15 unités de soins. En décembre 2013, nous avons établi un calendrier de rendez-vous hebdomadaires entre l’interne et une personne de référence de l’unité de soins préalablement sensibilisée à cette question. La personne de référence est chargée d’établir la liste de tous les effets indésirables médicamenteux suspectés. Ces rencontres visent à permettre à l’interne et au soignant des échanges directs d’information sur tout cas rapporté.
Discussion : En 2012, 73 effets indésirables ont été déclarés, contre 21 en 2011. L’efficacité de la démarche s’est maintenue en 2013 avec 79 effets indésirables signalés, qui impliquaient principalement les anticoagulants (28 % des cas). Cette initiative a permis de multiplier par quatre le nombre de cas déclarés, et l’ajout du calendrier de rendez-vous de l’interne a dynamisé le recueil de ces situations. Les soignants ont porté une attention particulière aux nouveaux anticoagulants oraux.
Conclusion : L’augmentation des déclarations des effets indésirables médicamenteux et la bonne collaboration entre les soignants et le département de pharmacie témoignent du succès de notre démarche.
Mots clés : Effets indésirables médicamenteux, pharmacovigilance
Abstract
Objective : The purpose of this study was to create a pharmacovigilance culture in our hospital by helping health care professionals to report adverse drug effects to the regional pharmacovigilance centre.
Background : In our hospital we had a low rate for reporting adverse reactions to drugs to the regional pharmacovigilance center. In June 2012, we instituted a proactive pharmacovigilance system in which a pharmacy intern contacts the care providers on 15 wards on a regular basis. In December 2013, a schedule of weekly visits between the intern and a pre-instructed contact person in the ward was set up. The latter is responsible for centralizing information on suspected adverse reactions to drugs. The goal is to have direct communication between the intern and the reporting care provider to discuss the cases.
Results : In 2012, 73 adverse reactions were reported, compared with 21 in 2011. In 2013, 79 adverse reactions were reported, with the main drugs involved being anticoagulants in 28% of the cases.
Discussion : This initiative led to a fourfold increase in the number of reports. The addition of scheduled visits by the intern gave new impetus to the gathering of these reports. Care providers paid special attention to the new oral anticoagulants.
Conclusion : The increase in the number of reported adverse reactions to drugs, along with cooperation between the care providers and the Department of Pharmacy, have made this initiative a success.
Keywords : Drug adverse effects, pharmacovigilance
Les processus d’évaluation et d’amélioration de la sécurité des médicaments contribuent au bon usage du médicament, car ils permettent de mettre en évidence les risques d’effets indésirables médicamenteux (EIM) et de les prévenir. Avant l’obtention d’une autorisation de mise sur le marché (AMM) ou d’une autorisation temporaire d’utilisation (ATU), des essais cliniques (phases I à III) étudient le profil d’innocuité du médicament pour des indications précises1,2. Cependant, les échantillons de population des essais ne sont très souvent pas représentatifs de la population des patients rencontrés en pratique. En effet, pour des raisons éthiques ou de frilosité de la part des promoteurs, les essais n’incluent généralement pas les patients âgés ou présentant plusieurs pathologies, les enfants et les femmes enceintes3. De plus, la durée relativement courte des études ne rend pas forcément compte des effets indésirables à long terme. De même, le nombre de sujets relativement restreint complique la détection des effets indésirables rares4.
L’évaluation du risque lié au médicament après l’obtention de l’AMM ou de l’ATU (phase IV) est donc indispensable1. Elle repose majoritairement sur les déclarations spontanées d’effets indésirables médicamenteux signalés par les professionnels de la santé, les patients, les associations de patients et les industriels. En France, les centres régionaux de pharmacovigilance recueillent les déclarations, déterminent la responsabilité du médicament et transmettent l’information à l’Agence nationale de la sécurité du médicament (ANSM), qui envoie des alertes ascendantes5.
Selon leur fréquence et leur gravité, ces déclarations peuvent conduire les autorités sanitaires à prendre des mesures telles qu’une modification du résumé des caractéristiques du produit1. Ces modifications peuvent se traduire par l’ajout de précautions d’emploi, des modalités de prescription particulières ou des restrictions d’AMM allant jusqu’au retrait du marché lorsque le rapport avantages-risques est jugé défavorable au médicament6. L’ensemble des professionnels de la santé reçoit alors un retour d’information ainsi que des recommandations (alertes descendantes), par l’intermédiaire notamment des centres régionaux de pharmacovigilance et des correspondants locaux de pharmacovigilance.
La limite principale de ce système, rencontrée dans la plupart des pays, demeure la sous-déclaration. En effet, les données de la littérature médicale rapportent une estimation du taux de déclaration inférieur à 10 % de l’ensemble des EIM7–9. La qualité inégale des déclarations est également problématique : quand elles sont trop pauvres en renseignements cliniques, elles ne permettent pas d’affirmer avec certitude le lien de causalité. Des déclarations incomplètes peuvent également incriminer à tort un médicament, ce qui peut conduire à des restrictions de l’indication, voire au retrait de médicaments efficaces6,9.
Face à ces difficultés, les autorités sanitaires européennes et mondiales ont pour mission de promouvoir les activités de pharmacovigilance et de donner aux professionnels de la santé des clés favorisant l’efficience des interventions dans ce domaine. L’European Medicines Agency (EMA) publie des bonnes pratiques de pharmacovigilance pour promouvoir une harmonisation des pratiques en Europe10. L’Organisation mondiale de la santé (OMS) rappelle que l’efficacité de la pharmacovigilance dépend de la participation active de tous les professionnels de la santé concernés par la prise en charge du patient. En effet, des études ont montré que les diverses catégories de professionnels de la santé observent différents types de problèmes liés au médicament11,12. L’OMS encourage la mise en place de systèmes innovants et souligne le rôle important du pharmacien dans la lutte contre l’iatrogénie médicamenteuse13.
Alors que la fréquence des EIM reste difficile à déterminer en raison de l’hétérogénéité des différentes estimations publiées dans la littérature médicale et de la sous-déclaration de ces effets, le taux d’hospitalisations liées à ces EIM est quant à lui mieux connu et varie entre 3 et 7 % selon les données de la littérature scientifique14–18. Ces hospitalisations consécutives aux EIM influent sensiblement sur la qualité de vie des patients et représentent un coût considérable pour les systèmes de santé14,19.
Notre centre hospitalier général compte 50 000 hospitalisations de patients par an, pour 850 lits. Au vu de ce volume d’activité, le taux de déclarations d’EIM était considéré comme très insuffisant : 19 EIM ont été déclarés en 2010 et 21 en 2011. Ces statistiques plaçaient notre centre hospitalier au bas du classement régional des établissements les plus performants en termes de déclaration des EIM, d’après des données non publiées du centre régional de pharmacovigilance auquel se rattache notre établissement.
Les principales raisons de la sous-notification évoquées dans la littérature médicale sont le manque de temps, le manque de connaissances (notamment la conviction que seuls les EIM graves ou inattendus doivent être déclarés, ou encore que seuls les EIM avérés peuvent être déclarés et non ceux suspectés)20,21. La difficulté à se procurer un formulaire de déclaration et l’indifférence, dans une plus faible mesure, contribuent également à la sous-déclaration des EIM22.
Notre objectif est d’instaurer une culture de pharmacovigilance chez les soignants de notre établissement en les aidant à signaler les EIM et en intégrant cette discipline au sein de la pratique clinique.
En juin 2012, notre établissement a mis en place un système de pharmacovigilance dite « active ». Ce système consiste en la prise de contact régulière d’un interne en pharmacie avec les soignants de diverses unités de soins. Un interne en pharmacie hospitalière est un étudiant en pharmacie ayant terminé sa cinquième année d’études, qui suit une formation rémunérée afin de devenir pharmacien hospitalier. Ces prises de contact visent à discuter des cas pouvant faire l’objet d’une déclaration d’EIM et, le cas échéant, à aider à la rédaction de la déclaration destinée au centre régional de pharmacovigilance.
En juin 2013, nous avons établi un calendrier de rendez-vous hebdomadaires des visites pour 15 unités de soins de médecine et de chirurgie. En décembre 2013, un entretien avec une personne de référence sensibilisée à la question et chargée de centraliser les EIM signalés a permis de formaliser la pharmacovigilance active. Le cadre de santé, personne responsable de l’encadrement du personnel paramédical, est choisi pour son rôle central dans l’organisation des unités de soins, ce qui lui permet d’interagir avec toutes les personnes susceptibles de signaler un EIM. L’objectif est donc de prendre en compte aussi bien les déclarations des médecins que celles du personnel paramédical, de manière à couvrir tout le spectre des EIM possibles. Néanmoins, lorsque la déclaration provient d’un membre du personnel paramédical, il est souvent nécessaire de contacter également le médecin prescripteur.
Après avoir découvert un cas d’EIM qui prête à suspicion, l’interne en pharmacie et le soignant chargé de la déclaration remplissent le formulaire national de déclaration. Il est possible de retrouver des informations complémentaires dans le dossier patient informatisé, notamment en ce qui concerne les données cliniques et biologiques du patient. Il est également possible de consulter le patient lorsqu’il s’agit d’un effet qu’il ressent ou lorsque l’effet est apparu avant l’hospitalisation.
La discussion avec le personnel soignant visant à décrire le contexte de manière exhaustive, suivie de la synthèse des informations, permet d’améliorer la qualité des déclarations. Les informations recueillies par l’interne en pharmacie permettant de remplir le formulaire de déclaration concernent les antécédents du patient ou les facteurs ayant pu favoriser l’apparition de l’EIM, la liste des médicaments pris par le patient (posologie, voie d’administration) avec la chronologie de leur instauration, la date de survenue de l’EIM ainsi que sa gravité, sa prise en charge et son évolution (délai de disparition, le cas échéant). L’interne en pharmacie se charge de faire parvenir la déclaration au centre régional de pharmacovigilance.
Le centre régional de pharmacovigilance offre par courrier un retour d’information à la pharmacie et au personnel de l’unité de soin. Ce courrier, qui mentionne la responsabilité du ou des médicaments suspectés, est incorporé au dossier patient et témoigne ainsi de la survenue de l’EIM lors des hospitalisations ultérieures. L’interne en pharmacie travaille sous la responsabilité du correspondant local de pharmacovigilance de l’établissement et avec son soutien tout au long du processus.
Un tableur Excel permet de suivre le passage de l’interne en pharmacie dans l’unité de soins et de retrouver les déclarations d’EIM qui en découlent. Il permet d’analyser les caractéristiques démographiques des patients ainsi que celles des EIM signalés en 2013.
La gravité de l’EIM est définie par le décès du patient, l’hospitalisation ou la prolongation du séjour hospitalier, l’incapacité ou l’invalidité permanente, ou la mise en jeu du pronostic vital. Le caractère « inattendu » des EIM est également étudié : un effet indésirable inattendu est défini comme n’étant pas mentionné dans le résumé des caractéristiques du produit du médicament. Enfin, les médicaments responsables d’EIM sont regroupés en fonction de leur classification anatomique, thérapeutique et chimique (ATC).
En 2011, le centre régional de pharmacovigilance avait reçu 11 déclarations d’EIM au deuxième semestre (dont 8 graves) et 21 sur l’année entière. La pharmacovigilance « active », débutée en juin 2012, a permis de déclarer en six mois 54 EIM au centre régional de pharmacovigilance (dont 34 graves). Au total, nous avons enregistré la déclaration de 152 EIM depuis la mise en place de la pharmacovigilance active, avec 79 déclarations d’EIM (dont 49 graves, soit 62 %) pour l’année 2013. Cette initiative a donc multiplié par quatre le nombre de déclarations d’EIM par rapport à 2011.
L’âge moyen des patients pour lesquels nous avons signalé au moins un EIM en 2013 est de 69 ± 16 ans. Le ratio homme-femme est de 0,8. La totalité des EIM correspond à des effets indésirables attendus. La classe ATC responsable du plus grand nombre d’EIM est celle des médicaments agissant sur le sang et les organes hématopoïétiques (notamment les anticoagulants), avec 28 % des EIM signalés. Les classes des antinéoplasiques et des anti-infectieux (notamment les antibiotiques) sont également fréquemment incriminées, avec respectivement 23 % et 20 % des EIM signalés.
En 2013 les nouveaux anticoagulants oraux sont incriminés dans 12 EIM (15 % des déclarations), dont 7 accidents vasculaires ou hémorragiques. Sept de ces 12 EIM sont graves, dont un qui a abouti à un décès et un autre à une mise en jeu du pronostic vital.
|
|
||
|
Figure 1 Nombre annuel d’effets indésirables médicamenteux signalés au centre régional de pharmacovigilance par notre centre hospitalier |
||
|
|
||
|
Figure 2 Nombre d’effets indésirables médicamenteux signalés en 2013 en fonction de l’âge du patient |
||
Notre initiative a permis d’augmenter de façon importante et croissante les déclarations d’EIM au sein de notre établissement. L’ajout d’un calendrier de rendez-vous hebdomadaire de l’interne en pharmacie a continué à dynamiser le recueil des déclarations en 2013. Ces résultats nous ont permis de devenir le second centre hospitalier de notre région qui a signalé le plus d’EIM en 2013. Le centre hospitalier en tête de liste s’appuie également sur des étudiants en pharmacie pour signaler les EIM.
Les sujets âgés sont plus susceptibles de développer des EIM, en raison notamment du déclin physiologique associé à une modification des caractéristiques pharmacocinétiques et de leur polymédication qui augmente les risques d’interactions médicamenteuses23. En effet, l’âge moyen des patients pour lesquels on a signalé un EIM est élevé. Aucun EIM n’a été signalé parmi les patients âgés de moins de 20 ans, alors que des études montrent que les enfants sont également sujets aux EIM24. La mise en place d’une pharmacovigilance active en pédiatrie (prévue dans un deuxième temps) pourrait permettre l’augmentation du nombre de déclarations des EIM portant sur ce groupe.
Les équipes se focalisent sur la détection des EIM connus, mais expriment plus de difficultés à faire le lien entre un EIM inattendu et le médicament qui pourrait en être responsable. Les soignants ont porté une attention particulière aux anticoagulants oraux directs, qui représentent 15 % des déclarations en 2013. En effet, la classe des anticoagulants oraux est connue pour représenter une source d’iatrogénie médicamenteuse non négligeable. Il faut rappeler que ces médicaments, qui sont relativement récents, n’ont pas d’antidote spécifique à ce jour. L’ANSM a communiqué une information substantielle sur le bon usage des anticoagulants oraux directs, en diffusant des études de pharmaco-épidémiologie comparant les risques observés en présence de cette nouvelle classe à ceux associés aux antagonistes de la vitamine-K. De même, l’ANSM a publié un communiqué sur la surveillance des anticoagulants oraux dans la pratique courante. Enfin, ces médicaments font l’objet d’un plan de gestion des risques au niveau européen25.
La proportion importante des EIM signalés qui sont liés aux antinéoplasiques peut s’expliquer par l’étroite collaboration, au sein de notre centre hospitalier, entre le service d’hospitalisation de jour d’hémato-oncologie et le service de pharmacie responsable de la reconstitution et de la gestion des poches de médicaments cytotoxiques. La littérature médicale mentionne souvent les antibiotiques à l’origine d’une proportion importante des EIM signalés26,27.
Une des principales contraintes de notre système de pharmacovigilance active demeure la formation de l’interne lors de son accès à ce poste, d’où la nécessité d’un système de procédures très complet. Des changements de personnel dans les unités de soin, notamment le changement de la personne de référence, peuvent également nécessiter un nouvel entretien de sensibilisation avec le remplaçant. Même si nous n’avons pas étudié le temps hebdomadaire nécessaire à la mise en application de ce système de pharmacovigilance, un investissement personnel assez important est requis.
D’autres publications ont démontré les effets bénéfiques sur le taux de déclarations des EIM d’une visite régulière d’un professionnel de la santé directement auprès des soignants au sein des unités de soins26. En outre, on retrouve dans la littérature médicale d’autres types d’initiatives qui relèvent d’une démarche active visant à potentialiser le nombre de déclarations spontanées. Certaines s’appuient sur l’informatisation des données liées au patient, avec le développement de systèmes d’alertes automatisées permettant de signaler les EIM28,29. D’autres reposent sur des messages de sensibilisation auprès des professions médicales et paramédicales30,31. L’expérience a démontré qu’un retour d’information sur le médicament incriminé de la part du centre régional de pharmacovigilance peut également avoir une influence32. La plupart du temps, ces initiatives nécessitent un investissement personnel important, mais s’inscrivent dans le cadre d’une participation pluridisciplinaire27.
|
|
||
|
Figure 3 Pourcentage des médicaments responsables d’un effet indésirable médicamenteux selon la classe ATC, signalé par notre centre hospitalier en 2013 |
||
Tableau I Effets indésirables médicamenteux liés aux nouveaux anticoagulants oraux en 2013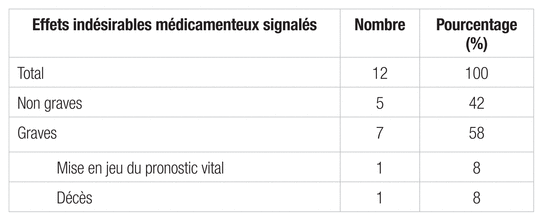
La pharmacovigilance instaurée dans notre centre hospitalier a eu des répercussions positives indéniables sur la croissance du nombre de déclarations de pharmacovigilance, tant au point de vue quantitatif que qualitatif. L’interne en pharmacie représente un acteur important pour favoriser la déclaration des EIM.
Les raisons de notre succès sont multiples. En plus d’augmenter les déclarations d’EIM, la régularité des visites de l’interne affecté aux déclarations a permis une meilleure sensibilisation des soignants et un gain de temps lors de l’enregistrement des déclarations. Un climat de confiance s’est instauré entre le personnel des unités de soins et l’équipe pharmaceutique, ce qui nous permet de prévoir une pérennisation de la pratique et par conséquent une augmentation des déclarations d’EIM.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflit d’intérêts potentiel. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Agence national de la sécurité du médicament et des produits de santé. Site de l’Agence national de la sécurité du médicament et des produits de santé. [en ligne] http://ansm.sante.fr/Activites/Autorisations-de-Mise-sur-le-Marche-AMM/LAMM-et-le-parcours-du-medicament/(offset)/1 (site visité le 13 janvier 2015).
2. Agence national de la sécurité du médicament et des produits de santé. Site de l’Agence national de la sécurité du médicament et des produits de santé. [en ligne] http://ansm.sante.fr/Activites/Autorisations-temporaires-d-utilisation-ATU/Qu-est-ce-qu-une-autorisation-temporaired-utilisation/(offset)/0 (site visité le 13 janvier 2015).
3. Bouvenot G, Villani P. Apport des essais pré-AMM à la connaissance du risque iatrogène chez la personne âgée. Thérapie 2004;59:233–6.
4. Moses C, Celi LA, Marshall J. Pharmacovigilance: an active surveillance system to proactively identify risks for adverse events Popul Health Manag 2013;16:147–9.

5. Agence national de la sécurité du médicament et des produits de santé. Site de l’Agence national de la sécurité du médicament et des produits de santé. [en ligne] http://ansm.sante.fr/Declarerun-effet-indesirable/Pharmacovigilance/Roledes-differents-acteurs/(offset)/3 (site visité le 13 janvier 2015).
6. Wysowski DK, Swartz L. Adverse drug event surveillance and drug withdrawals in the United States, 1969–2002: the importance of reporting suspected reactions. Arch Intern Med 2005;165:1363–9.

7. Hazell L, Shakir SAW. Under-reporting of adverse drug reactions: a systematic review. Drug Saf 2006;29:385–96.
8. Heeley E, Riley J, Layton D, Wilton LV, Shakir SA. Prescription-event monitoring and reporting of adverse drug reactions. Lancet 2001;358:1872–3.

9. Edwards IR. An agenda for UK clinical pharmacology: Pharmacovigilance. Br J Clin Pharmacol 2012;73:979–82.


10. European Medicines Agency. Guideline on good pharmacovigilance practices (GVP). [en ligne] http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/document_listing/document_listing_000345.jsp (site visité le 05 décembre 2014).
11. Bäckström M, Ekman E, Mjörndal T. Adverse drug reaction reporting by nurses in Sweden. Eur J Clin Pharmacol 2007;63:613–8.

12. Hall M, McCormack P, Arthurs N, Feely J. The spontaneous reporting of adverse drug reactions by nurses. Br J Clin Pharmacol 1995;40:173–5.


13. World Health Organization. The Importance of Pharmacovigilance – Safety Monitoring of Medicinal Products. [en ligne] http://apps.who.int/medicinedocs/en/d/Js4893e/ (site visité le 5 décembre 2014).
14. International Society of Drug Bulletins. Déclaration de Berlin sur la Pharmacovigilance. Rev Prescrire 2005;25:276.
15. Imbs JL, Pouyanne P, Haramburu F, Welsch M, Decker N, Blayac JP et coll. Iatrogenic medication: estimation of its prevalence in French public hospitals. Regional Centers of Pharmacovigilance. Therapie 1999;54:21–7.
16. Lazarou J, Pomeranz BH, Corey PN. Incidence of adverse drug reactions in hospitalized patients: a meta-analysis of prospective studies. JAMA 1998;279:1200–5.

17. Pouyanne P, Haramburu F, Imbs JL, Bégaud B. Admissions to hospital caused by adverse drug reactions: cross sectional incidence study. BMJ 2000;320:1036.
18. Pirmohamed M, James S, Meakin S, Green C, Scott AK, Walley TJ et coll. Adverse drug reactions as cause of admission to hospital: prospective analysis of 18 820 patients. BMJ 2004;329:15–9.


19. Hug BL, Keohane C, Seger DL, Yoon C, Bates DW. The costs of adverse drug events in community hospitals. Jt Comm J Qual Patient Saf 2012;38:120–6.
20. Lopez-Gonzalez E, Herdeiro MT, Figueiras A. Determinants of under-reporting of adverse drug reactions: a systematic review. Drug Saf 2009;32:19–31.

21. Vallano A, Cereza G, Pedròs C, Agustí A, Danés I, Aguilera C et coll. Obstacles and solutions for spontaneous reporting of adverse drug reactions in the hospital. Br J Clin Pharmacol 2005;60:653–8.


22. McGettigan P, Golden J, Conroy RM, Arthur N, Feely J. Reporting of adverse drug reactions by hospital doctors and the response to intervention. Br J Clin Pharmacol 1997;44:98–100.


23. Routledge PA, O’Mahony MS, Woodhouse KW. Adverse drug reactions in elderly patients. Br J Clin Pharmacol 2004;57:121–6.


24. Clavenna A, Bonati M. Adverse drug reactions in childhood: a review of prospective studies and safety alerts. Arch Dis Child 2009;94:724–8.

25. Agence nationale de sécurité du médicament et des produits de santé. Les anticoagulants en France en 2014: état des lieux, synthèse et surveillance. [en ligne] http://ansm.sante.fr/Dossiers/Les-anticoagulants/Les-anticoagulants-en-France-Etudes-et-surveillance/(offset)/0 (site visité le 5 décembre 2014).
26. Gony M, Badie K, Sommet A, Jacquot J, Baudrin D, Gauthier P et coll. Improving adverse drug reaction reporting in hospitals: results of the French Pharmacovigilance in Midi-Pyrénées region (PharmacoMIP) network 2-year pilot study. Drug Saf 2010;33:409–16.

27. Yun IS, Koo MJ, Park EH, Kim S-E, Lee J-H, Park J-W et coll. A comparison of active surveillance programs including a spontaneous reporting model for pharmacovigilance of adverse drug events in a hospital. Korean J Intern Med 2012;27:443–50.


28. Osmont M-N, Cuggia M, Polard E, Riou C, Balusson F, Oger E. Use of the PMSI for the detection of adverse drug reactions. Therapie 2013;68:285–95.

29. Haerian K, Varn D, Vaidya S, Ena L, Chase HS, Friedman C. Detection of pharmacovigilance-related adverse events using electronic health records and automated methods. Clin Pharmacol Ther 2012;92:228–34.


30. Tabali M, Jeschke E, Bockelbrink A, Witt CM, Willich SN, Ostermann T et coll. Educational intervention to improve physician reporting of adverse drug reactions (ADRs) in a primary care setting in complementary and alternative medicine. BMC Public Health 2009;9:274.


31. Johansson M-L, Brunlöf G, Edward C, Wallerstedt SM. Effects of e-mails containing ADR information and a current case report on ADR reporting rate and quality of reports. Eur J Clin Pharmacol 2009;65:511–4.

32. Wallerstedt SM, Brunlöf G, Johansson M-L, Tukukino C, Ny L. Reporting of adverse drug reactions may be influenced by feedback to the reporting doctor. Eur J Clin Pharmacol 2007;63:505–8.

PHARMACTUEL, Vol. 48, No. 1, 2015