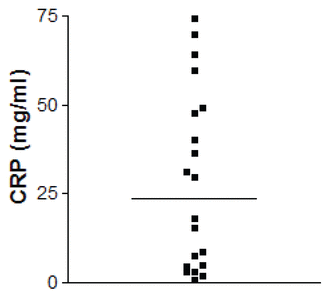
Figure 1. Distribution de la CRP des patients traités avec des fluoroquinolones, avant le début de l’antibiothérapie
Abréviation : CRP : protéine C-réactive
Pauline Calvet1, D.Pharm., Charlotte Rouzaud-Laborde1,2,3, D.Pharm., Ph.D.
Reçu le 12 août 2015; Accepté après révision le 6 octobre 2015
Résumé
Objectif : L’objectif de l’étude est de connaitre les pratiques de prescriptions des fluoroquinolones dans des services de neurologie en France, en évaluant la réévaluation à 48–72 heures de la mise en place d’une telle antibiothérapie.
Mise en contexte : Les fluoroquinolones sont des antibiotiques largement prescrits. De nombreuses démarches permettent d’améliorer la qualité de la prescription des antibiotiques, notamment la réévaluation de l’antibiothérapie à 48–72 heures.
Résultats : Cette étude descriptive et prospective, portant sur le recueil des prescriptions informatisées de fluoroquinolones, a été réalisée dans les services de neurologie pendant une période de trois mois. En tout, 23 prescriptions de fluoroquinolones ont été sélectionnées. Dix-neuf (83 %) des infections traitées étaient nosocomiales et 16 (70 %) étaient probabilistes (ou empiriques). La médiane des valeurs de la protéine C-réactive était de 23,8 mg/ml (intervalle : 0,7 à 69,8 mg/ml) et celle des taux de leucocytes était de 9,6 g/l (intervalle de 7,3 à 19,7 g/l). La durée moyenne d’antibiothérapie était de six jours. La réévaluation de l’antibiothérapie à 48–72 heures était mentionnée dans le dossier du patient dans 39 % des cas.
Conclusion : Il convient de réserver l’usage des fluoroquinolones à des infections documentées pour diminuer le risque de résistance envers cette classe d’antibiotiques. La création de protocoles de prise en charge probabiliste (ou empirique) d’infections nosocomiales peut être envisagée. La réévaluation de l’antibiothérapie à 48–72 heures est primordiale et doit être généralisée. L’informatisation de ces étapes peut aider à y parvenir.
Mots clés : Fluoroquinolones, réévaluation à 48-72 heures, utilisation appropriée
Abstract
Objective: The objective of this study was to explore fluoroquinolone prescribing practices in neurology departments in France, with a focus on the reassessment at 48 to 72 hours after initiation of the antibiotic therapy.
Background: Fluoroquinolones are widely prescribed antibiotics. There are many approaches for improving the quality of antibiotic prescribing. One of them is a reassessment of the antibiotic therapy at 48 to 72 hours.
Results: This descriptive, prospective study based on a compilation of computerized prescriptions for fluoroquinolones was carried out in neurology departments over a 3-month period. Twenty-three fluoroquinolone prescriptions were selected. Nineteen (83%) of the treated infections were nosocomial, and 16 (70%) were empirical. The median C-reactive protein level was 23.8 mg/mL (range: 0.7 to 69.8 mg/mL), and the median leucocyte count was 9.6 g/l (range: 7.3 to 19.7 g/l). The mean duration of antibiotic therapy was six days. A reassessment of the antibiotic therapy at 48 to 72 hours was mentioned in the patient’s chart in 39% of the cases.
Conclusion: The use of fluoroquinolones should be reserved for targeted infections to reduce the risk of resistance to this class of antibiotics. Consideration might be given to creating protocols for the empirical management of nosocomial infections. Reassessing antibiotic therapy at 48 to 72 hours is essential and should be generalized. Computerizing these steps could help achieve this.
Key words: Appropriate use, fluoroquinolones, reassessment at 48 to 72 hours.
Les fluoroquinolones sont largement prescrites en médecine, en raison de leur excellente biodisponibilité et de leur large spectre antimicrobien. De nombreux autres facteurs sont également à l’origine de cette forte utilisation, notamment la multiplicité des prescripteurs et les habitudes de ces derniers, la complexité des situations cliniques rencontrées, la facilité de prescription, ainsi qu’une prescription souvent trop large résultant de la crainte du praticien face à l’échec thérapeutique. La surconsommation des fluoroquinolones a entrainé l’apparition de certaines résistances bactériennes à cette famille d’antibiotiques, dont l’utilisation favorise la colonisation par des bactéries multirésistantes et ainsi l’apparition d’infections correspondantes. Dans certains cas, cette résistance croissante pourrait mener à une impasse thérapeutique, car les fluoroquinolones constituent une option de traitement encore très précieuse de nos jours… mais pour combien de temps?
En France, un certain nombre d’organismes, dont la Direction générale de l’offre de soins et la Direction générale de la santé, ont entrepris des actions pour améliorer la qualité de la prescription des antibiotiques1. Cependant, entre 20 et 50 % des prescriptions d’antibiotiques dans les hôpitaux ne seraient toujours pas adaptées. Cette circulaire de 2002 indique les orientations à mettre en œuvre pour une utilisation appropriée des antibiotiques dans les établissements de santé.
Un rapport de la Haute Autorité de Santé (HAS) publié en 2014 précise les trois antibiotiques (ou familles d’antibiotiques) particulièrement générateurs de résistances bactériennes, dont font partie les fluoroquinolones2. À la suite de ce rapport, une fiche mémo a été créée afin d’éviter la prescription inappropriée des antibiotiques3. Le plan national d’alerte sur les antibiotiques 2011–2016 vise l’utilisation à bon escient des antibiotiques4. Il a pour objectif de lutter contre le développement des résistances aux antibiotiques et contre un nombre croissant de situations d’impasses thérapeutiques.
Depuis 2008, la réévaluation de l’antibiothérapie à 48–72 heures est un critère de qualité faisant partie des recommandations de la HAS pour un usage adéquat des antibiotiques. La HAS précise en effet que « la réévaluation entre la 24e heure et la 72e heure permet d’apprécier l’évolution clinique, d’obtenir les données microbiologiques, de s’assurer de la preuve ou non d’une infection et de sa nature bactérienne. Cette réévaluation est essentielle au bon usage, en particulier dans le cadre des antibiothérapies probabilistes »5. Elle s’inscrit dans le plan stratégique 2009–2013 de lutte contre les infections nosocomiales6.
Ce critère de qualité est appuyé d’abord par l’indice composite du bon usage des antibiotiques (ICATB), puis par la version numéro 2 de cet indicateur de qualité (ICATB.2)7. Cette deuxième version définit de nouveaux objectifs permettant d’améliorer la prise en charge des patients et de prévenir les résistances bactériennes aux antibiotiques, notamment : intégration du bon usage dans la politique de l’établissement; accès pour chaque prescripteur à un conseil diagnostique et thérapeutique; collaboration formalisée entre les différents acteurs; définition d’une procédure d’alerte pour une réévaluation de l’antibiothérapie; informatisation des prescriptions; création d’un référent compétent; formation des nouveaux prescripteurs; définition de protocoles d’antibiothérapie de première intention7.
La certification V2010 (procédure d’évaluation externe des établissements de santé, réalisée par des experts de la HAS), revisitée à la suite de l’arrêté du 6 avril 2011, et poursuivie dans la V2014, incite les établissements de santé à surveiller deux indicateurs : la maitrise des résistances bactériennes et le bon usage des antibiotiques8. Elle précise également que la réévaluation de l’antibiothérapie entre la 24e heure et la 72e heure doit être inscrite dans le dossier du patient9. Cette réévaluation permet aux professionnels de la santé de prendre en compte les résultats bactériologiques pour adapter les traitements empiriques, afin d’optimiser l’antibiothérapie tout en limitant une pression antibiotique inutile sur la flore commensale bactérienne du patient ou écologique de l’établissement. Elle leur offre également l’occasion d’arrêter une antibiothérapie inutile, qui pourrait entrainer une augmentation des dépenses, ou de dépister un échec thérapeutique le plus précocement possible.
L’objectif principal de cette étude est de connaitre les pratiques de prescription des fluoroquinolones dans les services de neurologie du Centre hospitalier universitaire (CHU) de Toulouse, forts consommateurs de fluoroquinolones en 2014. L’objectif secondaire est l’appréciation de la réévaluation du traitement par fluoroquinolones à 48–72 heures.
Il s’agit d’une étude prospective et descriptive portant sur le recueil des prescriptions informatisées (grâce au logiciel OrbisMD de la société AGFA) de fluoroquinolones dans les services de neurologie inflammatoire et vasculaire (soit un total de 46 lits) sur une période de trois mois. Tous les patients hospitalisés dans ces services qui avaient une prescription de fluoroquinolones (ofloxacine, ciprofloxacine, lévofloxacine, loméfloxacine, péfloxacine, moxifloxacine, norfloxacine) ont été inclus. Étaient exclus les patients de moins de 18 ans ainsi que les patients admis dans le service avec un traitement par fluoroquinolones commencé en ambulatoire ou dans un autre établissement de soins.
Une grille de recueil en deux parties a été élaborée. La première partie reprend des informations concernant les données du patient et les renseignements cliniques et biologiques sur l’infection (site d’infection traité, dosage de la protéine C-réactive [CRP], taux de leucocytes sanguins, types de bactéries retrouvés), ainsi que des informations sur l’antibiothérapie prescrite (choix de la molécule, voie intraveineuse ou orale, posologie, durée du traitement). La prescription d’une antibiothérapie par fluoroquinolones durant les trois (infections respiratoires) à six mois (infections urinaires) précédant le traitement mis en place dans le service a été systématiquement recherchée.
La seconde partie traite de l’évaluation de l’antibiothérapie à 48–72 heures, selon les critères de la Société de Pathologie Infectieuse de Langue Française (SPILF):
Le diagnostic d’une infection présumée bactérienne est-il noté dans le dossier du service initiateur de la prescription ou ses transmissions médicales ou infirmières?
Un prélèvement à visée bactériologique a-t-il été réalisé avant la mise sous antibiotique?
Une évaluation de l’antibiothérapie est-elle mentionnée dans le dossier clinique entre 48 et 72 heures après le début de l’antibiothérapie?
La décision d’arrêt ou de poursuite du traitement à la suite de cette évaluation est-elle consignée dans le dossier?
Les résultats d’examens microbiologiques spécifiques de l’infection étaient-ils disponibles dans le dossier à 72 heures?
Un ajustement de l’antibiothérapie à l’antibiogramme a-t-il été réalisé?
Un relais oral était-il possible et a-t-il été réalisé?
Dans le cas d’une prise de décision de poursuivre l’antibiothérapie, la durée prévisionnelle de celle-ci est-elle précisée?
Une association de plusieurs antibiotiques est-elle maintenue plus de trois jours avec une justification dans le dossier?
Un masque de saisie a été élaboré avec le logiciel Microsoft Office ExcelMD. La saisie a été effectuée durant la période de l’étude. Le masque de saisie a permis l’analyse ultérieure des données. Les calculs de distribution ont été réalisés avec le logiciel PrismMD version 6. Les valeurs quantitatives sont exprimées en moyenne ± écart type.
De février à avril 2014 (période de collecte de données), on compte un total de 731 admissions pour les trois services de neurologie. Parmi ces patients, 25 ont fait l’objet d’une prescription de fluoroquinolones. Sur ces 25 patients, 23 ont été inclus dans l’étude (92 % des patients) et 2 ont été exclus, car ils avaient commencé le traitement par fluoroquinolones en ambulatoire.
Parmi ces 23 patients, nous retrouvons 16 femmes (70 % de la population étudiée). L’âge moyen des patients sélectionnés est de 64 ± 17 ans (intervalle : 42 à 87 ans). La clairance à la créatinine des patients a été calculée selon la formule de Cockcroft-Gault. Selon cette formule, la clairance moyenne est de 89 ± 37 ml/min. Aucun patient ne présentait d’allergie aux antibiotiques. Aucune donnée concernant la prise antérieure de fluoroquinolones n’a été retrouvée dans les dossiers médicaux des patients.
Le recueil de données a été réalisé auprès de trois services de soins neurologiques. Plus de la moitié (57 %) des prescriptions de fluoroquinolones provient du service d’hospitalisation de neurologie vasculaire. Parmi ces 23 dossiers, 15 antibiothérapies ont été prescrites par un interne en médecine et huit antibiothérapies l’ont été par un praticien hospitalier.
Pour les 23 patients, les sites d’infections traités sont les suivants : 18 sites urinaires, deux sites pulmonaires, deux sites prostatiques et un site digestif. La majorité (83 %) des infections traitées n’étaient pas présentes à l’admission et s’étaient déclarées au minimum 48 heures après l’hospitalisation; elles sont donc considérées comme liées aux soins.
Tous les patients ayant une infection urinaire soupçonnée ont fait l’objet d’une analyse d’urine par bandelette urinaire et d’un examen cytobactériologique des urines (culture d’urine) avant la mise sous antibiotiques. La bandelette urinaire s’est avérée positive dans tous les cas d’infections urinaires soupçonnées. Parmi les 18 patients traités pour une infection urinaire, quatre étaient traités pour une infection urinaire communautaire soupçonnée et 14 pour une infection liée aux soins (10 de façon probabiliste, quatre après analyse des données de l’antibiogramme) (tableau I).
Tableau I. Données détaillées des 23 patients ayant été traités par une fluoroquinolone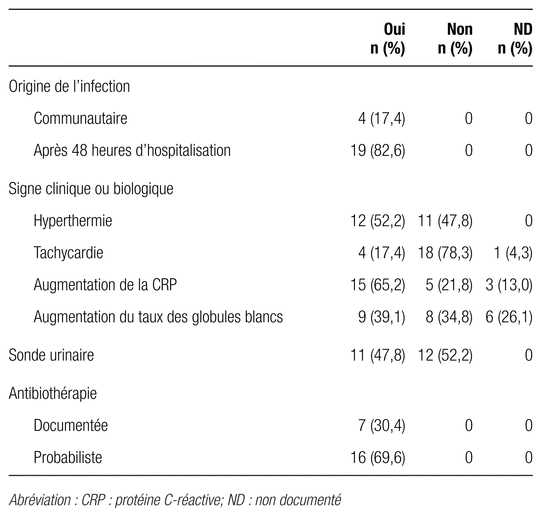
La figure 1 présente les résultats des dosages de la CRP avant le début de l’antibiothérapie. Une augmentation de la CRP était retrouvée dans 65 % des cas. La médiane de ces valeurs était de 23,8 mg/ml, alors que la normale est inférieure à 5 mg/ml. La figure 2 présente les résultats des dosages des leucocytes sanguins avant le début de l’antibiothérapie. La médiane de ces valeurs était de 9,6 g/l, alors que la normale est considérée comme étant entre 4 et 10 g/l.
|
|
||
|
Figure 1. Distribution de la CRP des patients traités avec des fluoroquinolones, avant le début de l’antibiothérapie |
||
|
|
||
|
Figure 2. Distribution du taux des leucocytes sanguins des patients traités avec des fluoroquinolones, avant le début de l’antibiothérapie |
||
L’antibiothérapie par fluoroquinolones est débutée le plus souvent de façon probabiliste ou empirique (70 % des cas). L’ofloxacine est la molécule la plus largement prescrite (96 % des cas), les autres prescriptions étant pour la ciprofloxacine. Nous ne retrouvons pas de prescription d’autres fluoroquinolones dans notre échantillon.
La durée moyenne de l’antibiothérapie prescrite, tous patients confondus, était de six jours (intervalle : 1 à 21 jours). Lorsque l’infection avait été acquise dans la communauté, la durée moyenne était de trois jours (intervalle : 1 à 7 jours). Pour les infections liées aux soins, la durée moyenne était de sept jours (intervalle : 2 à 21 jours). Parmi les 23 prescriptions, trois (13 %) correspondaient à une association avec un antibiotique d’une autre classe pharmacologique (amoxicilline-acide clavulanique, pipéracilline-tazobactam et amikacine), notamment pour le traitement d’une prostatite à Pseudomonas aeruginosa et d’une infection pulmonaire soupçonnée.
Les analyses des prélèvements bactériologiques réalisés pour 18 des 23 patients étudiés (78 %) ont permis de retrouver au moins une bactérie. Escherichia coli (dont une souche possédant une bêta-lactamase à spectre étendu) correspondait à 60 % des bactéries rencontrées. On retrouvait également des Klebsiella spp., des Proteus mirabilis, des Citrobacter spp. et un Pseudomonas aeruginosa. L’analyse des résultats de l’antibiogramme a révélé que 85 % des bactéries retrouvées étaient sensibles aux fluoroquinolones.
Le tableau II présente les résultats de l’évaluation des dossiers des patients en fonction des différents critères regroupés de la SPILF. La justification d’une première prescription d’antibiotique n’est pas systématiquement notée dans le dossier du patient. Le diagnostic d’une infection présumée bactérienne n’est ainsi retrouvé que dans 61 % des dossiers de patients ayant une infection présumée. Un prélèvement à visée bactériologique est systématiquement réalisé (100 % des cas). L’évaluation de l’antibiothérapie à 72 heures n’est mentionnée que dans 39 % des dossiers médicaux. La durée prévisionnelle de l’antibiothérapie est mentionnée dans le dossier médical ou dans le système informatisé de prescription OrbisMD pour environ 40 % des dossiers. Les résultats des examens microbiologiques sont retrouvés de façon systématique dans le serveur intranet. Cependant le type de bactérie retrouvée dans les prélèvements bactériologiques est consigné de façon plus rare (35 %) dans le dossier médical du patient. La voie orale a été systématiquement respectée (100 % des traitements par fluoroquinolones prescrits par voie orale).
Tableau II. Répartition des 23 dossiers retenus selon les critères de réévaluation de l’antibiothérapie de la SPILF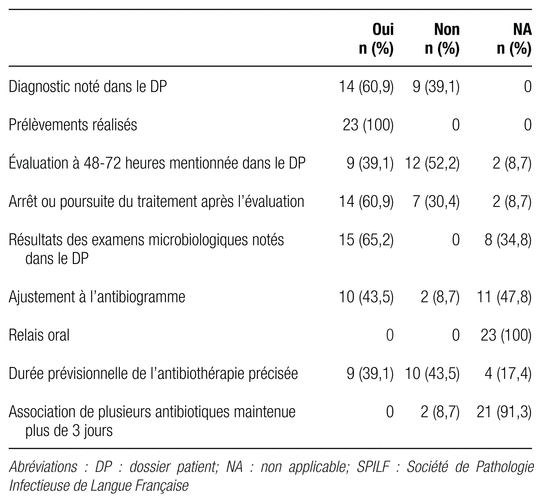
Pour préserver l’ensemble des avantages des fluoroquinolones, il est nécessaire de ne pas utiliser cette classe d’antibiotique de façon empirique, sauf dans quelques situations à bas risque définies au préalable. La consommation des fluoroquinolones doit être étroitement liée à leur bon usage. Les établissements hospitaliers se doivent de cibler les indications thérapeutiques de cette famille d’antibiotiques, d’où le rôle important que jouent la commission des anti-infectieux (qui regroupe des infectiologues, des pharmaciens et des anesthésistes et qui décide du référencement des anti-infectieux), les infectiologues, les microbiologistes et les pharmaciens au regard de l’écologie bactérienne de l’établissement.
Dans cette étude, la prescription de fluoroquinolones est réalisée le plus souvent de façon probabiliste (70 %). L’enjeu étant de protéger cette classe thérapeutique d’antibiotique, une étude de pertinence pourrait permettre de déterminer si la prescription réalisée avant que ne soient connues la nature ou la sensibilité du microorganisme responsable de l’infection est justifiée. En effet, il existe des indications pour lesquelles les fluoroquinolones peuvent être le traitement de choix, comme les pyélonéphrites aigües simples ou les prostatites aigües. Néanmoins, parmi les nombreuses indications que possède cette classe d’antibiotique, très peu n’offrent aucune autre option thérapeutique11.
En 2015, la SPILF a publié de nouvelles recommandations sur le traitement des infections urinaires acquises de façon communautaire10. Dans notre étude, quatre jeunes patients ont débuté une antibiothérapie par fluoroquinolones après avoir eu une bandelette urinaire positive, sans présenter de signes biologiques d’infection ni d’hyperthermie. Dans une telle situation, les recommandations de la SPILF conseillent un traitement court. La question de disposer au CHU d’un traitement antibiotique dit « minute » ou ne nécessitant qu’une seule prise médicamenteuse (autre qu’une fluoroquinolone) de la cystite aigüe peut se poser pour les infections communautaires se révélant dans les 48 heures après l’hospitalisation. Lorsqu’on soupçonne une infection urinaire liée aux soins avec un risque de complications, un traitement par fluoroquinolones doit être raisonné afin de contrôler l’émergence de résistances bactériennes, malgré l’efficacité de cette famille d’antibiotiques sur les bactéries à Gram négatif12. Il serait intéressant de travailler sur la création de protocoles informatisés pour la prise en charge empirique d’infections communautaires ou liées aux soins. Ces protocoles pourraient servir aux services d’hospitalisation traditionnelle et généraliser ainsi le bon usage de l’antibiothérapie.
Par ailleurs, il faut éviter de prescrire des fluoroquinolones lorsque cette classe thérapeutique a déjà été utilisée dans les six mois précédents. En effet, la réutilisation de fluoroquinolones durant cette période accroit le risque d’infections urinaires ou pulmonaires à entérobactérie résistante aux fluoroquinolones13. Les professionnels de la santé ignorent souvent cette information et, dans notre étude, aucune notion d’antécédents d’antibiothérapie n’était mentionnée dans le dossier du patient. La création d’un mémo pour le prescripteur – reprenant les règles de prescription d’un antibiotique en fonction du lieu d’infection – ou encore la désignation dans chaque service d’un médecin référent en infectiologie pourraient servir de relais aux équipes spécialistes d’infectiologie. Le mémo pourrait également mentionner la recherche systématique de différents critères cliniques et biologiques (hyperthermie, augmentation de la CRP, augmentation du taux des leucocytes sanguins) pour faciliter la prise de décision quant à la prescription d’une antibiothérapie. Il permettrait également de rappeler la biodisponibilité de ces molécules et ainsi de favoriser la voie orale par rapport à la voie intraveineuse. Dans notre étude, 100 % des fluoroquinolones ont été prescrites par voie orale, ce qui favorise très certainement une diminution des coûts de santé et des complications infectieuses14.
L’hyperthermie est un signe clinique capital pour le clinicien, car elle témoigne d’un processus pathologique responsable d’une réaction inflammatoire générale de l’organisme. Cependant, l’hyperthermie n’est pas systématiquement synonyme d’infection et encore moins d’une infection d’origine bactérienne. Le diagnostic d’infection bactérienne doit intégrer des éléments cliniques et biologiques, le plus souvent une numération de la formule sanguine et un résultat de la CRP. L’étude rapporte une médiane des dosages de la CRP à 23,8 mg/ml. Outre le fait que cette dernière soit peu élevée, elle manque également de spécificité (66 à 85 %)15,16. Cependant ce dosage est encore largement utilisé, malgré la publication d’études qui prouvent qu’il possède une faible valeur prédictive positive et qu’il est d’une faible utilité pour le suivi du patient sous traitement antibiotique17,18. Le dosage de la CRP devrait être considéré comme un des éléments d’un faisceau d’arguments et non de manière isolée. Ces différents critères cliniques et biologiques permettent d’apprécier la prise en charge thérapeutique et donc la qualité de la prescription d’une antibiothérapie.
En effet, le bon usage des antibiotiques doit tenir compte de la qualité des prescriptions d’antibiotiques. La réévaluation de l’antibiothérapie fait partie intégrante de cette qualité. Cette réévaluation est essentielle, car elle peut permettre de diminuer la consommation d’antibiotiques et donc la pression de sélection et la prévalence des bactéries multirésistantes19.
La réévaluation à 48–72 heures de l’antibiothérapie par fluoroquinolones est mentionnée dans 39 % des dossiers des patients de notre étude. Certaines publications font mention de cette réévaluation à des taux plus élevés que ceux observés dans notre étude (65 à 74 %)20–22. Ce taux plus élevé peut s’expliquer par le fait que l’une des études a été réalisée au sein d’une unité de réanimation, dans laquelle les médecins portent une attention plus grande à la réévaluation de l’antibiothérapie, en raison notamment des problèmes que posent les bactéries multirésistantes au quotidien23. Pour les deux autres études, la réévaluation de l’antibiothérapie a été considérée comme réalisée sur la base des résultats microbiologiques, de l’efficacité clinique, des effets indésirables rencontrés et de l’adaptation du traitement aux recommandations officielles20,21. Dans notre étude, la réévaluation a été jugée conforme quand elle était notée dans le dossier du patient. La réalisation systématique d’un examen bactériologique avant la mise sous antibiothérapie a probablement favorisé cette réévaluation. Cependant les résultats de cet examen n’ont pas toujours été consignés dans le dossier du patient comme le demandent les critères de la SPILF.
Le principal problème relevé durant cette enquête est le manque de données dans le dossier du patient (format papier), notamment celles liées aux critères de la SPILF. En effet, bien que ces derniers soient souvent connus des médecins, les données correspondantes ne sont pas consignées de façon systématique dans le dossier du patient. Avec la prescription informatique, il conviendrait de créer un formulaire que le médecin devrait remplir après 72 heures de traitement par antibiotique. Ce formulaire reprendrait les critères de la SPILF et serait archivé directement dans le dossier du patient.
La principale limite de cette étude vient de la petite taille de l’échantillon. En effet, la courte durée d’inclusion n’a pas permis d’obtenir un échantillon assez important. Le recrutement dans les services de neurologie en est certainement la cause, puisque les fluoroquinolones sont connues pour leur effet pro-convulsivant.
Cette étude reflète l’utilisation de fluoroquinolones dans les services de soins neurologiques de notre CHU. L’utilisation de cette classe d’antibiotique est mal connue, mais nous pouvons y remédier en se posant quelques questions : quel est le site à traiter? Le patient présente-t-il des critères biologiques et cliniques d’infection? Quelles sont les dernières recommandations officielles en ce qui concerne l’antibiothérapie de choix? La réévaluation de l’antibiothérapie, bien qu’elle soit le plus souvent réalisée, n’est pas toujours consignée dans le dossier de soins du patient. Une étude de la pertinence des prescriptions de fluoroquinolones permettrait d’évaluer les pratiques professionnelles de divers services hospitaliers. Des protocoles informatisés de prise en charge empirique d’infections communautaires et nosocomiales permettraient d’étendre le champ d’action à tous les antibiotiques. Il convient également de trouver un moyen d’avoir une réévaluation à 48–72 heures du début d’une antibiothérapie, par exemple sous la forme d’une alerte au sein du logiciel informatique. Enfin, la désignation pour chaque pôle d’un médecin référent en antibiothérapie, qui serait en étroite collaboration avec un infectiologue, pourrait être un bon moyen de promouvoir les bonnes pratiques de prescriptions des anti-infectieux.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflit d’intérêts potentiel. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Ministère de l’Emploi et de la Solidarité. Circulaire DHOS/E 2 - DGS/SD5A n° 2002-272 du 2 mai 2002 relative au bon usage des antibiotiques dans les établissements de santé et à la mise en place à titre expérimental de centres de conseil en antibiothérapie pour les médecins libéraux. [en ligne] http://www.sante.gouv.fr/fichiers/bo/2002/02-21/a0212060.htm (site visité le 25 juin 2015).
2. Haute Autorité de Santé. Décision n° 2014.0018/DC/SBPP du 5 février 2014 du collège de la Haute Autorité de santé adoptant la fiche mémo « Principes généraux et conseils de prescription des antibiotiques en premier recours ». [en ligne] http://www.has-sante.fr/portail/jcms/c_1725438/en/decision-n2014-0018/dc/sbpp-du-5-fevrier-2014-du-college-de-la-haute-autorite-de-sante-portant-adoption-de-la-fiche-memo-principes-generaux-et-conseils-deprescription-des-antibiotiques-en-premier-recours (site visité le 25 juin 2015).
3. Haute Autorité de Santé. Fiche mémo « Principes généraux et conseils de prescription des antibiotiques en premier recours ». [en ligne] http://www.has-sante.fr/portail/jcms/c_1723138/fr/principes-generaux-et-conseils-de-prescription-des-antibiotiques-en-premier-recours (site visité le 25 juin 2015).
4. Ministère du travail, de l’emploi et de la santé. Plan national d’alerte sur les antibiotiques 2011–2016. [en ligne] http://www.sante.gouv.fr/IMG/pdf/Plan_antibiotiques_2011-2016_.pdf. (site visité le 25 juin 2015).
5. Haute Autorité de Santé. Stratégie d’antibiothérapie et prévention des résistances bactériennes en établissement de santé. [en ligne] http://www.has-sante.fr/portail/upload/docs/application/pdf/bon_usage_des_antibiotiques_rapport_complet.pdf (site visité le 25 juin 2015).
6. Ministère des affaires sociales, de la santé et des droits des femmes. Circulaire interministérielle n° DGS/DHOS/DGAS/2009/264 du 19 août 2009 relative à la mise en œuvre du plan stratégique national 2009–2013 de prévention des infections associées aux soins. [en ligne] http://www.sante.gouv.fr/IMG/pdf/circulaire_264_190809.pdf (site visité le 25 juin 2015).
7. Ministère des affaires sociales et de la santé. Instruction n° 103 du 15 mars 2013 relative au bilan des activités de lutte contre les infections nosocomiales dans les établissements de santé pour l’année 2012 (ICATB2). [en ligne] http://www.sante.gouv.fr/fichiers/bo/2013/13-04/ste_20130004_0100_0051.pdf (site visité le 25 juin 2015).
8. Haute Autorité de Santé. Arrêté du 6 avril 2011 relatif au management de la qualité de la prise en charge médicamenteuse et aux médicaments dans les établissements de santé. [en ligne] http://www.has-sante.fr/portail/jcms/c_1085389/fr/cadre-reglementaire-de-la-prise-en-charge-medicamenteuse-en-etablissement-de-sante-evolutions-recentes (site visité le 25 juin 2015).
9. Haute Autorité de Santé. Manuel V2010 de certification des établissements de santé, avril 2011. Manuel V2014, janvier 2014
10. Société de pathologie infectieuse de langue française. Diagnostic et antibiothérapie des infections urinaires bactériennes communautaires de l’adulte. [en ligne] http://www.infectiologie.com/UserFiles/File/spilf/recos/infections-urinaires-spilf.pdf (site visité le 18 janvier 2016).
11. Agence française de sécurité sanitaire des produits de santé. Indications essentielles des fluoroquinolones et alternatives thérapeutiques. [en ligne] http://ansm.sante.fr/var/ansm_site/storage/original/application/9a8517d58f9b3613c4bbe589c36e6545.pdf (site visité le 25 juin 2015).
12. Conférence de consensus co-organisée par la société de pathologie infectieuse de langue française et l’association française d’urologie, 2002. Infections urinaires nosocomiales de l’adulte. [en ligne] http://www.infectiologie.com/site/medias/_documents/consensus/iun-02.pdf (site visité le 25 juin 2015).
13. Vellinga A, Tansey S, Hanahoe B, Bennett K, Murphy AW, Cormican M. Trimethoprim and ciprofloxacin resistance and prescribing in urinary tract infection associated with Escherichia coli: a multilevel model. J Antimicrob Chemother 2012;67:2523–30.
14. Shrayteh ZM, Rahal MK, Malaeb DN. Practice of switch from intravenous to oral antibiotics. Springerplus 2014;3:717–24.
15. Póvoa P. C-reactive protein: a valuable marker of sepsis. Intensive Care Med 2002;28:235–43.
16. Simon L, Gauvin F, Amre DK, Saint-Louis P, Lacroix J. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis. Clin Infect Dis 2004; 39:206–17.
17. Clyne B, Olshaker JS. The C-reactive protein. J Emerg Med 1999;17:1019–25.
18. Roger PM, Hung S, de Salvador F, Allieri-Rosenthal A, Farhad R, Pulcini C et coll. Utilité de la C-reactive protein dans le suivi thérapeutique des patients infectés. Med Mal Infect 2009;39:319–24.
19. Manuel O, Burnand B, Bady P, Kammerlander R, Vansantvoet M, Francioli P et coll. Impact of standardised review of intravenous antibiotic therapy 72 hours after prescription in two internal medicine wards. J Hosp Infect 2010;74:326–31.
20. Piednoir E, Borderan G-C, Krug E, Verger P, Le Dinh T. Évaluation de l’utilisation des antibiotiques dans un centre hospitalier général. Hygiènes 2007;15:150–7.
21. Mechkour S, Vinat A, Yilmaz M, Faure K, Grandbastien B. Quality of antibiotic (fluoroquinolones, aminosids and amoxicillin-clavulanic acid) prescription in a French teaching hospital. Pathol Biol (Paris) 2011;59:9–15.
22. Montay V, Alfandari S, Senneville E, Guery B, Georges H, Leroy O et coll. Evaluation of prescription of antibiotics in an intensive care unit. Presse Med 1998;27:700–4.
23. Roger PM, Labate C, Serre S, Zumbo C, Valério L, Bonnet H et coll. Factors associated with effective reassessment of antibiotic therapy on day 3. Med Mal Infect 2013;43:123–7.
PHARMACTUEL, Vol. 49, No. 1, 2016