Ariane Cantin1, Pharm.D., M.Sc., Alexandre Lahaie2, Pharm.D., M.Sc., Laurent Nguyen3, Pharm.D.
Reçu le 23 août 2015; Accepté après révision par les pairs le 18 décembre 2015
Titre : Lactulose vs Polyethylene Glycol 3350-Electrolyte solution for treatment of overt hepatic encephalopathy. The HELP randomized clinical trial. JAMA Intern Med 2014;174:1727-331.
Auteurs : Rahimi RS, Singal AG, Cuthbert JA, Rockey DC.
Commanditaires : L’étude a obtenu un soutien financier des National Institutes of Health (NIH) et du National Center for Advancing Translational Sciences. Ces institutions n’ont joué aucun rôle dans la conduite de l’étude.
Cadre de l’étude : L’encéphalopathie hépatique aiguë (EHA) est une complication neuropsychiatrique bien documentée dans la population souffrant de cirrhose, et qui se manifeste par divers symptômes tels qu’un trouble du comportement ou une atteinte de l’état de conscience, voire même un coma1,2. Elle est associée à un risque accru de décès et à des coûts importants en santé2,3. Son étiologie demeure complexe, multifactorielle et mal comprise2,4. Parmi les différentes théories, la production d’ammoniac par les bactéries de l’intestin serait un facteur contributoire expliquant les symptômes associés, et la maladie serait principalement due à l’incapacité du foie cirrhotique de métaboliser l’ammoniac4–6. Les options thérapeutiques comportent habituellement l’utilisation de disaccharides non absorbables (comme le lactulose) ou d’antibiotiques (comme la rifaximine ou le métronidazole) afin d’éliminer les métabolites toxiques de l’appareil digestif, dont l’ammoniaque7. Les laxatifs de type disaccharides non absorbables, particulièrement le lactulose, sont devenus le traitement de première intention depuis la parution du premier rapport d’efficacité en 19668. Selon les associations American Association for the Study of Liver Diseases et European Association for the Study of the Liver, la posologie habituelle du lactulose est de 20 à 30 g ou de 25 ml toutes les une à deux heures jusqu’à l’obtention de deux à trois selles molles par jour9,10. Bien que le lactulose soit le traitement de premier choix recommandé, son mécanisme d’action reste méconnu. L’hypothèse la plus valide serait que la métabolisation du lactulose par les bactéries entériques libère des acides organiques qui se lient à l’ammoniac pour former des ions ammonium qui ne peuvent traverser la paroi intestinale8–10. De plus, le milieu acide généré par le laxatif favorise une flore bactérienne produisant moins d’ammoniac8–10. Cependant, avec un taux d’échec du traitement pouvant aller jusqu’à 20 %, d’autres solutions thérapeutiques sont à envisager11. Toutefois, il y a peu d’études avec d’autres types de laxatifs. Avant l’ère du lactulose, les sels de magnésium étaient utilisés, ce qui laisse ainsi supposer qu’un effet cathartique seul serait efficace12. Cependant, peu d’études ont évalué l’utilisation des sels de magnésium en tant que traitement de première intention.
Parmi les produits laxatifs figure le polyéthylène glycol 3350 avec électrolytes (PEG-E), fréquemment utilisé auprès des patients nécessitant une colonoscopie (ColyteMD, GolytelyMD)13. Le PEG-E a fait preuve d’une bonne innocuité, et son effet cathartique est potentiellement plus important que celui du lactulose. L’objectif de cette étude est donc d’évaluer l’efficacité et l’innocuité du PEG-E comme option thérapeutique pour le traitement de l’EHA. L’hypothèse soulevée par les auteurs est que l’efficacité du PEG-E serait supérieure à celle du lactulose pour le traitement de l’EHA, en raison de son effet cathartique plus puissant.
Protocole de recherche : Il s’agit d’une étude clinique à répartition aléatoire, monocentrique, à simple insu, menée dans un hôpital de Dallas entre janvier 2011 et juin 2012. L’étude comparait l’administration du lactulose à celle du PEG-E pour des patients se présentant au service des urgences avec une cirrhose connue et une altération du niveau de conscience. Les patients sélectionnés étaient suivis jusqu’à leur départ de l’hôpital. L’étude a été approuvée par le comité d’éthique de l’institution.
Patients : Les patients âgés de 18 à 80 ans, avec un diagnostic de cirrhose d’étiologie quelconque, en présence d’une EHA pouvaient participer à l’étude. Étant donné l’altération de l’état de conscience des patients, le consentement d’un tuteur légal était nécessaire pour la participation à l’étude. Les patients étaient exclus s’ils présentaient l’un des critères suivants : insuffisance hépatique aiguë (définie par une coagulopathie avec un ratio normalisé international supérieur à 1,5) sans antécédent d’hépatopathie chronique, altération de l’état de conscience due à une autre cause que l’EHA, prise de rifaximine ou de néomycine dans les sept jours précédents, prise de plus d’une dose de lactulose avant d’avoir obtenu le consentement, absence de tuteur pour fournir le consentement, refus du tuteur de consentir à la participation à l’étude, participation antérieure à l’étude, instabilité hémodynamique nécessitant l’utilisation de vasopresseurs, grossesse, statut de prisonnier.
Interventions : Les patients admissibles étaient répartis aléatoirement dans les deux groupes, avec un ratio d’attribution de 1:1. Le groupe qui suivait le traitement standard recevait du lactulose à raison de 20 à 30 g par voie orale ou par tube naso-gastrique (trois doses ou plus par jour) ou 200 g par voie intra-rectale si l’administration par voie orale était impossible. Les auteurs ne mentionnent pas de quelle façon ils ont optimisé la dose du lactulose et ils ne mentionnent aucun décompte de selles. Le groupe à l’étude recevait quatre litres de PEG-E en une seule dose administrée par voie orale ou par tube naso-gastrique (selon le jugement du médecin traitant) sur une période de quatre heures. À la suite de l’administration du PEG-E, aucun autre traitement pour l’EHA n’était autorisé pendant un délai de 24 heures, au terme duquel les chercheurs évaluaient le score HESA (Hepatic Encephalopathy Scoring Algorithm) des patients. Après cette période, les patients ayant reçu le PEG-E pouvaient recevoir du lactulose si nécessaire.
Points évalués : L’objectif primaire d’efficacité était l’amélioration d’un point ou plus du score HESA 24 heures après l’administration du traitement. L’échelle HESA comporte quatre points pour mesurer la gravité de la maladie, allant de léger (grade 0) à très grave (grade 4)14. Les objectifs secondaires comprenaient la durée d’hospitalisation et le temps nécessaire pour la résolution de l’EHA. L’étude évaluait également l’innocuité des traitements à l’aide d’analyses de laboratoire (notamment le taux sérique de sodium, de potassium, de créatinine et d’urée) et selon les effets indésirables rapportés.
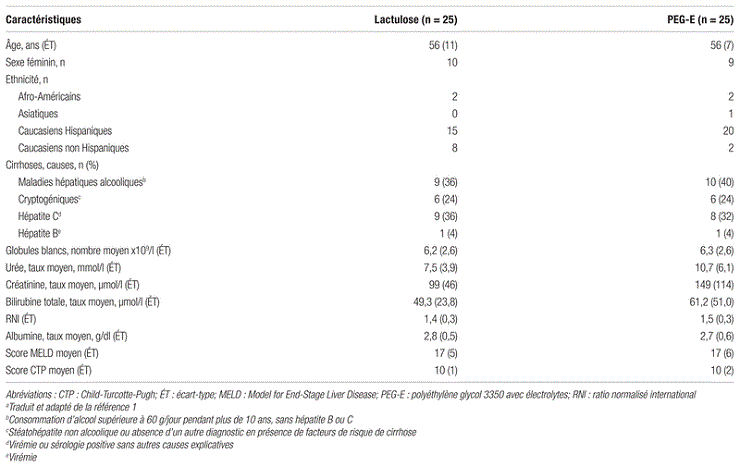
Résultats : Au total, les chercheurs ont évalué 186 patients; de ce nombre, 136 ont été exclus de l’étude. Les raisons d’exclusion les plus fréquentes étaient la prise de plus d’une dose de lactulose avant de consentir à participer à l’étude, l’absence de tuteur légal pour fournir le consentement et l’absence d’encéphalopathie hépatique. Des 50 patients répartis aléatoirement, 25 ont été affectés au groupe lactulose et 25 au groupe PEG-E. Il est à noter qu’un patient assigné au PEG-E a changé de traitement pour du lactulose intra-rectal en raison de l’impossibilité d’administrer la solution par voie orale ou par tube naso-gastrique. De plus, deux patients du groupe PEG-E ont été exclus de l’analyse primaire, car leur score HESA n’a pas été obtenu 24 h après le traitement. Les caractéristiques de base des patients étaient comparables dans les deux groupes, à l’exception du niveau d’urée sérique plus élevé dans le groupe PEG-E (p=0,03). Les patients sélectionnés étaient majoritairement d’origine hispanique, et près de la moitié présentait une cirrhose d’origine alcoolique. Telle que présentée dans le tableau I, la population à l’étude représente une population cirrhotique habituelle : des patients principalement de sexe masculin avec une moyenne d’âge de 56 ans15.
Tableau I Caractéristiques de base des patients à l’étudea
En ce qui concerne le critère d’évaluation primaire, la moyenne du score HESA après 24 h de traitement est passée de 2,3 à 1,6 (différence de 0,7) pour le groupe ayant reçu le traitement standard, et de 2,3 à 0,9 (différence de 1,5) pour le groupe ayant reçu le traitement expérimental; la différence de variation du score entre les deux groupes était statistiquement significative (p=0,002). En ce qui concerne les critères d’évaluation secondaires, le temps médian pour la résolution de l’EHA était de deux jours dans le groupe traité avec le lactulose, par rapport à un jour dans le groupe traité avec la solution de PEG-E (p=0,01). La durée d’hospitalisation semblait également plus courte dans le groupe ayant reçu le PEG-E (durée moyenne de 4 ± 3 jours comparativement à 8 ± 12 jours pour le groupe ayant reçu le lactulose [p=0,07]); toutefois cette différence n’était pas statistiquement significative. Les auteurs ont également comparé le taux sérique d’ammoniaque entre les groupes lorsque ce résultat était disponible. Ce taux, similaire dans les deux groupes au début de l’étude, était plus bas après 24 h de traitement pour le groupe ayant reçu le traitement standard que pour celui ayant reçu le PEG-E (82 μmol/l comparativement à 120 μmol/l, p=0,049; tableau II).
Tableau II Résumé des résultats
Sur le plan de l’innocuité, chaque thérapie était bien tolérée, sans effets indésirables majeurs pouvant être liés de façon certaine ou probable aux traitements de l’étude. Une proportion plus élevée des patients sous lactulose ont rapporté des ballonnements, alors que les patients sous PEG-E ont rapporté plus fréquemment une diarrhée. En ce qui concerne les paramètres de laboratoire, il n’y a pas eu de changement significatif du taux sérique de sodium, de créatinine et d’urée à 0, 6 et 24 h après le début du traitement. Toutefois, le taux sérique de potassium a diminué dans le groupe PEG-E, passant de 4,3 mmol/l à 3,8 mmol/l (p=0,006). Ces paramètres ont été mesurés pour évaluer si les traitements pouvaient altérer les taux sériques d’électrolytes et la fonction rénale. Plus de 50 % des patients ayant reçu le traitement à l’étude ont préféré le goût salé du PEG-E au goût sucré du lactulose et ont souhaité continuer à prendre du PEG-E plutôt que du lactulose à leur congé de l’hôpital.
L’étude HELP est la première étude ayant évalué le PEG-E pour le traitement de l’EHA comparativement au traitement standard par lactulose. L’objectif de cette étude était de déterminer si un effet purgatif seul pouvait traiter efficacement l’EHA. L’étude a démontré que le PEG-E était une stratégie thérapeutique efficace et faisant preuve d’innocuité dans le contexte de l’EHA. Comparé au traitement standard par lactulose, le PEG-E entraînait une meilleure amélioration des symptômes après 24 heures de traitement, selon le score HESA. De plus, l’EHA s’est résolue plus rapidement chez les patients traités par PEG-E. Il s’agit d’un avantage pour les professionnels de la santé, puisque cela leur permet de gérer plus rapidement l’EHA. Bien que la différence ne soit pas statistiquement significative, le traitement sous PEG-E a réduit la durée moyenne d’hospitalisation de moitié comparativement au traitement par lactulose. Les auteurs rapportent que le coût moyen au États-Unis d’une prise en charge de l’EHA s’élève jusqu’à 38 130 $, selon les données de 2011 du Healthcare Cost and Utilization Project16. Cette nouvelle approche thérapeutique pourrait donc se montrer intéressante sur le plan des économies de coûts hospitaliers.
Un des facteurs contributoires de l’EHA serait la production excessive d’ammoniac par les bactéries de l’appareil digestif1,2,4. Il semble y avoir peu de lien entre l’ammoniémie et la gravité des symptômes. L’étude reflète bien cette étiologie toujours controversée. En effet, la diminution plus grande du taux d’ammoniaque sanguin observée avec le lactulose ne semble pas corréler avec l’efficacité clinique, puisque le traitement par PEG-E s’est avéré plus avantageux. Une étude publiée en 2007 n’a pas trouvé de différence entre le taux d’ammoniaque des patients présentant des symptômes légers et celui des patients asymptomatiques5.
À ce jour, il n’existe aucun étalon-or pour décider du stade de l’encéphalopathie hépatique14. Toutefois, plusieurs outils existent pour évaluer la gravité et l’évolution des symptômes d’encéphalopathie hépatique, tels que le HESA – qui combine des éléments objectifs et subjectifs – et le score de West Haven14. En l’absence d’un outil de mesure normalisé, l’échelle HESA demeure adéquate. Cette échelle a été validée principalement pour des patients avec une EHA de grade 3 ou 4. L’échelle devient donc plus difficile à interpréter pour les patients ayant des symptômes plus légers (grades 1 et 2). Ainsi, on ne peut garantir qu’un patient passant d’un grade 3 à un grade 2 équivaut d’un point de vue clinique à un patient allant d’un grade 2 à un grade 1. Une diminution d’un grade du score HESA n’a donc probablement pas la même valeur selon le score initial du patient. Pour contrer cette faiblesse, certains auteurs ont même suggéré de regrouper ces stades en deux catégories, soit les grades élevés (3–4) et faibles (1–2)14. Une diminution d’au moins deux grades du score HESA semblerait plus significative sur le plan clinique.
Les résultats de l’étude HELP montrent qu’une plus grande proportion de patients ayant reçu du PEG-E a connu une amélioration de leur score HESA d’au moins un point comparativement aux patients ayant reçu du lactulose (tableau III). Une diminution d’au moins deux grades du score HESA a été rapportée pour 43 % des patients du groupe PEG-E, par rapport à 16 % des patients du groupe lactulose. Dix patients du groupe PEG-E ont eu un score HESA égal à zéro après 24 heures de traitement, comparativement à deux patients du groupe lactulose. Enfin, près de la moitié des patients ayant reçu le traitement standard (48 %) n’ont eu aucune amélioration de leurs symptômes, comparativement à seulement 9 % des patients traités par PEG-E. Le traitement par PEG-E semble donc apporter un avantage clinique plus important que le traitement par lactulose.
Tableau III Changement dans les grades du score HESA après 24 h de traitement
Une force de l’étude est le choix du PEG-E comme traitement expérimental, puisqu’il est largement disponible, peu onéreux et bien toléré. L’étude comporte plusieurs faiblesses. Les chercheurs ne travaillaient pas à l’aveugle, ce qui a pu affecter la validité des résultats, car l’algorithme HESA comporte des éléments subjectifs. Pour atténuer ce biais, le chercheur chargé d’obtenir le consentement du patient et de distribuer les traitements était différent, dans la mesure du possible, de celui chargé d’administrer le questionnaire HESA au patient.
L’étude ne portait que sur un faible échantillon de seulement 50 patients au total et n’a été effectuée que dans un seul centre, ce qui affecte sa validité externe. Le critère d’évaluation primaire était de détecter une différence du score HESA entre les deux groupes de traitements. Normalement, la taille d’échantillon doit être évaluée en fonction de la différence de l’effet envisagé, dans ce cas-ci, une différence du score HESA. Cependant, dans cette étude, le calcul de la taille de l’échantillon reposait sur un taux de réponse au PEG-E estimé à 90 %, ce qui pourrait expliquer l’imprécision des résultats. Deux patients ayant reçu le traitement PEG-E ont été exclus de l’analyse primaire, car leur score HESA à 24 heures était manquant. Il aurait été pertinent d’effectuer d’autres analyses statistiques permettant d’inclure ces données manquantes. Cela aurait fourni un résultat ainsi qu’une conclusion plus robuste.
L’étude s’est concentrée sur le traitement aigu d’un épisode d’EHA dans le service des urgences. Étant donné les symptômes récurrents et réfractaires de l’encéphalopathie hépatique, le PEG-E n’a pas été étudié dans un contexte d’utilisation chronique pour cette indication. Selon les auteurs, plus de 50 % des patients ont préféré le goût salé du PEG-E comparativement au goût sucré du lactulose.
D’autres études sont nécessaires afin de définir la posologie adéquate du PEG-E pour un usage chronique. Le PEG-E ne peut donc pas être recommandé pour une prise à long terme pour le moment.
Le traitement usuel de l’EHA avec le lactulose consiste à titrer la dose jusqu’à ce que le patient obtienne deux à trois selles molles par jour8–10. Cependant, les auteurs n’ont pas rapporté un décompte de selles dans l’étude. Il se peut donc que les patients du groupe lactulose aient reçu un traitement inférieur au traitement standard habituellement recommandé. Par ailleurs, plusieurs variables confondantes pouvant influencer les résultats n’ont pas été prises en compte par les auteurs. L’étude excluait les patients ayant reçu de la rifaximine ou de la néomycine, afin d’éviter que ces traitements n’affectent les objectifs de l’étude. Finalement, des médicaments comme les narcotiques ou les benzodiazépines peuvent aggraver les signes et les symptômes d’encéphalopathie. Il aurait été pertinent de considérer la médication concomitante des patients à l’étude.
Bien que l’étude HELP n’ait pas été effectuée à double insu, l’administration de la solution de PEG-E a engendré une amélioration plus rapide de l’EHA comparativement au lactulose, en plus d’avoir potentiellement diminué la durée de l’hospitalisation dans un contexte aigu. Ces résultats suggèrent qu’un effet cathartique important serait efficace pour traiter l’EHA et pourrait devenir une bonne stratégie thérapeutique sur le plan du rapport coût-efficacité. Cette étude remet en question le dogme des disaccharides non absorbables comme traitement de première intention de l’EHA et ouvre la porte à de nouvelles recherches avec des laxatifs faisant preuve d’innocuité, comme le PEG-E. Compte tenu de la nature monocentrique de l’étude et de la posologie possiblement non optimale du lactulose dans cette étude, d’autres essais cliniques sont nécessaires afin de concrétiser l’application du traitement par PEG-E dans la pratique. L’efficacité et l’innocuité à long terme du PEG-E restent également à être évaluées dans cette indication.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et les collaborateurs. Une autorisation écrite a été obtenue de ces personnes.
1. Rahimi RS, Singal AG, Cuthbert JA, Rockey DC. Lactulose vs polyethylene glycol 3350-electrolyte solution for treatment of overt hepatic encephalopathy: the HELP randomized clinical trial. JAMA Intern Med 2014;174:1727–33.
2. Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei AT. Hepatic encephalopathy— definition, nomenclature, diagnosis, and quantification: final report of the working party at the 11th World Congress of Gastroenterology, Vienna, 1998. Hepatology 2002;35:716–21.
3. Poordad FF. Review article: the burden of hepatic encephalopathy. Aliment Pharmacol Ther 2007;25(suppl. 1):3–9.
4. Blei AT, Córdoba J. Hepatic encephalopathy. Am J Gastroenterol 2001;96:1968–76.
5. Shawcross DL, Wright G, Olde Damink SW, Jalan R. Role of ammonia and inflammation in minimal hepatic encephalopathy. Metab Brain Dis 2007;22:125–38.
6. Rose CF. Ammonia-lowering strategies for the treatment of hepatic encephalopathy. Clin Pharmacol Ther 2012;92:321–31.
7. Frederick RT. Current concepts in the pathophysiology and management of hepatic encephalopathy. J Gastroenterol Hepatol 2011;7:222–33.
8. Bircher J, Müller J, Guggenheim P, Haemmerli UP. Treatment of chronic portal-systemic encephalopathy with lactulose. Lancet 1966;1:890–2.
9. Vilstrup H, Amodio P, Bajaj J, Cordoba J, Ferenci P, Mullen KD et coll. Hepatic encephalopathy in chronic liver disease: 2014 Practice Guideline by the American Association for the Study of Liver Diseases and the European Association for the Study of the Liver. Hepatology 2014;60:715–35.
10. Elkington SG, Floch MH, Conn HO. Lactulose in the treatment of chronic portal-systemic encephalopathy: a double-blind clinical trial. N Engl J Med 1969;281:408–12.
11. Sharma P, Sharma BC, Sarin SK. Predictors of nonresponse to lactulose in patients with cirrhosis and hepatic encephalopathy. Eur J Gastroenterol Hepatol 2010;22:526–31.
12. Delp M, Manning RT. The management of hepato-cerebral intoxication. Trans Am Clin Climatol Assoc 1958;69:161–75.
13. Belsey J, Epstein O, Heresbach D. Systematic review: oral bowel preparation for colonoscopy. Aliment Pharmacol Ther 2007;25:373–84.
14. Hassanein T, Blei AT, Perry W, Hilsabeck R, Strange J, Larsen FS et coll. Performance of the hepatic encephalopathy scoring algorithm in a clinical trial of patients with cirrhosis and severe hepatic encephalopathy. Am J Gastroenterol 2009;104:1392–400.
15. Cordoba J. Characteristics, risk factors, and mortality of cirrhotic patients hospitalized for hepatic encephalopathy with and without acute-on-chronic liver failure (ACLF). J Hepatol 2014;60:275–81.
16. Agency for healthcare research and quality (AHRQ). Healthcare cost and utilisation project (HCUP) [en ligne] http://www.ahrq.gov/research/data/hcup/index.html (site visité le 1er août 2015).
PHARMACTUEL, Vol. 49, No. 2, 2016