
Vincent Dagenais-Beaulé1,2,3, Pharm.D., M.Sc, Alice Mathieu-Bégin1,4,5, Pharm.D., M.Sc.
Reçu le 23 août 2015; Accepté après révision par les pairs le 18 octobre 2015
Titre : Cumulative use of strong anticholinergics and incident dementia: a prospective cohort study. JAMA Intern Med 2015;175:401-71.
Auteurs : Gray SL, Anderson ML, Dublin S, Hanlon JT, Hubbard R, Walker R et coll.
Commanditaires : L’étude a reçu des fonds de recherche du National Institute on Aging et de la fondation Branta. Les commanditaires n’ont pas eu de rôle actif dans l’étude.
Cadre de l’étude : Le taux d’utilisation des médicaments au potentiel anticholinergique élevé varie entre 8 et 37 % dans la population âgée, malgré la présence d’effets indésirables importants comme une somnolence, une rétention urinaire, des chutes, un délirium, une constipation, une xérostomie et une tachycardie1–3. Le délirium pourrait augmenter le risque de démence, d’institutionnalisation et de mortalité; il est donc lourd de conséquences4. De plus, le trouble cognitif – qui peut donc être un effet indésirable de cette thérapie – est un des syndromes gériatriques problématiques et il diminue la survie du patient5. Au Canada, on estime que le fardeau économique des démences s’élève à 15 milliards de dollars en 2008, avec notamment un fardeau financier pour les aidants naturels devant renoncer à leur salaire qui s’élève à environ cinq milliards de dollars6. Ces facteurs peuvent donc avoir des effets importants sur la qualité de vie des personnes âgées, ainsi que sur l’entourage de ces personnes et la société.
De plus, les changements pharmacodynamiques et pharmacocinétiques qui affectent les personnes âgées les rendent plus susceptibles de manifester des effets indésirables des médicaments ayant un potentiel anticholinergique7,8. Une diminution de l’activité neuronale cholinergique chez les personnes âgées peut contribuer à cette augmentation du risque9. De plus, l’augmentation de la perméabilité de la barrière hémato-encéphalique chez ces personnes accroît l’exposition du système nerveux central (SNC) à des médicaments comme l’amitriptyline, la diphenhydramine, la prochlorpérazine et aggrave donc les effets néfastes de ces médicaments sur le SNC7,9,10. De la même manière, une réduction de la clairance rénale, une diminution de certaines voies métaboliques, ainsi que l’excrétion des médicaments, peuvent également augmenter l’exposition globale de l’organisme aux médicaments ayant un potentiel anticholinergique élevé11.
Plusieurs échelles ou listes ont été élaborées pour mieux cibler les médicaments ayant un potentiel anticholinergique élevé et dont l’usage par les personnes âgées est à éviter ou à surveiller, afin de prévenir les effets indésirables pour cette population. Les outils les plus utilisés sont les critères de Beers, ainsi que les échelles Anticholinergic Drug Scale et Anticholinergic Risk Scale2,12,13. Des scores élevés indiquent une activité anticholinergique plus élevée qu’un score nul2,13. Bien que ces listes et ces scores aient été validés, il n’existe pas pour le moment de liste faisant consensus. En effet, selon les échelles, certains médicaments (comme l’alprazolam) avaient un potentiel anticholinergique élevé ou nul. Plus récemment, Durán et coll. ont établi une liste plus uniforme après avoir passé en revue la documentation scientifique portant sur les différents scores existant14.
Cependant, il existe peu de données sur les risques neurologiques à long terme d’une utilisation cumulative de médicaments ayant un potentiel anticholinergique élevé, comme le risque de contracter une démence ou la maladie d’Alzheimer15,16.
Protocole de recherche : Il s’agit d’une étude de cohorte ouverte prospective, qui porte sur une population provenant de l’étude Adult Changes in Thought Study menée à Seattle, aux États-Unis. L’exposition cumulative à des médicaments à potentiel anticholinergique élevé était mesurée avant l’entrée des participants dans l’étude, pendant les 10 ans précédant l’inclusion. Une fois sélectionnées, les personnes étaient suivies afin de détecter si elles contractaient une démence.
Patients : Les participants inclus devaient être des adultes d’un âge égal ou supérieur à 65 ans. Ils devaient être membres de Group Health, un fournisseur de soins de santé. Ce critère permettait aux auteurs de l’étude de recenser les prescriptions des participants et donc d’évaluer leur exposition aux médicaments. En effet, Group Health permet l’accès aux bases de données contenant les prescriptions remplies par les patients dans les 10 ans avant leur entrée dans l’étude. Les patients atteints de démence étaient exclus. Le recrutement s’est déroulé entre 1994 et 1996, puis entre 2000 et 2003 et a permis de sélectionner 3 434 patients. De plus, les personnes devaient avoir reçu au moins une visite de suivi pour être incluses dans l’analyse. Les suivis consistaient en des visites médicales bisannuelles y compris une évaluation de la fonction cognitive.
Interventions : L’exposition cumulative des participants à des médicaments ayant un potentiel anticholinergique était mesurée par l’analyse des dossiers informatiques des 10 années précédentes, qui contenaient donc les médicaments qui avaient été prescrits et distribués aux participants. La liste des médicaments anticholinergiques utilisée par les auteurs reposait sur les critères de Beers, mais comprenait aussi d’autres médicaments qui ne sont plus sur le marché (comme la cycrimine), mais qui l’étaient encore pendant la période d’inclusion12. Les médicaments en vente libre n’étaient pas comptabilisés.
L’utilisation de médicaments à potentiel anticholinergique élevé était évaluée par un score correspondant à la somme des doses quotidiennes standardisées (SDQS). D’abord, pour chaque médicament ayant un potentiel anticholinergique élevé, un score était calculé en fonction de la dose de médicament prescrite et de la dose minimale efficace par jour recommandée pour les personnes âgées selon le Geriatric Dosage Handbook17. Par exemple, les doses quotidiennes recommandées par cet ouvrage de référence sont de 50 mg pour la diphenhydramine, de 10 mg pour l’amitriptyline et de 200 mg pour le dimenhydrinate. Ensuite, la somme des scores pour chaque médicament permettait d’obtenir le score total, à savoir la SDQS. Une journée de prise de médicament à dose minimale correspond donc à une SDQS égale à 1 (voir un exemple dans le tableau I). Ce score a déjà été utilisé, mais n’a jamais été validé en pratique18,19.
Tableau I. Exemple de calcul de la SDQS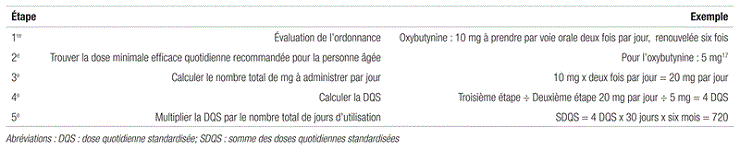
L’exposition cumulative a été divisée en catégories selon la durée et la dose des médicaments choisis. Ces catégories sont les suivantes : SDQS nulle, 1 à 90, 91 à 365, 366 à 1 095 et supérieure à 1 095. Les auteurs ont déterminé les bornes de chaque catégorie selon des critères d’interprétation clinique et la distribution des scores obtenus. Une SDQS de 1 095 représente trois ans d’exposition d’un médicament à la dose minimale efficace, comme l’utilisation d’une dose d’oxybutynine par voie orale de 5 mg par jour.
Points évalués : L’objectif primaire de l’étude était d’évaluer le risque de démence associé à une utilisation cumulative de médicaments anticholinergiques sur une période de 10 ans. La démence était évaluée à l’entrée de l’étude et lors des visites bisannuelles à l’aide de l’outil Cognitive Abilities Screening Instrument20. Cet outil permettait de dépister la démence et les participants correspondants étaient évalués par la suite par un médecin qui posait un diagnostic, établi selon les critères prédéfinis (voir tableau II)21,22.
Tableau II. Évaluation réalisée lors des visites de suivi bisannuelles
Cette étude évaluait les covariables suivantes : âge à l’entrée de l’étude, sexe, race, niveau d’éducation, indice de masse corporelle, statut tabagique, pratique d’une activité physique régulière, perception de l’état de santé, hypertension, diabète, antécédents d’accident vasculaire cérébral (AVC), maladie coronarienne, maladie de Parkinson, symptômes dépressifs, utilisation de benzodiazépines et génotype de l’apolipoprotéine ɛ4.
Résultats : Parmi les 3 434 patients inclus dans l’étude, 78,3 % ont rempli au moins une prescription pour un médicament à potentiel anticholinergique élevé dans les 10 ans précédant leur entrée dans l’étude. Les classes médicamenteuses les plus souvent prescrites étaient les antidépresseurs (principalement la doxépine), les antihistaminiques (principalement la chlorphéniramine) et les antimuscariniques utilisées pour traiter l’incontinence urinaire (principalement l’oxybutynine). Les caractéristiques des patients inclus dans l’étude sont présentées dans le tableau III.
Tableau III. Caractéristiques des différents groupesa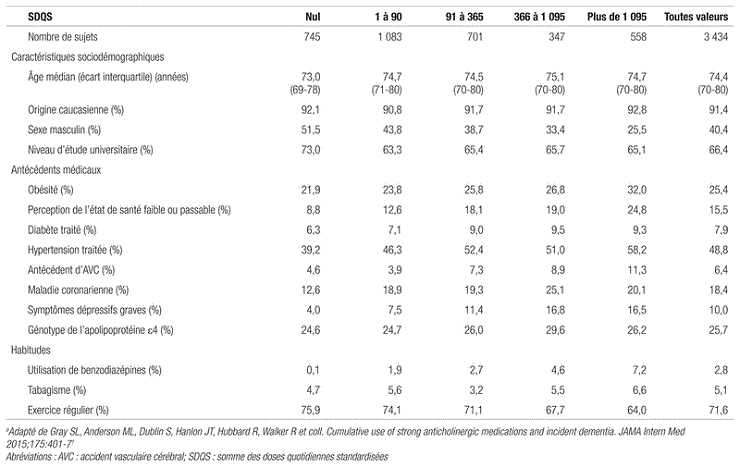
Pendant le suivi moyen de 7,3 ans, 797 sujets (23,2 % des participants) ont contracté une démence. La démence la plus fréquente était celle d’Alzheimer, présente chez 637 participants (79,9 % des cas de démence).
Le rapport de risque a été calculé pour chaque catégorie de SDQS et a été ajusté selon les covariables. Les participants ayant une SDQS nulle (n’ayant pris aucun médicament ayant un potentiel anticholinergique élevé) représentaient le rapport de risque de référence, c’est-à-dire un risque de 1. Seul le groupe avec une SDQS supérieure à 1 095 présente une augmentation statistiquement significative du risque de démence (rapport de risque [RR] : 1,54; intervalle de confiance à 95 % [IC 95 %] : 1,21–1,96; p < 0,001) (voir tableau IV).
Tableau IV. Association entre l’usage cumulatif, sur une période de 10 ans, de médicament ayant un potentiel anticholinergique et la fréquence des cas de démence et de démence de type Alzheimera
Les auteurs ont également mesuré les liens entre l’utilisation de médicaments ayant un potentiel anticholinergique élevé et l’apparition de la démence de type Alzheimer. Ces rapports de risque calculés ont été ajustés selon les mêmes covariables. De la même façon, en ce qui concerne l’apparition de la démence de type Alzheimer, seul le groupe avec la SDQS la plus élevée (supérieure à 1 095) obtient une augmentation statistiquement significative du rapport de risque de présenter ce type de démence (RR:1,63;IC 95 %:1,24–2,14; p<0,001). Le nombre nécessaire pour nuire – c’est-à-dire le nombre de patients qu’il est nécessaire de traiter avec des médicaments à potentiel anticholinergique pour qu’un patient contracte une démence, lorsqu’on compare les patients ayant la SDQS la plus élevée (supérieure à 1 095) à ceux ayant une SDQS nulle – est de sept.
Le risque accru de démence reste le même, que l’usage des médicaments à potentiel anticholinergique élevé soit récent ou plus ancien. Le risque accru de démence n’est pas influencé par le caractère continu ou intermittent de l’usage des médicaments à potentiel anticholinergique élevé pour le groupe ayant une SDQS supérieure à 1 095.
Bien qu’il soit généralement accepté que les médicaments ayant un potentiel anticholinergique élevé entraînent des effets sur la cognition, le lien entre la prise de ces médicaments et une démence est moins bien établi9. Plusieurs raisons expliquent ce manque de données probantes. D’abord, la démence se développe sur le long terme, et les études sont souvent limitées par un suivi de courte durée. Afin de contourner cette limite, les études évaluent des objectifs intermédiaires, comme le trouble cognitif léger. De plus, la plupart des recherches étant observationnelles, rétrospectives et menées auprès d’une petite population, la puissance de l’étude est souvent insuffisante pour démontrer clairement et de façon convaincante une association ou l’absence de celle-ci15,16. Enfin, à l’heure actuelle, il ne semble pas y avoir de méthode consensuelle pour calculer la charge anticholinergique ni de seuil déterminé au-delà duquel le risque serait plus inquiétant. Les définitions sont donc différentes d’une étude à l’autre, ce qui limite la possibilité de pouvoir regrouper ces études pour en augmenter la puissance.
Récemment, deux études de cohorte prospectives ont fait ressortir un lien entre l’utilisation de médicaments ayant un potentiel anticholinergique et l’apparition d’une démence ou de troubles cognitifs légers. Ces études ont rapporté une augmentation du risque de démence de l’ordre de 1,5 à 2 fois pour les personnes prenant des médicaments anticholinergiques, par rapport aux personnes qui ne prenaient pas ces médicaments23,26. Dans l’étude de Carrière et coll., seuls les patients qui faisaient un usage continu de médicaments à potentiel anticholinergique élevé présentaient une augmentation statistiquement significative du risque, contrairement aux patients qui ont cessé de prendre ces médicaments en cours d’étude26. Les propriétés anticholinergiques des médicaments inclus dans l’étude étaient déterminées selon des bases de données pharmacologiques françaises. Il ne s’agit donc pas d’une liste validée et explicitée.
Une autre étude, celle de Jessen et coll., a mesuré l’effet des médicaments selon l’intensité de leur charge anticholinergique. Cette étude longitudinale de 54 mois portait sur la fréquence d’apparition de la démence chez les patients d’un âge égal ou supérieur à 75 ans23. Cette étude a montré que le risque de présenter une démence augmentait avec l’usage d’un médicament à potentiel anticholinergique.
L’étude de Gray et coll. a également démontré que les patients âgés de plus de 65 ans utilisant des médicaments ayant un potentiel anticholinergique élevé présentent un risque de contracter une démence1. Bien que la plupart des rapports de risque ne soient pas significatifs, les patients du groupe ayant une SDQS supérieure à 1 095 sont toutefois plus susceptibles de contracter tout type de démence ainsi qu’une démence de type Alzheimer (augmentation respective du risque de 54 % et de 63 %). Cette valeur de SDQS équivaut à l’utilisation d’un médicament à potentiel anticholinergique élevé à la dose minimale efficace durant au moins trois ans. La valeur utilisée pour la dose minimale efficace est parfois sujette à caution. Par exemple, la dose minimale efficace utilisée dans cette étude est de 50 mg pour la diphenhydramine, mais de 200 mg pour le dimenhydrinate. Les effets anticholinergiques de ces deux molécules ne semblent pas équivalents pour la même valeur de SDQS. Le degré d’exposition, mesuré selon la SDQS, ne correspondrait donc pas à des effets anticholinergiques équivalents.
Bien que l’étude présentée soit observationnelle, les auteurs ont diminué certains biais. En effet, certains des médicaments à potentiel anticholinergique peuvent être utilisés pour traiter des symptômes précurseurs de la démence, tels que la dépression et l’anxiété : il pourrait donc y avoir un biais de causalité inverse avec certains médicaments27. Ces médicaments, comme les antidépresseurs tricycliques, n’auraient pas causé la démence, mais celle-ci aurait mené à l’utilisation de ces médicaments. Afin de limiter ce biais, les auteurs n’ont pas comptabilisé les prescriptions servies dans l’année précédant l’inclusion des patients dans la cohorte. Une période de latence d’un an permet en effet de limiter ce biais, car les symptômes précurseurs se présentent entre 10 mois et deux ans avant le diagnostic de démence 27.
La définition de la démence utilisée est une force de l’étude, puisqu’elle est doublement mesurée de façon rigoureuse à l’aide d’un outil validé et du diagnostic posé par un médecin. La sensibilité de l’outil Cognitive Abilities Screening Instrument est forte (96,5 %), ce qui est nécessaire lors d’un dépistage21,24. Les autres forces de l’étude comprennent la taille de la cohorte et la durée du suivi moyen de sept ans, ce qui en fait une des plus grosses études sur le sujet. De plus, les auteurs ont corrigé les résultats selon plusieurs covariables pour les rendre plus justes.
La principale faiblesse de cette étude est la mesure de la SDQS, puisqu’il n’existe pas d’outil de mesure validé correspondant. La qualité de cette mesure n’a pas été précédemment établie. La SDQS a été conçue par les auteurs de l’étude lors de recherches précédentes18,19. Il est donc difficile de comparer les résultats de cette étude, basés sur la SDQS, avec ceux d’autres études. De plus, les intervalles de SDQS sont déterminés d’une façon qui n’est pas validée. L’augmentation du risque de démence pourrait apparaitre à une période autre que celles prédéterminées, à savoir avant ou après ce qui est rapporté dans l’étude. L’exposition aux médicaments a été évaluée en fonction des prescriptions achetées par les participants. La consommation médicamenteuse réelle ne peut donc être précisément établie, puisque la mesure est l’achat et non la prise des médicaments. Par contre, on évite ainsi un biais de mémoire, ce qui est nécessaire lors d’une aussi longue période d’exposition mesurée a posteriori. En outre, certaines molécules disponibles en vente libre, comme certains antihistaminiques, ne sont pas comptabilisées dans l’étude alors qu’elles ont une charge anticholinergique non négligeable. Aucun consensus n’existe sur la liste idéale de médicaments à potentiel anticholinergique élevé. La liste choisie provient d’un consensus d’experts respectés, ayant développé les critères de Beers12. Le choix de cette liste peut être débattu, et une autre liste basée sur des critères objectifs ou sur une revue de la documentation scientifique aurait pu être préférée.
Une autre faiblesse de l’étude en est sa validité externe; il est effectivement difficile d’extrapoler les données obtenues à l’ensemble de la population observée en clinique. Cette limite s’explique par l’utilisation d’une mesure non validée (la SDQS), mais aussi par la population à l’étude, qui semble différer de celle rencontrée en clinique. En effet, 66,4 % de la population à l’étude a reçu une éducation postsecondaire, alors que cette proportion est de 36,1 % dans la population générale selon le recensement canadien de 200628. Une telle différence est pertinente à noter, puisqu’un faible niveau d’éducation peut augmenter le risque de démence29. De plus, la fréquence d’utilisation de benzodiazépines semble plutôt faible dans l’étude (2,8 %), comparativement à ce que l’on rencontre dans la population des patients de plus de 65 ans au Québec (25,4 %)30. Des études ont récemment fait ressortir le lien possible entre l’utilisation des benzodiazépines et la démence31,32. Ainsi, le risque de contracter une démence pourrait être différent pour la population à l’étude que pour la population générale.
Bien que les résultats récents sur l’existence d’un lien entre la prise de médicaments à potentiel anticholinergique élevé et la démence semblent se multiplier, les études sont de nature observationnelle, ce qui limite la qualité des résultats. L’étude présentée amène toutefois des données probantes supplémentaires en faveur d’un tel lien. Ce risque potentiel devrait être pris en compte lors de la prescription de telles molécules à la personne âgée. En clinique, ces résultats devraient donc nous porter à limiter le nombre de médicaments prescrits ayant un potentiel anticholinergique élevé, la dose de ceux-ci, ainsi que leur durée d’utilisation, afin de réduire le risque potentiel de démence. Par contre, il n’existe aucune mesure consensuelle pour calculer la charge anticholinergique, ni pour déterminer un seuil d’exposition anticholinergique maximal. Ce seuil n’est pas mis en lumière de façon précise dans cette étude et pourrait se situer avant ou après la période de trois ans proposée dans l’article et basée sur l’usage quotidien d’un médicament à la dose minimale efficace.
Une étude à répartition aléatoire contrôlée cherchant à répondre à cette question de recherche est actuellement en période de recrutement. Les résultats d’une telle étude permettront de confirmer ou d’infirmer l’existence d’un tel lien ainsi que les résultats obtenus précédemment33.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique (PHA62102) de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables. Une autorisation écrite a été obtenue de ces personnes.
1. Gray SL, Anderson ML, Dublin S, Hanlon JT, Hubbard R, Walker R et coll. Cumulative use of strong anticholinergic medications and incident dementia: a prospective cohort study. JAMA Intern Med 2015;175:401–7.


2. Carnahan RM, Lund BC, Perry PJ, Pollock BG, Culp KR. The anticholinergic drug scale as a measure of drug-related anticholinergic burden: associations with serum anticholinergic activity. J Clin Pharmacol 2006;46:1481–6.

3. Davidoff AJ, Miller GE, Sarpong EM, Yang E, Brandt N, Fick DM. Prevalence of potentially inappropriate medication use in older adults using the 2012 Beers criteria. J Am Geriatr Soc 2015;63:486–500.


4. Witlox J, Eurelings LSM, de Jonghe JFM, Kalisvaart KJ, Eikelenboom P, van Gool WA. Delirium in elderly patients and the risk of postdischarge mortality, institutionalization, and dementia. JAMA 2010;304;443–51.

5. Kane RL, Shamliyan T, Talley K, Pacala J. The association between geriatric syndromes and survival. J Am Geriatr Soc 2012;60;896–904.

6. La Société Alzheimer du Canada 2010. Raz-de-marée : Impact de la maladie d’Alzheimer et des affections connexes au Canada. [en ligne] http://www.alzheimer.ca/~/media/Files/national/Advocacy/ASC_Rising_Tide_Full_Report_f.pdf (site visité le 17 août 2015).
7. Merle L, Laroche ML, Dantoine T, Charmes JP. Predicting and preventing adverse reactions in the very old. Drugs Aging 2005;22:375–92.
8. Aparasu RR, Mort JR. Prevalence, correlates and associated outcomes of potentially in-appropriate psychotropic use in the community-dwelling elderly. Am J Geriatr Pharmacother 2004;2:102–11.

9. Campbell N, Boustani M, Limbil T, Ott C, Fox, C, Maidment I et coll. The cognitive impact of anticholinergics: a clinical review. Clin Interv Aging 2009;4:225–33.

10. Ebly EM, Hogan DB, Fung TS. Potential adverse outcomes of psychotropic and narcotic drug use in Canadian seniors. J Clin Epidemiol 1997;50:857–63.

11. McLean AJ, Le Couteur DG. Aging biology and geriatric clinical pharmacology. Pharmacol Rev 2004;56:163–84.

12. American Geriatrics Society 2012 Beers criteria update expert panel. American Geriatrics Society updated Beers criteria for potentially inappropriate medication use in older adults. J Am Geriatr Soc 2012;60:616–31.


13. Rudolph JL, Salow MJ, Angelini MC, McGlinchey RE. The Anticholinergic Risk Scale and anticholinergic adverse effects in older persons. Arch Intern Med 2008;168:508–13.

14. Durán CE, Azermai M, Vander Stichele RH. Systematic review of anticholinergic risk scales in older adults. Eur J Clin Pharmacol 2013;69:1485–96.

15. Tannenbaum C, Paquette A, Hilmer S, Holroyd-Leduc J, Carnaham R. A systematic review of amnestic and non-amnestic mild cognitive impairment induced by anticholinergic, antihistamine, GABAergic and opioid drugs. Drugs Aging 2012;29:639–58.
16. Ancelin ML, Artero S, Portet F, Dupuy AM, Touchon J, Ritchie K. Non-degenerative mild cognitive impairment in elderly people and use of anticholinergic drugs: longitudinal cohort study. BMJ 2006;332:455–9.


17. Semla TP, Beizer JL, Higbee MD. Geriatric Dosage Handbook. 15th ed. Hudson, OH : Lexicomp; 2010. 1605 p.
18. Gray SL, LaCroix AZ, Blough D, Wagner EH, Koepsell TD, Buchner D. Is the use of benzodiazepines associated with incident disability? J Am Geriatr Soc 2002;50:1012–8.


19. Hanlon JT, Boudreau RM, Roumani YF, Newman AB, Ruby CM, Wright RM et coll. Number and dosage of central nervous system medications on recurrent falls in community elders: the Health, Aging and Body Composition Study. J Gerontol A Biol Sci Med Sci 2009;64:492–8.


20. Teng EL, Hasegawa K, Homma A, Imai Y, Larson E, Graves A et coll. The Cognitive Abilities Screening Instrument (CASI): a practical test for cross-cultural epidemiological studies of dementia. Int Psychogeriatr 1994;6:45–58.

21. American Psychiatric Association. Diagnostic and statistical manual of mental disorders. 4th ed. Washington, DC : American Psychiatric Association; 1994. 886 p.
22. McKhann G, Drachman D, Folstein M, Katzman R, Price D, Stadlan EM. Clinical diagnosis of Alzheimer’s disease: report of the NINCDS-ADRDA work group under the auspices of department of health and human services task force on Alzheimer’s disease. Neurology 1984;34:939–44.

23. Jessen F, Kaduszkiewicz H, Daerr M, Bickel H, Pentzek M, Riedel-Heller S et coll. Anticholinergic drug use and risk for dementia: target for dementia prevention. Eur Arch Psychiatry Clin Neurosci 2010;260:S111–5.

24. Gray SL, Anderson ML, Hubbard RA, LaCroix A, Crane PK, McCormick W et coll. Frailty and incident dementia. J Gerontol A Biol Sci Med Sci 2013;68:1083–90.


25. CCCDTD Troisième conférence canadienne de consensus sur le diagnostic et le traitement de la démence. [en ligne] http://www.cccdtd.ca/pdfs/Recommandations_approuvees_CCCDTD_2007.pdf (site visité le 17 août 2015).
26. Carrière I, Fourrier-Reglat A, Dartigues JF, Rouaud O, Pasquier F, Ritchie K et coll. Drugs with anticholinergic properties, cognitive decline, and dementia in an elderly general population: the 3-city study. Arch Intern Med 2009;169:1317–24.


27. Robert P. Understanding and managing behavioural symptoms in Alzheimer’s disease and related dementias: focus on rivastigmine. Curr Med Res Opin 2002;18:156–71.
28. Statistique Canada. Population âgée de 15 ans et plus selon le plus haut certificat, diplôme ou grade, selon le groupe d’âge, Recensement de 2006. [en ligne] http://www.statcan.gc.ca/tables-tableaux/sum-som/l02/cst01/educ43bfra.htm (site visité le 20 septembre 2015).
29. Scalco MZ, Van Reekum R. Prevention of Alzheimer disease. Encouraging evidence. Can Fam Physician 2006;52:200–7.

30. Voyer P, Préville M, Cohen D, Berbiche D, Béland SG. The prevalence of benzodiazepine dependence among community-dwelling older adult users in Quebec according to typical and atypical criteria. Can J Aging 2010;26:205–13.
31. Billioti de Gage S, Moride Y, Ducruet T, Kurth T, Verdoux H, Tournier M et coll. Benzodiazepine use and risk of Alzheimer’s disease: case-control study. BMJ 2014:9;1–10.
32. Billioti de Gage S, Pariente A, Bégaud B. Is there really a link between benzodiazepine use and the risk of dementia? Expert Opin Drug Saf 2015;18:1–15.
33. Wouters H, Quik EH, Boersma F, Nygård P, Bosman J, Böttger WM et coll. Discontinuing inappropriate medication in nursing home residents (DIM-NHR Study): protocol of a cluster randomised controlled trial. BMJ Open 2014;4:e006082.

PHARMACTUEL, Vol. 49, No. 1, 2016