
Vlad Alexandru Rosu1,2,3, B.Pharm., M.Sc., Anissa Capilnean1,2,4, Pharm.D., M.Sc.
Reçu le 23 août 2015; Accepté après révision par les pairs le 2 janvier 2016
Titre : Valganciclovir for the prevention of complications of late cytomegalovirus infection after allogeneic hematopoietic cell transplantation : a randomized trial. Ann Intern Med 2015;162:1-101.
Auteurs : Boeckh M, Nichols WG, Chemaly RF, Papanicolaou GA, Wingard JR, Xie H et coll.
Commanditaires : Le principal commanditaire de l’étude était la compagnie Roche, qui a fourni le médicament étudié ainsi que le placebo, mais qui n’a pas participé à la conception ou au déroulement de l’étude, ni à l’analyse des résultats ou à la décision de soumettre l’article pour publication. Le National Institutes of Health a également financé cette étude pour les épreuves de résistance et de l’immunité T.
Cadre de l’étude : Les receveurs d’une greffe de cellules souches hématopoïétiques (GCSH) sont plus susceptibles de contracter des infections opportunistes, notamment une infection à cytomégalovirus (CMV); c’est particulièrement vrai en cas de GCSH allogénique, qui est associée à un risque de décès lié au CMV de 25 %2. L’infection à CMV se définit par une charge virale sérique élevée, tandis que la maladie à CMV correspond à une atteinte d’organe par l’agent pathogène. Le risque de réactivation du CMV est de 60 à 70 % après une GCSH pour un receveur séropositif, tandis qu’il est de 30 % pour un receveur séronégatif lorsque le donneur est séropositif3. D’autres facteurs de risque, tels que l’utilisation de hautes doses de corticostéroïdes, l’usage de mycophénolate mofétil ou une déplétion des cellules T, rendent les patients plus susceptibles de contracter une infection ou une maladie à CMV2.
La prévention d’une infection à CMV par prophylaxie ou par traitement anticipé, dans les 100 premiers jours après une GCSH, a réduit substantiellement le risque d’infection ou de maladie à CMV, de sorte que la majorité des infections sont apparues à plus de 100 jours après une GCSH4. La prophylaxie comprend un traitement antiviral entamé au moment de la GCSH et poursuivi jusqu’à 100 jours après celle-ci, alors qu’un traitement anticipé se définit comme un traitement antiviral mis en route au moment de la détection d’une infection de novo ou d’une réactivation du CMV (détection par réaction d’amplification en chaîne par polymérase [PCR])5. Les lignes directrices américaines ne recommandent aucune prophylaxie du CMV au-delà de 100 jours après une GCSH, mais plutôt des suivis sérologiques hebdomadaires par PCR ou par antigénémie, uniquement pour les patients à haut risque6.
Les antiviraux ganciclovir et valganciclovir sont utilisés pour la prophylaxie et le traitement anticipé7. Ces deux méthodes ont permis de réduire la prévalence des maladies à CMV de 33 % en 1986 à 3 à 6 % en 19942. Les infections et la maladie à CMV sont plus fréquentes après l’arrêt de prise de l’agent préventif et se présentent plus souvent de façon tardive, avec 17,8 % des patients développant une maladie à CMV 169 jours après une GCSH2. Même si une stratégie par anticipation au-delà de 100 jours après une GCSH s’avère alors intéressante, il est difficile de s’assurer que les patients habitant dans des régions éloignées respecteront les suivis virologiques. En ce qui concerne la stratégie prophylactique, l’usage du valganciclovir prédispose à des toxicités hématologiques, particulièrement la neutropénie, ce qui constitue un risque de décès indépendant après une GCSH1. L’étude de Boeckh et coll. avait pour but d’évaluer l’efficacité et l’innocuité des deux stratégies de prévention de la réactivation tardive du CMV.
Protocole de recherche : Il s’agit d’un essai clinique multicentrique à répartition aléatoire et à double insu, contrôlé par placebo. L’étude compare la prophylaxie du CMV par valganciclovir à la thérapie anticipée (groupe recevant un placebo), du jour 100 au jour 270 après une GCSH, avec un suivi jusqu’au jour 640. Le recrutement s’est déroulé de 1999 à 2008 dans sept centres aux États-Unis coordonnés par le Fred Hutchinson Cancer Research Center. La répartition aléatoire, effectuée par un logiciel statistique, était stratifiée par site, par la présence ou l’absence de neutropénie antérieure (nombre absolu de neutrophiles [NAN] inférieur à 1,0 × 109 cellules/l après la prise de greffe) et par la présence ou l’absence d’un cas réfractaire de maladie du greffon contre l’hôte (GVH).
L’analyse principale, qui incluait tous les patients répartis aléatoirement ayant reçu au moins une dose du médicament étudié, avait pour intention de démontrer la supériorité de l’approche prophylactique par rapport au traitement anticipé. Les auteurs ont fixé une marge de diminution de 45 % de leur critère d’évaluation primaire composite comparativement à 53 % de réduction dans leur précédente étude de cohorte1,4.Un échantillon de 184 patients (92 par groupe thérapeutique) était nécessaire pour atteindre une puissance de 87 % avec une erreur alpha de 0,048. Le comité indépendant de la sécurité des données a passé en revue une analyse intérimaire effectuée une fois que 50 % des patients avaient achevé 90 jours d’étude. Cette analyse portait sur les critères d’évaluation primaires et les effets indésirables.
Patients : Les patients inclus dans l’étude étaient d’un âge supérieur ou égal à 16 ans, avaient reçu une GCSH allogénique et devaient avoir un taux de créatinine sérique inférieur à 221 μmol/l. Les patients séropositifs ou ayant un donneur séropositif devaient avoir eu une infection à CMV et avoir reçu un traitement adéquat avant la répartition aléatoire. Les patients séropositifs sans infection à CMV devaient avoir un antécédent de GVH ou une prophylaxie antivirale avant la répartition aléatoire pour pouvoir participer à l’étude. Le tableau I présente l’ensemble des critères d’inclusion et d’exclusion.
Tableau I Critères de sélection des participants à l’étudea
Interventions : Les sujets recrutés dans l’étude ont été répartis dans deux groupes (prophylaxie ou témoin). Les patients du groupe prophylaxie recevaient 900 mg par jour de valganciclovir du jour 100 au jour 270 après une GCSH. Les patients du groupe témoin recevaient un placebo. Dans les deux groupes, la charge virale du CMV était mesurée par PCR de façon hebdomadaire et les prélèvements étaient envoyés pour analyse à l’Université de Washington. Durant l’étude, si la charge virale du CMV était supérieure à 1 000 copies/ml ou supérieure à cinq fois la valeur de base, le traitement en cours était interrompu et remplacé par un traitement anticipé avec du ganciclovir par voie intraveineuse (5 mg/kg deux fois par jour), du valganciclovir par voie orale (900 mg deux fois par jour) ou du foscarnet par voie intraveineuse (90 mg/kg deux fois par jour) pour les patients neutropéniques. Les doses étaient ajustées en fonction de la clairance de la créatinine et selon les recommandations du fabricant. L’administration de l’antiviral était interrompue si le patient devenait neutropénique (NAN inférieur à 1,0 × 109 cellules/l). Au milieu de l’étude, les auteurs ont amendé le protocole pour y ajouter un traitement obligatoire par facteur de croissance granulocytaire pour les patients neutropéniques. Cet amendement avait également permis d’utiliser le valganciclovir par voie orale comme traitement des patients ayant une charge virale du CMV supérieure à 1 000 copies/ml ou à cinq fois la valeur de base.
Points évalués : Le critère d’évaluation primaire était un paramètre composite évaluant la survenue d’une maladie à CMV, d’une infection bactérienne ou fongique invasive ou d’un décès après une GCSH. Le critère d’évaluation primaire couvre la période de 100 à 270 jours après une GCSH, mais les patients étaient suivis jusqu’au jour 640. Chacun des critères formant le paramètre composite primaire était évalué de manière indépendante en tant que critère secondaire. Ainsi, la différence entre les deux stratégies thérapeutiques en ce qui concerne chaque composante du paramètre primaire prise individuellement était évaluée et comprenait l’utilisation de tests invasifs (procédures endoscopiques) pendant le traitement, le nombre de jours sans hospitalisation, l’émergence d’une résistance au ganciclovir, la qualité de vie, les fonctions des lymphocytes T dirigés contre le virus de l’herpès simplex (VHS) et les effets indésirables cliniques et biochimiques.
Résultats : Des 190 sujets répartis de façon aléatoire, 184 ont reçu au moins une dose orale quotidienne de valganciclovir 900 mg (n = 95) ou de placebo (n = 89). Les caractéristiques démographiques des sujets à l’étude étaient similaires dans les deux groupes (tableau II). La population à l’étude était âgée en moyenne de 50 ans, était plutôt de sexe masculin (56 %) et avait reçu en grande majorité une GCSH périphérique. Parmi les sujets, 91 % étaient des receveurs séropositifs au CMV. En ce qui concerne le statut sérologique du CMV, il existait une proportion plus importante de donneurs négatifs/receveurs positifs dans le groupe placebo (48 %) que dans le groupe valganciclovir (41 %).
Tableau II Caractéristiques des patients au début de l’étudea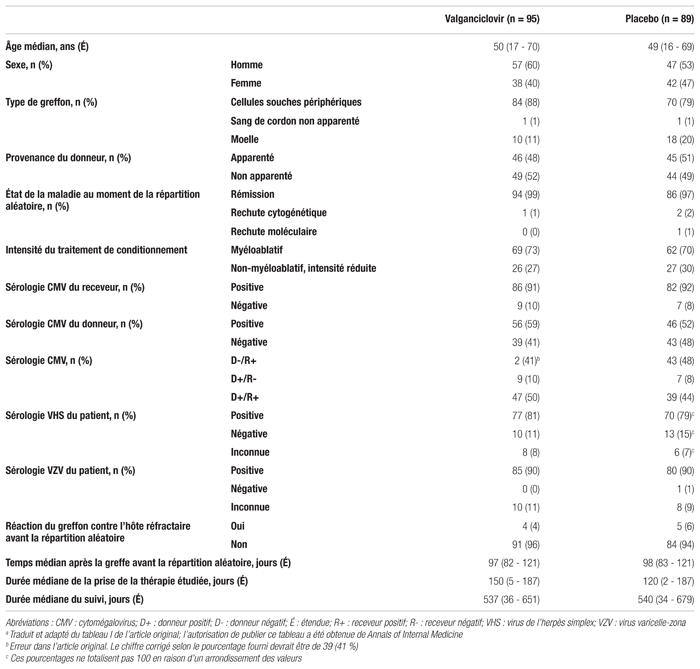
Les auteurs n’ont rapporté aucune perte des patients au suivi. Cependant, 99 patients ont arrêté le traitement (48 % des patients du groupe valganciclovir et 59 % de ceux du groupe placebo). Une virémie positive requérant un traitement en était la raison principale pour les patients du groupe placebo (31 % comparativement à 5,3 % des patients du groupe valganciclovir). Un patient dans chaque groupe a développé une maladie à CMV. L’arrêt du traitement en raison d’effets indésirables était plus important dans le groupe valganciclovir (31 %) que dans le groupe placebo (17 %; p=0,03).
Les résultats obtenus à 270 jours après la GCSH ont montré un taux de survenue d’événements liés au critère d’évaluation primaire égal à 20 % dans le groupe valganciclovir et à 21 % dans le groupe placebo, avec une différence cumulative de traitement de −0,01 (rapport de risque [RR] : 0,9; intervalle de confiance à 95 % [IC 95 %] : 0,5–1,8, p=0,86) (tableau III). En ce qui concerne les critères d’évaluation secondaires, aucune différence significative n’a été notée dans la survenue d’infections bactériennes ou fongiques invasives entre les deux groupes (RR:1,0;IC 95 %:0,1–0,5;p=0,94). Aucune différence significative n’a été démontrée entre les deux groupes quant à la survenue d’une maladie à CMV ou d’un décès lié à une maladie à CMV.
Tableau III Principaux résultats liés aux critères d’évaluation primaires et secondaires d’efficacitéa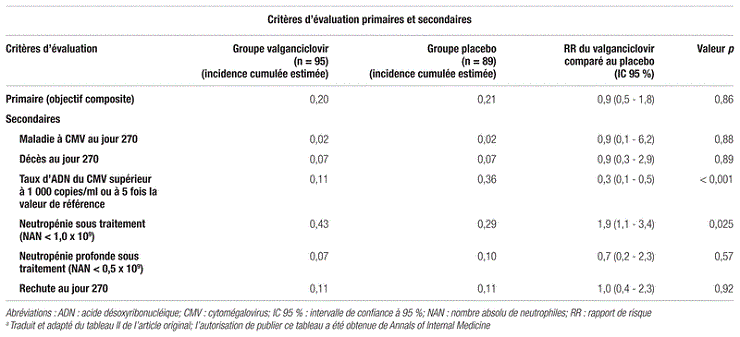
Tableau IV Principaux résultats de l’étude en matière d’innocuitéa
En ce qui concerne les toxicités hématologiques, les épisodes de neutropénie étaient plus fréquents dans le groupe valganciclovir (43 %) que dans le groupe placebo (29 %; p=0,025), ce qui explique le recours plus fréquent au filgrastim dans le groupe valganciclovir que dans le groupe placebo (respectivement 25,3 % comparativement à 12,4 %, p=0,026). Cette différence n’était pas observée dans le cas des neutropénies profondes (NAN inférieur à 0,5 × 109; tableau III). Un test de résistance phénotypique (présence de la mutation UL97), réalisé pour six patients du groupe valganciclovir et 18 patients du groupe placebo, n’a révélé aucune mutation chez ces patients. De plus, une évaluation de la reconstitution immunitaire après une GCSH, mesurée en testant l’immunité médiée par les lymphocytes T contre le CMV, le VHS et le virus varicelle-zona (VZV), n’a montré aucune différence entre les groupes.
L’étude de Boeckh et coll. a démontré que la prophylaxie au valganciclovir et le suivi des virémies à CMV par PCR quantitative sont associés au même taux global de survenue de certains événements indésirables (décès, maladie à CMV, infections fongiques ou bactériennes invasives). Seule la survenue d’une virémie à CMV supérieure à 1 000 copies/ml ou à cinq fois la valeur de base était plus fréquente dans le groupe de traitement anticipé que dans le groupe valganciclovir. Aucune différence n’a été notée entre les deux groupes en ce qui concerne les toxicités, la résistance phénotypique ou la reconstitution immunitaire. Les auteurs ont émis l’hypothèse que l’absence de différence entre les groupes pouvait s’expliquer par l’efficacité de la méthode anticipée, bien que cette stratégie engendre des coûts et requière des effectifs importants. Aucune différence significative n’a été notée entre les deux groupes en ce qui concerne le taux de survenue de neutropénie, bien que la prophylaxie utilise du valganciclovir, un médicament connu pour sa propension à causer des neutropénies. Les auteurs n’ont donc pas pu conclure à la supériorité de la prophylaxie par rapport à la stratégie anticipée et ont mentionné que les deux stratégies peuvent être utilisées.
Pour la mise en route du traitement de secours, les auteurs avaient déterminé un seuil de charge virale du CMV supérieur à 1 000 copies/ml ou à cinq fois la valeur de base. Les lignes directrices américaines ne déterminent pas de seuil à partir duquel on caractérise une infection à CMV pour un patient asymptomatique ayant reçu une GCSH allogénique; ce seuil dépend donc du jugement clinique7. Le choix de la PCR comme méthode de détection de la charge virale est adéquat, mais demeure discutable. Comparativement au test d’antigénémie pp65, la PCR est hautement sensible, n’est pas affectée par la leucopénie, offre plus rapidement un résultat et s’avère techniquement plus facile à réaliser8,11. Cependant, les lignes directrices actuelles expriment les seuils de traitement anticipé du CMV en fonction des résultats du test d’antigénémie pp65 pour les GCSH autologues, alors qu’elles ne mentionnent pas de seuil pour les GCSH allogéniques7. De plus, le seuil de la PCR indiquant le besoin d’un traitement anticipé demeure incertain7,8. Dans une étude sud-américaine prospective, 21 patients (62 % étant des enfants) ont subi des suivis simultanés par PCR et par antigénémie pp65 du jour 15 au jour 98 après une GCSH8. L’étude a permis de déterminer qu’une antigénémie positive (définie dans l’étude comme la présence d’au moins une cellule positive/2 × 105 leucocytes) est la mieux définie par une charge virale de 1 067,5 copies/ml ou 3,03 log10/ml (sensibilité de 100 % et spécificité de 71 %) et a suggéré de limiter l’analyse par PCR aux cas de neutropénie prolongée ou aux enfants de petit poids, en raison du coût élevé de l’analyse8. Il est communément accepté qu’une augmentation significative de la charge virale doive être d’au moins 0,5 log10 ou d’environ trois fois la valeur de base2. Ainsi, il est difficile de déterminer si le fait d’avoir choisi un seuil à 1 000 copies/ml a précipité ou ralenti le recours au traitement de secours dans le groupe témoin, étant donné que les auteurs ne précisent pas à quel moment le traitement de secours a été mis en route.
Il est difficile de comparer ces résultats à ceux figurant dans la documentation scientifique, car la plupart des études ont mis en route une prophylaxie antivirale dans les 80 jours après la GCSH5,6. Malgré tout, les résultats de cette étude sont en accord avec ceux de la récente publication par Marty et coll., qui montraient qu’il n’existait pas de différence statistiquement significative entre un traitement par maribavir, mis en route entre le jour 14 et 30 après une GCSH et administré pendant 12 semaines, et une thérapie anticipée en ce qui concerne l’apparition d’une maladie à CMV9.
Une force de l’étude de Boeckh et coll. est la rigueur des descriptions. Mis à part le fait que les auteurs ont mentionné la fréquence du suivi de la charge virale par PCR seulement dans la discussion, ils ont clairement défini les composantes associées au critère d’évaluation primaire et les paramètres du test PCR en appuyant leurs définitions sur la documentation scientifique. La prolongation de la durée d’observation jusqu’à 640 jours permet un suivi de l’apparition de maladies à CMV sur une plus longue période. Les auteurs ont également présenté les résultats de chaque élément associé au critère d’évaluation primaire, ce qui permettait d’observer directement la survenue de maladies à CMV.
De plus, une proportion plus importante et significative de neutropénies et d’arrêts de thérapie à la suite de l’apparition d’un effet indésirable était rapportée pour les patients traités au valganciclovir que pour ceux sous traitement anticipé, ce qui concorde avec le recours plus important au filgrastim dans ce même groupe et l’absence de neutropénies profondes. Cependant, c’est surtout la présence d’infections qui augmente le risque de décès secondaire aux antiviraux. Or, l’étude ne démontre aucune différence significative du taux d’infections bactériennes ou fongiques entre les deux groupes, ce qui fait de la prophylaxie une stratégie tout aussi intéressante que la stratégie anticipée, sur le plan de l’innocuité.
Les patients étaient contactés lorsque leur échantillon sanguin n’arrivait pas à l’établissement où devait se faire l’analyse. Cependant, les auteurs n’ont pas noté à quel point les patients respectaient le traitement et le suivi de la virémie. De plus, certaines caractéristiques des patients au début de l’étude, comme la médication concomitante (prise de corticostéroïdes, de valacyclovir, etc.), étaient absentes de la comparaison des groupes et pourraient représenter des facteurs confondants. Ces facteurs auraient pu avoir une répercussion sur la virémie et sur la survenue d’effets indésirables médicamenteux. De plus, le pourcentage de patients qui ont cessé de suivre la thérapie était respectivement de 46 % et de 60 % dans le groupe valganciclovir et le groupe sous traitement anticipé. Dans le groupe recevant la prophylaxie, la majorité des arrêts étaient dus à l’apparition d’effets indésirables. Un tel résultat limite la quantité de données récoltées et vient remettre en question la faisabilité et la pertinence des interventions. La complexité du protocole de l’étude a fait en sorte que l’étude a pris huit ans à être réalisée, ce qui corrobore le point précédent.
Les lignes directrices actuelles n’émettent aucune recommandation claire pour la prévention des manifestations du CMV chez les patients 100 jours après une GCSH7. Cependant, la documentation scientifique démontre une augmentation tardive des maladies à CMV, qui justifie la prise en charge au-delà de 100 jours après une GCSH2. Étant donné la réalité géographique de la province du Québec, l’accès des patients au personnel médical qui assure un suivi des virémies à CMV peut grandement varier. À la lumière des résultats présentés dans cette étude, il serait dorénavant possible de personnaliser l’approche préventive des manifestations du CMV selon la réalité géographique des patients, ce qui améliorerait la pratique clinique actuelle. Ainsi, il serait pertinent de favoriser davantage une approche par prophylaxie au valganciclovir pour des patients habitant dans des régions éloignées et ayant un accès restreint aux suivis médicaux.
Cette étude a démontré qu’il n’existe aucune différence entre l’utilisation d’une prophylaxie par valganciclovir et un traitement anticipé guidé par la détection par PCR de la charge virale du CMV sur la survenue d’un décès, d’une maladie à CMV et d’infections fongiques ou bactériennes. L’utilisation d’une stratégie anticipée semble mener à des charges virales du CMV plus élevées requérant une thérapie de secours. Cependant, l’utilisation du valganciclovir semble entraîner plus de cas de neutropénie. Les résultats de cette étude permettront aux cliniciens de personnaliser l’approche thérapeutique selon la réalité du patient. Cependant, une étude pharmaco-économique serait de mise afin de déterminer laquelle des deux approches serait globalement la plus avantageuse dans la pratique.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et les collaborateurs. Les auteurs remercient également M. Philippe Bouchard, pharmacien en hémato-oncologie et transplantation de cellules hématopoïétiques à l’Hôpital Maisonneuve-Rosemont, pour ses commentaires lors de la lecture de l’article. Une autorisation écrite a été obtenue de ces personnes.
1. Boeckh M, Nichols GW, Chemaly RF, Papanicolaou GA, Wingard JR, Xie H et coll. Valganciclovir for the prevention of complications of late cytomegalovirus infection after allogeneic hematopoietic cell transplantation: a randomized trial. Ann Intern Med 2015;162:1–10.

2. Boeckh M, Nichols GW, Papanicolaou GA, Rubin R, Wingard JR, Zaia J. Cytomegalovirus in hematopoietic stem cell transplant recipients: current status, known challenges, and future strategies. Biol Blood Marrow Transplant 2003;9:543–58.
3. Boeckh M, Ljungman P. How we treat cytomegalovirus in hematopoietic stem cell transplant recipients. Blood 2009;113:5711–9.

4. Boeckh M, Leisenring W, Riddell SR, Bowden RA, Huang ML, Myerson D et coll. Late cytomegalovirus disease and mortality in recipients of allogeneic hematopoietic stem cell transplants: importance of viral load and T-cell immunity. Blood 2003;101:407–14.
5. Meijer E, Boland GJ, Verdonck LF. Prevention of cytomegalovirus disease in recipients of allogeneic stem cell transplants. Clin Microbiol Rev 2003;16:647–57.

6. Centers for Disease Control and Prevention. Guidelines for preventing opportunistic infections among hematopoietic stem cell transplant recipients. [en ligne] http://www.cdc.gov/mmwr/preview/mmwrhtml/rr4910a1.htm (site visité le 16 août 2015).
7. Tomblyn M, Chiller T, Einsele H, Gress R, Sepkowitz K, Storek J et coll. Guidelines for preventing infectious complications among hematopoietic cell transplantation recipients: a global perspective. Biol Blood Marrow Transplant 2009;15:1143–238.

8. Breda G, Almeida B, Carstensen S, Bonfim CM, Nogueira MB, Vidal LR et coll. Human cytomegalovirus detection by real-time PCR and pp65-antigen test in hematopoietic stem cell transplant recipients: a challenge in low and middle-income countries. Pathog Glob Health 2013;7:S1–8.
9. Marty FM, Ljungman P, Papanicolaou GA, Winston DJ, Chemaly RF, Strasfeld L et coll. Maribavir prophylaxis for prevention of cytomegalovirus disease in recipients of allogeneic stem-cell transplants: a phase 3, double-blind, placebo-controlled, randomised trial. Lancet 2011;11:284–92.
10. Freemantle N, Calvert M, Wood J, Eastaugh J, Griffin C. Composite outcomes in randomized trials: greater precision but with greater uncertainty? JAMA 2003;289:25549.
11. Fraser GAM, Walker II. Cytomegalovirus prophylaxis and treatment after hematopoietic stem cell transplantation in Canada: a description of current practices and comparison with Centers for Disease Control/Infectious Diseases Society of America/American Society for Blood and Marrow Transplantation guideline recommendations. Biol Blood Marrow Transplant 2004;10:287–97.
PHARMACTUEL, Vol. 49, No. 2, 2016