Thiéry Clinchamps-Lortie1,2, B.Pharm., M.Sc., Jordane St-Hilaire Dupuis1,2,3, B.Pharm., M.Sc.
Reçu le 4 septembre 2015; Accepté après révision par les pairs le 10 décembre 2015
Titre : Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015;372:2521-321.
Auteurs : Robert C, Schachter J, Long GV, Arance A, Grob JJ, Mortier L et coll. pour les chercheurs de KEYNOTE-006.
Commanditaire: Merck Sharp & Dohme a conçu l’étude, a analysé et interprété les données en collaboration avec les auteurs, puis a participé à l’élaboration de l’article. Un comité indépendant externe de surveillance des données était responsable de s’assurer de la sécurité des patients et de l’intégrité éthique de l’étude.
Cadre de l’étude : En 2015, le mélanome représentait environ 3,4 % des nouveaux cas de cancer au Canada2. Parmi ceux-ci, entre 2 et 5 % sont métastatiques au diagnostic3. Selon les statistiques internationales de 2009, le mélanome métastatique avait un mauvais pronostic avec une survie globale (SG) respective à un an de 62, 52 et 33 % pour les stades M1a, M1b et M1c4.
En l’absence de mutation du gène BRAF V600, la seule chimiothérapie officiellement indiquée lors de métastases non résécables est la dacarbazine. Les taux de réponse à la dacarbazine ou à d’autres chimiothérapies comme le témozolomide, le paclitaxel en association ou non avec la carboplatine et le paclitaxel en nanoparticules sont inférieurs à 26 %3. Le témozolomide et le paclitaxel en nanoparticules ne sont pas remboursés par la Régie de l’assurance maladie du Québec (RAMQ)5.
En présence de mutation BRAF V600, les thérapies ciblées suivantes sont recommandées par le National Comprehensive Cancer Network (NCCN) : dabrafénib en monothérapie ou en association avec le tramétinib ou encore le vémurafénib en monothérapie ou en association avec le cobimétinib. Ce dernier médicament n’est pas commercialisé au Canada3. Les monothérapies de dabrafénib et vémurafénib entraînent des taux de réponse respectifs d’environ 53 et 48 % et représentent des médicaments d’exception à la RAMQ3,6. L’association de dabrafénib et de tramétinib augmente le taux de réponse et diminue les effets indésirables, mais cette association n’est pas remboursée par la RAMQ5,6.
L’interleukine-2 à haute dose a été la première immunothérapie qui a été reconnue pour le traitement du mélanome métastatique3. Seuls quelques hôpitaux au Québec administrent cette thérapie, puisqu’elle peut engendrer des effets indésirables importants nécessitant un accès rapide aux soins intensifs en cas de besoin (hypotension, syndrome de fuite capillaire, œdème pulmonaire, arythmie, etc.)6,7. Bien que l’interleukine-2 entraîne parfois des réponses prolongées, la vaste majorité des patients ne répondent pas au traitement6,7.
L’ipilimumab, mis sur le marché en 2012 au Canada, est un anticorps monoclonal recombinant entièrement humanisé qui présente un mécanisme d’action novateur : en inhibant le cytotoxic T-lymphocyte-associated antigen 4 (CTLA-4), il permet l’activation des lymphocytes T et de leur activité antitumorale. Par rapport au vaccin peptidique gp100, l’ipilimumab augmente le taux de réponse à 10,9 % (comparativement à 1,5 %) et la SG médiane à 10,1 mois (comparativement à 6,4 mois) pour les patients atteints d’un mélanome métastatique ou non résécable qui n’avaient pas répondu à une chimiothérapie systémique8. C’est dans cette indication que l’ipilimumab est remboursé par la RAMQ5. Toutefois, l’ipilimumab est également un choix de première ligne en association avec le nivolumab selon les dernières recommandations du NCCN pour le traitement du mélanome métastatique ou non résécable3.
Le pembrolizumab est un anticorps monoclonal recombinant entièrement humanisé qui inhibe de façon sélective le récepteur programmed cell death-1 (PD-1) sur les lymphocytes T, ce qui bloque l’accès des ligands programmed death-ligand 1 (PD-L1) et programmed death-ligand 2 (PD-L2) à ce récepteur et empêche l’inhibition de l’activité antitumorale par les cellules cancéreuses. Des études de phase I ont comparé différentes posologies de pembrolizumab pour traiter les patients atteints d’un mélanome et qui n’ont pas répondu à l’ipilimumab9. Les résultats d’une première étude ont montré que les posologies de 2 et de 10 mg/kg toutes les trois semaines et de 10 mg/kg toutes les deux semaines sont considérées équivalentes et entraînent une réponse pour respectivement 28 et 40 % des patients ayant reçu ou non l’ipilimumab en traitement de première ligne10. Ces résultats ont été reproduits dans deux autres études de phase I menées respectivement auprès de 135 et 173 patients, ainsi que dans une étude de phase II menée auprès de 540 patients9,11,12. C’est dans ce contexte que le pembrolizumab a été commercialisé le 1er juin 2015 au Canada pour le traitement du mélanome non résécable ou métastatique ayant évolué sous ipilimumab ou sous un inhibiteur de BRAF ou de MEK, en présence d’une mutation BRAF V600.
Protocole de recherche : L’étude KEYNOTE-006 est une étude de phase III multicentrique, ouverte, avec répartition aléatoire, contrôlée par traitement actif, à trois bras de traitements, sans possibilité de chevauchement. L’étude a été réalisée en intention de traiter. La sélection des participants s’est effectuée dans 16 pays, y compris le Canada.
Patients : Les patients d’un âge égal ou supérieur à 18 ans pouvaient participer à l’étude s’ils avaient un diagnostic confirmé histologiquement de mélanome non résécable de stade III ou IV et s’ils avaient reçu au maximum une ligne de traitement antérieure pour un mélanome à un stade avancé ou métastatique. Les autres critères d’inclusions étaient un statut BRAF V600 connu (les patients avec un BRAF V600 muté ou sauvage pouvaient être inclus dans l’étude), un score Eastern Cooperative Oncology Group (ECOG) de 0 ou de 1, et l’accès à un échantillon tumoral pour tester l’expression du PD-L1. En l’absence de symptômes liés au cancer, d’une maladie à évolution rapide ou d’une élévation des taux de lactates déshydrogénases (LDH), un traitement antérieur par un inhibiteur du BRAF V600 n’était pas obligatoire pour l’inclusion des patients ayant cette mutation dans l’étude. De plus, pour être admissibles, les patients ne devaient pas présenter de fortes anomalies de la formule sanguine ou du bilan hépatique, ni de troubles graves de la fonction rénale. Les patients devaient avoir au moins une lésion mesurable selon les critères de la ligne directrice Response Evaluation Criteria In Solid Tumor (RECIST)13.
L’étude excluait les patients qui avaient déjà reçu un inhibiteur du CTLA-4, du PD-1, du PD-L1 ou du PD-L2. Les mélanomes uvéaux ou oculaires, la présence de métastases cérébrales et un diagnostic de méningite carcinomateuse faisaient partie des critères d’exclusion. L’étude excluait également les patients qui avaient reçu une chimiothérapie dans les quatre dernières semaines ou qui avaient été traités pour un autre cancer dans les cinq dernières années avant le début de l’étude, ainsi que ceux qui étaient atteints d’une maladie auto-immune, du virus de l’immunodéficience humaine (VIH), de l’hépatite B ou C, ou d’une infection nécessitant un traitement systémique.
Interventions : Les patients étaient répartis de façon aléatoire dans chaque bras de traitement selon un ratio 1:1:1. Les trois bras thérapeutiques correspondaient respectivement à de l’ipilimumab 3 mg/kg toutes les trois semaines pour quatre cycles maximum, à du pembrolizumab 10 mg/kg toutes les deux semaines ou à du pembrolizumab 10 mg/kg toutes les trois semaines. Les patients répartis dans les bras pembrolizumab recevaient leur traitement jusqu’à l’un des évènements suivants : 1) progression de la maladie, 2) apparition d’une intolérance obligeant le patient à se retirer de l’étude, 3) retrait volontaire du patient ou décidé par le chercheur, 4) réponse complète après au moins six mois de traitement avec un minimum de deux doses supplémentaires après l’objectivation de la réponse complète, 5) 24 mois de traitement. La répartition aléatoire était stratifiée selon le score ECOG, la ligne de traitement et l’expression du PD-L1.
Points évalués : L’objectif primaire de l’étude était d’évaluer la survie sans progression (SSP) et la SG. Les objectifs secondaires étaient d’évaluer l’innocuité, le profil de tolérance et les effets indésirables des traitements. De plus, l’étude évaluait le taux et le temps de réponse, la SSP et la SG dans certains sous-groupes.
Les auteurs avaient prévu trois analyses intérimaires, mais seulement deux ont été effectuées. La deuxième analyse avait lieu après 290 décès tous groupes confondus et un suivi minimal de neuf mois, ou après 12 mois de suivi quel que soit le nombre de décès. Les auteurs ont arrêté l’étude à ce moment, car la SG était significativement supérieure avec le pembrolizumab comparativement à l’ipilimumab. L’analyse finale de la SG (objectif primaire d’efficacité) n’a pas encore été réalisée. Les auteurs effectueront cette analyse après la survenue d’au moins 435 décès tous groupes confondus ou après que chaque patient ait été suivi pendant au moins 21 mois. Étant donné que l’étude a recruté les patients du 18 septembre 2013 au 3 mars 2014, ce délai de 21 mois devait arriver à échéance en décembre 2015.
Résultats : Les auteurs ont dépassé leur objectif de recrutement de 645 sujets, avec 834 patients répartis de façon aléatoire. Dans le bras ipilimumab, 22 patients ont retiré leur consentement. Le tableau I présente la population à l’étude. Il n’y avait aucune différence statistiquement significative quant aux caractéristiques des patients entre les trois bras. Environ 65 % des patients avaient un diagnostic de mélanome métastatique de stade M1c et environ 32 % avaient des taux de LDH élevés, c’est-à-dire des facteurs de mauvais pronostic.
Tableau I. Caractéristiques des patients inclus dans l’étude KEYNOTE-006a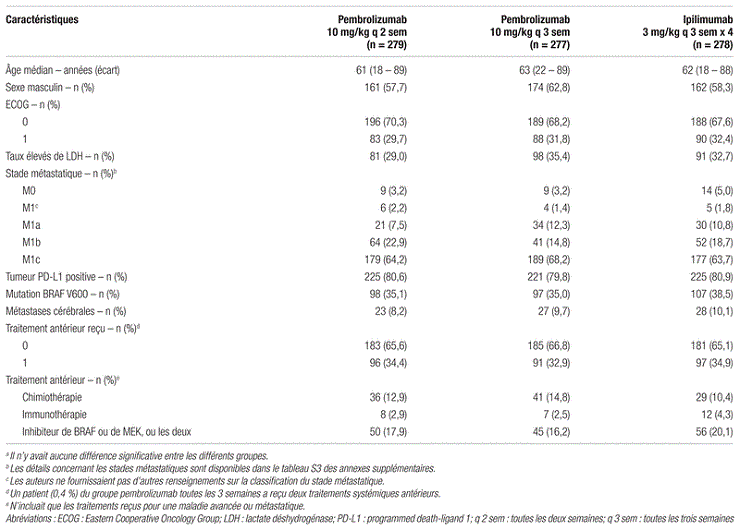
Les principaux résultats de l’étude sont présentés dans le tableau II. Toutefois, les résultats finaux concernant la SG ne sont pas encore disponibles, puisque la médiane n’avait pas encore été atteinte lors de la publication des résultats de KEYNOTE-006. Le rapport de risques (RR) de la SSP à six mois comparativement à l’ipilimumab est de 0,58 (intervalle de confiance à 95 % [IC 95 %]:0,46–0,72;p<0,001) pour le pembrolizumab toutes les deux semaines et de 0,58 (IC 95 %:0,47–0,72;p<0,001) pour le pembrolizumab toutes les trois semaines, ce qui correspond respectivement à un nombre nécessaire de sujets à traiter (NNT) de 5 et de 6. Le RR de la SG à un an comparativement à l’ipilimumab était respectivement de 0,63 (IC 95 %:0,47–0,83;p<0,0005) et de 0,69 (IC 95 %:0,52–0,90;p=0,0036) pour ces deux traitements, ce qui correspond à un NNT respectif de 7 et de 10. Ces avantages thérapeutiques étaient constants dans presque tous les sous-groupes analysés (analyses selon le sexe, l’âge, la race, l’ECOG et le nombre de lignes de traitements reçues). Toutefois, ces avantages n’étaient pas significatifs si la tumeur n’exprimait pas le PD-L1 ou si elle présentait une mutation BRAF.
Tableau II. Principaux résultats d’efficacité et d’innocuité observés dans les groupes pembrolizumab et ipilimumab de l’étude KEYNOTE-006
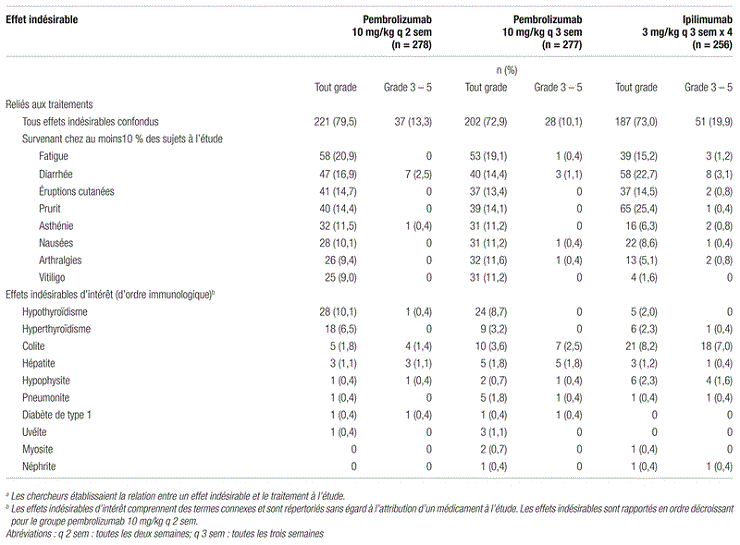
En ce qui concerne l’innocuité, le pembrolizumab toutes les deux à trois semaines était mieux toléré que l’ipilimumab et entraînait moins d’effets indésirables de grade 3 à 5 (respectivement 13,3 et 10,1 %, comparativement à 19,9 %), malgré une durée d’exposition trois fois plus importante dans les groupes pembrolizumab. Le taux d’arrêt permanent des traitements était inférieur dans les groupes pembrolizumab toutes les deux à trois semaines (respectivement 4,0 et 6,0 %) comparativement à celui du groupe ipilimumab (9,4 %). Les effets indésirables les plus fréquemment observés avec le pembrolizumab, tous grades confondus, étaient la fatigue, les diarrhées, les éruptions cutanées et le prurit. Le tableau III présente les effets indésirables les plus fréquents ainsi que les effets indésirables de nature immunitaire du pembrolizumab et de l’ipilimumab.
Tableau III. Principaux effets indésirables du pembrolizumab et de l’ipilimumab observés dans l’étude KEYNOTE-006a

La mise en œuvre d’une étude d’oncologie multicentrique de cette envergure, avec répartition aléatoire, contrôlée par traitement actif et analysée en intention de traiter sont des points forts de KEYNOTE-006. De plus, l’ipilimumab était un bon choix de comparateur puisqu’il s’agissait au moment de l’étude KEYNOTE-006 d’un bon traitement de première intention ayant démontré sa supériorité comparativement aux chimiothérapies traditionnelles3,8,15. Dans cette étude, le taux de réponse à l’ipilimumab est de 11,9 %, similaire au taux de 10,1 % observé dans l’étude de Hodil et coll., qui présentait une population recevant l’ipilimumab en deuxième ligne de traitement8. Ceci semble montrer que le bras ipilimumab de l’étude KEYNOTE-006 était valide8. De plus, la dose d’ipilimumab utilisée dans l’étude KEYNOTE-006 correspond à celle recommandée dans la monographie du produit, soit 3 mg/kg toutes les trois semaines, pour un total de quatre doses16. Étant donné la toxicité importante de cet agent, il serait difficile de poursuivre le traitement au-delà de ces quatre doses recommandées. À l’opposé, le pembrolizumab entraîne moins d’effets indésirables et il est donc possible de poursuivre le traitement jusqu’à l’évolution du cancer, comme il a été fait dans cette étude17. Dans l’étude KEYNOTE-006, l’exposition des patients au pembrolizumab a été trois fois supérieure à celle des patients sous ipilimumab, ce qui représente un avantage inhérent à la faible toxicité du pembrolizumab.
Les populations étudiées dans les trois bras thérapeutiques étaient semblables, sans différences statistiquement significatives. De plus, la population étudiée était assez âgée et une majorité des participants avait des facteurs de mauvais pronostic, comme un mélanome de stade M1c et des taux élevés de LDH. Malgré cela, le pembrolizumab a démontré des avantages importants par rapport à l’ipilimumab qui étaient constants dans les différents sous-groupes évalués, avec un RR pour la SSP à six mois de 0,58 pour les deux régimes de pembrolizumab, comparativement à l’ipilimumab. Le RR pour la SG à un an était respectivement de 0,63 et de 0,69 pour le pembrolizumab toutes les deux et toutes les trois semaines. Concrètement, il faudrait traiter 7 patients avec du pembrolizumab toutes les deux semaines ou 10 patients avec du pembrolizumab toutes les trois semaines pour obtenir un survivant de plus après un an de traitement. Pour ce qui est de la SSP, il faudrait traiter 5 patients avec du pembrolizumab toutes les deux semaines ou 6 patients avec du pembrolizumab toutes les trois semaines pendant six mois pour éviter une évolution de la maladie. En plus de ces avantages importants, les effets indésirables de grade 3 à 5 étaient près de deux fois moins fréquents avec le pembrolizumab qu’avec l’ipilimumab et ils se manifestaient plus tard. De plus, les taux de réponse d’environ 33 % obtenus dans l’étude KEYNOTE-006 étaient cohérents avec ceux observés dans les études de phase I et II9–12.
Dans les cas de mélanomes métastatiques ou non résécables en l’absence d’une mutation de BRAF V600, le NCCN recommande comme traitement de première intention le nivolumab, l’ipilimumab en association avec le nivolumab, ou le pembrolizumab3. Pendant le déroulement de l’étude KEYNOTE-006, l’ipilimumab en monothérapie était considéré comme une première ligne de traitement, ce qui en faisait un bon comparateur pour le pembrolizumab. L’interleukine-2 n’est administrée que par quelques hôpitaux au Québec; elle possède un profil d’effets indésirables important et n’entraîne une évolution favorable de la maladie que pour un nombre négligeable de patients6,7. L’étude de phase II KEYNOTE-002 comparait deux doses de pembrolizumab (2 et 10 mg/kg toutes les trois semaines) à une chimiothérapie (paclitaxel et carboplatine seuls ou en association, dacarbazine ou témozolomide, au choix du chercheur) pour le traitement du mélanome métastatique ou non résécable ayant évolué sous ipilimumab ou sous un inhibiteur de BRAF ou de MEK. Cette étude démontrait une SSP à six mois de 34 % pour le pembrolizumab 2 mg/kg, de 38 % pour le pembrolizumab 10 mg/kg et de 16 % pour la chimiothérapie au choix. Les valeurs de p pour la SSP étaient toutes inférieures à 0,0001. Les effets indésirables de grade 3 ou 4 étaient environ deux fois moins fréquents dans les groupes pembrolizumab que dans le groupe chimiothérapie au choix12. Le nivolumab, un inhibiteur du PD-1 comme le pembrolizumab, a été développé par Bristol-Myers SquibbMD et a récemment été commercialisé au Canada pour le traitement du mélanome non résécable ou métastatique avec un gène BRAF V600 de type sauvage, pour les patients n’ayant jamais reçu de traitement. Dans l’étude de phase III CheckMate 037, le nivolumab a été comparé à une chimiothérapie au choix du chercheur après une évolution du mélanome à un stade avancé sous ipilimumab : le taux de réponse était de 31,7 % dans le groupe nivolumab comparativement à 10,6 % dans le groupe chimiothérapie18. Le nivolumab a également été étudié en traitement de première intention pour le mélanome à un stade avancé sans mutation BRAF, comparativement à la dacarbazine19. À un an, le taux de SG était de 72,9 % pour le nivolumab et de 42,1 % pour la dacarbazine (p<0,001)19. Le taux de réponse était de 40,0 % pour le nivolumab et de 13,9 % pour la dacarbazine (p<0,001)19. La SSP médiane était de 5,1 mois pour le nivolumab et de 2,2 mois pour la dacarbazine (p<0,001)19. L’association du nivolumab à l’ipilimumab a été étudiée dans une étude de phase III3. La SSP de cette association était améliorée comparativement à chaque agent en monothérapie, au prix de toxicités significatives3. Depuis une mise à jour des recommandations d’experts du NCCN de 2015, l’ipilimumab, l’interleukine-2 à haute dose et les chimiothérapies traditionnelles sont passées de première ligne de traitement à des choix de deuxième ligne3. Ces changements de recommandations d’experts ont probablement été motivés par des études comme KEYNOTE-006.
Dans les cas de mélanomes métastatiques ou non résécables avec une mutation de BRAF V600, le NCCN recommande les traitements de première intention suivants : pembrolizumab, nivolumab ou ipilimumab en association avec le nivolumab3. Il recommande également le vémurafénib en monothérapie ou en association au cobimétinib ou encore le dabrafénib en monothérapie ou en association avec le tramétinib3. Ces derniers traitements sont très intéressants si une réponse rapide est désirée et c’est probablement la raison pour laquelle les auteurs de la présente étude ont exclu les patients qui pouvaient recevoir ce traitement et qui avaient des lésions évoluant rapidement, des taux élevés de LDH ou des symptômes liés à leur cancer.
L’étude KEYNOTE-006 était intéressante en raison de son inclusion de patients ayant déjà montré un échec à une autre ligne de traitement ou de patients présentant une mutation BRAF. En effet, KEYNOTE-006 a démontré que le pembrolizumab était un choix intéressant aussi bien en première qu’en deuxième ligne de traitement. L’étude a également démontré que le pembrolizumab est un choix intéressant dans les cas de mutation BRAF, si le mélanome n’évolue pas rapidement. Le pembrolizumab ne démontrait pas d’avantages par rapport à l’ipilimumab pour les patients de ce sous-groupe ni pour les patients qui n’exprimaient pas le PD-L1. Ces sous-groupes étaient sous-représentés dans l’étude, ce qui pourrait expliquer ces résultats non significatifs. De plus, il existe beaucoup de controverses concernant l’expression du PD-L1. Le seuil de détection à utiliser, la méthode de coloration, l’hétérogénéité de l’expression intratumorale et le changement de l’expression du PD-L1 au cours du temps sont autant de points qui limitent l’interprétation de ces résultats20.
Pour ce qui est des autres limites de cette étude, mentionnons la conception ouverte de l’étude et l’exclusion de certains patients que les cliniciens sont susceptibles de rencontrer au quotidien : patients ayant un ECOG supérieur à 1 ou une mutation de BRAF avec une maladie à évolution rapide. Merck a participé à tous les processus de l’étude, de la conception du protocole à l’écriture de l’article scientifique, en passant par l’analyse des données. Une telle participation implique un fort potentiel de conflit d’intérêts. Sur le plan éthique, l’étude ne permettait pas de chevauchement des bras à l’étude. Une telle restriction permet de préserver la signification des tests statistiques, mais a pu être délétère pour les patients du bras ipilimumab qui ont dû attendre la fin de l’étude pour recevoir le traitement le plus efficace. La dose indiquée de pembrolizumab pour le traitement du mélanome métastatique ou non résécable est de 2 mg/kg toutes les trois semaines, ce qui est largement inférieur aux doses de 10 mg/kg utilisées dans l’étude KEYNOTE-006. Cette différence peut s’expliquer par le fait que les résultats d’études de phase I démontrant l’équivalence des doses de 2 mg/kg et de 10 mg/kg en matière d’efficacité ont été publiés pendant le déroulement de l’étude KEYNOTE-0069,10. Bien qu’il soit impossible d’extrapoler directement les résultats de KEYNOTE-006 à la dose de 2 mg/kg, il est rassurant de voir que le taux de réponse associé à ces deux doses différentes était de 26 % (p=0,96) dans l’étude KEYNOTE-0019. De plus, une autre étude de phase I menée auprès de 411 patients a démontré des résultats très semblables à ceux de KEYNOTE-006 en ce qui concerne le taux de réponse, la SSP à six mois ainsi que la SG à 12 mois10. On a observé ces résultats aussi bien avec les doses de 10 mg/kg toutes les deux ou trois semaines qu’avec la dose de 2 mg/kg toutes les trois semaines10. Une troisième étude publiée en août 2015, l’étude KEYNOTE-002, a également démontré que les doses de pembrolizumab de 2 et 10 mg/kg toutes les trois semaines étaient équivalentes et entraînaient un taux de réponse respectif de 21 et 25 % (p=0,21)12. Ces études semblent s’accorder sur le fait que les doses de pembrolizumab de 2 et 10 mg/kg toutes les trois semaines sont équivalentes. Cependant ces études n’avaient probablement pas la puissance statistique pour distinguer une différence d’efficacité entre ces deux doses. Santé Canada a autorisé la mise en marché du pembrolizumab sur la base des données de l’étude de phase Ib KEYNOTE-001, dans le cadre de laquelle on a étudié les doses de 2 mg/kg et de 10 mg/kg de pembrolizumab toutes les trois semaines pour le traitement du mélanome non résécable ou métastatique9. La population à l’étude était semblable à celle de KEYNOTE-006, à la différence que 73 % (n = 126) des patients de KEYNOTE-001 avaient reçu au moins deux traitements antérieurs, et que tous les patients avaient au moins reçu l’ipilimumab9. Les résultats de KEYNOTE-001 n’ont démontré aucune différence significative d’efficacité entre les deux doses étudiées9. Avec ce recul, il est cohérent que Santé Canada ait approuvé la plus petite dose efficace, soit 2 mg/kg toutes les trois semaines.
Le pembrolizumab a été évalué de manière prioritaire par l’INESSS, qui a rendu un avis au ministre en février 2016, mais cet avis n’est pas disponible pour consultation par le public. Santé Canada place le pembrolizumab comme choix de traitement après un échec à l’ipilimumab. De son côté, la RAMQ ne rembourse l’ipilimumab qu’à la suite de l’échec d’un traitement antérieur, ce qui mettrait le pembrolizumab en troisième ligne de traitement advenant son acceptation par l’INESSS. Paradoxalement, le NCCN recommande le pembrolizumab en première ligne et l’ipilimumab en monothérapie en deuxième ligne de traitement3.
L’étude KEYNOTE-006 présente des résultats prometteurs pour le pembrolizumab pour le traitement du mélanome métastatique non résécable, comparativement à l’ipilimumab. Ces résultats de SSP et de SG, tous significatifs, démontrent des avantages importants, sans nécessité de traiter un large nombre de patients. KEYNOTE-006 fournit également des données rassurantes en ce qui concerne l’innocuité du pembrolizumab, qui entraînerait près de deux fois moins de toxicités que l’ipilimumab. Toutefois, l’utilisation de cet agent pourrait être freinée par son prix et par son évaluation par les organismes gouvernementaux.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
L’article a été fait dans le cadre du cours Information sur les médicaments basée sur la preuve (PHA-6074) de la maîtrise en pharmacothérapie avancée de la Faculté de pharmacie de l’Université Laval. Les auteurs tiennent à remercier Julie Méthot pour son soutien à la publication de cet article.
1. Robert C, Schachter J, Long GV, Arance A, Grob JJ, Mortier L et coll. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015;372:2521–32.
2. Comité consultatif de la Société canadienne du cancer : statistiques canadiennes sur le cancer 2015. Toronto (Ontario) : Société canadienne du cancer. 160 p.
3. Coit DG, Thompson JA, Andtbacka R, Bichakjian CK, Carson WE, Daniels GA et coll. Melanoma version 2.2016. [En ligne] http://www.nccn.org/professionals/physician_gls/pdf/melanoma.pdf (site visité le 25 mai 2015; accès réservé aux abonnés).
4. Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR et coll. Final version of 2009 AJCC melanoma staging and classification. J Clin Oncol 2009;27:6199–206.

5. Régie de l’assurance maladie du Québec. Liste de médicaments. [En ligne] http://www.ramq.gouv.qc.ca/fr/professionnels/optometristes/medicaments/Pages/liste-medicaments.aspx (site visité le 24 août 2015).
6. Palathinkal DM, Sharma TR, Koon HB, Bordeaux JS. Current systemic therapies for melanoma. Dermatol Surg 2014;40:948–63.
7. Foletto MC, Haas SE. Cutaneous melanoma: new advances in treatment. An Bras Dermatol 2014;89:301–10.

8. Hodi FS, O’Day SJ, McDermott DF, Weber RW, Sosman JA, Haanen JB et coll. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010;363:711–23.

9. Robert C, Ribas A, Wolchok JD, Hodi FS, Hamid O, Kefford R et coll. Anti-programmed-death-receptor- 1 treatment with pembrolizumab in ipilimumab-refractory advanced melanoma: a randomised dose-comparison cohort of a phase 1 trial. Lancet 2014;384:1109–17.
10. Ribas A, Wolchok JD, Robert C, Kefford K, Hamid O, Daud A et coll. Updated clinical efficacy of the anti-PD-1 monoclonal antibody pembrolizumab in 411 patients with melanoma [abstract]. Soc Melanoma Res (Meeting Abstracts) 2015.
11. Hamid O, Robert C, Daud A, Hodi FS, Hwu WJ, Kefford R et coll. Safety and tumor responses with lambrolizumab (anti-PD-1) in melanoma. N Engl J Med 2013;369:134–44.

12. Ribas A, Puzanov I, Dummer R, Schadendorf D, Hamid O, Robert C et coll. Pembrolizumab versus investigator-choice chemotherapy for ipilimumab- refractory melanoma (KEYNOTE-002): a randomised, controlled, phase 2 trial. Lancet Oncol 2015;16:908–18.
13. Eisenhauer EA, Therasse P, Bogaerts J, Schwartz LH, Sargent D, Ford R et coll. New response evaluation criteria in solid tumours: revised RECIST guideline (version 1.1). Eur J Cancer 2009;45:228–47.
14. Régie de l’assurance maladie du Québec. Liste des médicaments – Établissement. [En ligne] http://www.ramq.gouv.qc.ca/fr/regie/publications-legales/Pages/liste-medicaments-etablissements.aspx (site visité le 25 août 2015).
15. Robert C, Thomas L, Bondarenko I, O’Day S, Weber J, Garbe C et coll. Ipilimumab plus dacarbazine for previously untreated metastatic melanoma. N Engl J Med 2011;364:2517–26.
16. Bristol-Myers Squibb. Monographie de l’ipilimumab (Yervoy). Montréal, Québec. Septembre 2015.
17. Merck. Monographie du pembrolizumab (Keytruda). Kirkland, Québec. Octobre 2015.
18. Weber JS, D’Angelo SP, Minor D, Hodi FS, Gutzmer R, Neyns B et coll. Nivolumab versus chemotherapy in patients with advanced melanoma who progressed after anti-CTLA-4 treatment (CheckMate 037): a randomised, controlled, open-label, phase 3 trial. Lancet Oncol 2015;16:375–84.
19. Robert C, Long GV, Brady B, Dutriaux C, Maio M, Mortier L et coll. Nivolumab in previously untreated melanoma without BRAF mutation. N Engl J Med 2015;372:320–30.
20. Teng MW, Ngiow SF, Ribas A, Smyth MJ. Classifying cancers based on T-cell infiltration and PD-L1. Cancer Res 2015;75:2139–45.

PHARMACTUEL, Vol. 49, No. 1, 2016