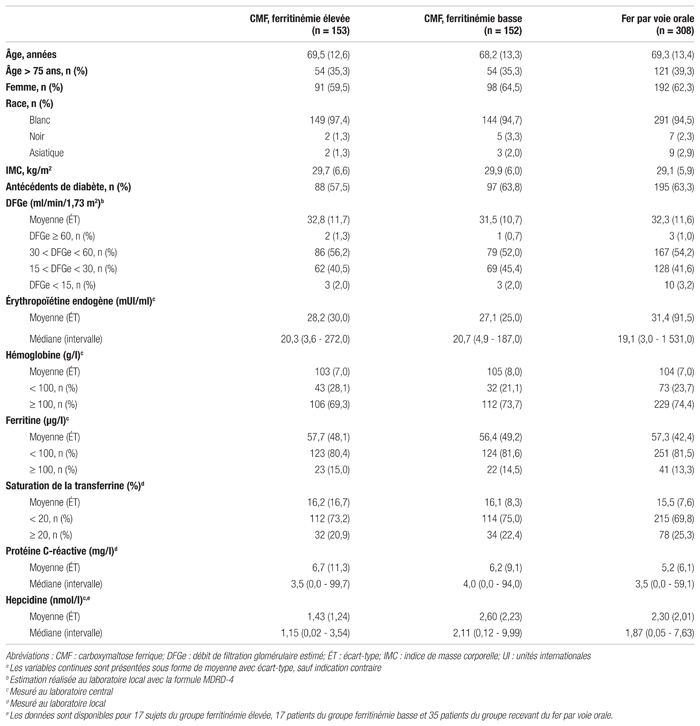
Tableau II Principaux résultats d’efficacité de l’étude FIND-CKDa
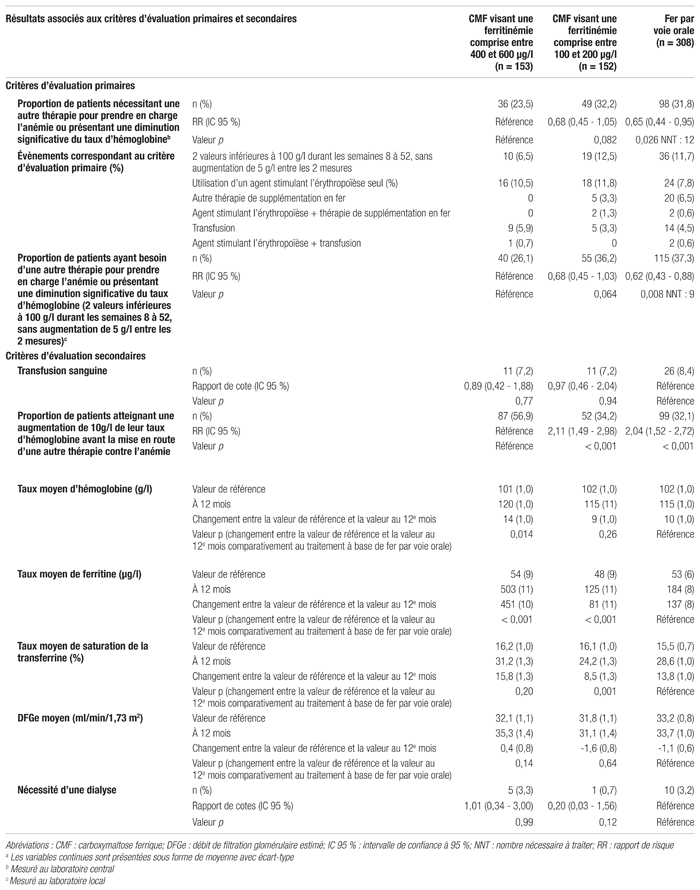
Catherine Blais1,2,3, B.Pharm., M.Sc., Stéphanie Gasse1,2,4, B.Pharm., M.Sc., Guillaume Gobeil1,2,5, B.Pharm., M.Sc.
Reçu le 5 septembre 2015; Accepté après révision par les pairs le 2 novembre 2015
Titre : FIND-CKD: a randomized trial of intravenous ferric carboxymaltose versus oral iron in patients with chronic kidney disease and iron deficiency anaemia. Nephrol Dial Transplant 2014;29:2075-841.
Auteurs : Macdougall IC, Bock AH, Carrera F, Eckardt KU, Gaillard C, Van Wyck D et coll.
Commanditaires : Cette étude a été financée par Vifor Pharma.
Cadre de l’étude : L’anémie représente une complication fréquente de l’insuffisance rénale chronique (IRC)2. Le taux d’hémoglobine est inférieur à 120 g/l pour 25 % des patients atteints d’IRC de stade I–II. Cette proportion augmente jusqu’à 50 % pour les patients atteints d’IRC de stade IV2. L’anémie peut être la conséquence d’une carence en érythropoïétine ou en fer3. Le groupe KDIGO (Kidney Disease: Improving Global Outcomes), après avoir pris en compte les effets indésirables signalés avec les agents stimulant l’érythropoïèse, notamment les accidents vasculaires cérébraux et les embolies pulmonaires, recommande dans ses nouvelles lignes directrices d’entreprendre dans un premier temps un traitement à base de fer pour la prise en charge de l’anémie4,5. Toutefois, à ce jour, les données probantes qui figurent dans la documentation scientifique sont insuffisantes pour déterminer la voie d’administration à privilégier pour la réplétion en fer des patients prédialysés.
L’objectif de cette étude consiste à comparer l’efficacité et l’innocuité de l’administration de carboxymaltose ferrique (CMF) par voie intraveineuse ou de fer par voie orale pour les patients anémiques et prédialysés, et à étudier les répercussions de différents taux cibles de ferritine dans cette même population.
Protocole de recherche : Il s’agit d’une étude ouverte, multicentrique, à répartition aléatoire, avec trois groupes parallèles et se déroulant sur 56 semaines. Les patients ont été répartis aléatoirement en trois groupes avec une ventilation par pays, selon la proportion 1:1:2, à savoir un groupe recevant du CMF visant une ferritinémie élevée, un groupe recevant du CMF visant une ferritinémie basse et un groupe recevant du fer par voie orale. Les analyses ont été effectuées en intention de traiter. En ce qui concerne le critère d’évaluation primaire, la taille de l’échantillon doit être de 360 patients pour obtenir une puissance de 90 % permettant de détecter une différence entre les deux groupes analysés (CMF visant une ferritinémie élevée et fer par voie orale) d’après la méthode d’analyse par descente par palier (step-down procedure).
Patients : Entre décembre 2009 et janvier 2012, l’étude a sélectionné 626 patients dans 193 centres de néphrologie de 20 pays différents. Les patients avaient plus de 18 ans, n’étaient pas dialysés, avaient un débit de filtration glomérulaire estimé (DFGe) entre 15 et 60 ml/min/1,73 m2 selon la formule MDRD (modification of the diet in renal disease) et devaient avoir une perte de fonction rénale prévue de moins de 12 ml/min/1,73 m2/an. Les patientes enceintes ne pouvaient pas participer à l’étude. Le taux d’hémoglobine des patients devait être compris entre 90 et 110 g/l et celui de la ferritine devait être inférieur à 100 μg/l (ou inférieur à 200 μg/l avec une saturation de la transferrine inférieure à 20 %) dans les quatre semaines précédant la répartition aléatoire. Les patients ne devaient pas avoir reçu des agents stimulant l’érythropoïèse dans les quatre mois avant la répartition aléatoire et devaient fournir un consentement écrit. Les principaux critères d’exclusion étaient une anémie due à une cause autre qu’une carence en fer, des antécédents d’intolérance au fer par voie orale en raison d’effets gastro-intestinaux, une infection, un taux de protéine-C réactive supérieur à 20 mg/l, un saignement actif, un cancer, une hépatopathie chronique ou une insuffisance cardiaque de classe IV sur l’échelle de la New York Heart Association. Le lecteur est invité à consulter l’annexe (tableau S1) de la publication originale pour obtenir l’ensemble des critères d’inclusion et d’exclusion1.
Interventions : Au jour 0, selon le groupe de traitement, tous les patients commençaient une thérapie de supplémentation en fer. Les doses de CMF pour le groupe visant une ferritinémie élevée étaient ajustées afin d’obtenir un taux de ferritine sérique compris entre 400 et 600 μg/l. Pour le groupe visant une ferritinémie basse, les doses étaient ajustées afin d’obtenir un taux de ferritine sérique compris entre 100 et 200 μg/l. Au jour 0, 1 000 mg de CMF était donné aux patients du groupe visant une ferritinémie élevée (500 mg au jour 0 et au jour 7 pour les patients pesant moins de 66 kg) et 200 mg de CMF était donné aux patients du groupe visant une ferritinémie basse si le taux de ferritine sérique était inférieur à 100 μg/l. Durant les semaines 4 à 48, du CMF était administré toutes les quatre semaines aux patients du groupe visant une ferritinémie élevée qui avaient un taux de ferritine inférieur à 400 μg/l (1 000 mg si le taux de ferritine était inférieur à 200 μg/l; 500 mg si le taux de ferritine était compris entre 200 et 400 μg/l) ainsi qu’aux patients du groupe visant une ferritinémie basse qui avaient un taux de ferritine inférieur à 200 μg/l (200 mg si le taux de ferritine était inférieur à 100 μg/l). Aucune administration de fer n’avait lieu si le taux de saturation de la transferrine d’un patient était supérieur à 40 %. Les patients répartis aléatoirement dans le groupe prenant du fer par voie orale recevaient un comprimé de sulfate ferreux contenant 100 mg de fer élémentaire deux fois par jour jusqu’à la semaine 52. Le traitement à base de fer par voie orale était interrompu lorsque le taux de ferritine était supérieur à 200 μg/l et repris lorsque le taux de ferritine devenait inférieur à 100 μg/l. Un suivi était effectué toutes les deux semaines pendant les huit premières semaines, puis toutes les quatre semaines. Au total, l’analyse a porté sur 153 patients du groupe visant une ferritinémie élevée, 152 patients du groupe visant une ferritinémie basse et 308 patients du groupe recevant du fer par voie orale. Durant les huit premières semaines de l’étude, les patients n’étaient pas autorisés à recevoir un autre traitement régulant le taux d’hémoglobine que celui auquel ils avaient été affectés de façon aléatoire, sauf en cas d’absolue nécessité. Par la suite, les patients pouvaient recevoir d’autres thérapies, selon l’usage local, si leur taux d’hémoglobine était inférieur à 100 g/l.
Points évalués : Le critère d’évaluation primaire de cette étude était le délai avant la mise en route d’une autre solution thérapeutique pour prendre en charge l’anémie (changement d’agent ou modification de la posologie) ou bien l’obtention de deux taux consécutifs d’hémoglobine inférieurs à 100 g/l entre les semaines 8 et 52, sans augmentation de 5 g/l entre ces deux mesures. Les critères d’évaluation secondaires étaient le pourcentage de patients nécessitant une transfusion sanguine ou une dialyse, arrêtant le traitement à l’étude en raison d’intolérances, présentant une hausse du taux d’hémoglobine supérieure ou égale à 10 g/l, présentant un changement de leur qualité de vie selon l’échelle SF-36 (Short Form36), et présentant une modification du DFGe ou des valeurs du bilan martial ou de la formule sanguine à 12 mois comparativement aux valeurs observées au moment de la répartition aléatoire.
Résultats : Les caractéristiques des patients étaient semblables entre les différents groupes à l’étude (tableau I). Les résultats associés aux critères d’évaluation primaires et secondaires sont présentés dans le tableau II. En ce qui concerne le critère d’évaluation primaire, le pourcentage de patients nécessitant une autre thérapie contre l’anémie ou présentant une diminution significative du taux d’hémoglobine était de 23,5 % pour le groupe CMF visant une ferritinémie élevée, de 32,2 % pour le groupe CMF visant une ferritinémie basse et de 31,8 % pour le groupe recevant du fer par voie orale. La différence observée entre le groupe CMF visant une ferritinémie élevée et le groupe fer par voie orale était significative (p=0,026). Selon ce résultat, le nombre nécessaire de sujets à traiter (NNT) est de 12. Pour les patients ayant eu besoin d’une autre thérapie, les agents stimulant l’érythropoïèse étaient le premier traitement le plus souvent utilisé dans les trois groupes de traitement (à savoir pour 10,5 % des patients du groupe visant une ferritinémie élevée, 11,8 % de ceux du groupe visant une ferritinémie basse et 7,8 % de ceux du groupe recevant du fer par voie orale). Les patients du groupe recevant du fer par voie orale avaient tendance à recevoir plus souvent une autre supplémentation en fer (6,5 %) comparativement aux patients des autres groupes (0 % pour le groupe visant une ferritinémie élevée et 3,3 % pour le groupe visant une ferritinémie basse). Enfin, la transfusion sanguine était le premier choix de traitement pour 5,9 % des patients du groupe visant une ferritinémie élevée, pour 3,3 % des patients du groupe visant une ferritinémie basse et pour 4,5 % des patients du groupe recevant du fer par voie orale.
Tableau I Caractéristiques de base des patients de l’étude FIND-CKD1,a

Tableau II Principaux résultats d’efficacité de l’étude FIND-CKDa
En ce qui concerne les critères d’évaluation secondaires, la proportion de patients ayant obtenu une augmentation du taux d’hémoglobine ≥ 10 g/l était de 56,9 % pour le groupe CMF visant une ferritinémie élevée, comparativement à 34,2 % pour le groupe CMF visant une ferritinémie basse (p<0,001) et à 32,1 % pour le groupe recevant du fer par voie orale (p<0,001). En ce qui concerne la proportion de patients ayant reçu une transfusion sanguine, la différence était non significative entre les trois groupes. Les trois groupes ont obtenu une augmentation du taux d’hémoglobine à 12 mois, celle-ci étant significativement plus grande dans le groupe CMF visant une ferritinémie élevée (p=0,014). La différence entre la valeur de référence du taux de saturation de la transferrine et celle observée à 12 mois était semblable dans le groupe recevant du fer par voie orale et dans le groupe CMF visant une ferritinémie élevée, mais significativement plus faible dans le groupe CMF visant une ferritinémie basse.
Le nombre de patients ayant subi au moins un effet indésirable était comparable dans chacun des groupes à l’étude. Les effets indésirables les plus courants dans les groupes recevant du CMF étaient un œdème périphérique (13,8 %), une hypertension (11,5 %), des infections urinaires (9,2 %) et une dorsalgie (8,9 %). Dans le groupe recevant du fer par voie orale, les effets indésirables les plus fréquents étaient une diarrhée (14,4 %), une constipation (11,9 %), une hypertension (10,3 %) et un œdème périphérique (9,3 %). Deux patients du groupe CMF visant une ferritinémie basse ont présenté une réaction d’hypersensibilité ayant mené à l’arrêt du traitement. Aucun cas d’hypophosphatémie secondaire au traitement n’a été répertorié. Des néoplasies bénignes ou malignes ont été répertoriées chez 12 patients (7,8 %) du groupe CMF visant une ferritinémie élevée, chez cinq patients (3,3 %) du groupe CMF visant une ferritinémie basse et chez huit patients (2,6 %) du groupe recevant du fer par voie orale. Les effets indésirables graves les plus courants étaient des problèmes cardiaques et des infections. Toutefois, seulement un patient prenant du fer par voie orale aurait eu un effet indésirable grave lié au traitement. La survenue d’une intolérance a entraîné l’arrêt du traitement à l’étude pour un patient (0,7 %) du groupe CMF visant une ferritinémie élevée, deux patients (1,3 %) du groupe CMF visant une ferritinémie basse et 23 patients (7,5 %) du groupe recevant du fer par voie orale (p=0,002). La survenue d’un effet indésirable a entraîné l’arrêt du traitement à l’étude pour cinq patients (3,2 %) du groupe CMF visant une ferritinémie élevée et sept patients (4,7 %) du groupe CMF visant une ferritinémie basse, comparativement à 42 patients (13,5 %) du groupe recevant du fer par voie orale (dont 23 patients [7,5 %] ayant présenté des troubles gastro-intestinaux). Durant l’étude, 25 patients (4,1 %) sont décédés. Aucun de ces décès n’a été associé à la thérapie à l’étude. La qualité de vie des patients ne s’est pas améliorée de façon significative dans les trois groupes de traitement à l’étude.
L’étude FIND-CKD démontre que l’utilisation de fer intraveineux est justifiée en pratique pour augmenter le taux d’hémoglobine des patients atteints d’insuffisance rénale et pour retarder l’utilisation d’un agent stimulant l’érythropoïèse. De plus, le fer intraveineux semble présenter une bonne innocuité pour la période étudiée de 56 semaines, ce qui est rassurant pour les cliniciens, étant donné que les études antérieures étaient effectuées sur une plus courte période. Par contre, d’autres essais cliniques devront être menés pour évaluer l’innocuité de ce produit à plus long terme, pour une période au-delà d’un an.
Les études actuelles comparant la préparation de fer par voie orale à celle par voie intraveineuse pour la prise en charge de l’anémie des patients prédialysés démontrent la supériorité du traitement par CMF pour obtenir une réplétion des réserves en fer et une augmentation du taux d’hémoglobine. Réalisées sur de courtes périodes et auprès de petites cohortes, ces études ne permettent toutefois pas d’évaluer l’efficacité et l’innocuité de chacun de ces traitements à plus long terme. Une méta-analyse a rassemblé six études incluant des patients atteints d’une IRC et sept études incluant des patients dialysés6. Cette analyse a montré que comparativement aux patients dialysés recevant du fer par voie orale, ceux traités par le CMF avaient un meilleur taux d’hémoglobine (résultat significatif; p=0,03). Cette différence était moindre pour les patients atteints d’une IRC non dialysés (IC 95 %:0,09–0,53), bien qu’elle demeurait significative (p=0,005). Cette méta-analyse a également démontré qu’il n’y avait pas de différence significative dans la survenue d’effet indésirable entre les groupes thérapeutiques recevant du fer intraveineux ou du fer par voie orale6. Étant donné l’absence d’un consensus clair sur la voie d’administration à favoriser pour la prise en charge de l’anémie des patients prédialysés, l’étude FIND-CKD, réalisée sur une période de 56 semaines, avait pour but d’éclairer les cliniciens sur le meilleur choix de traitement à envisager pour cette population.
Les essais cliniques à répartition aléatoire étudient rarement les taux de ferritine qu’un traitement à base de fer devrait cibler. Ainsi, à l’heure actuelle, il n’est pas possible d’élaborer des recommandations précises basées sur des données probantes quant aux taux de ferritine à cibler au cours de la prise en charge de l’anémie5,7. L’étude FIND-CKD avait pour objectif de comparer l’efficacité des préparations intraveineuses de fer ciblant différents taux de ferritine de celle d’un traitement de fer par voie orale. L’analyse des résultats a principalement porté sur la comparaison de la préparation de CMF visant une ferritinémie élevée et de celle de fer par voie orale. De ce fait, il est difficile de déterminer si le traitement par CMF visant une ferritinémie élevée est supérieur à celui par CMF visant une ferritinémie basse. Toutefois, l’étude FIND-CKD conclut, avec les résultats obtenus, que les patients atteints d’une IRC bénéficieraient davantage d’un traitement par fer intraveineux visant une ferritinémie élevée pour la prise en charge de leur anémie.
Les forces de l’étude reposent entres autres sur la longue période de suivi de 56 semaines et sur la présence de trois groupes à l’étude recevant différents traitements de fer qui reflètent les traitements recommandés à l’heure actuelle. Les critères d’évaluation primaires et secondaires concernant l’innocuité des trois schémas thérapeutiques à l’étude sont également pertinents et inspirants pour la pratique actuelle, étant donné que la préparation de fer par voie orale demeure à ce jour très utilisée. Enfin, puisque les préparations intraveineuses de fer sont comparables, il est possible d’extrapoler à notre clientèle certaines des données de cette étude concernant l’efficacité et l’innocuité du CMF et de nous rassurer sur la pratique actuelle au Québec.
Il aurait été intéressant d’avoir un groupe comparateur avec placébo. Toutefois, étant donné l’aspect plus effractif de l’administration intraveineuse et le profil anémique des patients, il n’aurait pas été justifié du point de vue éthique de réaliser cette étude en double aveugle avec la présence d’un groupe placébo. Certaines caractéristiques de la population à l’étude, notamment l’état inflammatoire faible permettant une meilleure absorption du fer par voie orale et l’ethnicité majoritairement caucasienne, limitent la généralisation des résultats obtenus à l’ensemble de la population. Une faiblesse de l’étude est qu’elle ne faisait aucune mention de la médication concomitante prise par les patients, qui aurait pu, dans certains cas, influencer les résultats obtenus. De plus, puisque les critères d’évaluation ne comprenaient pas l’innocuité d’une utilisation sur le long terme des différentes préparations de fer intraveineux, aucune différence significative entre les groupes n’a pu être observée, notamment en ce qui concerne les hypophosphatémies et les cancers. Il n’est donc pas possible de conclure qu’une utilisation sur le long terme de fer intraveineux fait preuve d’innocuité. Toutefois, cette étude se déroulait sur 56 semaines, ce qui peut malgré tout rassurer partiellement les cliniciens. Enfin, l’omission possible de doses dans le groupe recevant du fer par voie orale a pu accentuer la différence observée en ce qui concerne les données d’efficacité obtenues avec la préparation de fer intraveineuse visant une ferritinémie élevée et celle de fer par voie orale.
Cette étude a démontré que les patients anémiques présentant un DFGe compris entre 15 et 60 ml/min bénéficieraient davantage d’un traitement de fer par voie intraveineuse plutôt que par voie orale. Pour ces patients, le traitement par fer intraveineux visant une ferritinémie élevée s’est révélé supérieur au traitement à base de fer par voie orale pour diminuer ou retarder le recours à d’autres méthodes thérapeutiques pour prendre en charge l’anémie (telles que les transfusions), pour diminuer les baisses du taux d’hémoglobine pendant la durée de l’étude (12 mois) et pour augmenter plus rapidement le taux d’hémoglobine, sans augmentation du risque d’effets indésirables.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Information sur les médicaments basée sur la preuve (PHA-6074) de la Faculté de pharmacie de l’Université Laval de Québec. Les auteurs remercient la responsable. Une autorisation écrite a été obtenue de cette personne.
1. Macdougall IC, Bock AH, Carrera F, Eckardt KU, Gaillard C, Van Wyck D et coll. FIND-CKD: a randomized trial of intravenous ferric carboxymaltose versus oral iron in patients with chronic kidney disease and iron deficiency anaemia. Nephrol Dial Transplant 2014;29:2075–84.

2. McClellan W, Aronoff SL, Bolton WK, Hood S, Lorber DL, Tang KL et coll. The prevalence of anemia in patients with chronic kidney disease. Curr Med Res Opin 2004;20:1501–10.
3. Locatelli F, Aljama P, Barany P, Canaud B, Carrera F, Eckardt KU et coll. Revised European best practice guidelines for the management of anaemia in patients with chronic renal failure. Nephrol Dial Transplant 2004; 19(suppl. 2):1–47.
4. Pfeffer MA, Burdmann EA, Chen CY, Cooper ME, de Zeeuw D, Eckardt KU et coll. A trial of darboetin alfa in type 2 diabetes and chronic kidney disease. New Engl J Med 2009;361:2019–32.
5. Kidney Disease Improving Global Outcomes (KDIGO). Clinical practice guideline for anemia in chronic kidney disease. Kid Int Suppl 2012;2:292–8.
6. Rosen-Zvi B, Gafter-Gvili A, Paul M, Leibovici L, Shpilberg O, Gafter U. Intravenous versus oral iron supplementation for the treatment of anemia in CKD: systematic review and meta-analysis. Am J Kidney Dis 2008;52:897–906.
7. Fishbane S. Upper limit of serum ferritin: misinterpretation of the 2006 KDOQI anemia guidelines. Semin Dial 2008;21:217–20.
PHARMACTUEL, Vol. 49, No. 2, 2016