Julie Bédard1,2,3, B.Pharm., M.Sc., Valérie Couillard-Montminy1,4,5, B.Pharm., M.Sc., Stéphanie Lefebvre1,2,6, B.Pharm., M.Sc.
Reçu le 9 septembre 2015; Accepté après révision le 23 décembre 2015
Titre : Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993-10041.
Auteurs : McMurray JJV, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR et coll. pour les investigateurs de PARADIGM-HF.
Commanditaires : L’étude PARADIGM-HF a été financée et appuyée (collaboration à l’élaboration du déroulement de l’étude et de l’analyse des données) par les laboratoires Novartis (Novartis Pharmaceuticals, East Hanover, NJ [JG, MPL, ARR, VCS]).
Cadre de l’étude : L’utilisation d’un inhibiteur de l’enzyme de conversion de l’angiotensine (IECA) fait actuellement partie du traitement de référence de l’insuffisance cardiaque (IC). Cette pratique permet de diminuer le risque de décès à long terme des patients. Les études CONSENSUS et SOLVD ont révélé des résultats positifs en faveur de l’énalapril avec une diminution significative des décès toutes causes confondues de 27 % et de 16 % respectivement. Ainsi, les IECA se retrouvent au premier rang du traitement de l’IC pour les patients présentant une baisse de la fraction d’éjection ventriculaire gauche (FEVG)2,3.
D’autres molécules associées aux IECA ont démontré des avantages supplémentaires sur la survie. En effet, les résultats de plusieurs études ont montré une réduction du nombre de décès et d’hospitalisations avec les bêta-bloquants (BB) et les antagonistes de l’aldostérone4–6. Les avantages cliniques des BB ne sont plus à prouver. L’étude COPERNICUS a notamment montré une diminution d’environ 35 % de la mortalité globale par le carvédilol4. Les antagonistes de l’aldostérone ont également fait leurs preuves. En effet, les études RALES et EMPHASIS-HF ont établi l’efficacité de la spironolactone et de l’éplérérone pour diminuer le taux de mortalité des patients atteints d’IC5,6. Les antagonistes des récepteurs de l’angiotensine II (ARA), quant à eux, demeurent une option thérapeutique en présence d’intolérance aux IECA. Le candésartan et le valsartan ont tous deux fait preuve d’une non-infériorité par rapport aux IECA7,8.
La néprilysine est une enzyme permettant de dégrader plusieurs peptides endogènes, dont la bradykinine, les peptides natriurétiques et l’adrénomédulline. L’inhibition de l’enzyme permet d’augmenter les taux de ces peptides et de limiter la suractivation neuro-hormonale, la vasoconstriction, la rétention hydrosodée, la fibrose et l’hypertrophie cardiaque1,9. Par ailleurs, des études expérimentales semblent démontrer que l’inhibition concomitante du système rénine-angiotensine et de la néprilysine amènerait de plus grands avantages en matière de survie que chacun des traitements en monothérapie10,11. Cependant, l’omapatrilat, une molécule combinant à la fois un IECA, un inhibiteur de la néprilysine et un inhibiteur de l’aminopeptidase P, était associé à un taux élevé d’angio-œdème grave, ce qui a provoqué son retrait du marché12,13. Le LCZ696, une nouvelle molécule combinant un ARA (valsartan) et un inhibiteur de la néprilysine (sacubitril), a été mis au point dans le but de diminuer ce risque d’effet indésirable grave. L’étude PARADIGM-HF compare les effets du LCZ696 et de l’énalapril sur la mortalité et la morbidité pour le traitement de patients présentant une IC avec une baisse de la FEVG1.
Protocole de recherche : Il s’agit d’une étude clinique prospective et multicentrique de phase III, avec répartition aléatoire et à double insu. Elle vise à évaluer l’efficacité et l’innocuité du LCZ696 (200 mg deux fois par jour) comparativement à l’énalapril (10 mg deux fois par jour) pour des patients atteints d’IC chronique avec une baisse de la FEVG.
Patients : Entre décembre 2009 et novembre 2012, 10 521 sujets ont été sollicités dans 1 043 centres répartis dans 47 pays. Pour être inclus dans l’étude, les patients devaient être âgés d’au moins 18 ans et être atteints d’IC de stade II, III ou IV selon la classification de la New York Heart Association (NYHA). Les patients devaient présenter une FEVG ≤ 40 %, ce critère s’étant abaissé à ≤ 35 % après un amendement du protocole. Les patients devaient également présenter un taux sanguin du peptide natriurétique de type B (BNP) ≥ 150 ρg/ml ou un taux sanguin du fragment N-terminal inactif du BNP (NT-proBNP) ≥ 600 ρg/ml. Pour être inclus dans l’étude, les patients hospitalisés pour une IC décompensée au cours des 12 mois précédant l’étude devaient avoir des taux respectifs de BNP et de NT-proBNP ≥ 100 ρg/ml et ≥ 400 ρg/ml. Enfin, le traitement médicamenteux des patients devait inclure un BB ainsi qu’un IECA ou un ARA correspondant à une dose équivalente ≥ 10 mg/jour d’énalapril (tableau I). Les doses de BB et d’IECA ou d’ARA devaient être stables pendant au moins quatre semaines avant l’inclusion des patients dans l’étude.
Tableau I. Doses équivalentes d’IECA et d’ARA utilisées dans l’étude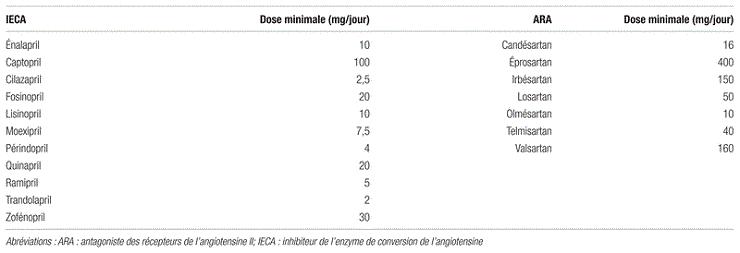
L’étude excluait les patients qui présentaient une hypotension symptomatique et une pression systolique < 100 mmHg au moment de la sélection ou < 95 mmHg au moment de la répartition aléatoire. Elle excluait également les patients qui avaient un débit de filtration glomérulaire estimé (DFGe) < 30 ml/min/1,73 m2 ou une diminution du DFGe > 25 % entre le moment du recrutement et celui de la répartition aléatoire. Enfin, l’étude excluait également les patients présentant une kaliémie > 5,2 mmol/L au moment du recrutement ou une kaliémie > 5,4 mmol/L au moment de la répartition aléatoire et un antécédent d’angio-œdème ou d’intolérance à un IECA ou un ARA.
Interventions : Tout d’abord, une phase de vérification de la tolérance en simple aveugle a été effectuée. Les patients admissibles devaient remplacer l’IECA ou l’ARA qu’ils recevaient avant le recrutement par de l’énalapril 10 mg deux fois par jour pendant deux semaines. En l’absence d’intolérance, le LCZ696 était alors administré durant quatre à six semaines. La dose initiale de LCZ696 était de 100 mg deux fois par jour avant d’être augmentée à 200 mg deux fois par jour dans un délai d’une à quatre semaines en fonction de la tolérance du patient. Toutefois, afin de diminuer le risque d’angio-œdème associé à la prise simultanée des molécules, le protocole exigeait des patients d’arrêter de prendre l’énalapril pendant une journée avant de commencer le traitement par LCZ696 et appliquait le même principe de précaution en regard du LCZ696 avant la répartition aléatoire. Si la tolérance des patients était acceptable, il y avait une répartition de ces derniers de façon aléatoire et à double insu dans chacun des groupes, selon un ratio 1:1. Le groupe énalapril recevait 10 mg de ce médicament deux fois par jour tandis que le groupe LCZ696 recevait 200 mg de cette molécule deux fois par jour. Après la répartition aléatoire, un suivi des patients était effectué toutes les deux à huit semaines pendant les quatre premiers mois, puis tous les quatre mois.
Points évalués : L’objectif primaire reflétant l’efficacité du traitement était le décès de cause cardiovasculaire ou une première hospitalisation en raison de l’IC. Les objectifs secondaires étaient le décès toutes causes confondues et un changement du score clinique du Kansas City Cardiomyopathy Questionnaire (KCCQ) après huit mois par rapport à ce score au début de l’étude. Le score clinique du KCCQ évalue les symptômes et les limitations causés par l’IC14. Le délai avant l’apparition d’un nouvel épisode de fibrillation auriculaire (FA) faisait également partie des objectifs secondaires.
Le seul objectif secondaire mesurant l’innocuité du traitement était établi par le temps avant la survenue d’un premier déclin de la fonction rénale. Ce déclin était défini comme la survenue d’une maladie rénale au stade terminal, une diminution de 50 % du DFGe ou une diminution du DFGe > 30 ml/min/1,73 m2 depuis la répartition aléatoire jusqu’à une valeur < 60 ml/min/1,73 m2.
Résultats : Au total, 10 513 sujets ont participé à la phase de vérification de la tolérance et 8 442 patients ont été répartis de façon aléatoire. Après la répartition aléatoire, le groupe LCZ696 comportait 4 187 patients et le groupe énalapril, 4 212 patients. Le suivi médian a été de 27 mois.
Les caractéristiques de la population dans les deux groupes de traitement étaient similaires et sont présentées dans le tableau II. L’âge moyen était de 63,8 ans, et 66 % des patients étaient de race blanche. Les patients avaient une tension artérielle systolique moyenne de 122 mmHg et la majorité (76 %) faisait partie de la classe fonctionnelle NYHA II.
Tableau II. Caractéristiques de base des patients inclus dans l’étude

Les résultats de l’étude concernant l’objectif primaire démontrent un avantage du LCZ696 comparativement à l’énalapril. Les avantages visés pour les décès de cause cardiovasculaire et pour l’objectif primaire dans sa globalité ont été atteints prématurément dans le groupe LCZ696, ce qui a justifié l’arrêt précoce de l’étude. En effet, de façon générale, un décès de cause cardiovasculaire ou une hospitalisation pour détérioration de l’IC ont affecté 21,8 % des patients du groupe LCZ696 comparativement à 26,5 % des patients du groupe énalapril (rapport de risque [RR] = 0,80; intervalle de confiance à 95 % [IC 95 %] = 0,73–0,87; p < 0,001; nombre nécessaire de patients à traiter [NNT] = 21) (tableau III). Plus spécifiquement, les décès de cause cardiovasculaire représentent 13,3 % des décès dans le groupe LCZ696 comparativement à 16,5 % dans le groupe énalapril (RR=0,80;IC 95 %=0,71–0,89;p<0,001;NNT=32) (tableau III). Les premières hospitalisations pour détérioration de l’IC sont survenues dans une proportion de 12,8 % pour les patients recevant le LCZ696 et de 15,6 % pour ceux recevant l’énalapril (RR=0,79;IC 95 %=0,71–0,89;p<0,001;NNT=35) (tableau III). La supériorité du LCZ696 persiste dans les analyses de sous-groupes de patients effectuées pour les décès et les hospitalisations combinés ainsi que pour les décès de cause cardiovasculaire.
Tableau III. Principaux résultats de l’étude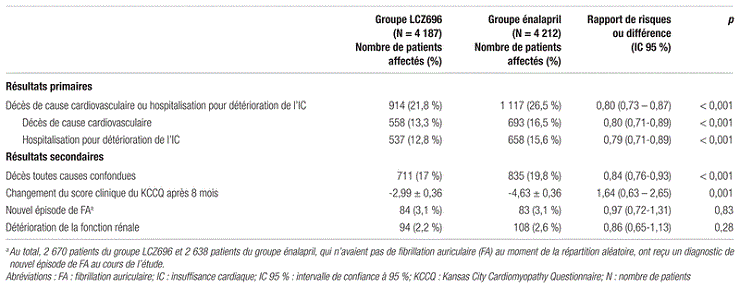
Les résultats concernant les objectifs secondaires montrent qu’un décès toutes causes confondues touche 17,0 % des patients du groupe LCZ696 comparativement à 19,8 % de ceux du groupe énalapril (RR=0,84;IC 95 %=0,76–0,93;p<0,001) (tableau III). Le changement du score clinique du KCCQ après 8 mois a été statistiquement significatif, avec une diminution moyenne du score de 2,99 ± 0,36 pour les patients du groupe LCZ696 comparativement à 4,63 ± 0,36 pour ceux du groupe énalapril (différence de risque = 1,64;IC 95 %=0,63–2,65;p=0,001) (tableau III). Par ailleurs, les résultats de l’étude n’ont démontré aucune différence statistiquement significative entre les deux groupes de traitement en ce qui concerne les objectifs secondaires d’un nouvel épisode de FA ou d’une détérioration de la fonction rénale.
Du point de vue de l’innocuité, le LCZ696 a entraîné plus d’hypotension symptomatique que l’énalapril (14,0 % comparativement à 9,2 %; p < 0,001). Cependant, l’énalapril a causé davantage d’élévation de la créatinine sérique (≥ 221 mmol/l) (4,5 % comparativement à 3,3 % avec le LCZ696; p = 0,007). On note aussi plus d’hyperkaliémie dans le groupe énalapril, avec une kaliémie ≥ 6,0 mmol/l chez 5,6 % des patients de ce groupe comparativement à 4,3 % des patients du groupe LCZ696 (p = 0,007). La toux a également été plus fréquente chez les patients du groupe énalapril comparativement aux patients du groupe LCZ696 (proportions respectives de 14,3 % et de 11,3 %; p < 0,001). Par ailleurs, aucune différence significative n’a été démontrée pour le taux d’angio-œdème rapporté entre les deux molécules (p = 0,13). Enfin, le taux d’arrêt de la médication en raison d’effets indésirables a été de 10,7 % dans le groupe LCZ696 et de 12,3 % avec l’énalapril (p = 0,03).
Les auteurs concluent leur article sur l’importance de l’étude PARADIGM-HF. Celle-ci démontre que l’inhibition des récepteurs de l’angiotensine et de la néprilysine avec le LCZ696 réduit le risque de décès de cause cardiovasculaire, le nombre d’hospitalisations liées à l’IC et le risque de décès toutes causes confondues, comparativement à un IECA. Une réduction des symptômes et des limitations physiques associées à l’IC a également été démontrée. Les avantages obtenus avec le LCZ696 en matière de mortalité laissent penser que l’inhibition du système rénine-angiotensine-aldostérone (SRAA) apportée par la combinaison d’un ARA et d’un inhibiteur de la néprilysine est supérieure à l’inhibition provoquée par une monothérapie avec un IECA.
Cette étude clinique démontre que la molécule LCZ696 est supérieure à l’énalapril pour réduire les décès de cause cardiovasculaire ainsi que les premières hospitalisations pour IC.
Le choix des chercheurs de l’étude d’utiliser l’énalapril 10 mg deux fois par jour comme molécule de comparaison est un point positif, puisque cet IECA a été la molécule la plus étudiée pour le traitement de l’IC2,3. À une telle dose cible, une réduction de la mortalité a pu être démontrée2,3. Dans cette étude, la dose moyenne d’énalapril était de 18,9 mg par jour, ce qui demeure une dose plus élevée que celle utilisée dans les études CONSENSUS (16,6 mg) et SOLVD (18,4 mg)2,3. Bien que cette molécule soit peu utilisée dans la pratique actuelle, le choix d’opter pour cet agent avec une prise biquotidienne est judicieux, car il facilite la titration des doses et le maintien du double aveugle.
Le fait que les patients recevaient au préalable une pharmacothérapie recommandée et stable augmente les répercussions des avantages obtenus avec le LCZ696. Toutefois, les patients atteints d’IC reçoivent rarement des doses aussi élevées d’IECA que celle demandée pour l’inclusion à l’étude, ce qui signifie que la population à l’étude est peu représentative de la pratique actuelle. La validité externe des résultats peut donc en être affectée. Par ailleurs, la dose quotidienne utilisée de LCZ696 (200 mg deux fois par jour, contenant l’équivalent de 160 mg deux fois par jour de valsartan, ce qui correspond à une dose moyenne de 300 mg/jour de valsartan) demeure un point en faveur de l’étude, puisque cette dose correspond à la dose cible visée et étudiée pour les patients atteints d’IC8. Cependant, les doses moyennes de valsartan utilisées dans les études antérieures étaient légèrement inférieures. L’étude Val-HeFT et l’étude VALIANT ont utilisé une dose moyenne respective de 254 mg/jour et de 247 mg/jour8,15. Il est néanmoins impossible de déterminer les répercussions de cette dose plus élevée de valsartan utilisée dans l’étude PARADIGM-HF sur les avantages obtenus avec le LCZ696. Pour continuer, la phase de vérification de la tolérance avant la répartition aléatoire est un élément important à souligner. L’objectif de cette phase était d’assurer la tolérance préalable aux doses étudiées d’énalapril et de LCZ696. Une telle méthodologie permet une comparaison de doses équivalentes entre les deux molécules étudiées et entraîne une mesure plus fiable de leur efficacité respective. Par contre, l’innocuité des agents est difficilement interprétable, puisque la prévalence des effets indésirables n’est pas représentative de la réalité. Encore une fois, la validité externe des résultats peut en être affectée.
Les caractéristiques de base de la population étaient similaires dans les deux groupes, sauf pour le taux de patients prenant de la digoxine et un antagoniste de l’aldostérone, qui était significativement plus élevé dans le groupe énalapril. Dans les deux groupes de traitement, les patients de classe fonctionnelle NYHA I ou II sont représentés à environ 75 %, tandis que ceux de classe fonctionnelle NYHA III ou IV sont plutôt sous représentés à environ 25 %. Cela témoigne du fait que l’IC des patients à l’étude est moins avancée. Sous un autre angle, les patients de classes fonctionnelles NYHA I et IV sont beaucoup moins représentés dans les deux groupes (environ 5 % de patients de classe fonctionnelle NYHA I et moins de 1 % de patients de classe fonctionnelle NYHA IV, comparativement à près de 95 % de patients de classes fonctionnelles NYHA II ou III). D’autres caractéristiques des patients, notamment la représentativité des femmes (environ 22 %) et des Nord-Américains (environ 7 %), amènent certaines interrogations sur l’applicabilité des résultats.
Les analyses de sous-groupes mettent en évidence des différences significatives entre certains sous-groupes, notamment entre les patients de classes fonctionnelles NYHA I ou II et ceux de classes fonctionnelles NYHA III ou IV. En ce qui concerne l’objectif primaire, ces derniers auraient moins bénéficié du LCZ696. Le LCZ696 semblait également moins avantageux pour les patients d’un âge ≥ 75 ans ou ceux ayant une FEVG > 35 %. Il est probable que l’absence de résultats significatifs s’explique par une sous-représentativité d’une telle population dans l’étude.
Le LCZ696 a un bon profil de tolérabilité. En effet, la molécule amène moins d’augmentation de la kaliémie et de toux. Cependant, il faut noter que le groupe LCZ696 a présenté davantage d’hypotension symptomatique que le groupe énalapril, sans entraîner plus d’arrêt prématuré du traitement. Cette constatation est en accord avec les effets observés dans l’étude OVERTURE, qui comparait l’omapatrilat à l’énalapril13. Le LCZ696 a été associé à plus de cas d’angio-œdème grave que l’énalapril, mais la différence n’est pas statistiquement significative. Toutefois, il faut demeurer prudent lors de l’interprétation de ce résultat, puisque la population à l’étude a été d’abord soumise à la phase de vérification de la tolérance et que l’angio-œdème est une réaction indésirable rare. Il faut aussi préciser qu’il y avait un bref arrêt des médicaments entre les différentes phases de l’étude, afin d’éviter la prise simultanée des deux molécules et de diminuer le risque d’angio-œdème. De façon générale, le LCZ696 a entraîné moins d’arrêts liés aux effets indésirables.
Les résultats relatifs au score clinique du KCCQ sont à considérer avec une certaine prudence. En effet, les chercheurs de l’étude ont attribué un score de zéro aux patients décédés, ce qui influence légèrement les résultats. Il faut également noter qu’un changement de 2 au score du KCCQ n’est pas cliniquement significatif. Toutefois, l’utilisation de ce score est pertinente puisque le KCCQ est un outil valide.
Malgré les avantages supplémentaires du LCZ696 en matière de survie et d’hospitalisations, observés après un suivi médian de 27 mois, des données à plus long terme sont nécessaires pour démontrer une efficacité soutenue et obtenir un profil d’innocuité plus complet.
D’un point de vue plus technique, il faut souligner que cette étude a été commanditée par une compagnie pharmaceutique, Novartis Pharmaceuticals, ce qui peut entraîner un biais de publication.
Les recherches dans la documentation scientifique actuelle permettent de relever quelques études préalablement mentionnées qui ont évalué les IECA et les ARA pour la prise en charge de l’IC. Premièrement, l’énalapril a démontré des avantages supérieurs à ceux d’un placebo dans les études CONSENSUS (classe fonctionnelle NYHA IV) et SOLVD (FEVG < 35 %). En effet, ces études ont rapporté une réduction respective du nombre de décès toutes causes confondues de 27 % et de 16 %2,3. L’étude Val-HeFT, quant à elle, a apporté des données sur les avantages du valsartan pour les patients de classes fonctionnelles NYHA II, III ou IV, avec une réduction de 13,2 % de la mortalité et de la morbidité combinées8.
L’omapatrilat, une molécule ayant un mécanisme d’action semblable à celui du LCZ696, a été comparé à l’énalapril 10 mg deux fois par jour. L’étude OVERTURE, une étude de non-infériorité, ciblait les patients souffrant d’IC de classes fonctionnelles NYHA II à IV. Les résultats de l’étude ont montré que l’omapatrilat entraînait des effets indésirables, comme l’angio œdème. La dose d’omapatrilat étudiée était de 40 mg une fois par jour, une dose prouvée efficace contre l’hypertension, tandis que, dans la présente étude, le LCZ696 a été administré deux fois par jour afin d’assurer une couverture quotidienne complète nécessaire en présence d’une IC13.
De façon plus générale, il est possible de comparer chacune des classes de médicaments utilisées pour le traitement de l’IC sur le plan des avantages apportés pour la réduction de la mortalité. Les antagonistes de l’aldostérone, les BB et les IECA amènent une réduction respective du nombre de décès d’environ 25 à 30 %, d’environ 30 % et d’environ 15 %5,16,17. Le LCZ696 ajoute des avantages supplémentaires à ces chiffres, d’où son intérêt1.
Le LCZ696 apparaît comme un traitement innovateur pour les patients atteints d’IC. Certains points demeurent toutefois à éclaircir. En effet, la faible représentativité dans l’étude de certaines catégories de patients préalablement mentionnées amène un doute sur l’applicabilité des résultats pour ces populations. Il en va de même pour les patients nouvellement atteints d’IC, atteints d’IC de classe fonctionnelle IV ou instables. Par ailleurs, les patients ayant un défibrillateur implantable ou un resynchronisateur cardiaque devront faire l’objet d’études supplémentaires afin que le LCZ696 puisse être envisagé avec ces dispositifs à n’importe quel moment dans les algorithmes de traitement. De plus, puisque l’étude excluait les patients présentant une IC avec FEVG préservée, il serait pertinent de pouvoir davantage étudier une telle population, sachant que, à ce jour, peu de traitements ont démontré des avantages considérables pour ce type d’IC18. L’étude PARAGON-HF, qui compare le LCZ696 et le valsartan pour les patients atteints d’IC avec FEVG préservée, est actuellement en cours et ses résultats devraient être publiés en mai 201919. Finalement, les patients présentant une hypotension plus sévère mériteraient une analyse supplémentaire, puisque la tension artérielle systolique moyenne des patients de l’étude PARADIGM-HF était de 122 ± 15 mmHg. Les patients traités pour une IC sont généralement plus hypotendus.
Les coûts engendrés par la thérapie seront également à considérer avant de pouvoir positionner le LCZ696 dans le traitement médicamenteux actuel de l’IC. Des études pharmacoéconomiques seront donc nécessaires. Étant donné le vieillissement de la population et le fait que l’IC représente l’une des principales causes d’hospitalisation pour les personnes d’un âge ≥ 65 ans au Canada, il est possible de penser que cette molécule pourrait avoir des retombées non négligeables sur les coûts des soins de santé associés à l’IC.
Pour l’instant, les lignes directrices de la Société canadienne de cardiologie stipulent que le LCZ696 peut être envisagé en remplacement des IECA et des ARA. Les patients visés ont une FEVG < 40 %, une classe fonctionnelle NYHA II, III ou IV et des symptômes persistants malgré une triple thérapie (IECA/ARA, BB et antagoniste de l’aldostérone)20.
Santé Canada a tout récemment approuvé l’utilisation du LCZ696, sous le nom d’EntrestoMC. Les formulations disponibles contiennent différentes doses possibles de sacubitril et de valsartan (24–26 mg, 49–51 mg et 97–103 mg). Il est à noter que la molécule a été approuvée spécifiquement pour les patients de classe fonctionnelle NYHA II ou III21.
L’étude PARADIGM-HF a établi l’efficacité supérieure d’une molécule possédant un nouveau mécanisme d’action pour traiter l’IC. Cette molécule a entraîné une diminution significative des décès de cause cardiovasculaire et des hospitalisations pour l’IC et a fait preuve d’une innocuité satisfaisante. Les résultats de l’étude semblent indiquer que cette classe de médicament entraînera des modifications de la pratique actuelle concernant le traitement de l’IC, puisque l’étude comportait peu de limites. Toutefois, des données additionnelles seront nécessaires pour cibler les patients qui profiteraient le plus d’une telle thérapie.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Information sur les médicaments basée sur la preuve (PHA-6074) de la Faculté de pharmacie de l’Université Laval de Québec. Les auteures remercient la responsable du cours ainsi que Louis-Étienne Marchand, pharmacien au Centre intégré de santé et de services sociaux de Chaudière-Appalaches – site Hôtel-Dieu de Lévis, qui a assuré la supervision de leur travail. Une autorisation écrite a été obtenue de ces personnes.
1. McMurray JJ, Packer M, Desai AS, Gong J, Lefkowitz MP, Rizkala AR et coll. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371:993–1004.
2. The CONSENSUS trial study group. Effects of enalapril on mortality in severe congestive heart failure. Results of the Cooperative North Scandinavian Enalapril Survival Study (CONSENSUS). N Engl J Med 1987;316:1429–35.
3. The SOLVD Investigators. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991;325:293–302.
4. Packer M, Fowler MB, Roecker EB, Coats AJ, Katus HA, Krum H et coll. Effect of carvedilol on the morbidity of patients with severe chronic heart failure: results of the carvedilol prospective randomized cumulative survival (COPERNICUS) study. Circulation 2002;106:2194–9.
5. Zannad F, McMurray JJ, Krum H, van Veldhuisen DJ, Swedberg K, Shi H et coll. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011;364:11–21.
6. Pitt B, Zannad F, Remme WJ, Cody R, Castaigne A, Perez A et coll. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 1999;341:709–17.
7. Granger CB, McMurray JJ, Yusuf S, Held P, Michelson EL, Olofsson B et coll. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet 2003;362:772–6.
8. Cohn JN, Tognoni G. A randomized trial of the angiotensin-receptor blocker valsartan in chronic heart failure. N Engl J Med 2001;345:1667–75.
9. King JB, Bress AP, Reese AD, Munger MA. Neprilysin inhibition in heart failure with reduced ejection fraction: a clinical review. Pharmacotherapy 2015;35:823–37.
10. Rademaker MT, Charles CJ, Espiner EA, Nicholls MG, Richards AM, Kosoglou T. Combined neutral endopeptidase and angiotensin-converting enzyme inhibition in heart failure: role of natriuretic peptides and angiotensin II. J Cardiovasc Pharmacol 1998;31:116–25.
11. Trippodo NC, Fox M, Monticello TM, Panchal BC, Asaad MM. Vasopeptidase inhibition with omapatrilat improves cardiac geometry and survival in cardiomyopathic hamsters more than does ACE inhibition with captopril. J Cardiovasc Pharmacol 1999;34:782–90.
12. Kostis JB, Packer M, Black HR, Schmieder R, Henry D, Levy E. Omapatrilat and enalapril in patients with hypertension: the Omapatrilat Cardiovascular Treatment vs. Enalapril (OCTAVE) trial. Am J Hypertens 2004;17:103–11.
13. Packer M, Califf RM, Konstam MA, Krum H, McMurray JJ, Rouleau JL et coll. Comparison of omapatrilat and enalapril in patients with chronic heart failure: the omapatrilat versus enalapril randomized trial of utility in reducing events (OVERTURE). Circulation 2002;106:920–6.
14. Green CP, Porter CB, Bresnahan DR, Spertus JA. Development and evaluation of the Kansas City cardiomyopathy questionnaire: a new health status measure for heart failure. J Am Coll Cardiol 2000;35:1245–55.
15. Pfeffer MA, McMurray JJ, Velazquez EJ, Rouleau JL, Kober L, Maggioni AP et coll. Valsartan, captopril, or both in myocardial infarction complicated by heart failure, left ventricular dysfunction, or both. N Engl J Med 2003;349:1893–906.
16. Chatterjee S, Biondi-Zoccai G, Abbate A, D’Ascenzo F, Castagno D, Van Tassell B et coll. Benefits of β blockers in patients with heart failure and reduced ejection fraction: network meta-analysis. BMJ 2013;346:f55.
17. Emdin CA, Callender T, Cao J, McMurray JJ, Rahimi K. Meta-analysis of large-scale randomized trials to determine the effectiveness of inhibition of the renin-angiotensin aldosterone system in heart failure. Am J Cardiol 2015;116:155–61.
18. Solomon SD, Zile M, Pieske B, Voors A, Shah A, Kraigher-Krainer E et coll. The angiotensin receptor neprilysin inhibitor LCZ696 in heart failure with preserved ejection fraction: a phase 2 double-blind randomised controlled trial. Lancet 2012;380:1387–95.
19. Novartis Pharmaceuticals. Efficacy and safety of LCZ696 compared to valsartan, on morbidity and mortality in heart failure patients with preserved ejection fraction (PARAGON-HF). Dans : ClinicalTrials.gov. National Library of Medicine (US). [en ligne] https://clinicaltrials.gov/ct2/show/NCT01920711?term=PARAGON-HF&rank=1 (site visité le 10 novembre 2015).
20. Howlett JG, Chan M, Ezekowitz JA, Harkness K, Heckman GA, Kouz S et coll. The Canadian cardiovascular society heart failure companion: bridging guidelines to your practice. Can J Cardiol 2015;1–15.
21. Novartis Pharma Canada Inc. Monographie du produit : Entresto. [en ligne] http://www.ask.novartispharma.ca/download.htm?res=entresto_scrip_f.pdf&resTitleId=1137 (site visité le 11 février 2016).
PHARMACTUEL, Vol. 49, No. 1, 2016