
Valérie Clément1, B.Pharm., M.Sc.
Reçu le 9 septembre 2015; Accepté après révision par les pairs le 23 décembre 2015
Résumé
Objectif : Différentes formules permettent d’estimer la fonction rénale, mais les résultats varient souvent d’une formule à l’autre. L’objectif de l’étude consiste à comparer le résultat obtenu par la formule de Cockcroft-Gault avec celui calculé grâce à l’équation du Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) ajusté selon la surface corporelle réelle du patient, afin de déterminer si une différence persiste après l’ajustement.
Méthode : Une étude descriptive rétrospective a porté sur tous les patients inscrits à la clinique de prédialyse du Centre hospitalier universitaire de Sherbrooke. Nous avons calculé la clairance de la créatinine à l’aide de la formule de Cockcroft-Gault et le débit de filtration glomérulaire selon l’équation CKD-EPI, résultat que nous avons ensuite ajusté en fonction de la surface corporelle du patient (conversion de ml/min/1,73 m2 en ml/min). Nous avons ensuite calculé la différence entre les valeurs obtenues par les formules de CKD-EPI ajustée selon la surface corporelle et de Cockcroft-Gault. Les données ont été réparties selon l’âge et l’indice de masse corporelle.
Résultats : Dans 84,1 % des cas, la différence entre les résultats obtenus selon les formules de CKD-EPI ajustée selon la surface corporelle et de Cockcroft-Gault était inférieure ou égale à 5 ml/min. Un indice de masse corporelle élevé et un âge égal ou supérieur à 80 ans tendent à augmenter la valeur obtenue selon l’équation de CKD-EPI ajustée selon la surface corporelle par rapport à celle obtenue avec la formule de Cockcroft-Gault; l’inverse se produit pour les patients d’un âge inférieur ou égal à 60 ans.
Conclusion : Peu de différences significatives ont été observées entre les résultats obtenus par la formule de CKD-EPI ajustée selon la surface corporelle et de Cockcroft-Gault. Les résultats de notre étude montrent qu’il semble raisonnable d’utiliser la formule de CKD-EPI ajustée selon la surface corporelle ou de Cockcroft-Gault pour ajuster la posologie de la plupart des médicaments pour la majorité des patients, quels que soient leur âge et leur indice de masse corporelle.
Mots clés : Ajustement posologique, CKD-EPI, Cockcroft-Gault, débit de filtration glomérulaire, insuffisance rénale chronique, surface corporelle
Abstract
Objective: Different formulas are available for estimating renal function. Often, there is a difference between the results obtained with these different formulas. The objective of this study was to compare the result obtained with the Cockroft-Gault formula with that obtained with the Chronic Kidney Disease Epidemiology Collaboration equation (CKD-EPI) adjusted for the patient’s actual body surface area (CKD-EPISC), to determine whether a difference persists after the adjustment.
Method: A retrospective, descriptive study was carried out among all the patients registered at the Centre hospitalier universitaire de Sherbrooke’s predialysis clinic. We calculated the creatinine clearance with the Cockcroft-Gault formula and the glomerular filtration rate with the CKD-EPI, which was then adjusted for the patient’s body surface area (conversion from mL/min/1.73 m2 to mL/min). We then calculated the difference between the value obtained with CKD-EPI and that obtained with Cockcroft-Gault. The data were stratified according to age and body mass index.
Results: In 84.1% of the cases, the difference between CKD-EPI and Cockcroft-Gault was 5 mL/min or less. A high body mass index and an age of 80 years or higher tend to increase the CKD-EPI value in relation to the Cockcroft-Gault value, while the opposite occurs for patients aged 60 or under.
Conclusion: Few clinically significant differences were found between the results obtained with CKD-EPI adjusted for the patient’s actual body surface area and those obtained with Cockcroft-Gault. Based on the findings of this study, it seems reasonable to use Chronic Kidney Disease Epidemiology Collaboration equation adjusted for the patient’s actual body surface area or Cockcroft-Gault for adjusting most medications for the majority of patients, regardless of their age and body mass index.
Keywords: Body surface area, chronic kidney disease, Chronic Kidney Disease Epidemiology Collaboration, Cockcroft-Gault, dosage adjustment, glomerular filtration rate
L’insuffisance rénale chronique se définit par des anomalies structurelles ou fonctionnelles des reins ou par une diminution de la fonction rénale qui perdure pendant plus de 3 mois1. La prévalence de l’insuffisance rénale chez les adultes est estimée à 12,5 % au Canada2. La prévalence devrait s’accroître au cours des prochaines années en raison du vieillissement de la population et de l’augmentation de la prévalence du diabète et de l’hypertension, les deux principales causes d’insuffisance rénale chronique2.
De nombreux médicaments sont éliminés par voie rénale. Leur posologie nécessite donc un ajustement en présence d’une diminution de la fonction rénale afin d’éviter l’accumulation du médicament dans l’organisme et une toxicité. Les médecins et les pharmaciens doivent quotidiennement prendre des décisions concernant l’ajustement de la pharmacothérapie selon la fonction rénale des patients.
Pour évaluer la fonction rénale, la mesure directe du débit de filtration glomérulaire (DFG) est possible, mais elle est fastidieuse et coûteuse. Elle nécessite l’administration intraveineuse d’un traceur exogène (par exemple l’inuline ou le 125I-iothalamate) qui n’est éliminé que par voie rénale et qui, dans le rein, n’est filtré que par les glomérules, sans être sécrété, réabsorbé ou métabolisé3. De nombreux prélèvements sanguins ou urinaires sont nécessaires, qui accaparent un personnel spécialisé pendant plusieurs heures3. Pour toutes ces raisons, la mesure directe du DFG, bien qu’il s’agisse de la mesure de référence, ne se fait pas en pratique.
Les médecins ou les pharmaciens doivent donc évaluer la fonction rénale à partir de formules utilisant le taux de créatinine sérique. La créatinine sérique est un marqueur peu sensible et peu précis, mais qui est facile d’accès et qui est couramment utilisé dans la pratique3. Pendant de nombreuses années, deux options s’offraient aux cliniciens pour estimer la fonction rénale. Premièrement, la mesure de la clairance de la créatinine par collecte urinaire sur une période de 24 heures. Cette collecte est souvent incomplète, ce qui fausse les résultats obtenus. Deuxièmement, l’estimation de la clairance de la créatinine par la formule de Cockcroft-Gault (CG)4.
Au cours des dernières années, deux formules estimant le débit de filtration glomérulaire (DFGe) ont fait leur apparition : les formules MDRD (Modification of Diet in Renal Diseases) et CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration)5,6. L’équation CKD-EPI prédit mieux le DFG que la formule MDRD pour les patients qui ont un DFGe supérieur à 60 ml/min/1,73 m2, et elle est aussi précise que la formule MDRD pour les patients qui ont un DFGe inférieur à 60 ml/min/1,73 m26. Par ailleurs, en clinique on constate que les plus grandes différences entre le DFGe obtenu avec la formule de CKD-EPI et la clairance de la créatinine calculée selon la formule de CG sont observées pour les patients très jeunes, très âgés, très maigres ou obèses.
La formule de CG est l’outil d’estimation de la fonction rénale le plus répandu pour l’ajustement de la posologie des médicaments. La majorité des études de pharmacocinétique ont été faites avec cette formule et les fabricants de produits pharmaceutiques recommandent généralement d’ajuster la posologie selon cette formule. Avant 2008, la formule de CG était la seule équation recommandée par la Food and Drug Administration (FDA) pour l’ajustement posologique dans le cadre d’études cliniques. Depuis 2008, la FDA accepte l’utilisation d’autres formules, telles que MDRD et CKD-EPI8.
Les cliniciens sont tentés d’utiliser la formule du CKD-EPI pour l’ajustement posologique, puisque le résultat est facilement accessible depuis le dossier clinique du patient. Par exemple, au Centre hospitalier universitaire de Sherbrooke (CHUS), le dossier clinique informatisé des patients présente le taux de créatinine sérique accompagné de la valeur du DFGe par CKD-EPI. Cependant, cette mesure est exprimée en ml/min/1,73 m2 alors que le résultat obtenu avec CG s’exprime en ml/min. Dans la pratique, on constate souvent une différence entre le CKD-EPI et le résultat de CG. L’hypothèse de la présente étude est que l’ajustement de la valeur obtenue par la formule de CKD-EPI selon la surface corporelle réelle permet d’éliminer quasiment toute différence entre les résultats des deux formules, ce qui rend possible l’utilisation de la formule de CKD-EPI ajustée selon la surface corporelle réelle du patient (CKD-EPISC) pour l’ajustement posologique.
L’objectif principal de cette étude consistait à comparer les valeurs obtenues avec l’équation de CG et la formule de CKD-EPISC afin de déterminer si la formule de CKD-EPISC peut également être utilisée pour l’ajustement posologique. L’objectif secondaire consistait à comparer les valeurs obtenues avec les deux formules selon une répartition de la population à l’étude en fonction de l’âge et de l’indice de masse corporelle (IMC).
L’étude descriptive a récolté des données rétrospectives sur tous les patients inscrits à la clinique de prédialyse du CHUS au mois d’août 2013 (542 patients). Pour qu’un patient puisse faire partie de l’étude, son dossier devait détailler le taux de créatinine sérique, le poids et la taille du patient au cours des six derniers mois. Les données ont été collectées à partir des dossiers médicaux des patients, puis compilées à l’aide du logiciel Microsoft ExcelMD afin de décrire les caractérisques de base de la population et de comparer les deux formules pour estimer la fonction rénale.
L’équation de CG qui a été utilisée dans la présente étude était la suivante9 :
 |
Le poids utilisé dans l’équation de CG était le poids réel lorsque l’IMC était inférieur à 30 (comme dans l’étude d’élaboration et de validation de l’équation CG) et le poids ajusté lorsque l’IMC était supérieur ou égal à 30 (selon les recommandations de Winter et coll. et de Bouquegneau et coll.8,10). Les formules utilisées pour estimer le poids ajusté étaient les suivantes :
Poids ajusté (kg) = poids idéal (kg) + 0,4 × (poids réel − poids idéal)
Poids idéal chez la femme (kg) = ([Taille en cm/2,54] − 60) × 2,3 + 45,5 kg
Poids idéal chez l’homme (kg) = ([Taille en cm/2,54] − 60) × 2,3 + 50 kg.
La formule de CKD-EPI utilisée est la suivante9 :
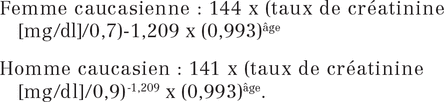 |
La conversion du taux de créatinine sérique pour la formule de CKD-EPI a été faite comme suit : taux de créatinine (mg/dl) = taux de créatinine (μmol/l) × 0,01131222 (en considérant que 1 mg/dl de créatinine = 88,4 μmol/l de créatinine).
Puisque la formule de CKD-EPI est exprimée en ml/min/1,73 m2, nous avons ajusté le résultat à la surface corporelle réelle du patient de la façon suivante :
 |
La surface corporelle du patient était extraite du dossier informatisé. La formule utilisée pour la calculer n’est pas spécifiée.
Nous avons calculé la différence entre les résultats obtenus avec la formule de CKD-EPISC et la formule de CG. Ensuite, nous avons calculé les proportions de patients pour lesquels le résultat de CKD-EPISC est supérieur (de 0 à 5 ml/min; de 5,1 à 10 ml/min; de plus de 10 ml/min) ou inférieur (de 0 à 5 ml/min; de 5,1 à 10 ml/min; de plus de 10 ml/min) au résultat de CG. Les patients ont été répartis en quatre groupes selon leur valeur d’IMC : 1) IMC inférieur à 18,5; 2) IMC compris entre 18,5 et 24,9; 3) IMC compris entre 25 et 29,9; 4) IMC supérieur ou égal à 30. Les patients ont été répartis en cinq groupes selon leur âge : 1) moins de 50 ans; 2) 50 à 59 ans; 3) 60 à 69 ans; 4) 70 à 79 ans; 5) 80 ans et audelà. Nous avons calculé les proportions de patients pour lesquels le résultat de CKD-EPISC est supérieur (de 0 à 5 ml/min; de 5,1 à 10 ml/min; de plus de 10 ml/min) ou inférieur (de 0 à 5 ml/min; de 5,1 à 10 ml/min; de plus de 10 ml/min) au résultat de CG en fonction des groupes d’âge et d’IMC.
Les logiciels SPSSMD et ExcelMD ont permis d’effectuer l’analyse statistique des données. Les résultats d’estimation de la fonction rénale obtenus à partir des deux formules ont été comparés pour chacun des patients qui prenait part à l’étude. Un coefficient de corrélation a été calculé pour comparer les valeurs obtenues avec la formule de CG à celles obtenues avec la formule de CKD-EPISC. Le coefficient alpha de Cronbach a servi à mesurer la cohérence entre le résultat obtenu par CKD-EPISC et celui obtenu par CG (un coefficient de 1 démontre une corrélation parfaite). Le directeur des services professionnels du CHUS a autorisé la réalisation de ce projet ainsi que l’accès aux dossiers des patients. Un mot de passe protégeait l’accès au fichier contenant les données.
Au total, l’étude a analysé les données de 542 patients de la clinique de prédialyse du Centre hospitalier universitaire de Sherbrooke. Tous les patients avaient un CKD-EPI inférieur à 60 ml/min/1,73 m2. L’âge moyen des patients ayant pris part à l’étude était de 73 ans. Ces patients avaient majoritairement un DFGe compris entre 15 et 30 ml/min/1,73 m2 (57,2 %) et le taux moyen de créatinine sérique était de 224 μmol/l. Les caractéristiques détaillées des patients compris dans l’étude sont présentées dans le tableau I.
Tableau I Caractéristiques de la population à l’étude

Le tableau II présente la différence entre les résultats de CKD-EPISC et CG. Dans 84,1 % des cas, la différence est faible (inférieure ou égale à 5,0 ml/min). Nous avons obtenu un coefficient alpha de Cronbach de 0,954 entre les valeurs de CKD-EPISC et CG.
Tableau II Différence entre le résultat de CKD-EPI ajusté selon la surface corporelle réelle et celui de CG

Le tableau III présente la différence entre les résultats de CKD-EPISC et CG en fonction de l’IMC. Un IMC supérieur ou égal à 30 tend à être associé à une valeur de CKD-EPISC plus élevée que celle de CG.
Tableau III Différence entre le résultat de CKD-EPI ajusté selon la surface corporelle réelle et celui de CG selon l’indice de masse corporelle

Le tableau IV présente la différence entre les résultats de CKD-EPISC et CG selon l’âge. Le DFGe obtenu selon l’équation de CKD-EPISC est majoritairement plus élevé que celui obtenu avec la formule de CG pour les patients d’un âge égal ou supérieur à 80 ans, tandis qu’il lui est inférieur pour les patients d’un âge égal ou inférieur à 60 ans.
Tableau IV Différence entre le résultat de CKD-EPI ajusté selon la surface corporelle réelle et celui de CG selon l’âge
Les résultats de cette étude laissent entendre qu’il est acceptable d’utiliser la formule de CKD-EPISC pour l’ajustement de la posologie médicamenteuse, puisque pour la majorité des patients il y a peu de différence entre le résultat de cette formule et celui obtenu avec l’équation de CG.
La formule de CG estime la clairance de la créatinine4. Elle a été élaborée en 1976 à partir des données de 249 patients. Les variables utilisées dans la formule sont l’âge, le sexe et le poids. Les patients étaient exclusivement des hommes, âgés de 18 à 92 ans, de race blanche et d’un poids moyen de 72 kg. Aucune femme ne figurait dans l’étude d’élaboration de la formule4. Le facteur de conversion de 0,85 pour le sexe féminin dans la formule est hypothétique11–13. Il est basé sur le fait que la masse adipeuse est plus importante chez la femme et que l’utilisation du poids total surestime ainsi la masse musculaire11. La formule a été élaborée avec le poids réel. Le comparatif était une collecte urinaire sur 24 h. La formule de CG s’exprime en ml/min. La formule de CG a été établie à partir de créatininémies non standardisées par isotopic dilution mass spectroscopy (IDMS). Depuis quelques années, les laboratoires médicaux ont standardisé la méthode de mesure du taux de créatinine sérique par IDMS dans le but d’améliorer la précision et la reproductivité des résultats d’un laboratoire à un autre14. Ceci signifie que la mesure de la créatininémie est effectuée selon une méthode différente que celle utilisée au moment de l’élaboration de la formule de CG, ce qui pourrait avoir une influence sur les résultats calculés avec la méthode actuellement utilisée. La formule de CG sous-estime la fonction rénale réelle du patient âgé et surestime celle du patient jeune et du patient obèse9.
La formule de CKD-EPI a quant à elle été élaborée en 2009 avec les données de 5 504 patients et validée auprès de 3 896 personnes6. La valeur obtenue était comparée à la mesure du DFG par marqueurs isotopiques exogènes. Les variables comprises dans la formule étaient l’âge, le sexe et l’ethnie. Cinquante-sept pour cent des patients étaient des hommes. L’âge moyen était de 47 ans, très peu de patients avaient plus de 75 ans (0,01 %) et le poids moyen était de 82 kg. L’ethnicité était variée : 63 % des patients étaient de race blanche, 32 % de race noire et 5 % étaient Hispaniques. Avec cette formule, on obtient un DFG estimé en ml/min/1,73 m2. Contrairement à l’élaboration de l’équation de CG, l’élaboration de la formule de CKD-EPI a été effectuée avec les taux de créatinine standardisés par IDMS.
Le poids est une variable de la formule de CG, alors que nous utilisons la surface corporelle pour l’ajustement du DFGe CKD-EPI. Ceci pourrait expliquer la différence plus importante que nous avons observée pour les patients ayant un poids élevé (IMC supérieur à 30 kg/m2).
Selon les lignes directrices du Kidney Disease: Improving Global Outcomes (KDIGO), l’ajustement des posologies en présence d’insuffisance rénale devrait être fait en fonction des données fournies dans les monographies15. La formule de CG est celle qui est la plus fréquemment utilisée pour l’ajustement de la posologie médicamenteuse en présence d’insuffisance rénale, puisque les études pharmacocinétiques ont généralement été effectuées avec cette formule16. La National Kidney Foundation (NKF) mentionne que l’ajustement posologique selon la fonction rénale avec le DFGe MDRD ajusté en fonction de la surface corporelle réelle est raisonnable. Nous avons appliqué ce même principe pour l’ajustement du DFGe CKD-EPI en fonction de la surface corporelle.
L’étude de Stevens et coll. a évalué 15 médicaments et comparé le résultat obtenu par MDRD ajusté (rapporté en ml/min) et CG au résultat du DFG mesuré avec la clairance urinaire du 125I-iothalamate (l’étalon-or)17. L’étude a établi que le résultat de MDRD ajusté selon la surface corporelle réelle détermine correctement une réduction de dose dans 88 % des cas, comparativement à 85 % des cas pour le résultat de CG calculé en utilisant le poids réel. On notait par contre une diminution de la concordance lorsque l’intervalle d’ajustement était étroit17.
Aucune étude n’a évalué les répercussions cliniques des ajustements posologiques en présence d’insuffisance rénale selon les formules de CKD-EPISC et de CG. En attendant des données probantes, certains professionnels recommandent d’utiliser les données des études cliniques et des monographies, car elles ont démontré être sécuritaires18.
Le programme NKDEP (National Kidney Disease Education Program), en se basant sur les résultats de l’étude Stevens et coll., recommande l’utilisation d’une seule formule d’estimation de la fonction rénale pour la détection, l’évaluation et la prise en charge de l’insuffisance rénale ainsi que pour l’ajustement des doses de médicaments17,19. Selon ce programme, le DFGe ajusté en fonction de la surface corporelle réelle du patient (estimé par la formule de MDRD ou de CKD-EPI) et la formule de CG peuvent être utilisés pour l’ajustement posologique.
L’initiative NKF KDOQI (National Kidney Foundation Kidney Disease Outcomes Quality Initiative) ne fait aucune recommandation sur le choix de la formule à utiliser pour l’ajustement posologique20. Elle recommande seulement d’estimer le DFG et d’utiliser la mesure directe du DFG si la précision est nécessaire20. À notre connaissance, la Société canadienne de néphrologie n’a pas émis de recommandations sur la formule à utiliser pour l’ajustement posologique.
Dans un article d’opinion, la Société de néphrologie française discute des faiblesses de l’argumentaire des partisans du maintien de l’utilisation de la formule de CG dans le contexte de l’adaptation posologique, ainsi que des limites et du manque de fiabilité de cette formule21. Les auteurs de l’article soutiennent la recommandation de la Haute Autorité de santé (HAS) sur l’utilisation systématique, en 2015, de l’équation CKD-EPI pour l’estimation du DFG21. Ils précisent que lorsque le DFG est évalué dans le but d’adapter la posologie d’un médicament, la désindexation de la surface corporelle est préférable21.
Une revue des différentes formules d’estimation de la fonction rénale (CG, MDRD et CKD-EPI) et de leur utilisation pour l’ajustement posologique a été faite22. L’auteur conclut que la formule CKD-EPI ajustée selon la surface corporelle est la formule la plus appropriée pour l’ajustement de la posologie médicamenteuse22.
La performance de la formule CKD-EPI peut être significativement améliorée pour un patient en convertissant le DFGe CKD-EPI en ml/min (ajustement en fonction de la surface corporelle). Cette étude conclut que le DFGe obtenu selon la formule de CKD-EPISC est comparable au DFG mesuré avec marqueur isotopique23.
Cette étude est intéressante pour la pratique quotidienne de la pharmacie. Elle confirme que l’équation de CKD-EPISC peut également être utilisée pour l’ajustement posologique. L’étude a été effectuée auprès d’une population à laquelle nous proposons le plus souvent des ajustements posologiques (DFGe inférieur à 60 ml/min/1,73 m2). Cependant, cette population était exclusivement de race blanche. Le fait qu’il n’y ait pas de comparatif de la mesure directe, comme une collecte urinaire ou un marqueur isotopique, représente une faiblesse de l’étude.
Pour conclure, nous avons observé peu de différences entre le DFGe calculé selon la formule de CKD-EPISC ou CG. Par conséquent, il semble raisonnable d’utiliser l’équation CKD-EPI SC ou CG pour l’ajustement de la plupart des posologies médicamenteuses, indépendamment de l’âge des patients et de la présence ou non d’obésité. Toutefois, les ajustements nécessitent bien entendu d’être effectués également selon le jugement clinique, en tenant compte des risques d’un surdosage ou d’un sous-dosage. Il est peut-être préférable d’être conservateur et d’utiliser la formule de CG pour les patients prenant des médicaments qui présentent un index thérapeutique étroit ou qui sont très susceptibles d’entraîner une toxicité (p. ex. aminosides, vancomycine).
Aucun financement en relation avec le présent article n’a été déclaré par l’auteur.
L’auteur a rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiel. L’auteur n’a déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Kidney disease improving global outcomes. KDIGO 2012 Clinical Practice Guideline for the Evaluation and management of chronic kidney disease. [en ligne] http://www.kdigo.org/clinical_practice_guidelines/pdf/CKD/KDIGO_2012_CKD_GL.pdf (site visité le 9 mai 2014).
2. Arora P, Vasa P, Brenner D, Iglar K, McFarlane P, Morrison H et coll. Prevalence estimates of chronic kidney disease in Canada: results of a nationally representative survey. CMAJ 2013;185:E417–23.
3. Froissart M, Karras A, Jacquot C. Quelles sont les bonnes méthodes de détermination du débit de filtration glomérulaire? RFL 2008; (suppl. 399):19–22.
4. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976;16:31–41.
5. Levey AS, Bosch JP, Lewis JB, Greene T, Rogers N, Roth D. A more accurate method to estimate glomerular filtration rate from serum creatinine: a new prediction equation. Modification of Diet in Renal Disease Study Group. Ann Intern Med 1999;130:461–70.
6. Levey AS, Stevens LA, Schmid CH, Zhand YL, Castro AF 3rd, Feldman HI et coll. CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604–12.
7. Stevens LA, Schmid CH, Greene T, Zhang YL, Beck GJ, Froissart M et coll. Comparative performance of the CKD Epidemiology Collaboration (CKD-EPI) and the Modification of Diet in Renal Disease (MDRD) Study equations for estimating GFR levels above 60 ml/min/1,73 m2. Am J Kidney Dis 2010;56:486–95.
8. Bouquegneau A, Vidal-Petiot E, Moranne O, Mariat C, Boffa JJ, Vrtovsnik F et coll. Creatinine-based equations for the adjustment of drug dosage in an obese population. Br J Clin Pharmacol 2016;81:349–61.
9. Société de néphrologie. Calculateurs – Équations DFG. [en ligne] http://www.sfndt.org/sn/eservice/calcul/eDFG.htm (site visité le 15 mai 2014).
10. Winter MA, Guhr KN, Berg GM. Impact of various body weights and serum creatinine concentrations on the bias and accuracy of the Cockcroft-Gault equation. Pharmacotherapy 2012;32:604–12.
11. Le Pogamp P, Frouget TH. La fonction rénale. [en ligne] https://facmed.univ-rennes1.fr/index.php/moteur.php (site visité le 10 décembre 2015).
12. Botev R, Mallié JP, Couchoud C, Schück O, Fauvel JP, Wetzels JF et coll. Estimating glomerular filtration rate: Cockcroft-Gault and modification of diet in renal disease formulas compared to renal inulin clearance. Clin J Am Soc Nephrol 2009;4:899–906.
13. Matzke GR, Aronoff GR, Atkinson AJ, Bennett WM, Decker BS, Eckardt K et coll. Drug dosing consideration in patients with acute and chronic kidney disease—a clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2011;80:1122–37.
14. Lessard S, Blanchet M, Morin N, Lefebvre J. Votre expérience avec l’estimation de la fonction rénale selon différentes formules mathématiques. Pharmactuel 2012;45:43–51.
15. National Kidney Foundation. Frequently asked questions about GFR estimates. [en ligne] https://www.kidney.org/sites/default/files/docs/12-10-4004_abe_faqs_aboutgfrrev1b_singleb.pdf (site visité le 15 mai 2014).
16. Stevens LA, Nolin TD, Richardson MM, Feldman HI, Lewis JB, Rodby R et coll. Comparison of drug dosing recommendations based on measured GFR and kidney function estimating equations. Am J Kidney Dis 2009;54:33–42.
17. Trinkley KT, Nikels SM, Page RL, Joy MS. Automating and estimating glomerular filtration rate for dosing medications and staging chronic kidney disease. Int J Gen Med 2014:7 211–8.
18. National kidney disease education program. CKD and drug dosing: information for providers. [en ligne] http://nkdep.nih.gov/resources/CKD-drug-dosing.shtml (site visité le 10 décembre 2015).
19. Hudson JQ, Nyman HA. Use of estimated glomerular filtration rate for drug dosing in the chronic kidney disease patient. Curr Opin Nephrol Hypertens 2011;20:482–91.
20. Inker LA, Astor BC, Fox CH, Isakova T, Lash JP, Peralta CA et coll. KDOQI US Commentary on the 2012 KDIGO clinical practice guideline for the evaluation and management of CKD. Am J Kidney Dis. 2014;63:713–5.
21. Delanaye P, Flamant M, Cavalier É, Guerber F, Vallotton T, Moranne O et coll. Adaptation posologique des médicaments et fonction rénale : quel(s) estimateur(s) faut-il choisir ? Nephrol Ther 2016;12:18–31.
22. Jones GRD. Renal function for drug dosing decisions. Clin Biochem Rev 2011;32:81–8.
23. Redal-Baigorri B, Rasmussen K, Heaf JG. The use of absolute values improves performance of estimation formulae: a retrospective cross-sectional study. BMC Nephrol 2013;14:271.
PHARMACTUEL, Vol. 49, No. 3, 2016