Utilisation de la procalcitonine pour le diagnostic et le suivi du traitement des infections respiratoires et du sepsis au Centre hospitalier de l’Université de Montréal
Lucie Tran1,2, Catherine Ferland2, B.Pharm., M.Sc., Anita Ang3, B.Pharm., M.Sc.
1Assistante de recherche en Gérance des antimicrobiens au moment de la rédaction, Centre hospitalier de l’Université de Montréal, Montréal (Québec) Canada;
2Pharmacienne, Université Paris-Sud XI, Paris, France;
3Pharmacienne, Centre hospitalier de l’Université de Montréal, Montréal (Québec) Canada
Reçu le 7 octobre 2015; Accepté après révision par les pairs le 22 mars 2016
Résumé
Objectif : L’objectif est d’évaluer l’utilisation du dosage de la procalcitonine sur le plan des indications, de l’utilisation d’un algorithme décisionnel, de la durée de l’antibiothérapie et du taux de mortalité pour les patients traités au Centre hospitalier de l’Université de Montréal.
Méthode : L’étude, descriptive et rétrospective, a analysé 500 dossiers patients pour lesquels au moins un dosage de la procalcitonine a été effectué entre le 20 juillet 2014 et le 12 janvier 2015. Aucun critère d’exclusion n’est retenu.
Résultats : L’analyse comprend 722 dosages de procalcitonine. Les patients sont âgés de 67 ± 16 ans, 78,4 % présentent une ou plusieurs comorbidités et 79,4 % d’entre eux sont hospitalisés (32 % sont admis dans le service de chirurgie et 26,7 % dans le service de pneumologie). La grande majorité (77,8 %) des dosages de procalcitonine ont été effectués pour mettre en évidence ou écarter une infection respiratoire basse ou un sepsis. Dans 52,4 % des cas, l’algorithme décisionnel propre à l’établissement a été respecté. L’utilisation du dosage de la procalcitonine semble être associée à une diminution de la durée de l’antibiothérapie (estimée à 5,8 ± 1,4 jours en moyenne; environ 1 036 jours de traitement sauvés), sans répercussions sur le taux de mortalité des patients (9,3 % comparativement à 7,8 %, différence non significative).
Conclusion : En cas d’infection respiratoire basse ou de sepsis, le dosage de la procalcitonine et l’utilisation d’un algorithme décisionnel semblent être associés à une réduction de l’utilisation des antibiotiques, sans répercussions sur le taux de mortalité. Une telle approche permettrait de limiter l’apparition de résistances bactériennes et de réduire les coûts de santé.
Mots clés : Antibiotique, infection respiratoire, procalcitonine, sepsis
Abstract
Objective: The objective was to evaluate the use of procalcitonin assays in terms of indication, use of a decision algorithm, duration of antibiotic therapy, and mortality in patients treated at the Centre Hospitalier de l’Université de Montréal.
Method: This is a descriptive, retrospective study based on the review of the charts of 500 patients for whom at least one procalcitonin assay was performed between July 20, 2014, and January 12, 2015. There were no exclusion criteria.
Results: The analysis concerned 722 procalcitonin assays. The patients were 67 ± 16 years of age, and 78.4% had one or more comorbidities. In all, 79.4% of the patients were inpatients; 32% had been admitted for surgery and 26.7% for respiratory care. A total of 77.8% of the procalcitonin assays were performed to identify or rule out a lower respiratory tract infection or sepsis. In 52.4% of the cases, the decision algorithm, specific to this institution, was followed. The use of procalcitonin assays seemed to be associated with a decrease in the duration of antibiotic therapy, estimated at 5.8 ± 1.4 days on average, with 1,036 treatment days saved, with no impact on patient mortality rates (9.3% vs. 7.8%, difference nonsignificant).
Conclusion: In cases of patients with lower respiratory tract infections or sepsis, procalcitonin assays and the use of a decision algorithm appear to be associated with a decline in antibiotic use, with no impact on mortality. This test can help limit the development of bacterial resistance and reduce healthcare costs.
Key words: Antibiotic, procalcitonin, respiratory infection, sepsis
Introduction
Les infections bactériennes, telles que la méningite, la pneumonie ou le sepsis, sont associées à une forte morbidité et mortalité dans les établissements de santé1. Ces derniers font ainsi largement appel aux antibiotiques, pierre angulaire du traitement de ces infections. Cependant, l’utilisation croissante de ces médicaments a entraîné l’émergence de bactéries multi-résistantes, rendant de plus en plus difficile la maîtrise des infections bactériennes. L’une des solutions à ce problème majeur est de limiter le plus possible la prescription d’antibiotiques non nécessaires (infection virale, inflammation d’origine non infectieuse). La prise de décision par le clinicien peut alors s’avérer délicate : décider d’administrer ou non un antibiotique de façon empirique, avant la confirmation bactériologique, au risque de favoriser le développement de résistance bactérienne dans le premier cas ou d’affecter directement la survie du patient dans le second. Toutefois, des marqueurs biologiques existent et peuvent aider le clinicien à diagnostiquer et à surveiller l’état infectieux des patients. Les plus utilisés sont le taux de globules blancs, la vitesse de sédimentation et le taux de protéine C réactive (CRP), mais ces marqueurs sont peu spécifiques de l’infection bactérienne.
La procalcitonine est une protéine initialement décrite comme un marqueur spécifique de l’infection bactérienne2. Elle est le précurseur d’une hormone, la calcitonine, mais elle n’a aucun rôle physiologique établi. Elle est sécrétée précocement lors d’états septiques, en trois à quatre heures, puis son taux s’élève rapidement jusqu’à atteindre un plateau vers la sixième heure. Son taux reste élevé pendant au moins 24 h. Sa demi-vie d’élimination est de 22 à 35 h, ce qui signifie que son taux retourne aux valeurs de base en deux à trois jours3.
Il a été démontré que la sensibilité et la spécificité du dosage de la procalcitonine pour différencier une infection d’origine bactérienne d’une inflammation d’origine non infectieuse (SRIS = syndrome de réponse inflammatoire systémique) sont respectivement de 60 % et 79 % avec un taux seuil de procalcitonine fixé à 0,5 μg/l4. L’augmentation précoce du taux de procalcitonine en cas de sepsis permettrait donc une détection rapide de l’infection.
Cependant, il existe des résultats faussement positifs, comme dans le cas des patients ayant subi une chirurgie lourde, un polytraumatisme, une brûlure grave ou un syndrome de détresse respiratoire aiguë (SDRA). Il existe également des résultats faussement négatifs, comme lorsque l’infection est très précoce ou localisée. L’utilisation du dosage de la procalcitonine a surtout été étudiée pour les infections des voies respiratoires inférieures (IVRI) et le sepsis.
L’utilisation du dosage de la procalcitonine dans le diagnostic et le suivi d’IVRI est bien établie. Plusieurs études (ProRESP, ProHOSP, ProCAP) ont montré que l’utilisation du dosage de la procalcitonine en tant que facteur décisionnel a permis de réduire l’utilisation des antibiotiques, en particulier dans le traitement des pneumonies acquises en communauté, de 40 à 55 %, de façon sûre et sans répercussion sur la résolution de l’infection5–7. Enfin, le groupe Cochrane a analysé 14 études regroupant 4 551 patients entre 2012 et 20148. Les résultats de cette méta-analyse montrent que l’utilisation du dosage de la procalcitonine pour guider l’initiation et la durée de l’antibiothérapie dans le cadre du traitement des infections respiratoires aiguës n’est pas associée à une augmentation du taux de mortalité ou d’échec au traitement, mais réduit significativement la consommation d’antibiotiques. Toutefois, cette méta-analyse souligne la nécessité d’avoir plus de données sur le taux de mortalité pour s’assurer de l’innocuité de l’outil pour les patients des unités de soins intensifs.
Plusieurs études ont porté sur l’utilisation du dosage de la procalcitonine dans le traitement du sepsis de patients des unités de soins intensifs. L’étude PRORATA montre un nombre de jours sans antibiotiques significativement plus élevé (réduction de l’exposition à l’antibiotique de 23 %) pour les patients dont le taux de procalcitonine est suivi, comparativement au groupe témoin, sans effet sur le taux de mortalité (décès à 28 et à 60 jours)9.
L’étude PASS montre également qu’il n’y a pas de différence en ce qui concerne le taux de mortalité entre des patients pour lesquels le taux de procalcitonine est suivi ou non10. Enfin, d’autres études et méta-analyses montrent que l’utilisation du dosage de la procalcitonine pour guider l’antibiothérapie du patient d’une unité de soins intensifs permet de diminuer significativement la consommation d’antibiotiques sans affecter la survie du patient11–13. Toutefois, une réserve persiste en ce qui concerne le taux de mortalité, et les auteurs critiquent le seuil de non-infériorité utilisé. Ainsi, il est recommandé d’utiliser le dosage de la procalcitonine en concordance avec l’évolution clinique du patient.
Le Centre hospitalier de l’Université de Montréal (CHUM) représente l’un des plus importants hôpitaux du Québec. Il offre en priorité des soins et des services spécialisés à une clientèle adulte régionale et suprarégionale.
Dans un contexte d’émergence de résistances bactériennes et de diminution de l’arsenal thérapeutique efficace, le CHUM a élaboré un programme de gérance des antimicrobiens (antimicrobial stewardship) ayant pour objectifs la maîtrise du bon usage des antimicrobiens dans l’établissement ainsi qu’une diminution des coûts de santé. Le dosage de la procalcitonine pourrait aider à réduire la surconsommation d’antibiotiques, et c’est dans ce contexte que ce test a été instauré au CHUM en 2013. Son usage est principalement promu dans le domaine de la pneumologie et, dans certains cas, des soins intensifs. Une ordonnance spécifique à la pneumologie et un algorithme décisionnel ont été élaborés (figure 1).
| |

|
|
|
Figure 1 Algorithme décisionnel utilisé par le service de pneumologie du Centre hospitalier de l’Université de Montréal
Abréviation : ARDS : syndrome de détresse respiratoire aiguë
L’autorisation de publier cette ordonnance a été obtenue de la direction du Centre hospitalier de l’Université de Montréal.
|
Aucun algorithme n’a été adopté pour les soins intensifs, mais pour l’analyse de nos données nous avons repris le seuil de 0,5 μg/l, qui correspond au seuil le plus utilisé dans les essais comparatifs à répartition aléatoire décrits dans la documentation scientifique13.
L’objectif de cette étude est d’évaluer rétrospectivement l’utilisation du dosage de la procalcitonine pour le diagnostic et le suivi du traitement des infections bactériennes au CHUM. Nous pourrons ainsi noter les éventuels avantages apportés par l’adoption de ce test de laboratoire en ce qui concerne le traitement des infections bactériennes par des antibiotiques et mettre en évidence des pratiques déviantes qui guideront les mesures éducatives à mettre en œuvre.
Méthode
Il s’agit d’une étude descriptive et rétrospective; le recueil de données a été fait à partir des dossiers cliniques informatisés, accessibles à partir du logiciel interne OacisMD.
La population étudiée comprend tous les patients hospitalisés au CHUM ou ayant consulté le service des urgences ou une clinique externe du CHUM entre le 20 juillet 2014 et le 12 janvier 2015, et pour lesquels au moins un dosage de procalcitonine a été réalisé. La liste des patients concernés a été fournie par le laboratoire de biochimie et un dossier clinique sur trois est analysé (environ 500 patients) afin d’obtenir un échantillon suffisamment important. L’étude n’avait aucun critère d’exclusion.
Des renseignements détaillés ont été consignés pour chacun des dosages de procalcitonine analysés : indication du dosage, spécialité du prescripteur, service d’admission du patient, utilisation d’un algorithme d’interprétation valide (propre à l’établissement), répercussion sur la conduite thérapeutique, diagnostics différentiels, durée de l’antibiothérapie, comorbidités, résultats faussement positifs ou faussement négatifs potentiels.
La réduction du nombre de jours d’antibiothérapie a été estimée d’après les durées usuelles de traitement pour des infections respiratoires basses : cinq jours pour une pneumonie acquise dans la communauté, sept jours pour une pneumonie nosocomiale, sept jours pour une bronchite surinfectée pour un patient ayant une maladie pulmonaire obstructive chronique (MPOC), 14 jours pour une pneumonie à Pseudomonas aeruginosa et 21 jours pour une pneumonie à SARM (Staphylococcus aureus résistant à la méthicilline)4–16. La durée de traitement pour un sepsis dépend de la source probable d’infection. Les résultats sont exprimés en pourcentage et en moyenne ± écart type. Les pourcentages sont comparés selon le test du χ2.
Les dossiers ont été analysés de façon anonyme. La collecte des données n’a fait appel à aucune donnée nominale de patient. La liste des dosages de la procalcitonine était codée et un numéro était assigné à chaque dosage évalué. Un même patient pouvait être analysé plusieurs fois si le dosage de la procalcitonine avait été effectué plusieurs fois pour ce patient. Une demande d’accès aux dossiers cliniques a été faite auprès du comité d’éthique de la recherche de l’établissement afin de respecter les bonnes pratiques de recherche. Le comité d’éthique a accédé à cette demande.
Résultats
Description de la population étudiée
Entre le 20 juillet 2014 et le 12 janvier 2015, 1 530 dosages de la procalcitonine ont été effectués. L’étude a analysé 500 dossiers cliniques, ce qui correspond à 722 dosages de procalcitonine (47,2 % de l’ensemble des dosages). Le tableau I présente les caractéristiques des patients.
Tableau I Caractéristiques des patients

Description de l’utilisation du dosage de la procalcitonine
Les résultats montrent que 77,8 % des dosages de procalcitonine, tous prescripteurs confondus, ont été faits dans un contexte d’infection respiratoire (69,8 %) ou de sepsis (8 %). Les diagnostics différentiels de l’IVRI étaient principalement des exacerbations aiguës de MPOC non infectées, des surcharges pulmonaires ou des infections aux virus grippaux.
Le pourcentage de non-conformité par rapport à l’indication du dosage de la procalcitonine était de 22,2 % (11,4 % d’indications autres et 10,8 % d’indications non spécifiées).
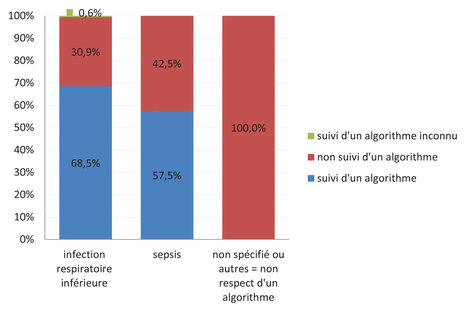
L’algorithme décisionnel propre à l’établissement (seuil de 0,25 μg/l en pneumologie, seuil de 0,5 μg/l en soins intensifs) a été respecté dans 52,4 % des cas. Il était majoritairement respecté en cas d’IVRI et de sepsis (figure 2).
| |
|
|
|
Figure 2 Prescription de procalcitonine et respect de l’algorithme
|
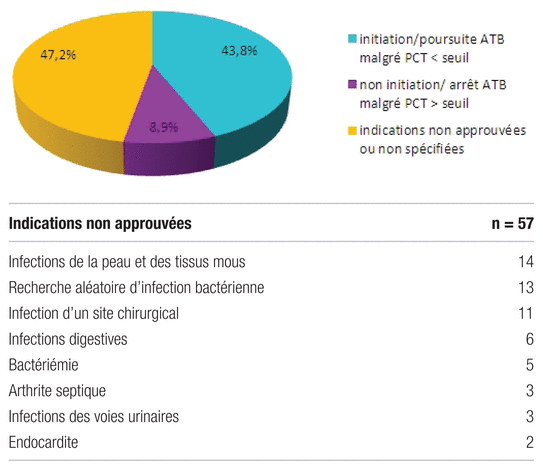
Le non-respect de l’algorithme était principalement lié à des prescriptions du dosage pour des indications non approuvées (indications autres que l’IVRI ou le sepsis) ou non spécifiées (figure 3).
| |
|
|
|
Figure 3 Non-respect de l’algorithme et détail des indications non approuvées
Abréviations : ATB : antibiotique; PCT : procalcitonine
|
Répercussion de l’utilisation du dosage de la procalcitonine
L’utilisation du dosage de la procalcitonine semblait être associée à une réduction de la durée de l’antibiothérapie pour 192 patients, dont 181 que l’on soupçonnait d’être atteints d’une IVRI ou d’un sepsis. Le dosage de la procalcitonine aurait permis de récupérer 1 036 jours estimés d’antibiothérapie lorsque ce dosage était prescrit pour une IVRI ou un sepsis. La réduction moyenne de jours était estimée à 5,8 ± 1,4 jours.
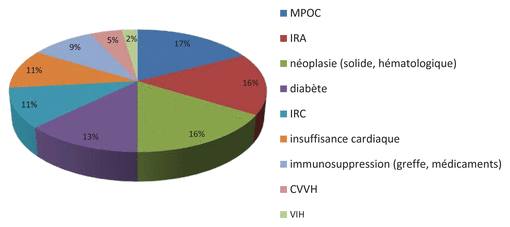
L’utilisation du dosage de la procalcitonine ne semblait pas être associée à une augmentation des décès. L’étude a mis en évidence que 42 patients sont décédés dans les 30 jours qui suivaient le dosage de la procalcitonine, mais aucun décès ne semblait lié à un mauvais diagnostic basé sur le résultat du dosage de la procalcitonine. Le taux de mortalité à 30 jours était similaire, que l’algorithme soit suivi ou non (9,3 % comparativement à 7,8 %, x2, différence non significative). La majorité (93 %) des patients décédés présentaient une ou plusieurs comorbidités (figure 4).
| |
|
|
|
Figure 4 Comorbidités des patients décédés
Abréviations : CVVH : continuous veno-venous hemofiltration; IRA : insuffisance rénale aiguë; IRC : insuffisance rénale chronique; MPOC : maladie pulmonaire obstructive chronique; VIH : virus de l’immunodéficience humaine
|
Sept rechutes ou récidives (1,5 %) ont eu lieu dans les 30 jours après la fin de l’antibiothérapie.
Résultats faussement positifs ou faussement négatifs
Des résultats potentiellement faussement positifs ou négatifs ont été relevés : 4,4 % des résultats associaient un taux élevé de procalcitonine à un diagnostic autre que l’IVRI ou le sepsis. Des causes possibles de résultats faussement positifs étaient présentes : chirurgie majeure, syndrome de détresse respiratoire aiguë, traumatisme grave, infection fongique invasive, pneumonite chimique ou cancer du poumon à petites cellules.
Inversement, 62 IVRI et six sepsis (13,6 % des patients) ont été diagnostiqués malgré un taux de procalcitonine inférieur à 0,25 μg/l ou à 0,5 μg/l. L’antibiothérapie avait été commencée ou poursuivie dans les cas cités. Ces résultats soulèvent donc la possibilité de résultats faussement négatifs (en cas d’infection précoce ou localisée).
Discussion
Dans notre établissement, le dosage de la procalcitonine est majoritairement utilisé pour des indications approuvées : 77,8 % d’entre eux sont effectués pour mettre en évidence ou écarter la présence d’une IVRI d’origine bactérienne ou d’un sepsis.
Dans 52,4 % des cas, la conduite thérapeutique a suivi l’algorithme établi au préalable. Le taux de non-conformité quant au respect de l’indication est alors de 22,2 % et atteint même 47,2 % si on tient strictement compte du respect de l’algorithme. Bien que non négligeable, ce taux de non-conformité reste similaire à celui décrit dans la documentation scientifique. En effet, selon les études, le taux de non-adhésion au protocole varie entre 9 et 53 %8–10.
Dans 47,2 % des cas, le non-suivi de l’algorithme était associé à une indication autre ou non spécifiée. Cependant, la documentation scientifique sur l’usage du dosage de la procalcitonine pour d’autres indications (par exemple, pour les infections de la peau et des tissus mous ou l’endocardite) est limitée et ne permet pas d’approuver une telle utilisation du dosage dans notre établissement17–19. Les autres situations de non-conformité (poursuite ou commencement du traitement malgré un taux de procalcitonine inférieur à 0,25 μg/l ou à 0,5 μg/l; arrêt du traitement malgré un taux de procalcitonine supérieur à 0,25 μg/l ou à 0,5 μg/l) se justifiaient principalement par le tableau clinique du patient. Il est à noter que tous les protocoles évaluant le taux de procalcitonine permettent d’adapter la conduite thérapeutique à l’état clinique du patient, même si le taux de procalcitonine est contradictoire.
Dans notre centre, l’utilisation du dosage de la procalcitonine ne semblait pas être directement liée à des complications ou des décès, et 93 % des patients décédés avaient une ou plusieurs comorbidités expliquant en partie leur décès. L’utilisation de ce dosage était associée à une diminution totale du nombre de jours d’antibiothérapie estimée à 1 036 jours et à une diminution moyenne de la durée d’antibiothérapie de 5,8 jours.
Bien que notre étude soit descriptive et non comparative, et que notre population soit plus large et moins homogène que celles des études précédemment publiées (études menées auprès de populations des unités de soins intensifs ou de pneumologie avec certains critères d’exclusion, comme les patients immunosupprimés [greffe, infection au VIH] ou ceux souffrant de pneumonies nosocomiales), nos résultats sont en accord avec les données trouvées dans la documentation scientifique5–9. Nos résultats montrent que l’usage du dosage de la procalcitonine et d’un algorithme décisionnel est associé aux mêmes avantages que ceux observés dans les essais comparatifs à répartition aléatoire, à savoir une diminution de la durée d’antibiothérapie sans répercussion sur le taux de mortalité des patients. Les avantages espérés de cette diminution de la consommation d’antibiotiques sont une limitation de l’apparition de résistances bactériennes et d’infections nosocomiales, ainsi qu’une réduction des coûts de santé.
Notre étude a porté sur un nombre important de dossiers cliniques (n = 500), qui représentent un nombre élevé de dosages de procalcitonine (n = 722). Tous les profils de patients ont été inclus, y compris les patients immunosupprimés ou dialysés. Aucun critère d’exclusion n’a été retenu. Tous les types de patients (hospitalisé, admis au service des urgences, ambulatoire) et de spécialités médicales (en faisant la distinction entre le service d’admission et la spécialité du prescripteur) ont été pris en compte. Enfin, la période étudiée (juillet à janvier) couvre plusieurs saisons, propices ou non aux infections respiratoires. Cette méthodologie permet donc d’obtenir un vaste échantillon, représentatif de la population traitée au CHUM, ce qui renforce la robustesse des résultats obtenus.
Toutefois, notre étude comporte plusieurs faiblesses. D’abord, l’étude est rétrospective et le nombre de données manquantes est élevé. Des biais de mesure et d’interprétation sont possibles, puisque le recueil de données dépend de la tenue du dossier médical (écriture manuscrite et lecture potentiellement difficile, informations manquantes ou peu claires, etc.) et de la saisie des données, malgré un dictionnaire rigoureux. L’interprétation de ces données peut parfois varier d’un chercheur à l’autre. L’étude est également monocentrique et les résultats ne s’appliquent qu’à notre établissement.
Ensuite, la réduction de jours d’antibiothérapie a été estimée en fonction des durées d’antibiothérapie habituelles, mais un défaut de pertinence peut être lié au contexte clinique propre au patient (par exemple, nombre de jours d’antibiothérapie nécessaires plus important que le nombre estimé)13–15. Il est à noter que les comorbidités sont nombreuses et fréquentes dans la population de notre étude (75 % des patients présentent une ou plusieurs comorbidités). L’inclusion de tous types de patients (immunosupprimés, dialysés, etc.) entraîne possiblement plus de résultats faussement positifs ou faussement négatifs et l’influence de tels résultats est difficile à déterminer. En outre, les rechutes ou les récidives sont difficiles à évaluer, le site de l’infection n’étant pas toujours clairement établi ou décrit dans les dossiers.
Enfin, l’étude n’a pas estimé les économies engendrées par l’utilisation de ce dosage (économies directes [coût du dosage par rapport au coût de l’antibiothérapie] et économies indirectes [durée du séjour à l’hôpital]). Elle n’a pas non plus évalué les éventuels effets indésirables imputables aux antibiotiques, ce qui aurait pu apporter des données supplémentaires concernant notre programme de gérance des antimicrobiens.
Conclusion
L’utilisation du dosage de la procalcitonine au CHUM est adéquate pour les indications approuvées, à savoir l’IVRI et le sepsis, mais le suivi de l’algorithme décisionnel établi au préalable est à améliorer. L’utilisation du dosage semble associée à une diminution de la durée de l’antibiothérapie, sans répercussion sur le taux de mortalité des patients. Ce dosage permettrait alors de limiter l’apparition de résistances bactériennes et des effets indésirables liés aux antibiotiques, et de réduire les coûts de santé. Des mesures éducatives et correctives sont à prévoir auprès des prescripteurs pour optimiser l’utilisation de ce dosage et en éviter la prescription pour des indications non approuvées, ce qui pourrait mener à des pratiques à risque pour le patient.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Anita Ang a été consultante pour Hospira et elle a donnée des conférences pour Hospira et Sonovion. Les autres auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Références
1. Vincent JL, Sakr Y, Sprung CL, Ranieri VM, Reinhart K, Gerlach H et coll. Sepsis in European intensive care units: results of the SOAP study. Crit Care Med 2006;34:344–53.

2. Assicot M, Gendrel D, Carsin H, Raymond J, Guilbaud J, Bohuon C. High serum procalcitonin concentrations in patients with sepsis and infection. Lancet 1993;341:515–8.

3. Dandona P, Nix D, Wilson MF, Aljada A, Love J, Assicot M et coll. Procalcitonin increase after endotoxin injection in normal subjects. J Clin Endocrinol Metab 1994;79:1605–8.
4. Al-Nawas B, Krammer I, Shah PM. Procalcitonin in diagnosis of severe infections. Eur J Med Res 1996;1:331–3.
5. Christ-Crain M, Jaccard-Stolz D, Bingisser R, Gencay MM, Huber PR, Tamm M et coll. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster-randomised, single-blinded intervention trial. Lancet 2004;363:600–7.

6. Schuetz P, Christ-Crain M, Thomann R, Falconnier C, Wolbers M, Widmer I et coll. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial. JAMA 2009;302:1059–66.

7. Christ-Crain M, Stolz D, Bingisser R, Müller C, Miedinger D, Huber PR et coll. Procalcitonin guidance of antibiotic therapy in community-acquired pneumonia: a randomized trial. Am J Respir Crit Care Med 2006;174:84–93.

8. Schuetz P, Müller B, Christ-Crain M, Stolz D, Tamm M, Bouadma L et coll. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Evid Based Child Health 2013;8:1297–371.

9. Bouadma L, Luyt CE, Tubach F, Cracco C, Alvarez A, Schwebel C et coll. Use of procalcitonin to reduce patients’ exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet 2010;375:463–74.

10. Jensen JU, Hein L, Lundgren B, Bestle MH, Mohr TT, Andersen MH et coll. Procalcitonin-guided interventions against infections to increase early appropriate antibiotics and improve survival in the intensive care unit: a randomized trial. Crit Care Med 2011;39:2048–58.

11. Nobre V, Harbarth S, Graf JD, Rohner P, Pugin J. Use of procalcitonin to shorten antibiotic treatment duration in septic patients: a randomized trial. Am J Respir Crit Care Med 2008;177:498–505.

12. Hochreiter M, Köhler T, Schweiger AM, Keck FS, Bein B, von Spiegel T et coll. Procalcitonin to guide duration of antibiotic therapy in intensive care patients: a randomized prospective controlled trial. Crit Care 2009;13:R83.


13. Matthaiou DK, Ntani G, Kontogiorgi M, Poulakou G, Armaganidis A, Dimopoulos G. An ESICM systematic review and meta-analysis of procalcitonin-guided antibiotic therapy algorithms in adult critically ill patients. Intensive Care Med 2012;38:940–9.

14. Mandell LA, Wunderink RG, Anzueto A, Bartlett JG, Campbell GD, Dean NC et coll. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults. Clin Infect Dis 2007;44(suppl. 2):27–72.

15. American Thoracic Society; Infectious Diseases Society of America. Guidelines for the management of adults with hospital-acquired, ventilator-associated, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005;171:388–416.

16. Woodhead M, Blasi F, Ewig S, Huchon G, Ieven M, Ortqvist A et coll. Guidelines for the management of adult lower respiratory tract infections. Eur Respir J 2005;26:1138–80.

17. Eder J, Hlavin G, Haushofer A, Trubert-Exinger D, Trautinger F. Correlation of serum procalcitonin with the severity of skin and skin structure infections – a pilot study. J Dtsch Dermatol Ges 2012;10:564–71.
18. Kocazeybek B, Küçükoğlu S, Oner YA. Procalcitonin and C-reactive protein in infective endocarditis: correlation with etiology and prognosis. Chemotherapy 2003;49:76–84.

19. Yu CW, Juan LI, Hsu SC, Chen CK, Wu CW, Lee CC et coll. Role of procalcitonin in the diagnosis of infective endocarditis: a meta-analysis. Am J Emerg Med 2013;31:935–41.

Pour toute correspondance : Anita Ang, Centre hospitalier de l’Université de Montréal, 1058, rue Saint-Denis, Montréal (Québec) H2X 3J4, CANADA; Téléphone : 514 890-8000, poste 36163; Télécopieur : 514 412-7381
(Return to Top)
PHARMACTUEL, Vol. 49, No. 2, 2016