
Marie-Ève Legris1,2, B.Pharm., M.Sc., Katherine Desforges2,3, B.Pharm., M.Sc.
Reçu le 28 février 2016; Accepté après révision par les pairs le 20 octobre 2016
Résumé
Objectifs : Revoir les différentes formules d’estimation de la fonction rénale basées sur la créatinine sérique et leurs avantages et inconvénients. Résumer les données de la littérature scientifique et les avis d’experts portant sur leur utilisation pour l’ajustement posologique des médicaments.
Source des données et sélection des études : Une revue de la littérature a été effectuée dans PubMed avec un croisement entre les mots-clés suivants : kidney function, glomerular filtration rate et drug dosing, sans limites de dates. Elle a permis la consultation d’études cliniques, de revues systématiques ou non, d’opinions d’experts et de lignes directrices publiées entre 1999 et 2016.
Revue du sujet traité : Malgré ses nombreuses limites, la créatinine sérique demeure le marqueur le plus souvent utilisé pour l’évaluation de la fonction rénale à l’heure actuelle. Parmi les formules d’estimation, celles de Cockcroft-Gault, Modification of Diet in Renal Disease (MDRD) et, plus récemment, Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) sont les plus connues. Les recommandations d’ajustement posologique sont généralement formulées à la suite d’une évaluation de la fonction rénale par la formule Cockcroft-Gault. Néanmoins, cette formule a été développée avant la standardisation des dosages de créatinine, ce qui en diminue l’applicabilité de nos jours. Plusieurs études comparent l’utilisation des différentes formules dans un but d’ajustement posologique, avec des résultats divergents. Les experts s’entendent toutefois pour recommander l’utilisation des formules Cockcroft-Gault ou CKD-EPI corrigée en fonction de la surface corporelle réelle. Ils mentionnent également des situations particulières, où on favorise d’obtenir une mesure exacte du débit de filtration glomérulaire.
Conclusion : Aucune formule spécifique ne convient à toutes les situations, et l’évaluation clinique du patient et du choix de traitement demeure de mise. De plus, le suivi de l’efficacité clinique et, lorsqu’ils sont disponibles, des dosages sériques des médicaments complète l’analyse du pharmacien.
Mots clés : Ajustement posologique, CKD-EPI, Cockcroft-Gault, estimation de la fonction rénale, MDRD
Abstract
Objectives: To review the different renal function estimation formulas based on the serum creatinine level and their advantages and drawbacks, and to summarize the literature and expert opinions regarding their use for drug dosage adjustment purposes.
Data source and study selection: A literature review was conducted in PubMed with a combination of the following keywords, with no date restrictions: kidney function, glomerular filtration rate and drug dosing. In the process, we consulted clinical studies, systematic and nonsystematic reviews, expert opinions and guidelines published between 1999 and 2016.
Review of the topic of interest: Currently, the serum creatinine level is the marker used most often to estimate renal function, despite its many limitations. The most widely known estimation formulas are the Cockcroft-Gault, the Modification of Diet in Renal Disease (MDRD) and, more recently, the Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) equations. Dosage adjustment recommendations are generally made after renal function is evaluated with the Cockcroft-Gault formula. However, this equation was developed before creatinine assays were standardized, which diminishes its current applicability. Several studies compare the use of the different formulas for dosage adjustment purposes, with divergent results. However, the experts agree on recommending the use of the Cockcroft-Gault or CKD-EPI formula corrected for actual body surface area. They also mention the specific situations in which accurately measuring the glomerular filtration rate is a priority.
Conclusion: No one formula is perfect in all situations, and a clinical evaluation of the patient and the choice of treatment are essential. Furthermore, monitoring clinical effectiveness and serum drug levels, if available, complements the pharmacist’s analysis.
Keywords: CKD-EPI, Cockcroft-Gault, dosage adjustment, estimation of renal function, MDRD
L’insuffisance rénale affecte un Canadien sur dix, et le nombre de Canadiens qui sont traités pour une insuffisance rénale terminale a plus que triplé en 20 ans1. L’évaluation fiable de la fonction rénale est donc primordiale, car elle permet la détection précoce de l’insuffisance rénale chronique (IRC) et le suivi de son évolution. Cette évaluation est également nécessaire pour ajuster adéquatement les médicaments qui sont éliminés par voie rénale. Même l’élimination des médicaments par d’autres voies que la voie rénale peut être modifiée par l’insuffisance rénale sévère, entre autres par l’accumulation de toxines urémiques qui diminuent l’activité des enzymes du métabolisme et des protéines de transport2. Le présent article résume les données de la littérature scientifique et les avis d’experts portant sur les principales formules d’estimation de la fonction rénale, leurs avantages et inconvénients ainsi que leur application pour l’ajustement posologique des médicaments afin d’apporter au clinicien tous les éléments de réflexion lui permettant de se positionner dans sa pratique. Seul le cas du patient adulte ayant une fonction rénale stable sera abordé. Nous excluons également le cas de la carboplatine, qui demeure très controversé.
Une revue de la littérature sans limites de dates a été effectuée dans PubMed avec un croisement entre les mots clés suivants : kidney function, glomerular filtration rate et drug dosing. Elle a permis la consultation d’études cliniques, de revues systématiques ou non, d’opinions d’experts et de lignes directrices publiées entre 1999 et 2016. Seuls les documents de langue anglaise ou française ont été pris en considération. Les listes de références des articles retenus ont également été parcourues.
L’évaluation de la fonction rénale repose sur le débit de filtration glomérulaire (DFG), qui représente la somme du taux de filtration de chaque néphron fonctionnel3,4. Il est possible de mesurer le DFG à l’aide de marqueurs exogènes, tels l’inuline ou les radio-isotopes (125I-iothalamate, éthylène-diamine-tétraacétate marqué au chrome 51 (51Cr-EDTA), etc.). Cependant, ces méthodes sont peu utilisées en clinique, car elles sont complexes et coûteuses3–6.
En pratique, on peut estimer le DFG en mesurant la clairance urinaire de la créatinine (ClCr) moyennant une collecte urinaire de 24 heures. Cependant, cette méthode est fastidieuse pour le patient, et la récolte est parfois incomplète3–6. Ainsi, on estime plus fréquemment le DFG à partir de la créatinine sérique. La créatinine est issue du métabolisme musculaire de la créatine : elle est donc fréquemment plus élevée chez les hommes, les personnes de race noire et celles qui mangent beaucoup de viande, tandis qu’elle est généralement plus basse chez les femmes, les personnes âgées, les patients paralysés, amputés et dénutris, et les végétariens4–7. La créatinine est librement filtrée par les glomérules, mais elle est également sécrétée par les cellules tubulaires. Ainsi, la clairance totale de la créatinine correspond à la somme de la filtration glomérulaire et de la sécrétion tubulaire, et elle surestime donc le DFG3,4,7. La contribution de la sécrétion tubulaire augmente à mesure que le DFG diminue; en effet, pour un DFG normal, la part de sécrétion tubulaire dans la clairance totale de la créatinine est de l’ordre de 10 %, alors qu’elle dépasse 50 % au stade terminal de l’insuffisance rénale8–10. Certains médicaments (ex. : triméthoprime, cimétidine) peuvent aussi affecter à la hausse la créatinine sérique par inhibition de la sécrétion tubulaire, ce qui peut fausser l’interprétation du DFG3,5. Enfin, lorsque la fonction rénale est instable, par exemple chez les patients des soins intensifs et ceux en insuffisance rénale aiguë, l’utilisation de la créatinine comme marqueur entraîne une estimation biaisée : une fonction rénale en détérioration sera surestimée tandis qu’une fonction rénale en récupération sera sous-estimée3,5,7. Bref, toutes les méthodes d’évaluation de la fonction rénale basées sur la créatinine sont sujettes à ces nombreux biais.
La mesure de la créatinine sérique à l’aide de la méthode colorimétrique de Jaffe était une source de grande variabilité entre les laboratoires (jusqu’à 20 %)6,7. Entre 2005 et 2010, les laboratoires ont dû graduellement se conformer à la standardisation par spectrométrie de masse par dilution isotopique (IDMS), et ce, à l’international, tel que le recommande le programme américain National Kidney Disease Education Program (NKDEP) puis l’organisation internationale Kidney Disease-Improving Global Outcomes (KDIGO)5,7. Cette standardisation assure une meilleure précision et reproductibilité des résultats. De façon générale, la valeur de la créatinine ainsi mesurée est légèrement inférieure à celle mesurée par colorimétrie (environ 5 à 7 %)3,7,8,11.
Développée à Montréal et publiée en 1976, la formule Cockcroft-Gault (CG) estime la ClCr en mL/min12. Elle a été développée à partir de la créatinine sérique, de l’âge et du poids de 249 hommes, vétérans, âgés entre 18 et 92 ans. L’estimation de la ClCr obtenue par cette formule a ensuite été comparée avec la moyenne de deux mesures de la ClCr par collecte urinaire chez 236 de ces mêmes patients. Le coefficient de corrélation obtenu était de 0,83.
Bien qu’elle soit encore largement utilisée en pratique, cette formule présente plusieurs limites. Tout d’abord, la population à l’étude était uniquement composée d’hommes caucasiens. La réduction du résultat de 15 % proposée par les auteurs pour les femmes est purement arbitraire et ne découle pas d’un processus scientifique. Ensuite, les auteurs ont utilisé le poids réel, sans évaluer d’ajustement pour les patients obèses ou présentant de l’ascite. Depuis lors, notamment à cause de l’augmentation de la prévalence de l’obésité avec les années, de nombreux auteurs se sont prononcés sur le meilleur choix de poids à intégrer dans la formule (poids réel, poids idéal, poids ajusté), sans que se dégage de consensus6,7,13,14. Par ailleurs, la formule estime la ClCr, donc surestime systématiquement le DFG, tel que nous l’avons expliqué plus haut. Enfin, la formule CG n’a pas été revalidée pour tenir compte de la standardisation de la créatinine, puisque la méthode d’analyse originale et les échantillons ne sont plus disponibles5,7.
Puisque la plupart des analyses non standardisées donnaient un résultat de créatinine supérieur à celui obtenu après la standardisation, on s’attend à ce que l’estimation de la fonction rénale à l’aide de la formule CG donne une valeur plus élevée en utilisant une créatinine standardisée6–8,11,13. Le groupe de recherche Chronic Kidney Disease Epidemiology Collaboration a étudié l’effet de l’utilisation de la créatinine standardisée dans la formule CG : la formule CG avec la créatinine non standardisée donnait des résultats supérieurs de 2 % par rapport à la mesure obtenue du DFG, mais la formule CG avec la créatinine standardisée donnait des résultats supérieurs de 11,4 % par rapport à la mesure obtenue du DFG (pourcentage de différence médian : respectivement −2,0 %; intervalle de confiance à 95 % [IC 95 %] −2,9 à −1,1; et −11,4 %; IC 95 % −12,4 à −11,7)11,15. Sur le plan de la précision, le pourcentage des estimations de la fonction rénale qui étaient à moins de 30 % de différence de la mesure obtenue du DFG passait de 74 % (IC 95 % 74–75) à 69 % (IC 95 % 69–70) après l’utilisation de la créatinine standardisée4,11. La performance de la formule CG diminue donc lorsqu’elle est utilisée avec la créatinine standardisée.
La formule Modification of Diet in Renal Disease (MDRD) a été développée en 1999 par Levey et coll. dans le cadre de l’étude Modification of Diet in Renal Disease16. Cette étude regroupait 1628 patients (1070 pour le développement et 558 pour la validation) atteints d’IRC. Ils étaient âgés entre 18 et 70 ans, de sexe masculin à 60 % et surtout caucasiens (88 %, 12 % restant étaient de race noire). Plusieurs variables ont été prises en considération lors de l’élaboration de la formule, et seulement celles avec une corrélation significative ont été retenues : créatinine sérique, âge, sexe, ethnie ainsi que l’urée et l’albumine sériques. Notons que le poids n’est pas retenu comme une variable significative, ce qui est d’ailleurs le cas de toutes les formules développées subséquemment. L’estimation de la fonction rénale obtenue grâce à la formule MDRD est indexée en fonction d’une surface corporelle (SC) de 1,73 m2. Dans cette étude, la formule MDRD estimait plus précisément le DFG mesuré par la clairance du 125I-iothalamate que la collecte urinaire de 24 h et la formule CG (respectivement R2 = 90,3 % vs 86,6 % vs 84,2 %, où R2 représente le coefficient de détermination, soit le pourcentage de la variation totale qui peut être expliqué par la régression linéaire). Par contre, cette formule sous-estime les DFG supérieurs à 60 mL/min/1,73 m2, et son utilisation nécessite un calculateur7,8,13,14. En 2000, les auteurs ont publié une version simplifiée de la formule, avec seulement quatre variables, puis une version revalidée en 2005 pour permettre son utilisation avec une créatinine sérique standardisée par IDMS17,18.
La formule MDRD présente plusieurs avantages : elle évalue directement le DFG plutôt que la ClCr (elle fait donc abstraction de la sécrétion tubulaire de la créatinine), elle est indépendante du poids, le protocole de recherche lors de son développement était plus rigoureux, et elle a été réexprimée pour tenir compte de la standardisation de la créatinine. De plus, la population à l’étude était plus grande et plus variée que celle de CG, bien que certains sous-groupes étaient sous-représentés ou absents (ex. : patients sans IRC, ethnies autres que caucasienne, femmes enceintes, greffés rénaux, etc.).
Pour tenter de pallier les imprécisions des deux formules précédentes ainsi que pour améliorer la précision de l’évaluation des DFG supérieurs à 60 mL/min/1,73 m2, le groupe Chronic Kidney Disease Epidemiology Collaboration, encore une fois placé sous la direction de Levey et coll, a développé une nouvelle formule, publiée en 200919. Cette formule a été élaborée selon les données de 8254 patients puis validée auprès de 3896 autres patients (total 12 150 patients). L’étude comprenait 56 % d’hommes et 71 % de Caucasiens (les autres étaient de race noire, hispanique et asiatique). Elle comprenait des patients sans IRC (DFG de 2 à 190 mL/min/1,73 m2). Tout comme la formule MDRD, la formule CKD-EPI estime le DFG : en effet, le comparateur dans l’étude était le DFG mesuré à l’aide de radio-isotopes. La formule est déjà exprimée pour des valeurs de créatinine standardisées et indexée pour une SC de 1,73 m2. Notons que la surface corporelle moyenne des patients participant à l’étude était de 1,93 m2, donc supérieure à la valeur usuelle de référence de 1,73 m2, ce qui reflète l’augmentation de la population en excès de poids avec les années. Dans l’étude, la formule CKD-EPI s’est montrée aussi précise que la formule MDRD pour estimer les valeurs de DFG inférieures à 60 mL/ min/1,73 m2 et substantiellement plus précise pour estimer les valeurs supérieures à 60 mL/min/1,73 m2 (88,3 % des estimations à moins de 30 % de différence du DFG mesuré pour CKD-EPI par rapport à 84,7 % pour MDRD, p < 0,001)19. Cette amélioration reflète l’utilisation de coefficients différents qui tiennent compte de la corrélation plus faible entre la créatinine sérique et le DFG lorsque la créatinine sérique est faible. Par ailleurs, la formule CDK-EPI permet une meilleure classification des patients qui sont à faible risque d’IRC et de mortalité dans les stades moins avancés d’insuffisance rénale20. Donc, en pratique, la formule MDRD a cédé la place à la formule CKD-EPI.
Les trois formules discutées ci-dessus sont présentées dans le tableau I.
Tableau I Formules d’estimation de la fonction rénalea12,18,19
L’utilisation de la cystatine C comme marqueur pour l’évaluation de la fonction rénale est de plus en plus discutée dans la littérature scientifique. Cette protéine est continuellement produite par les cellules nucléées et est filtrée librement par le glomérule, puis elle est réabsorbée par le tubule proximal, où elle se dégrade9,21,22.
Sa concentration plasmatique dépend de la fonction rénale et est inversement proportionnelle au DFG21,23. C’est également un marqueur très sensible, qui augmente même lorsque la fonction rénale ne diminue que légèrement21,22. L’intérêt de cette protéine se trouve aussi dans son indépendance face au genre, à l’âge et à la masse musculaire (du moins dans une plus grande mesure que la créatinine)21,22,24,25. Des études récentes ont démontré que ce marqueur ne serait pas influencé par les différences ethniques et géographiques, mais des données supplémentaires sont nécessaires avant de pouvoir l’appliquer à toutes les populations26.
Malgré tout, la prudence est de mise lors de l’interprétation des valeurs de cystatine C, car celle-ci peut être influencée par divers facteurs. En effet, sa production augmente ou semble augmenter, entre autres, lors de maladie rénale, d’hyperthyroïdie, d’inflammation, de diabète, d’obésité, d’athérosclérose et en présence de corticostéroïdes, tandis que sa production diminue, notamment lors d’hypothyroïdie, de cancer, de désordres inflammatoires neurologiques (la sclérose en plaques et la maladie d’Alzheimer) et en présence de cyclosporine21,22,27.
L’ajout de la cystatine C à la créatinine comme variable dans la formule CKD-EPI en a amélioré l’efficacité, surtout en matière de précision de l’estimation du DFG24,26,28. Les lignes directrices KDIGO 2012 recommandent l’utilisation de cette formule combinée dans deux situations : lorsque l’estimation du DFG basée sur la créatinine seule n’est pas suffisamment précise pour les besoins du clinicien et pour confirmer l’IRC des adultes dont l’estimation du DFG avec la créatinine seule se situe entre 45 et 59 mL/min/1,73 m2, sans marqueur de dommage rénal5,24. En somme, des études supplémentaires sont nécessaires avant l’élargissement de l’utilisation de la cystatine C pour l’estimation de la fonction rénale.
Il est possible de doser la cystatine C dans certains laboratoires du Québec. À l’heure actuelle, ce marqueur est surtout utilisé dans le contexte d’études cliniques.
Les organismes réglementaires fournissent des recommandations aux compagnies pharmaceutiques concernant la méthodologie à adopter pour la tenue d’études pharmacocinétiques chez les patients atteints d’insuffisance rénale afin de déterminer les ajustements posologiques optimaux. Santé Canada n’a pas publié un tel guide, mais se réfère plutôt au guide de son homologue américain, la Food and Drug Administration (FDA)29. Celle-ci recommande aux compagnies pharmaceutiques d’utiliser la fonction rénale estimée par la formule CG dans les études pharmacocinétiques pour les patients atteints d’insuffisance rénale30. Cette recommandation suscite d’ailleurs de vives réticences des professionnels de la santé à utiliser une autre formule pour ajuster les médicaments. Cependant, ce guide de la FDA date de 1998, soit avant la publication des études et la diffusion des formules MDRD et CKD-EPI4,7,30,31. La FDA en a fait une révision en 2010, où elle recommande aux compagnies pharmaceutiques de fournir un tableau d’ajustement posologique selon une estimation de la ClCr ET du DFG. Cette nouvelle version est malheureusement encore à l’état d’ébauche32. Néanmoins, les compagnies pharmaceutiques ont commencé à s’y conformer et, à l’heure actuelle, Santé Canada accepte les soumissions qui utilisent les deux méthodes d’estimation29. Notons d’ailleurs quelques exemples de molécules commercialisées durant les dernières années, dont la monographie canadienne décrit la pharmacocinétique en insuffisance rénale en termes de DFG rapporté en mL/min/1,73 m2 : sacubitril/valsartan (EntrestoMD), empagliflozine (JardianceMD) ou lédipasvir/ sofosbuvir (HarvoniMD)33–35. Quant à l’European Medicines Agency (EMA), elle recommande dans ses lignes directrices en vigueur depuis juillet 2016 et destinées aux compagnies pharmaceutiques de mesurer la fonction rénale à l’aide d’un marqueur exogène. Pour les médicaments principalement éliminés par voie hépatique ou dont le suivi des concentrations sériques est possible, l’EMA trouve raisonnable d’utiliser une estimation du DFG lors des études pharmacocinétiques. Elle ne recommande pas de formule particulière, mais elle insiste pour que, dans les études puis dans la monographie, la fonction rénale soit exprimée en mL/min, donc corrigée en fonction de la SC réelle des patients participant à l’étude et qu’une méthode standardisée d’analyse de la créatinine soit utilisée2.
Il faut mettre en perspective le fait que les tableaux d’ajustement posologique sont générés au moyen de modèles mathématiques qui extrapolent les paramètres pharmacocinétiques d’un petit nombre de patients (souvent six à huit par stade d’insuffisance rénale) ayant reçu une dose unique ou suffisamment de doses pour atteindre l’état d’équilibre2,30,32. Il n’y a donc généralement pas d’études cliniques portant sur l’efficacité et la sécurité derrière ces recommandations.
Par ailleurs, les études pharmacocinétiques portant sur la majorité des médicaments disponibles (et donc les monographies mentionnant des ajustements posologiques recommandés pour les patients atteints d’IRC) ont été effectuées avant la standardisation des dosages de créatinine. Ainsi, les modèles développés dépendaient de la méthode d’analyse spécifique utilisée dans chaque étude. Étant donné la variabilité des résultats des mesures de la créatinine entre les laboratoires avant la standardisation (tel que nous l’avons expliquée précédemment), l’application des tableaux d’ajustement posologique en clinique est inconsistante4,7. De même, l’application de ces tableaux de nos jours, avec une estimation de la fonction rénale basée sur une créatinine standardisée, pourrait entraîner un ajustement posologique différent de celui mentionné dans l’étude originale6. Néanmoins, la reprise de toutes les études pharmacocinétiques sur la base des valeurs standardisées de créatinine serait une tâche colossale.
Les formules MDRD et CKD-EPI donnent des résultats en mL/min/1,73 m2, c’est-à-dire des résultats normalisés selon la SC moyenne des jeunes adultes. Il est reconnu que la fonction rénale est proportionnelle à la taille des reins, qui elle-même est proportionnelle à la SC. Ce mode d’expression permet de comparer plus facilement la fonction rénale d’un patient à celle de l’ensemble de la population dans un but de diagnostic et de suivi5,7,13,36. Cependant, les médicaments sont éliminés du corps proportionnellement à la fonction rénale brute en mL/min : on préconise donc d’utiliser cette valeur pour l’ajustement posologique des médicaments4,5,7,13,36,37. En effet, l’utilisation d’une fonction rénale normalisée pour ajuster la médication entraînerait un sous-dosage pour les patients obèses et un surdosage pour les patients maigres13,14,37. Des données récentes ont démontré que la désindexation du résultat pour la surface corporelle réelle du patient donnerait une valeur se rapprochant davantage du résultat mesuré à l’aide d’un marqueur nucléaire37–39. Il est possible de corriger les résultats des formules MDRD ou CKD-EPI en fonction de la SC réelle du patient à l’aide d’une simple « règle de trois » (voir tableau IIa). Pour ce faire, il est préférable de calculer la SC avec la formule de Dubois et Dubois, puisque c’est celle qui a été utilisée dans les études MDRD et CKD-EPI13,16. Notons que cette désindexation repose sur des arguments théoriques, mais n’est validée par aucune étude14,40.
Tableau II Outils d’ajustement pour les patients en excès de poids38
Plusieurs auteurs ont comparé les différentes formules dans un but d’ajustement posologique, incluant dans un volume antérieur de cette publication15,41–49. Les études choisies sont résumées dans le tableau III. En général, ces auteurs observaient le choix d’une dose plus élevée lorsque l’ajustement était fondé sur les formules MDRD ou CKD-EPI par rapport à la formule CG. Toutefois, l’ampleur des différences varie d’une étude à l’autre en raison des différences de méthodologie. Ceci est surprenant puisque, tel que nous l’avons mentionné plus haut, la ClCr devrait surestimer le DFG en raison de la contribution de la sécrétion tubulaire, dont l’importance est supérieure à l’écart introduit par le changement de méthode d’analyse de la créatinine. Les résultats discordants peuvent être dus à divers éléments, par exemple à l’utilisation d’une créatinine standardisée ou non, au choix du poids (réel, idéal, ajusté) dans la formule CG, à la correction ou non des résultats des formules MDRD et CKD-EPI en fonction de la SC réelle ou au degré d’insuffisance rénale de la population étudiée8,15,31. Nous présenterons l’étude de Stevens et coll., une des plus importantes et la plus souvent citée dans les recommandations d’experts15. Cette étude, qui comptait 5504 patients, a comparé dans un premier temps la fonction rénale estimée selon les formules MDRD et CG, calculée selon le poids réel (CGPR) ou le poids idéal (CGPI), avec la fonction rénale mesurée par radio-isotope. Il faut noter que la formule MDRD utilisée était la version de 2005 à quatre variables, réexprimée pour l’utilisation d’une créatinine standardisée, et que le résultat était désindexé en mL/min. De plus, lorsque l’évaluation se faisait selon la formule CGPI, si le poids réel était inférieur au poids idéal, les chercheurs se basaient sur le poids réel. Au contraire, si le poids réel était supérieur au poids idéal de plus de 30 %, les auteurs se basaient sur le poids ajusté (pour le calculer, voir tableau IIb). Dans un deuxième temps, l’étude a analysé les différences dans les recommandations hypothétiques d’ajustement posologique de 15 médicaments couramment utilisés et éliminés par voie rénale. Comparativement à la mesure obtenue du DFG, le taux de concordance dans le choix de l’ajustement posologique était de 88 % pour MDRD, de 85 % pour CGPR et de 82 % pour CGPI (p < 0,001 pour tous les résultats). En ce qui concerne la concordance des formules entraînaient le même ajustement entre elles, MDRD et CGPR posologique dans 89 % des cas et MDRD et CGPI, dans 88 % des cas (p < 0,05). La concordance était inférieure lorsque les médicaments avaient de nombreux paliers d’ajustement. Elle allait de 90 % pour les médicaments à deux paliers à 81 % pour ceux à cinq paliers. Les effets cliniques n’étaient malheureusement pas évalués, comme c’est d’ailleurs le cas des autres études similaires14,31. Sans corrélation avec des critères d’efficacité et de sécurité, il est difficile d’évaluer si les discordances notées sont cliniquement significatives.
Tableau III Sélection d’études comparatives des formules d’estimation de la fonction rénale dans un but d’ajustement posologique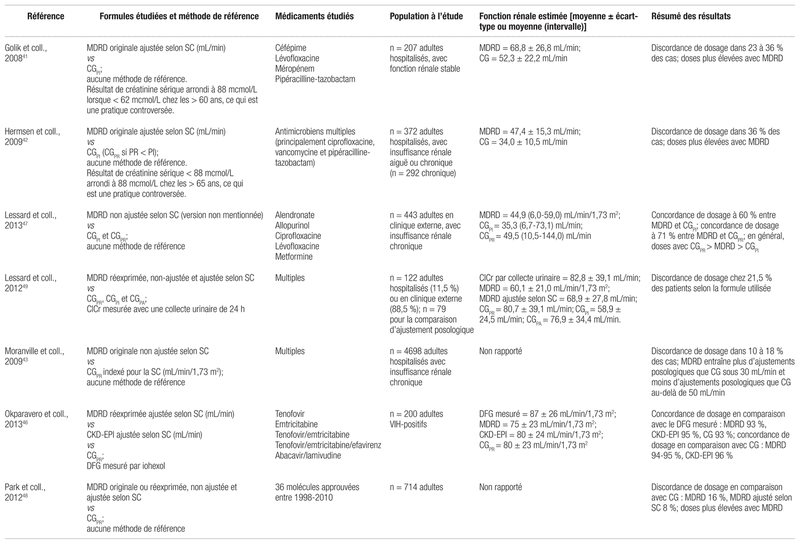
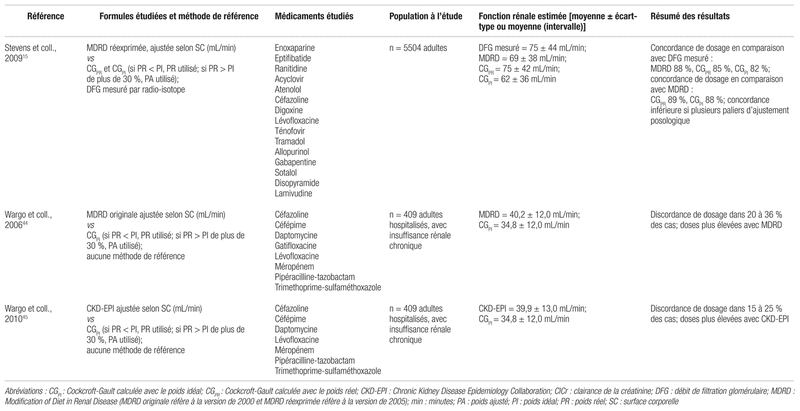
Il est vrai qu’il est essentiel d’obtenir une estimation de la fonction rénale qui soit aussi proche que possible de la fonction rénale réelle du patient pour l’ajustement posologique afin d’éviter soit une surdose et une toxicité, soit un échec thérapeutique15. Néanmoins, puisque les recommandations sont divisées en paliers (ex. : < 15 mL/min, 15 à 30 mL/min, 30 à 60 mL/min, > 60 mL/min), une valeur exacte est rarement nécessaire, et les formules disponibles sont probablement assez précises dans la plupart des cas5. Il n’existe malheureusement aucune formule qui soit parfaite dans toutes les situations, et l’évaluation clinique du patient et du choix de traitement demeure de mise, surtout pour les médicaments à index thérapeutique étroit et pour les populations à risque, telles que les personnes âgées5,6,8,15,31. De surcroît, il ne faut pas négliger le suivi de l’efficacité clinique et des dosages sériques, lorsqu’ils sont disponibles, qui fait partie intégrante du processus6,8,13,15,31.
Nous présenterons les positions de l’organisation internationale KDIGO, du programme américain NKDEP sous l’égide des National Institutes of Health (NIH) ainsi que la position conjointe de l’Association des médecins biochimistes du Québec et de la Société québécoise de néphrologie (AMBQ-SQN)5–7,36.
Les experts s’entendent pour dire que la formule CKD-EPI est actuellement la meilleure qui soit disponible pour estimer la fonction rénale dans le but de diagnostiquer, de classifier et de suivre la progression de la maladie rénale5–7. C’est d’ailleurs cette formule qu’ils recommandent d’utiliser dans les rapports de laboratoire lors de la mesure d’une créatinine sérique5,36. Concernant l’ajustement posologique, le KDIGO recommande d’utiliser pour chaque patient la méthode d’évaluation de la fonction rénale la plus précise, soit estimée à l’aide d’une formule, soit mesurée par la clairance urinaire de la créatinine ou par un marqueur exogène6. Bien qu’il mentionne qu’il n’existe aucune donnée probante démontrant la supériorité d’une formule par rapport aux autres dans tous les cas d’ajustement posologique, le KDIGO indique que la formule CKD-EPI est la plus précise6. Il recommande également de tenir compte de la SC du patient. Quant au NKDEP et au groupe de travail AMBQ-SQN, ils recommandent d’utiliser les formules CG ou CKD-EPI corrigée en fonction de la SC réelle pour l’ajustement posologique des médicaments. Ils conseillent de mesurer le DFG (par collecte urinaire ou radio-isotope) si les résultats d’estimation par les formules CG et CKD-EPI sont très différents, s’il y a prescription d’un médicament à index thérapeutique étroit ou pour les patients pour lesquels on ne peut obtenir une estimation adéquate basée sur la créatinine (ex. : masse musculaire extrême, diète faible ou riche en viande, etc.)7,36.
Ces recommandations sont partagées par le Nephrology Practice and Research Network de l’American College of Clinical Pharmacy, qui les résume dans un algorithme pertinent, reproduit et adapté à la figure 18.
|
|
||
|
Figure 1 Algorithme décisionnel pour l’utilisation des formules d’estimation de la fonction rénale dans un but d’ajustement posologique |
||
Dans la littérature scientifique, il n’existe pas de consensus sur la meilleure formule d’estimation de la fonction rénale des patients âgés. Tous les auteurs reconnaissent que la créatinine est un marqueur imprécis en raison de sa grande dépendance à la masse musculaire, souvent faible dans cette population40.
Il faut savoir d’emblée qu’aucune des équations présentées jusqu’à maintenant dans cet article n’a été spécifiquement développée pour les personnes âgées, car cette population était minoritaire dans les études de développement et de validation des formules12,14,16,19. Néanmoins, des recherches ont démontré que la formule CKD-EPI était aussi performante pour les patients âgés que pour les patients plus jeunes50. Malgré cela, plusieurs cliniciens continuent d’utiliser la formule CG dans leur pratique quotidienne. Leur raisonnement est le suivant : même si cette formule sous-estime le résultat pour les patients âgés, elle permet une plus grande prudence dans l’ajustement des doses administrées à cette population souvent plus vulnérable aux effets secondaires et toxiques de leurs traitements médicamenteux14,25,51. Il ne faut pas oublier qu’à l’instar des études faites chez les patients plus jeunes, les études comparant les formules pour les personnes âgées ont seulement démontré des différences de proposition d’ajustement des doses de différents médicaments, sans mesure directe validant l’efficacité et la sécurité de ces produits dans un contexte contrôlé14. Le jugement clinique reste donc de mise dans l’utilisation de l’une ou l’autre des formules, surtout pour des patients qui pourraient bénéficier de thérapies plus vigoureuses14. Lors de l’analyse de la prescription, il faut évaluer, entre autres, les antécédents du patient, sa condition actuelle, les risques associés au surdosage du médicament administré et les autres options thérapeutiques possibles (on pourrait préférer les traitements pouvant être dosés au niveau sérique, compte tenu du suivi possible)14. La figure 1 décrit un exemple de marche à suivre.
Certains cliniciens ont également le réflexe de gonfler systématiquement les valeurs de créatinine de leurs patients âgés pour les faire équivaloir à leur âge (créatinine = âge) ou à la valeur arbitraire de 88 mcmol/L. Les experts ne recommandent pas cette pratique, car cela entrainerait une diminution significative du résultat de la formule utilisée et ainsi un sous-dosage possible des médicaments pour ces patients8,39,51.
Finalement, des chercheurs allemands ont développé deux nouvelles formules d’estimation de la fonction rénale pour les patients âgés caucasiens dans la Berlin Initiative Study 1 (BIS1, en utilisant seulement la créatinine standardisée) et dans la BIS2 (en utilisant à la fois la créatinine et la cystatine C). L’évaluation de ces formules a démontré une précision très élevée par rapport au DFG mesuré avec un marqueur exogène52. Par contre, en la comparant à la formule CKD-EPI, d’autres auteurs ont déterminé que leur efficacité respective est similaire, et donc que ces nouvelles formules semblent présenter peu d’intérêt26. D’autres auteurs ont étudié l’utilisation combinée de la cystatine C et de la créatinine dans la formule CKD-EPI, qui donnerait aussi des résultats plus précis pour l’estimation de la fonction rénale des personnes âgées par rapport aux formules utilisant un seul de ces marqueurs25. L’utilisation d’équations avec la cystatine C seule pour des patients âgés pourrait être envisageable, mais elle doit être étudiée plus longuement avant d’être recommandée24,40.
La formule d’estimation de la fonction rénale la mieux adaptée aux patients obèses est également un sujet controversé dans la littérature scientifique. Les études qui ont permis l’élaboration des trois formules présentées comprenaient peu de patients obèses. Néanmoins, la formule CG est la plus étudiée pour cette population, probablement puisque c’est la seule dont le poids fasse partie des variables14. Lorsqu’elle est utilisée avec le poids réel, elle surestime la fonction rénale des patients en excès de poids ou obèses22,25,38,53. En effet, la masse musculaire, et donc la production de créatinine, n’augmente pas proportionnellement au poids réel38. Cette formule a parfois recours au poids ajusté, mais cette pratique a seulement été validée pour les aminoglycosides8,31. Le poids maigre (lean body weight) serait probablement le meilleur choix, puisque c’est celui qui corrèle le mieux avec la masse musculaire et donc avec la créatinine sérique (pour le calculer, voir tableau IIc)8,31,38,48,54.
Encore une fois, il n’y a pas une réponse universelle à cette controverse. Une étude ayant analysé la performance de la formule CG pour les patients obèses a montré une concordance optimale avec la ClCr mesurée lorsque le poids utilisé dans le calcul suivait l’algorithme suivant : poids réel des patients normaux ou en léger excès de poids (indice de masse corporelle [IMC] < 30 kg/m2), poids ajusté des patients obèses (IMC 30 à 40 kg/m2) et poids maigre des patients obèses morbides (IMC > 40 kg/m2)48. Évidemment, ceci serait complexe à appliquer en pratique.
La formule CKD-EPI, quant à elle, n’est pas influencée directement par le poids, celui-ci ne faisant pas partie des variables de l’équation (non significatif à l’intérieur de la plage de poids présente dans l’étude de validation)55. Par contre, tel que nous l’avons mentionné plus haut, pour les patients obèses, et dans une plus forte mesure si l’IMC est plus élevé, la formule CKD-EPI en mL/min/1,73 m2 sous-estime la fonction rénale brute37. Malgré tout, elle serait quand même une formule appropriée pour cette population, à condition de la corriger en fonction de la SC réelle du patient, tel que nous l’avons discuté précédemment53.
Finalement, pour certains médicaments, les recommandations d’ajustement posologique mentionnent l’utilisation d’un poids spécifique, par exemple le poids réel pour la daptomycine et le poids idéal pour le ténofovir. Le clinicien doit donc être vigilant lors de ses recherches8,31.
À la lumière de la revue de la littérature scientifique présentée ici, il appert que la formule CKD-EPI est celle qui, à l’heure actuelle, estime la fonction rénale de la façon la plus précise possible. Néanmoins, la communauté pharmaceutique conserve un attachement pour la formule CG, malgré ses nombreuses limites, notamment l’affaiblissement de sa performance lorsqu’elle est utilisée avec une créatinine standardisée. Cet attachement est en grande partie dû au fait que les ajustements posologiques, pour les monographies existantes, sont en général proposés à la suite d’une évaluation de la fonction rénale par la formule Cockcroft-Gault14. À notre avis, cet argument seul ne fait pas le poids. Par exemple, en pratique, si, pour l’ajustement posologique d’un médicament pour un patient donné, nous avons accès à une mesure exacte de sa fonction rénale par radio-isotope, devons-nous tout de même estimer sa fonction rénale par CG, simplement pour nous conformer à la monographie? À notre connaissance, aucune référence ne contre-indique de procéder à l’ajustement posologique avec la mesure exacte ou l’estimation la plus précise de la fonction rénale, peu importe la méthode utilisée dans l’étude pharmacocinétique initiale. Cet avis est partagé par Santé Canada29.
Grâce au taux de concordance élevé (généralement dans les 80 %, voir tableau III) entre CG et MDRD/CKD-EPI corrigées en fonction de la SC réelle du patient, plusieurs experts (NKDEP, AMBQ-SQN), mais pas tous (KDIGO), jugent la formule CG encore acceptable pour l’ajustement posologique5–7,36. Toutefois, les cas discordants qui font hésiter les cliniciens entre les formules sont généralement les patients présentant une condition qui altère la production de créatinine (ex. : dénutrition, masse musculaire extrême, etc.). Dans ces cas, si la mesure du DFG par radio-isotope n’est pas disponible, une approche comparative, telle que celle présentée à la figure 1, nous semble adéquate.
Dans le futur, il est probable que les compagnies pharmaceutiques délaissent la formule CG au profit de la formule CKD-EPI ou encore, idéalement, d’une mesure exacte de la fonction rénale dans l’élaboration des études pharmacocinétiques et des modélisations mathématiques à l’origine des recommandations d’ajustements posologiques. L’EMA fait d’ailleurs office de figure de proue à ce sujet dans ses lignes directrices2.
Il est donc important que les pharmaciens se familiarisent avec la formule CKD-EPI et qu’ils comprennent les limites de la formule CG. Il sera également intéressant de suivre les développements concernant l’utilisation de la cystatine C.
De façon générale, aucune formule ne devrait être appliquée aveuglément : nous devons reconnaître les limites de l’utilisation de la créatinine comme marqueur de la fonction rénale et les situations où une mesure exacte est bénéfique ou nécessaire, individualiser notre analyse selon chaque patient lors de discordances entre les formules pour prendre une décision prudente ou vigoureuse, et effectuer le suivi de nos recommandations sur le plan de l’efficacité, de la toxicité et des dosages sériques, lorsque ces données sont disponibles.
Aucun financement en relation avec le présent article n’a été déclaré par les auteures.
Toutes les auteures ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteures n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. La Fondation canadienne du rein, 2015. Face aux faits : incluant les points saillants du Registre canadien des insuffisances et des transplantations d’organes. [en ligne] http://www.rein.ca/document.doc?id=7555 (site visité le 29 octobre 2015).
2. European Medicines Agency, Science Medicines Health; Committee for Medicinal Products for Human use (CHMP), 1er juillet 2016. Guideline on the evaluation of the pharmacokinetics of medicinal products in patients with decreased renal function. [en ligne] http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2016/02/WC500200841.pdf (site visité le 11 août 2016).
3. MacGregor MS, Methven S. Assessing Kidney Function. Dans : Daugirgas JT, éditeur. Handbook of chronic kidney disease management. Philadelphie: Lippincott Williams & Wilkins, Wolters Kluwer Health; 2011. p. 1–18.
4. National Kidney Foundation, Inc, 2014. Frequently asked questions about GFR estimates. [en ligne] https://www.kidney.org/sites/default/files/docs/12-10-4004_abe_faqs_aboutgfrrev1b_singleb.pdf (site visité le 24 novembre 2015).
5. Kidney Disease : Improving Global Outcomes (KDIGO) CKD Work Group. KDIGO 2012 clinical practice guideline for the evaluation and management of chronic kidney disease. Kidney Int Suppl 2013;3:1–150.
6. Matzke GR, Aronoff GR, Atkinson Jr AJ, Bennett WM, Decker BS, Eckardt K-U et coll. Drug dosing consideration in patients with acute and chronic kidney disease – a clinical update from Kidney Disease: Improving Global Outcomes (KDIGO). Kidney Int 2011;80:1122–37.

7. National Institute of Diabetes and Digestive and Kidney Diseases, National Kidney Disease Education Program, révisé en avril 2015. CKD and drug dosing : information for providers. [en ligne] http://www.niddk.nih.gov/health-information/health-communication-programs/nkdep/a-z/ckd-drug-dosing/Documents/ckd-drug-dosing-508.pdf (site visité le 16 septembre 2015).
8. Nyman HA, Dowling TC, Hudson JQ, St. Peter WL, Joy MS, Nolin TD. Comparative evaluation of the Cockcroft-Gault equation and the Modification of Diet in Renal Disease (MDRD) study equation for drug dosing: an opinion of the Nephrology Practice and Research Network of the American College of Clinical Pharmacy. Pharmacotherapy 2011;31:1130–44.

9. Berns JS. Clinical decision making in a patient with stage 5 CKD – Is eGFR good enough? Clin J Am Soc Nephrol 2015;10:2065–72.


10. Roland M, Guiard E, Karras A, Jacquot C. Pour la clairance de la créatinine doit-elle céder la place aux formules d’estimation du débit de filtration glomérulaire? RFL 2011;429(suppl 1):28–31.
11. Stevens LA, Manzi J, Levey AS, Chen J, Deysher AE, Greene T et coll. Impact of creatinine calibration on performance of GFR estimating equations in a pooled individual patient database. Am J Kidney Dis 2007;50:21–35.

12. Cockcroft DW, Gault MH. Prediction of creatinine clearance from serum creatinine. Nephron 1976;16:31–41.

13. Jones GRD. Estimating renal function for drug dosing decisions. Clin Biochem Rev 2011;32:81–8.

14. Delanaye P, Flamant M, Cavalier E, Guerber F, Vallotton T, Moranne O et coll. Adaptation posologique des médicaments et fonction rénale : quel(s) estimateur(s) faut-il choisir? Nephrol Ther 2016;12:18–31.
15. Stevens LA, Nolin TD, Richardson MM, Feldman HI, Lewis JB, Rodby R et coll, on behalf of the Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI). Comparison of drug dosing recommendations based on measured GFR and kidney function estimating equations. Am J Kidney Dis 2009;54:33–42.


16. Levey AS, Bosch JP, Breyer Lewis J, Greene T, Rogers N, Roth D, for the Modification of Diet in Renal Disease Study Group. A more accurate method to estimate glomerular filtration rate from serum creatinine : a new prediction equation. Ann Intern Med 1999;130:461–70.

17. Levey AS, Greene T, Kusek J, Beck G. A simplified equation to predict glomerular filtration rate from serum creatinine. J Am Soc Nephrol 2000;11:155A. Abstract.
18. Levey AS, Coresh J, Greene T et coll. Expressing the MDRD study equation for estimating GFR with IDMS traceable (gold standard) serum creatinine values. J Am Soc Nephrol 2005;16:69A. Abstract.
19. Levey AS, Stevens LA, Schmid CH, Zhang Y, Castro III AF, Feldman HI et coll, for the CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration). A new equation to estimate glomerular filtration rate. Ann Intern Med 2009;150:604–12.


20. Stevens LA, Li S, Kurella Tamura M, Chen SC, Vassalotti JA, Norris KC et coll. Comparison of the CKD Epidemiology Collaboration (CKD-EPI) and Modification of Diet in Renal Disease (MDRD) study equations: risk factors for and complications of CKD and mortality in the Kidney Early Evaluation Program (KEEP). Am J Kidney Dis 2011;57(suppl 2):S9–16.


21. Onopiuk A, Tokarzewicz A, Gorodkiewicz E. Cystatin C : a kidney function biomarker. Adv Clin Chem 2015;68:57–69.
22. Maillard N, Delanaye P, Mariat C. Exploration de la fonction glomérulaire rénale : estimation du débit de filtration glomérulaire. Nephrol Ther 2015;11:54–67.

23. Lamb EJ, Stevens PE. Estimating and measuring glomerular filtration rate: methods of measurement and markers for estimation. Curr Opin Nephrol Hypertens 2014;23:258–66.

24. Delanaye P, Mariat C. The applicability of eGFR equations to different populations. Nat Rev Nephrol 2013;9:513–22.

25. Garasto S, Fusco S, Corica F, Rosignuolo M, Marino A, Montesanto A et coll. Estimating glomerular filtration rate in older people. Biomed Res Int 2014;2014:916542.


26. Fan L, Levey AS, Gudnason V, Eiriksdottir G, Andresdottir MB, Gudmundsdottir H et coll. Comparing GFR estimating equations using cystatin C and creatinine in elderly individuals. J Am Soc Nephrol 2015;26:1982–9.

27. Rule AD, Glassock RJ. GFR estimating equations: getting closer to the truth? Clin J Am Soc Nephrol 2013;8:1414–20.


28. Levey AS, Inker LA, Coresh J. GFR estimation: from physiology to public health. Am J Kidney Dis 2014;63:820–34.


29. Agente d’évaluation, Direction des produits thérapeutiques, Division cardio-rénale, Santé Canada, communication personnelle, 14 septembre 2016.
30. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER) and Center for Biologic Evaluation and Research (CBER), mai 1998. Guidance for industry: pharmacokinetics in patients with impaired renal function – study design, data analysis, and impact on dosing and labeling. [en ligne] http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm072127.pdf (site visité le 24 novembre 2015).
31. Hudson JQ, Nyman HA. Use of estimated glomerular filtration rate for drug dosing in the chronic kidney disease patient. Curr Opin Nephrol Hypertens 2011;20:482–91.

32. U.S. Department of Health and Human Services, Food and Drug Administration, Center for Drug Evaluation and Research (CDER), mars 2010. Guidance for industry: pharmacokinetics in patients with impaired renal function – study design, data analysis, and impact on dosing and labeling : draft guidance. Clinical pharmacology; revision 1. [en ligne] http://www.fda.gov/downloads/Drugs/.../Guidances/UCM204959.pdf (site visité le 24 novembre 2015).
33. Novartis Pharma Canada inc. Monographie de produit : Entresto. [en ligne] http://www.ask.novartispharma.ca/download.htm?res=entresto_scrip_f.pdf&resTitleId=1137 (site visité le 14 septembre 2016).
34. Boehringer Ingelheim (Canada) Ltée. Monographie de produit : Jardiance. [en ligne] http://www.boehringer-ingelheim.ca/content/dam/internet/opu/ca_FR/documents/monographie/JardiancePMFR.pdf (site visité le 14 septembre 2016).
35. Gilead Sciences Canada, Inc. Monographie de produit : Harvoni. [en ligne] http://www.gilead.ca/pdf/ca/harvoni_pm_french.pdf (site visité le 14 septembre 2016).
36. Association des médecins biochimistes du Québec, Société québécoise de néphrologie, juin 2010. Estimation du débit de filtration glomérulaire au Québec. [en ligne] http://www.ambq.org/telechargement/Documents/Onglet%20DPC/AMBQrapport_DFGe_AMBQ_SQN_2010.pdf (site visité le 16 septembre 2015).
37. Chew-Harris JSC, Chin PKL, Florkowski CM, George P, Endre Z. Removal of body surface area normalisation improves raw-measured glomerular filtration rate estimation by the Chronic Kidney Disease Epidemiology Collaboration equation and drug dosing in the obese. Intern Med J 2015;45:766–73.

38. Pai MP. Estimating the glomerular filtration rate in obese adult patients for drug dosing. Adv Chronic Kidney Dis 2010;17:e53–e62.

39. Hudson JQ, Bean JR, Burger CF, Stephens AK, McFarland MS. Estimated glomerular filtration rate leads to higher drug dose recommendations in the elderly compared with creatinine clearance. Int J Clin Pract 2015;69:313–20.

40. Elinder C-G, Bárány P, Heimbürger O. The use of estimated glomerular filtration rate for dose adjustment of medications in the elderly. Drugs Aging 2014;31:493–9.

41. Golik MV, Lawrence KR. Comparison of dosing recommendations for antimicrobial drugs based on two methods for assessing kidney function: Cockcroft-Gault and Modification of Diet in Renal Disease. Pharmacotherapy 2008;28:1125–32.

42. Hermsen ED, Maiefsky M, Florescu MC, Qiu F, Rupp ME. Comparison of the Modification of Diet in Renal Disease and Cockcroft-Gault equations for dosing antimicrobials. Pharmacotherapy 2009;29:649–55.

43. Moranville MP, Jennings HR. Implications of using modification of diet in renal disease versus Cockcroft-Gault equations for renal dosing adjustments. Am J Health-Syst Pharm 2009;66:154–61.

44. Wargo KA, Eiland III EH, Hamm W, English TM, Philippe HM. Comparison of the Modification of Diet in Renal Disease and Cockcroft-Gault equations for antimicrobial dosage adjustments. Ann Pharmacother 2006;40:1248–53.

45. Wargo KA, English TM. Evaluation of the Chronic Kidney Disease Epidemiology Collaboration Equation for dosing antimicrobials. Ann Pharmacother 2010;44:439–46.

46. Okparavero AA, Tighiouart H, Krishnasami Z, Wyatt CM, Graham H, Hellinger J et coll. Use of glomerular filtration rate estimating equations for drug dosing in HIV-positive patients. Antivir Ther 2013;18:793–802.


47. Lessard BA, Zaiken K. Comparison of equations for dosing of medications requiring renal adjustment. J Am Pharm Assoc 2013;53:54–7.
48. Park EJ, Wu K, Mi Z, Dong T, Lawrence JP, Ko C-W et coll. A systematic comparison of Cockcroft-Gault and Modification of Diet in Renal Disease equations for classification of kidney dysfunction and dosage adjustment. Ann Pharmacother 2012;46:1174–87.

49. Lessard S, Blanchet M, Morin N, Lefebvre J. Votre expérience avec l’estimation de la fonction rénale selon différentes formules mathématiques. Pharmactuel 2012;45:43–51.
50. Kilbride HS, Stevens PE, Eaglestone G, Knight S, Carter JL, Delaney MP et coll. Accuracy of the MDRD (Modification of Diet in Renal Disease) study and CKD-EPI (CKD Epidemiology Collaboration) equations for estimation of GFR in the elderly. Am J Kidney Dis 2013;61:57–66.
51. Dowling TC, Wang E-S, Ferrucci L, Sorkin JD. Glomerular filtration rate equations overestimate creatinine clearance in older individuals enrolled in the Baltimore Longitudinal Study on Aging: Impact on renal drug dosing. Pharmacotherapy 2013;33:912–21.


52. Schaeffner ES, Ebert N, Delanaye P, Frei U, Gaedeke J, Jakob O et coll. Two novel equations to estimate kidney function in persons aged 70 years or older. Ann Intern Med 2012;157:471–81.

53. Ungar A, Iacomelli I, Giorgano A, Roberts AT, Rafanelli M, Marchionni N. Evaluation of renal function in the elderly not as easy as it seems: a review. Aging Clin Exp Res 2015;27:391–401.
54. Demirovic JA, Pai AB, Pai MP. Estimation of creatinine clearance in morbidly obese patients. Am J Health-Syst Pharm 2009;66:642–8.

55. Delanaye P, Mariat C, Moranne O, Cavalier E, Flamant M. L’estimation du débit de filtration glomérulaire en 2012 : quelle valeur ajoutée pour la nouvelle équation CKD-EPI? Nephrol Ther 2012;8:199–205.

PHARMACTUEL, Vol. 50, No. 1, 2017