Gabriel Gazzé1,2, B.Pharm., DPH, Nushin Sadeghi1,2, Pharm.D., M.Sc.
Reçu le 16 mars 2016; Accepté après révision par les pairs le 22 août 2016
Résumé
Objectif : Depuis quelques années, plusieurs nouvelles molécules ont fait preuve d’efficacité pour le traitement de la leucémie lymphoïde chronique. L’objectif de cet article est de passer en revue les études pivot évaluant ces molécules, de mentionner les profils d’innocuité de ces dernières et la prise en charge des effets secondaires associés, et de discuter de la place de ces nouvelles molécules dans le choix du traitement de la leucémie lymphoïde chronique.
Sources des données et sélection des études : Une revue de la documentation scientifique publiée entre 2009 et 2015 a permis de mettre en évidence les études de phase III évaluant la bendamustine, l’ibrutinib, l’idélalisib, l’ofatumumab et l’obinutuzumab comme traitement de la leucémie lymphoïde chronique.
Revue du sujet traité : La bendamustine, en monothérapie ou associée au rituximab, s’est avérée une option thérapeutique intéressante en première intention pour les patients âgés et présentant des comorbidités, pour lesquels l’association fludarabine-cyclophosphamide-rituximab n’est pas une option. L’obinutuzumab combiné au chlorambucil a démontré un avantage pour la survie sans progression comparativement à l’association rituximab-chlorambucil pour des patients présentant des comorbidités significatives. L’association ofatumumab-chlorambucil ne s’est pas montrée supérieure au chlorambucil seul en ce qui concerne la survie globale. L’ibrutinib était supérieur à l’ofatumumab ou au chlorambucil, et devrait être envisagé comme traitement de première intention pour les patients présentant une délétion du chromosome 17p. L’idélalisib combiné au rituximab était supérieur au rituximab seul, mais entraîne des toxicités importantes.
Conclusion : L’arrivée de ces agents novateurs offre des nouvelles options pour le traitement de la leucémie lymphoïde chronique, particulièrement pour les patients plus âgés et frêles ainsi que pour ceux présentant une délétion 17p.
Mots clés : Bendamustine, ibrutinib, idélalisib, leucémie lymphoïde chronique, obinutuzumab, ofatumumab
Abstract
Objective: In the past few years, a number of new drugs have been shown to be effective in the treatment of chronic lymphocytic leukemia. The objective of this article is to review the pivotal studies evaluating these drugs, to discuss their safety profiles and the management of their adverse effects, and to discuss the role of these new drugs in the therapeutic arsenal for chronic lymphocytic leukemia.
Data sources and study selection: A review of the literature from 2009 to 2015 was conducted to identify the phase III studies evaluating bendamustine, ibrutinib, idelalisib, ofatumumab and obinutuzumab in chronic lymphocytic leukemia.
Topic review: Bendamustine as monotherapy or in combination with rituximab has proven to be an attractive firstline treatment option in elderly patients with comorbidities in whom the combination fludarabine/cyclophosphamide/ rituximab is not an option. Obinutuzumab combined with chlorambucil has been shown to provide a benefit in terms of progression-free survival when compared with rituximab and chlorambucil in patients with significant comorbidities. Ofatumumab combined with chlorambucil has not been shown to be superior in terms of overall survival when compared with chlorambucil alone. Ibrutinib was superior to ofatumumab or chlorambucil and should be considered a first-line option in patients with a 17p deletion. Idelalisib combined with rituximab was superior to rituximab alone, but it has a significant toxicity profile.
Conclusion: The advent of these innovative drugs offers new treatment options for chronic lymphocytic leukemia, especially in older, fragile patients and in those with a 17p deletion.
Key words: Bendamustine, chronic lymphocytic leukemia, ibrutinib, idelalisib, obinutuzumab, ofatumumab
La leucémie lymphoïde chronique (LLC) est le type le plus courant de leucémie observé en Occident1. La LLC est une maladie hématologique maligne qui se manifeste par une évolution clonale de lymphocytes fonctionnellement incompétents qui s’accumulent dans la moelle osseuse, les ganglions lymphatiques, le sang, la rate, le foie et d’autres organes2. L’âge moyen au moment du diagnostic est de 72 ans. Cette maladie touche ainsi principalement des patients âgés, une population souvent sous-représentée dans les études cliniques3. La LLC est une maladie fortement hétérogène dont l’évolution clinique peut durer de quelques années à quelques décennies en fonction des facteurs de risque que peut présenter le patient2,4. La LLC reste incurable à moins d’avoir recours à une greffe allogénique, qui n’est pas une option thérapeutique pour la majorité des patients, en raison de leur âge1,5,6.
Dans la plupart des cas, les patients sont asymptomatiques et la LLC se diagnostique après une prise de sang fortuite qui met en évidence des anomalies hématologiques. Les manifestations hématologiques sont une hyperleucocytose, une lymphocytose, une anémie, une thrombopénie, une hypogammaglobulinémie et une neutropénie. Certains patients consultent parce qu’ils présentent des antécédents d’infections chroniques, des saignements, des lymphadénopathies, une hépatomégalie ou une splénomégalie et, plutôt rarement, des symptômes de type B (fièvre, perte de poids, sudations nocturnes)1,7.
Plusieurs facteurs de risque vont avoir une répercussion importante sur l’évolution de la maladie. Plus le patient est âgé, plus sa LLC est de stade avancé (p. ex. stade III ou IV selon les critères de Rai, ou stade C selon les critères de Binet) et plus son statut de performance est pauvre, plus la maladie évoluera rapidement. Des taux élevés des marqueurs de masse tumorale (lactate déshydrogénase [LDH] et β2-microglobuline) auront des répercussions négatives sur l’évolution de la LLC1. Certaines délétions chromosomiques sont des facteurs de mauvais pronostic, comme les délétions 17p – souvent associée à une inhibition du gène suppresseur TP53 – et 11q : la délétion 17p est présente au moment du diagnostic chez moins de 10 % de patients atteints d’une LLC mais demeure présente chez plus de 50 % des patients présentant une rechute de la maladie ou une maladie réfractaire au traitement. D’autres marqueurs qui peuvent avoir un effet négatif sur l’évolution de la maladie sont la surexpression du CD38, la présence de la protéine ZAP-70, la présence du gène de l’IgVH (immunoglobulin heavy chain variable) non muté et des mutations du gène Notch-11,6.
Étant donné que le patient atteint d’une LLC est généralement âgé, la présence de comorbidités représente souvent un problème important. Près de 90 % des patients qui ont une LLC présentent au moins une comorbidité au moment du diagnostic, qui s’avère grave pour près de la moitié d’entre eux. Un patient âgé de 65 ans est atteint en moyenne de trois comorbidités. Il n’y a pas de consensus sur la meilleure méthode pour mesurer ou quantifier le degré de fonctionnalité des patients atteints de LLC. Le système ECOG (Eastern Cooperative Oncology Group) est souvent utilisé dans les études en hémato-oncologie, mais il n’est pas adapté à la population âgée. Le système CIRS (Cumulative Illness Rating Scale) est de plus en plus utilisé. Un score CIRS supérieur à six indique un faible degré de fonctionnalité3,8.
De ces observations découle la notion de patient fit ou unfit. Un patient considéré fit serait le candidat idéal pour recevoir l’association fludarabine-cyclophosphamide-rituximab (FCR) : il aurait jusqu’à 65 ans et présenterait peu de comorbidités (voir aucune) ou serait âgé de plus de 65 ans sans aucune comorbidité; son score ECOG serait de 0–2 et son score CIRS serait inférieur ou égal à 6, avec une clairance de la créatinine supérieure ou égale à 70 ml/min. Un patient considéré unfit ne pourrait pas recevoir l’association FCR : un tel patient aurait plus de 65 ans et des maladies associées, un score ECOG de 3–4, un score CIRS supérieur à 6 et une clairance de la créatinine inférieure à 70 ml/min3.
Historiquement, le traitement de la LLC reposait sur l’utilisation des agents alkylants, comme le chlorambucil et le cyclophosphamide, qui avaient très peu d’effet sur l’évolution naturelle de la maladie. L’arrivée des analogues de la purine, comme la fludarabine, a permis d’obtenir une augmentation des taux de réponse, ainsi qu’une répercussion positive sur la survie sans progression, mais pas sur la survie globale9. Le rituximab a apporté des avantages en matière de survie, tel que démontré dans l’étude CLL8, avec le FCR qui s’est montré nettement supérieur au FC (fludarabine et cyclophosphamide)3. Cependant, il reste des besoins thérapeutiques non comblés : certains patients ne peuvent pas recevoir le FCR en raison de leur état de santé ou de la présence de sérieuses comorbidités et ne bénéficient donc pas d’une thérapie optimale. De plus, il est connu que les patients atteints d’une LLC et porteurs d’une délétion 17p ne répondent pas à une thérapie anti-CD20. De nouvelles modalités thérapeutiques sont nécessaires pour mieux traiter la LLC1,3,4,9,10.
Depuis quelques années, plusieurs nouvelles molécules se sont montrées efficaces pour le traitement de la LLC. L’avènement de molécules inhibitrices de la voie de signalisation en aval des récepteurs des cellules B, soit les inhibiteurs de la tyrosine kinase de Bruton (BTK), les inhibiteurs de l’isoforme δ de la phosphatidylinositol-3-kinase (PI3Kδ) et de nouvelles molécules anti-CD20 ont transformé la compréhension de la LLC et la façon de traiter cette maladie11–15.
Une revue de la documentation scientifique publiée entre 2009 et 2015 a permis de mettre en évidence les études de phase III évaluant les nouveaux agents pour le traitement de la leucémie lymphoïde chronique, à savoir la bendamustine, l’ibrutinib, l’idélalisib, l’ofatumumab et l’obinutuzumab. Les études pivot ayant amené la commercialisation de ces molécules au Canada ont surtout été retenues.
La bendamustine est une molécule qui a été synthétisée en Allemagne durant les années soixante à la recherche d’une option moins toxique que les agents alkylants de l’époque qui coûtaient très cher. La bendamustine est un agent alkylant dont la structure comprend un anneau benzimidazole purine; cet anneau confère à la bendamustine les propriétés cytotoxiques des agents alkylants et des analogues de la purine, ce qui engendre une ≪ mitose catastrophique ≫ caractéristique de la bendamustine16–19.
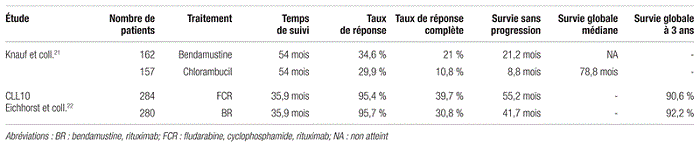
Une étude de phase III portant sur 319 patients de moins de 75 ans atteints d’une LLC de stade Binet B ou C a comparé la bendamustine au chlorambucil. Les patients étaient répartis aléatoirement de façon à recevoir de la bendamustine à raison de 100 mg/m2 en intraveineuse (IV) une fois par jour pour deux jours tous les 28 jours (162 patients) ou du chlorambucil à raison de 0,8 mg/kg par voie orale les jours 1 et 15 d’un cycle de 28 jours (157 patients). Ces traitements étaient répétés pour six cycles. Les objectifs primaires de l’étude étaient le taux de réponse globale et la survie sans progression; les objectifs secondaires étaient le délai avant la progression, la durée de la rémission et la survie globale20. Après un suivi de 54 mois, les résultats observés dans le groupe bendamustine et dans le groupe chlorambucil étaient respectivement les suivants : taux de réponse globale : 34,6 % contre 29,9 %; survie sans progression : 21,2 mois contre 8,8 mois; taux de réponse complète : 21 % contre 10,8 %. Il faut mentionner que le croisement était permis dans le cadre de cette étude. Le taux de survie globale observé avec les deux options thérapeutiques était similaire. Cependant, il a été démontré qu’une réponse objective ou complète au traitement entraînait un avantage pour la survie globale. Les patients recevant de la bendamustine présentaient également un avantage statistiquement significatif en ce qui concerne le délai avant la prochaine thérapie, soit 31,7 mois pour la bendamustine contre 10,1 mois pour le chlorambucil21.
L’étude CLL10 comparait le FCR à l’association bendamustine et rituximab (BR) pour des patients ayant reçu un diagnostic de LLC avec un score CIRS < 6, une clairance de la créatinine > 70 ml/min et ne présentant aucune anomalie chromosomique de type délétion 17p (patients considérés fit). Les patients étaient répartis aléatoirement pour recevoir soit du FCR (284 patients) tous les 28 jours pour six cycles (fludarabine : 25 mg/m2 en IV une fois par jour pour trois jours; cyclophosphamide : 250 mg/m2 en IV une fois par jour pour trois jours; rituximab : 375 mg/m2 en IV pour une dose au cycle 1 puis 500 mg/m2 aux cycles 2 et subséquents), soit du BR (280 patients) tous les 28 jours pour six cycles (bendamustine : 90 mg/m2 en IV une fois par jour pour deux jours; rituximab : 375 mg/m2 en IV pour une dose au cycle 1 et 500 mg/m2 aux cycles 2 et subséquents). L’objectif primaire de l’étude était la survie sans progression. La survie sans progression était de 55,2 mois dans le groupe FCR comparativement à 41,7 mois dans le groupe BR, une différence statistiquement significative (p < 0,001, rapport de risque [RR] = 1,626). Le taux de réponse globale était similaire entre les deux groupes, soit 95,4 % pour le groupe FCR et 95,7 % pour le groupe BR (p = 1,0). Le taux de réponse complète était plus élevé dans le groupe FCR (39,7 %) que dans le groupe BR (30,8 %) (p = 0,034). Pour l’instant, les différences de survie globale à trois ans observées entre les deux groupes ne sont pas statistiquement significatives (90,6 % pour le groupe FCR et 92,2 % pour le groupe BR; p = 0,897; tableau I)11,22. En ce qui concerne le profil de toxicités des deux schémas thérapeutiques, il y avait plus de cas de neutropénie grave dans le groupe FCR que dans le groupe BR (87,7 % contre 67,8 %; p < 0,0001) et plus de cas d’infections graves dans le bras FCR (39,8 % contre 26,8 %; p = 0,001)22.
Tableau I Résultats des études cliniques de phase III étudiant la bendamustine pour le traitement de la leucémie lymphoïde chronique
Ces études démontrent l’utilité et la pertinence de la bendamustine en monothérapie ou en association avec le rituximab pour le traitement de la LLC. Les données de l’étude CLL10 montrent qu’il serait prématuré de conclure à une supériorité thérapeutique du FCR par rapport au BR; il faudrait considérer, pour l’instant, que le BR demeure une option thérapeutique efficace avec un profil de toxicité gérable et différent de celui du FCR.
La bendamustine est un agent cytotoxique qui est relativement bien toléré. L’étude de Knauf et coll. montre que les effets secondaires hématologiques de grade 3–4 de cette molécule sont la neutropénie (23 %), la thrombocytopénie (11,8 %), l’anémie (2,5 %), la leucopénie (14,3 %) et la lymphopénie (6,2 %)17,20. Les effets secondaires non hématologiques de grade 3–4 sont principalement une fièvre (1,9 %), une hypersensibilité (1,2 %), une infection (1,9 %), une fatigue (1,2 %), une hyperuricémie (1,9 %) et des éruptions cutanées qui se traitent de manière symptomatique (2,5 %) (tableau II)20.
Tableau II Effets secondaires de la bendamustinea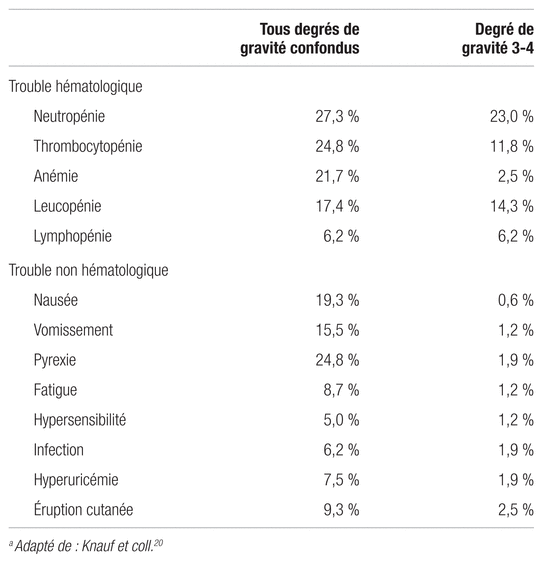
La bendamustine est considérée comme une molécule modérément émétogène; dans la majorité des cas, une prophylaxie avec un antagoniste des récepteurs sérotoninergiques 5HT3 (anti-5HT3) en association avec un corticostéroïde est suffisante pour bien prévenir et maîtriser les nausées et les vomissements. Afin de prévenir les réactions d’hypersensibilité, certains auteurs recommandent une prophylaxie primaire. Dans notre pratique, nous ne considérons pas le traitement au préalable de tous les patients comme nécessaire et pensons qu’une prophylaxie secondaire avec un antipyrétique et un antihistaminique peut suffire. Les patients atteints d’une LLC courent un risque de lyse tumorale et ceci demeure vrai si l’on instaure un traitement à la bendamustine; tout patient susceptible de présenter une lyse tumorale devrait recevoir un traitement préalable adapté17,20.
L’obinutuzumab est un anticorps monoclonal recombinant anti-CD20 de type 2, modifié par glyco-ingénierie23. L’efficacité des anticorps de type 2 dépend de la cytotoxicité à médiation cellulaire dépendante des anticorps ainsi que de la cytotoxicité cellulaire directe, tandis que celle des anticorps de type 1 – comme le rituximab – dépend plutôt de la cytotoxicité dépendante du complément. De plus, la glycolysation de la région Fc (fragment cristallisable) de l’obinutuzumab augmente son affinité pour les récepteurs FcgRIII à la surface des cellules effectrices de l’immunité, par rapport aux anticorps non modifiés par glyco-ingénierie24–26.
Une étude de phase III menée par Goede et coll. a évalué l’utilisation de l’obinutuzumab comme traitement de la LLC. L’étude avait comme objectif d’évaluer si l’ajout d’un anticorps anti-CD20 au chlorambucil offrait un avantage aux patients atteints de LLC ayant des comorbidités, et si l’association d’obinutuzumab (pour cibler l’antigène CD20) et de chlorambucil s’avérait supérieure à l’association chlorambucil-rituximab. Cette étude ouverte à répartition aléatoire regroupait 781 participants atteints de LLC n’ayant jamais été traités et qui avaient des comorbidités cliniquement significatives (score CIRS supérieur à 6 ou clairance de la créatinine entre 30 et 69 ml/min). Les participants de cette étude multicentrique internationale étaient répartis aléatoirement entre trois groupes de traitement et recevaient soit le chlorambucil seul, soit le chlorambucil avec rituximab, soit le chlorambucil avec obinutuzumab, donnés en six cycles de 28 jours. Le chlorambucil était donné à une dose de 0,5 mg/kg par voie orale aux jours 1 et 15 de chaque cycle. Le rituximab était administré à une dose de 375 mg/m2 de surface corporelle en IV au jour 1 du premier cycle, puis à une dose de 500 mg/m2 au premier jour des cycles subséquents. La dose d’obinutuzumab était de 1 000 mg en IV aux jours 1, 8 et 15 du premier cycle puis au jour 1 des cycles subséquents. Après avoir observé un taux élevé de réactions lors de la première perfusion d’obinutuzumab, le protocole a été modifié afin que l’administration de la dose du jour 1 du premier cycle s’effectue sur une période de deux jours27. L’objectif primaire de l’étude était la survie sans progression telle qu’évaluée par les chercheurs. La survie sans progression était prolongée de façon statistiquement significative avec la combinaison obinutuzimab-chlorambucil par rapport à la monothérapie de chlorambucil, avec une survie sans progression médiane respective de 26,7 mois contre 11,1 mois (p < 0,001). Cet avantage était observé pour tous les sous-groupes de patients, à l’exception des patients porteurs d’une délétion 17p. Le traitement avec obinutuzumab-chlorambucil s’avérait également supérieur à celui par rituximab-chlorambucil, avec une survie sans progression médiane de 26,7 mois contre 15,2 mois (p < 0,001) et un taux de réponse complète plus élevé, soit 20,7 % contre 7,0 % (p < 0,001).
L’association de l’obinutuzumab avec le chlorambucil offrait également un avantage en matière de survie globale par rapport au traitement avec le chlorambucil seul (taux de mortalité respectif : 9 % contre 20 %; p = 0,002). Cependant, la différence entre le taux de mortalité observé avec l’association obinutuzumab-chlorambucil (8 %) et celui observé avec la combinaison rituximab-chlorambucil (12 %) n’était pas statistiquement significative (p = 0,08)27.
En ce qui concerne l’innocuité des traitements, les effets indésirables étaient plus fréquents avec les combinaisons d’anticorps qu’avec la monothérapie. Les cas de neutropénie de grade 3 ou 4 étaient plus fréquents avec l’obinutuzumab, tandis que la différence observée entre les groupes en ce qui concerne les taux d’infections de grade 3 à 5 n’était pas statistiquement significative. La combinaison obinutuzumab-chlorambucil entraînait plus de réactions liées à la perfusion (tous degrés de gravité confondus) que l’association rituximab-chlorambucil (66 % contre 38 %). Les réactions de grade 3 ou 4 liées à la perfusion, également plus fréquentes avec l’obinutuzumab qu’avec le rituximab, affectaient 20 % des patients lors de la première perfusion; cette observation a mené les auteurs de l’étude à changer le protocole pour que l’administration de la première dose d’obinutuzumab s’effectue sur deux jours. Aucune réaction de grade 3 ou 4 liée à la perfusion n’a été observée lors des perfusions subséquentes d’obinutuzumab27. Le traitement préalable recommandé avant la première perfusion comprend un corticostéroïde en IV (20 mg de dexaméthasone ou 80 mg de méthylprednisolone), un analgésique et antipyrétique (1 000 mg d’acétaminophène), et un antihistaminique (50 mg de diphénhydramine)23. Il est à noter que les mesures prophylactiques avaient seulement un effet modéré sur la fréquence des réactions liées à la perfusion observées dans l’étude. Enfin, pour les patients susceptibles de contracter un syndrome de lyse tumorale (patients ayant un taux de lymphocytes circulants élevé, une charge tumorale importante ou une insuffisance rénale), une prophylaxie par hydratation intraveineuse et administration d’allopurinol devrait être envisagée27.
L’ofatumumab est un anticorps monoclonal humain qui se lie à un épitope de l’antigène CD20, distinct du site de liaison du rituximab. Cette liaison provoque la lyse des cellules cancéreuses avec le recrutement et l’activation du complément à la surface de la cellule, ainsi qu’une lyse cellulaire par une cytotoxicité à médiation cellulaire dépendante de l’anticorps. L’ofatumumab a démontré une efficacité à provoquer une lyse cellulaire des cellules résistantes au rituximab ainsi que des cellules avec une forte ou une faible expression de CD2028.
L’étude COMPLEMENT 1, une étude prospective ouverte de phase III à répartition aléatoire, a évalué l’efficacité et l’innocuité de l’ofatumumab lorsqu’ajouté au chlorambucil pour les patients atteints de LLC n’ayant jamais été traités et qui ne pouvaient pas recevoir un traitement à base de fludarabine en raison de leur âge avancé ou de la présence de comorbidités. Parmi les participants compris dans l’étude, 87 % présentaient au moins l’une des caractéristiques suivantes : âge égal ou supérieur à 65 ans (médiane : 69 ans); existence d’au moins deux comorbidités; clairance de la créatinine inférieure à 70 ml/min. Un total de 447 patients ont été répartis aléatoirement de façon à recevoir soit du chlorambucil par voie orale seul (10 mg/m2 par jour durant les jours 1 à 7, tous les 28 jours), soit du chlorambucil par voie orale (même dose) combiné avec de l’ofatumumab (300 mg en IV au jour 1 puis 1 000 mg en IV au jour 8 du premier cycle, puis 1 000 mg en IV au jour 1 des cycles subséquents). L’association chlorambucilo-fatumumab s’est avérée supérieure à la monothérapie, avec une survie sans progression respective de 22,4 mois contre 13,1 mois (p < 0,0001). Bien qu’une supériorité numérique pour la survie sans progression ait également été observée avec la combinaison thérapeutique pour les patients avec une délétion 17p, la différence n’était pas statistiquement significative (RR:0,46; intervalle de confiance à 95 % [IC 95 %] : 0,18–1,19). Après un suivi médian de 28,9 mois, aucune différence significative en matière de survie globale n’a pu être observée entre les deux groupes, avec 15 % de décès dans le groupe recevant du chlorambucil-ofatumumab comparativement à 18 % dans le groupe recevant du chlorambucil seul (p = 0,666). La survie à trois ans était respectivement de 85 % et de 83 % dans ces deux groupes. L’absence d’avantage en matière de survie a entraîné le refus de l’inscription de l’ofatumumab à la Liste de médicaments – Établissements par l’Institut national d’excellence en santé et en services sociaux (INESSS) au Québec.
En ce qui concerne l’innocuité, les effets indésirables de grade 3 ou supérieur étaient plus fréquents dans le groupe ayant reçu du chlorambucil-ofatumumab. Alors que les cas d’anémie et de thrombocytopénie étaient plus fréquemment rapportés dans le groupe recevant le chlorambucil seul, le nombre de cas de neutropénie était plus élevé dans le groupe recevant l’association chlorambucil-ofatumumab. Cependant, le taux d’infections de grade 3 ou supérieur était similaire dans les deux groupes. De plus, les réactions de grade 3 ou 4 liées à la perfusion ont été signalées chez 10 % des patients recevant du chlorambucil-ofatumumab29. Les réactions liées à la perfusion surviennent principalement au moment de l’administration de la première (38 à 44 % des patients) ou de la deuxième (29 %) dose. Un traitement au préalable avec un analgésique, un antihistaminique et un corticostéroïde est recommandé avant chaque perfusion30.
L’ibrutinib est un inhibiteur de la BTK. La BTK est une enzyme essentielle qui joue un rôle dans les voies de signalisation du récepteur des cellules B, entraînant l’activation de la circulation et l’adhésion des cellules B. L’ibrutinib se lie de façon covalente au site d’action de la BTK et inhibe son activité enzymatique31.
Une première étude évaluant l’ibrutinib était l’étude RESONATE, publiée en 2014, qui comparait cette molécule à l’ofatumumab en monothérapie pour des patients atteints d’une LLC ou d’un lymphome lymphocytaire à petites cellules en rechute ou réfractaire au traitement. Dans cette étude à répartition aléatoire ouverte de phase III, les participants devaient déjà avoir reçu au moins un autre traitement pour pouvoir être sélectionnés. De plus, les participants à l’étude devaient être considérés comme de mauvais candidats pour un traitement avec un analogue de purine, soit parce qu’ils avaient eu une période de survie sans progression trop courte après une chimio-immunothérapie, soit parce qu’ils étaient âgés d’au moins 70 ans ou présentaient des comorbidités ou une délétion 17p. Au total, 391 patients ont été répartis aléatoirement de façon à recevoir soit de l’ibrutinib (420 mg une fois par jour par voie orale jusqu’à progression de la maladie ou apparition d’une toxicité inacceptable), soit de l’ofatumumab (300 mg en IV la première semaine, puis 2000 mg en IV une fois par semaine pour sept semaines, puis toutes les quatre semaines pour 16 semaines). L’ibrutinib prolongeait de façon statistiquement significative la survie sans progression (médiane non atteinte après un suivi médian de 9,4 mois, comparativement à une survie sans progression de 8,1 mois avec l’ofatumumab). Une diminution de 78 % du risque de progression de la maladie ou de décès a été observée avec l’ibrutinib lorsque comparé à l’ofatumumab (p < 0,001). Cette amélioration de la survie sans progression était également observée pour les patients ayant une délétion 17p. La survie globale était également significativement améliorée avec l’ibrutinib, avec une diminution du risque de décès de 57 % (p = 0,005)32.
L’étude de phase III la plus récente ayant évalué l’ibrutinib pour le traitement de la LLC était l’étude RESONATE 2. Cette étude ouverte à répartition aléatoire comparait l’ibrutinib au chlorambucil pour les patients d’un âge égal ou supérieur à 65 ans atteints d’une LLC ou d’un lymphome lymphocytaire à petites cellules et n’ayant jamais reçu de traitement. Les patients porteurs d’une délétion 17p ne pouvaient pas participer à l’étude. L’objectif primaire de cette étude était d’évaluer la survie sans progression et les objectifs secondaires comprenaient l’évaluation de la survie globale, la réponse globale au traitement et l’innocuité. Au total, 269 patients ont été répartis aléatoirement de façon à recevoir soit de l’ibrutinib (420 mg une fois par jour jusqu’à progression de la maladie ou apparition d’une toxicité inacceptable), soit du chlorambucil (0,5 mg/kg aux jours 1 et 15 de chaque cycle de 28 jours, avec une augmentation de dose jusqu’à 0,8 mg/kg en absence de toxicité inacceptable, pour un maximum de 12 cycles). Après une période de suivi médiane de 18,4 mois, la survie sans progression avec le chlorambucil était 18,9 mois, alors qu’elle n’a pas été atteinte dans le groupe ibrutinib. Le risque relatif de progression de la maladie ou de décès était diminué de 84 % avec l’ibrutinib (p < 0,001). Le taux de survie sans progression observé après 18 mois pour les patients traités avec l’ibrutinib était de 90 %, contre 52 % pour les patients ayant reçu le chlorambucil. La supériorité de l’ibrutinib, mise en évidence par l’analyse de la survie sans progression, s’observait également pour les sous-groupes de patients présentant un risque plus élevé, notamment les patients atteints d’une maladie à un stade plus avancé ou ayant un indice fonctionnel inférieur. L’ibrutinib augmentait également la survie globale, avec un taux de survie à 24 mois de 98 % par rapport à 85 % pour le chlorambucil, et diminuait le risque relatif de décès de 84 % (p = 0,001). Le taux de réponse était significativement supérieur dans le groupe traité avec l’ibrutinib (86 % comparativement à 35 % avec le chlorambucil; p < 0,001)33.
L’effet indésirable le plus fréquent de l’ibrutinib était la diarrhée, rapportée pour 42 % des patients, y compris des diarrhées de grade 3 observées chez 4 % de ces patients33. Les mesures non pharmacologiques de prise en charge de la diarrhée doivent être expliquées aux patients, comme s’assurer d’une bonne hydratation, éviter les aliments riches en fibres et manger et boire plus souvent, mais en plus petite quantité34. Le recours à un antidiarrhéique, comme le lopéramide, peut également être envisagé35. Les autres effets secondaires affectant au moins 20 % des patients du groupe ibrutinib étaient une fatigue, une nausée et une toux. Tandis que des cas d’hémorragies majeurs affectaient 4 % des patients recevant l’ibrutinib dans l’étude RESONATE 2, les évènements hémorragiques mineurs touchaient environ la moitié des patients traités avec l’ibrutinib33–36. L’administration concomitante d’ibrutinib et de warfarine ou autres antagonistes de la vitamine K est contre-indiquée et son utilisation avec tout autre anticoagulant ou antiplaquettaire doit s’entourer de précautions37,38. Des cas de fibrillation auriculaire ont été observés avec l’ibrutinib, et un électrocardiogramme doit être réalisé pour tout patient ayant des symptômes d’arythmies ou accusant de nouveau une dyspnée36. La lymphocytose est un autre effet indésirable de l’ibrutinib, observée chez 70 % des patients atteints de LLC. Il est important de ne pas confondre cette lymphocytose provoquée par l’ibrutinib avec une progression de la maladie. Le temps médian d’apparition est d’environ une semaine et l’effet est temporaire, avec un temps médian de résolution de 14 semaines. À la suite de cette augmentation importante du nombre de lymphocytes, un syndrome de leucostase peut également survenir. Il est donc recommandé d’interrompre le traitement par ibrutinib pour les patients présentant une augmentation importante du nombre de lymphocytes (> 400 000/ml) et d’administrer des soins de soutien si nécessaire (hydratation avec ou sans cytoréduction)37.
L’idélalisib est un inhibiteur sélectif de la PI3Kδ. Les PI3K, des kinases cytoplasmiques similaires aux BTK, sont des enzymes participant au recrutement et à l’activation des différentes enzymes intracellulaires qui régulent la croissance, la différentiation et la survie des cellules. Il existe trois classes de sous-types de PI3K, et la classe I comprend quatre isoformes. L’isoforme δ est celle qui joue le rôle le plus important dans le développement et la fonction des cellules B normales. La PI3Kδ active l’AKT, qui active à son tour la protéine mTOR (cible de la rapamycine chez les mammifères), une protéine régulant le métabolisme, la croissance et la prolifération cellulaire. Cette voie de signalisation est souvent hyperactive et surexprimée dans les cellules B dans le cas d’une LLC. En inhibant le PI3Kδ, l’idélalisib pourrait donc inhiber la prolifération, la motilité et l’adhésion cellulaire et promouvoir l’apoptose des cellules cancéreuses39.
Une étude de phase III a évalué le rôle de l’idélalisib en LLC. Cette étude multicentrique à répartition aléatoire contrôlée comparait l’association d’idélalisib et de rituximab au rituximab plus placébo pour des patients ayant une rechute de LLC. Ces patients devaient avoir une LLC ayant évolué dans les 24 mois après leur dernier traitement. Ils devaient également être des mauvais candidats pour un traitement par agents cytotoxiques, en raison d’une neutropénie ou d’une thrombocytopénie causée par une myélotoxicité cumulative due à leurs traitements précédents, ou devaient avoir une clairance de la créatinine estimée inférieure à 60 ml/min ou encore un score CIRS supérieur ou égal à six en raison de comorbidités non liées à la LLC. Les patients devaient tous avoir reçu précédemment une thérapie à base d’anticorps anti-CD20 ou au moins deux régimes cytotoxiques avant de pouvoir participer à l’étude. L’ensemble des 220 participants recevaient du rituximab à une dose de 375 mg/m2 en IV, suivie de 500 mg/m2 en IV toutes les deux semaines pour quatre doses, puis toutes les quatre semaines pour trois doses, pour un total de huit doses. En plus du rituximab, les patients étaient répartis aléatoirement de façon à recevoir soit de l’idélalisib (150 mg par voie orale) soit un placébo deux fois par jour. Le traitement par voie orale était poursuivi de façon continue. Les patients présentant une progression de leur maladie avec l’idélalisib pouvaient voir leur dose d’idélalisib augmentée à 300 mg deux fois par jour, et ceux recevant le placébo avec une progression de la maladie pouvaient participer à une étude de prolongation qui leur permettait de recevoir de l’idélalisib. L’issue primaire de l’étude était la survie sans progression. Le taux de réponse et la survie globale faisaient partie des objectifs secondaires évalués. À 24 mois, le taux de survie sans progression était de 93 % avec l’idélalisib et de 46 % avec le placébo (p < 0,001). La médiane de survie sans progression était de 5,5 mois dans le groupe témoin, alors qu’elle n’a pas été atteinte dans le groupe idélalisib (p < 0,001). Cette supériorité de l’association d’idélalisib et de rituximab était également observée dans les différents sous-groupes évalués, notamment pour les patients porteurs d’une délétion 17p. Le taux de réponse globale était supérieur avec l’idélalisib (81 % contre 13 % avec le placebo, p < 0,001) et la survie globale à 12 mois était également améliorée dans le groupe expérimental (92 % contre 80 %, p = 0,02)40.
L’idélalisib entraîne parfois une lymphocytose, mais l’ajout du rituximab diminue cet effet. Dans cette étude, le nombre de lymphocytes était le plus élevé après deux semaines de traitement par idélalisib, avec résolution de la lymphocytose après 12 semaines. Cependant, dans le groupe placébo, une augmentation soutenue du nombre des lymphocytes était observée à partir de la 24e semaine, ce qui coïncidait avec la fin du traitement avec le rituximab40.
En ce qui concerne l’innocuité, l’anémie, la neutropénie et la thrombocytopénie étaient souvent observées dans les deux groupes, mais les cinq effets secondaires les plus fréquemment observés avec l’idélalisib dans cette étude étaient la pyrexie, la fatigue, les nausées, les frissons et la diarrhée40. La diarrhée est un effet indésirable cliniquement significatif de l’idélalisib, dont l’intensité peut être variable. Les diarrhées peuvent être légères à modérées, de grade 1 ou 2, avec une augmentation du nombre des selles jusqu’à quatre à six par jour de plus que la normale. Ces diarrhées apparaissent normalement dans les huit premières semaines de traitement avec l’idélalisib et répondent bien aux agents antidiarrhéiques, comme le lopéramide. Ces patients doivent être conseillés sur les mesures non pharmacologiques de prise en charge de la diarrhée, notamment la modification du régime alimentaire et l’importance de l’hydratation. Ils doivent continuer à prendre la même dose d’idélalisib et être suivis au moins une fois par semaine jusqu’à la résolution des symptômes. Le deuxième type de diarrhées provoquées par l’idélalisib sont plus graves. Des diarrhées de grade 3 (augmentation de sept selles ou plus par jour ou nécessitant une hospitalisation), voire de grade 4, ont été observées. Ces cas de diarrhées ou de colites apparaissent souvent plus tardivement, parfois des mois après le début du traitement avec l’idélalisib. Elles sont habituellement liquides, sans crampes, et sans présence de sang ou de mucus dans les selles. Il est à noter que la prise en charge d’une diarrhée de grade 2 qui ne répond pas au traitement par lopéramide après 24 heures devrait être la même que celle des diarrhées de grade 3 ou 4. Lors de la prise en charge des patients atteints de ce deuxième type de diarrhées, des examens sont nécessaires afin d’éliminer la possibilité d’une cause infectieuse. Il faut cesser le traitement par idélalisib et entamer un traitement par budésonide ou tout autre corticostéroïde par voie orale. Si la voie orale n’est pas tolérée, il faut administrer un corticostéroïde par voie intraveineuse jusqu’à ce qu’un traitement oral soit possible. La prise de budésonide par voie entérique doit également être envisagée pour les patients présentant une colite ou des diarrhées plus graves liées à l’idélalisib. Après la résolution des symptômes, les patients ayant eu des diarrhées de grade 3 peuvent recommencer à prendre de l’idélalisib à une dose réduite de 100 mg deux fois par jour. En cas de diarrhées de grade 4, il est conseillé d’arrêter le traitement par idélalisib de façon permanente41. Le tableau III décrit les diarrhées observées avec l’idélalisib et les recommandations pour la prise en charge de cet effet secondaire.
Tableau III Description et prise en charge des diarrhées provoquées par l’idélalisiba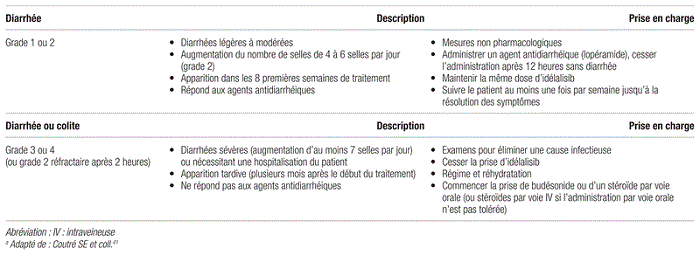
L’augmentation du taux des enzymes hépatiques est un autre effet secondaire important observé avec l’idélalisib, qui engendre des cas graves et même fatals d’hépatotoxicité. Cette augmentation des taux d’alanine aminotransférase (ALT) et d’aspartate aminotransférase (AST) survient généralement dans les 12 premières semaines de traitement. Dans la plupart des cas, cette augmentation était réversible après l’interruption du traitement par idélalisib. Lorsque l’augmentation du taux d’ALT ou d’AST est de trois à cinq fois la limite supérieure de la normale (LSN), il est recommandé de continuer le traitement par idélalisib à la même dose et de faire un suivi au moins une fois par semaine jusqu’à la normalisation du taux des enzymes. En cas d’augmentation du taux d’ALT ou d’AST de cinq à 20 fois la LSN, il est recommandé d’interrompre le traitement par idélalisib et de faire un suivi hebdomadaire jusqu’à un retour des taux à la normale, puis de recommencer le traitement par idélalisib à une dose réduite de 100 mg deux fois par jour. Lorsque l’augmentation du taux d’ALT ou d’AST est supérieure à 20 fois la LSN, le traitement par idélalisib doit être cessé41.
Des cas de pneumonite, y compris des cas mortels, sont également survenus avec l’idélalisib. En cas de pneumonite soupçonnée chez un patient prenant de l’idélalisib, le traitement doit être interrompu jusqu’à ce que la cause des symptômes soit déterminée. Des examens doivent également être effectués à la recherche d’une source infectieuse responsable des symptômes pulmonaires41. Il est recommandé de cesser le traitement par idélalisib dans tous les cas de pneumonite symptomatique considérés comme dus à l’idélalisib, quelle que soit la gravité des symptômes42. Bien que le mécanisme exact de cet effet indésirable ne soit pas connu, les cas de pneumonite due à l’idélalisib ressemblent aux pneumonites provoquées par la prise des inhibiteurs de la mTOR. En cas de diagnostic de pneumonite due à un inhibiteur de la mTOR, il est recommandé de déterminer le degré de gravité des symptômes selon une échelle d’évaluation et d’établir la fréquence des suivis nécessaires. Selon la gravité et le degré de toxicité, il faut réévaluer la dose de l’agent inhibiteur de la mTOR, interrompre le traitement par cet agent jusqu’à la résolution des symptômes ou cesser de prendre cet agent de façon permanente. De plus, il faut envisager la nécessité d’entamer un traitement, par exemple avec des corticostéroïdes, ainsi que le besoin de consulter un spécialiste, comme un pneumologue43. Bien que ces recommandations ne s’appliquent pas précisément aux cas de pneumonite provoquée par l’idélalisib mais plutôt à celles dues aux inhibiteurs de la mTOR, elles pourraient inspirer la prise en charge des patients prenant de l’idélalisib et qui manifestent cet effet indésirable41.
Le choix d’un traitement pour la LLC est tout d’un coup devenu compliqué, pour de multiples raisons : il existe beaucoup de nouvelles molécules pour le traitement de la LLC, plusieurs molécules n’existent pas ou plus sur le marché canadien (p. ex. l’alemtuzumab et la pentostatine) et il n’existe pas de consensus chez les experts malgré l’existence de plusieurs pratiques décrites dans la documentation scientifique, comme les recommandations du NCCN (National Comprehensive Cancer Network) ou des recommandations canadiennes. Plusieurs facteurs doivent être pris en compte avant d’entreprendre un traitement, notamment le stade de la maladie, les symptômes et l’état de santé général du patient, ainsi que les facteurs de risque génétiques de la maladie.
Cependant, le FCR semblerait être le traitement de choix pour les patients qui sont en mesure de le tolérer, à savoir ceux de moins de 70 ans sans comorbidités. Le choix se complique lorsqu’il existe plusieurs options thérapeutiques possibles (tableau IV). Pour les patients très frêles ou qui présentent des comorbidités graves, une thérapie à base de chlorambucil, en monothérapie ou en association à un agent anti-CD20 (à savoir, chlorambucil-obinutuzumab ou chlorambucil-rituximab) est encore considérée comme appropriée. À l’heure actuelle, l’INESSS ne recommande toujours pas l’utilisation de l’ofatumumab. Pour les patients âgés de plus de 70 ans qui présentent des comorbidités, plusieurs choix thérapeutiques sont possibles : chlorambucil en monothérapie ou en association avec une thérapie anti-CD20; obinutuzumab ou rituximab; bendamustine en monothérapie ou en association avec le rituximab; fludarabine en monothérapie ou en association avec le rituximab. Depuis tout récemment, l’ibrutinib en monothérapie est devenu le choix de traitement en première intention pour les patients atteints de LLC et porteurs d’une délétion 17p, étant donné que les autres options thérapeutiques sont manifestement moins efficaces.
Tableau IV Choix thérapeutiques pour le traitement de la leucémie lymphoïde chronique
Avant de faire un choix thérapeutique face à une rechute de LLC ou à une maladie réfractaire au traitement, il faut réfléchir au genre et à la durée de réponse que la première ligne de traitement avait entraînés. Plusieurs auteurs s’entendent sur le principe que si le patient avait obtenu une rémission supérieure à 24–36 mois, le traitement de première intention peut être répété. En cas contraire, il faut choisir un autre traitement.
Avec l’arrivée des nouvelles modalités thérapeutiques, l’ibrutinib, l’idélalisib en association avec le rituximab et les associations de chimio-immunothérapie (p. ex. FCR à dose réduite, bendamustine en association avec le rituximab, chlorambucil en association avec le rituximab) demeurent des options valables. Le choix d’un traitement devenant de plus en plus difficile, le mieux est de personnaliser la thérapie en prenant en considération le coût du traitement, le profil de toxicité des agents choisis et le statut de performance du patient.
Pour les patients atteints de LLC et porteurs d’une délétion 17p, l’ibrutinib ou l’association idélalisib-rituximab demeurent deux options de choix.
La LLC a longtemps été une maladie pour laquelle les choix thérapeutiques étaient limités, particulièrement pour les patients présentant des comorbidités substantielles ou ayant une maladie plus agressive avec délétion 17p, qui n’étaient pas de bons candidats pour les traitements conventionnels existants. L’arrivée des nouveaux agents présentés dans cet article permet de répondre à des besoins thérapeutiques non comblés et de mieux prendre en charge les patients les plus vulnérables. Dans un tel contexte, le pharmacien joue un rôle important, de concert avec les autres membres de l’équipe traitante, dans la prise en charge de ces nouveaux agents qui présentent des profils d’effets secondaires particuliers et qui sont souvent administrés à des patients plus âgés et frêles, ayant fréquemment plusieurs comorbidités et qui sont déjà polymédicamentés.
D’autres agents prometteurs sont également en cours d’évaluation, comme le venetoclax, un inhibiteur spécifique du BCL-2 qui a démontré des résultats très favorables – notamment dans le cas d’une rechute de LLC ou d’une maladie réfractaire avec la présence d’une délétion 17p – et pour lequel une étude de phase III est actuellement en cours44. De nouvelles associations d’agents ont également été évaluées et pourraient offrir d’autres options thérapeutiques intéressantes. Par exemple, l’étude HELIOS, publiée en 2015, a évalué l’utilisation de l’ibrutinib en association avec la bendamustine et le rituximab. Cette association a démontré une efficacité supérieure à la combinaison de bendamustine et de rituximab sans ibrutinib, avec une survie sans progression qui n’était pas atteinte après un suivi de 17 mois dans le groupe recevant l’ibrutinib, comparativement à une survie sans progression de 13,3 mois dans le groupe témoin (p < 0,0001)45. Les nouveaux agents sur le marché et ceux actuellement en cours d’évaluation offrent donc l’espoir d’un meilleur avenir pour le traitement des patients atteints de LLC.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Gabriel Gazzé a donné des conférences ou a été consultant pour Roche, Lundbeck et Janssen dans le domaine de l’oncologie. Nushin Sadeghi n’a déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Nabhan C, Rosen ST. Chronic lymphocytic leukemia: a clinical review. JAMA 2014;312:2265–76.

2. Spaargaren M, de Rooji MFM, Kater AP, Eldering E. BTK inhibitors in chronic lymphocytic leukemia: a glimpse to the future. Oncogene 2015; 34:2426–36.
3. MacDonald D, Lachance S, Larratt L. A Canadian perspective on the treatment of unfit patients with chronic lymphocytic leukemia. New Evid Oncol 2013;19:118–35.
4. Owen C, Bence-Bruckler I, Chamaki I, Toze C, Assaily W, Christofides A et coll. A Canadian perspective on the first-line treatment of chronic lymphocytic leukemia. Clin Lymphoma Myeloma Leuk 2015;15:303–13.

5. Dreger P, Schetelig J, Andersen N, Corradini P, van Gelder M, Gribben J et coll. Managing high-risk CLL during transition to a new treatment era: stem cell transplantation or novel agents? Blood 2014;124:3841–9.


6. Strefford JC. The genomic landscape of chronic lymphocytic leukemia: biological implications and clinical implications. Br J Haematol 2015; 169:14–31.
7. Hallek M. Chronic lymphocytic leukemia: 2015 update on diagnosis, risk stratification, and treatment. Am J Hematol 2015;90:447–60.
8. Shanafelt T. Treatment of older patients with chronic lymphocytic leukemia: key questions and current answers. Hematol Am Soc Hematol Educ Prog 2013;2013:158–67.
9. Delgado J, Baumann T, Santacruz R, Montserrat E. New treatment options for chronic lymphocytic leukemia. Expert Opin Pharmacother 2014; 15:823–32.

10. O’Brien SM, Furman RR, Byrd JC. Unmet needs in the treatment of chronic lymphocytic leukemia: integrating a targeted approach. Clin Adv Hematol Oncol 2014;12:2–15.
11. O’Brien SM. Treatment of chronic lymphocytic leukemia, where are we heading? Hematol Oncol 2015;33:46–9.
12. San Miguel JF, Kantarjian HM. Improved understanding of disease biology and treatment. Nat Rev Clin Oncol 2015;12:71–2.
13. Jones JA, Byrd JC. How will B-cell-receptor-targeted therapies change the future CLL therapy? Blood 2014;123:1455–60.


14. Siddiqi T, Rosen ST. Novel biologic agents for non-Hodgkin lymphoma and chronic lymphocytic leukemia – Part 1: monoclonal antibodies. Oncology (Williston Park) 2015;29:198–203.
15. Siddiqi T, Rosen ST. Novel biologic agents for non-Hodgkin lymphoma and chronic lymphocytic leukemia – Part 2: adoptive cellular immunotherapy, small-molecule inhibitors, and immunomodulation. Oncology (Williston Park) 2015; 29:299–308.
16. Hoy SM. Bendamustine: A review of its use in the management of chronic lymphocytic leukaemia, rituximab-refractory indolent non-Hodgkin’s lymphoma and multiple myeloma. Drugs 2012; 72:1929–50.

17. Koolwine J, Crosbie T, Gazzé G, Turner R, Wiernikowski J, Assaily W. A Canadian perspective on the safe administration of bendamustine and the prevention of adverse events. Curr Oncol 2014;21:35–42.


18. Van der Jagt R, Laneuville P, MacDonald D, Stewart D, Christofides A, Sehn LH. A Canadian perspective on bendamustine for the treatment of chronic lymphocytic leukemia and non-Hodgkin lymphoma. Curr Oncol 2012;19:160–8.


19. Chang JE, Kahl BS. Bendamustine for the treatment of chronic lymphocytic leukemia. Expert Opin Pharmacother 2012;13:1495–505.


20. Knauf WU, Lissichkov T, Aldaoud A, Loscertales J, Herbrecht R, Juliusson G et coll. Phase III randomized study of bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 2009;27:4378–84.

21. Knauf WU, Lissitchkov T, Aldaoud A, Liberati AM, Loscertales J, Herbrecht R et coll. Bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukemia: updated results of a randomized phase III trial. Br J Haematol 2012;159:67–77.

22. Eichorst B, Fink AM, Busch R, Kovacs G, Maurer C, Lange E et coll. Frontline chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and rituximab (R) (FCR) shows superior efficacy in comparison to bendamustine (B) and rituximab (BR) in previously untreated and physically fit patients (PTS) with advanced chronic lymphocytic leukemia (CLL): final analysis on an international, randomized study of the German CLL study group (GCLLSG) (CLL10 study). ASH 2014 Abstract. Blood 2014:(21).
23. Roche Canada. Monographie : Gazyva. [en ligne] http://www.rochecanada.com/content/dam/roche_canada/fr_CA/documents/Research/ClinicalTrialsForms/Products/ConsumerInformation/MonographsandPublicAdvisories/Gazyva/Gazyva_PM_F.pdf (site visité le 10 décembre 2015).
24. Owen C, Stewart DA. Obinutuzimab for the treatment of lymphoproliferative disorders. Expert Opin Biol Ther 2012;12:343–51.

25. Burger JA. Obinutuzumab: the more the merrier? Blood 2015;127:6–8.
26. Shah A. Obinutuzumab: a novel anti-CD20 monoclonal antibody for previously untreated chronic lymphocytic leukemia. Ann Pharmacother 2014;48:1356–61.

27. Goede V, Fischer K, Busch R, Engelke A, Eichhorst B, Wendtner CM et coll. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370:1101–10.

28. Novartis Pharmaceuticals Canada Inc. Monographie de produit : Arzerra. Dorval, Québec. Août 2015
29. Hillmen P, Robak T, Janssens A, Babu K G, Kloczko J, Grosicki S et coll. Chlorambucil plus ofatumumab versus chlorambucil alone in previously untreated patients with chronic lymphocytic leukaemia (COMPLEMENT 1): a randomised, multicentre, open-label phase 3 trial. Lancet 2015;385:1873–83.

30. BC Cancer Agency. Drug name: ofatumumab. [en ligne] http://www.bccancer.bc.ca/drug-database-site/Drug%20Index/OfatumumabINTERIM_monograph_1May2012_formatted.pdf (site visité le 20 décembre 2015).
31. Janssen. Autorisation avec conditions de Imbruvica (ibrutinib) pour le traitement du lymphome à cellules du manteau en rechute ou réfractaire. [en ligne] http://hc-sc.gc.ca/dhpmps/prodpharma/notices-avis/conditions/imbruvica_dhcpl_lapds_179136-fra.php (site visité le 10 décembre 2015).
32. Byrd JC, Brown JR, O’Brien S, Barrientos JC, Kay NE, Reddy NM et coll. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. New Engl J Med 2014;371:213–23.


33. Burger JA, Tedeschi A, Barr PM, Robak T, Owen C, Ghia P et coll. Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med 2015;373:2425–37.


34. BC Cancer Agency. For the patient: Ibrutinib. [en ligne] http://www.bccancer.bc.ca/drug-database-site/Drug%20Index/Ibrutinib_handout_1Dec2015.pdf (site visité le 20 décembre 2015).
35. Dana-Farber Cancer Institute Patient Education Committee. Ibrutinib (Imbruvica). [en ligne] http://www.dana-farber.org/uploadedFiles/Library/health-library/medications/Ibrutinib-Imbruvica.pdf (site visité le 20 décembre 2015).
36. BC Cancer Agency. Ibrutinib (monograph). [en ligne] http://www.bccancer.bc.ca/drugdatabase-site/Drug%20Index/Ibrutinib_monograph_1Dec2015.pdf (site visité le 20 décembre 2015).
37. Janssen. Product monograph including patient medication information: Imbruvica [en ligne] https://www.janssen.com/canada/sites/www_janssen_com_canada/files/product/pdf/imb09142015cpm_nc_185130.pdf (site visité le 25 janvier 2016).
38. Bhatt V, Alejandro L, Michael A, Ganetsky A. The promising impact of Ibrutinib, a Bruton’s tyrosine kinase inhibitor, for the management of lymphoid malignancies. Pharmacotherapy 2014;34:303–14.
39. Shah A, Mangaonkar A. Idelalisib: a novel PI3Kδ inhibitor for chronic lymphocytic leukemia. Ann Pharmacother 2015;49:1162–70.

40. Furman RR, Sharman JP, Coutre SE, Cheson BD, Pagel JM, Hillmen P et coll. Idelalisib and rituximab in relapsed chronic lymphocytic leukemia. N Engl J Med 2014;370:997–1007.


41. Coutré SE, Barrientos JC, Brown JR, de Vos S, Furman RR, Keating MJ et coll. Management of adverse events associated with idelalisib treatment: expert panel opinion. Leuk Lymphoma 2015;56:2779–86.


42. Gilead. Monographie de produit : ZydeligMD [en ligne] http://www.gilead.ca/pdf/ca/zydelig_pm_french.pdf (site visité le 8 octobre 2016).
43. Duran I, Goebell PJ, Papazisis K, Ravaud A, Weichhart T, Rodriguez-Portal JA et coll. Drug-induced pneumonitis in cancer patients treated with mTOR inhibitors: management and insights into possible mechanisms. Expert Opin Drug Saf 2014;13:361–372.

44. Stilgenbauer S, Furman RR, Zent CS. Management of chronic lymphocytic leukemia. ASCO Meeting Library. Educational Book 2015. [en ligne] http://meetinglibrary.asco.org/content/115000164-156 (site visité le 25 janvier 2016).
45. Chanan-Khan A, Cramer P, Demirkhan F, Fraser G, Silva RS, Grosicki S et coll. Ibrutinib combined with bendamustine and rituximab compared with placebo, bendamustine, and rituximab for previously treated chronic lymphocytic leukaemia or small lymphocytic lymphoma (HELIOS): a randomised, double-blind, phase 3 study. Lancet Oncol 2016;17:200–11.
PHARMACTUEL, Vol. 49, No. 4, 2016