Jessica Virgili1,2, Pharm.D., Audrey Faucher-Genest3, Émilie Aubry-Lafontaine1,2, B.Sc., Nicolas Dupré4,5, MD, M.Sc., FRCP(C), Frédéric Calon6,7, B.Pharm., B.Sc., Ph.D.
Reçu le 17 mars 2016; Accepté après révision par les pairs le 6 juin 2016
Résumé
Objectif : Discuter des modalités de traitement du tremblement essentiel.
Source des données : Une revue de la documentation scientifique portant sur la pharmacothérapie du tremblement essentiel a été effectuée en recherchant des articles à partir de Pubmed entre 1975 et 2015 à l’aide des mots-clés suivants: adult, alprazolam, atenolol, benzodiazepines, botulinum toxin, clonazepam, deep brain stimulation, diazepam, essential tremor, gabapentin, lorazepam, metoprolol, nadolol, pediatrics, pharmacotherapy, phenobarbital, primidone, propranolol, sotalol, thalamotomy, topiramate. Les lignes directrices de l’American Academy of Neurology sur les traitements du tremblement essentiel révisées en 2011 ont également été consultées.
Analyse des données : Le faible nombre d’essais cliniques à répartition aléatoire publiés et le nombre de patients inclus dans ces études sont deux problèmes fréquemment associés à la majorité des traitements étudiés pour le tremblement essentiel. De plus, les outils utilisés dans les essais cliniques pour évaluer l’efficacité des traitements à l’étude ne sont pas toujours bien décrits, ce qui rend l’interprétation des données complexe. Aucun essai clinique à répartition aléatoire n’a été publié sur le traitement du tremblement essentiel de l’enfant et de l’adolescent.
Conclusion : Le tremblement essentiel est une maladie mal connue. Les traitements pharmacologiques ne permettent pas de guérir la maladie, mais vont plutôt atténuer les symptômes. Le propranolol et la primidone demeurent les agents pharmacologiques de première ligne pour l’adulte. Pour l’enfant et l’adolescent, la pharmacothérapie est rarement nécessaire, bien que le propranolol soit parfois utilisé en premier recours dans les cas plus sévères.
Mots clés : Adulte, pédiatrie, traitements pharmacologiques, tremblement essentiel
Abstract
Objectives: To discuss the treatment options for essential tremor.
Data Source: A review of the literature on the pharmacotherapy of essential tremor was conducted by searching PubMed from 2005 to 2015 for articles, using the following keywords: adult, alprazolam, atenolol, benzodiazepines, botulinum toxin, clonazepam, deep brain stimulation, diazepam, essential tremor, gabapentin, lorazepam, metoprolol, nadolol, pediatrics, pharmacotherapy, phenobarbital, primidone, propranolol, sotalol, thalamotomy, topiramate. The American Academy of Neurology’s 2011 revised guidelines on the treatments for essential tremor were also consulted.
Data analysis: The small number of published randomized clinical trials and the number of patients included in these studies are two problems frequently encountered in the literature review for the treatment essential tremor. Furthermore, the tools used in clinical trials to evaluate their efficacy are not always clearly described, which makes interpreting the data a complex task. No randomized clinical trial has been published on the treatment of essential tremor in children and adolescents.
Conclusion: Essential tremor is a poorly understood disorder. The pharmacological treatments are not a cure but rather alleviate the symptoms. Propranolol and primidone are the first-line pharmacological agents in adults. In children and adolescents, pharmacotherapy is seldom necessary. Propranolol is sometimes used as first-line therapy in more severe cases.
Keywords: Adult, essential tremor, pediatrics, pharmacological treatments
Le tremblement essentiel (TE) est la maladie neurologique considérée comme le trouble du mouvement le plus fréquent de l’adulte âgé de plus de 65 ans1. On estime que la prévalence de ce trouble est d’environ 0,4 % dans la population générale tous âges confondus et de 4 à 6 % dans la population âgée de plus de 65 ans2. La prévalence du TE serait toutefois sousévaluée, car près de 30 à 50 % des patients atteints de TE seraient diagnostiqués à tort comme ayant la maladie de Parkinson (MP) ou une autre forme de tremblement3. Le pic de fréquence est bimodal. Le TE apparait généralement vers l’âge de 20 ans ou de 65 ans, bien qu’il puisse survenir à n’importe quel moment de la vie1.
L’apparition de la maladie est insidieuse et évolue habituellement lentement. Sur le plan clinique, cette maladie se définit par la présence d’un tremblement postural ou cinétique (pendant l’action) bilatéral relativement symétrique, d’une fréquence généralement située entre 4 et 12 Hz, sans autre anomalie neurologique à l’exception du phénomène de roue dentée qui se caractérise par une résistance des muscles aux mouvements passifs4,5. Elle atteint d’abord les membres supérieurs, particulièrement les mains et les avant-bras. Lorsque la maladie évolue, les tremblements affectent parfois la tête (30 %) et, plus rarement, le visage, les jambes, la voix et le tronc1. Au fil du temps, la fréquence du tremblement tend à diminuer tandis que l’amplitude tend à augmenter. Pour certains patients, les symptômes peuvent devenir très invalidants et avoir des répercussions importantes sur leur qualité de vie. Certains gestes simples de la vie quotidienne, comme manger, boire, écrire et prendre un objet deviennent de plus en plus difficiles, voire impossibles à réaliser. La coexistence de symptômes non moteurs, comme les troubles olfactifs, qui sont également fréquemment observés dans la MP, demeure controversée1.
Le diagnostic du TE repose sur les symptômes et l’examen neurologique du patient4,5. Il s’agit d’un diagnostic d’exclusion, puisqu’à l’heure actuelle il n’existe aucun test ou biomarqueur spécifique connu pour cette maladie. Les critères diagnostiques les plus utilisés à ce jour sont ceux du Tremor Investigation Group et du Consensus Statement of the Movement Disorder Society on Tremor4,5. Il est parfois difficile de distinguer une MP à un stade précoce d’un TE. Le tremblement du TE se distingue de celui de la MP par sa symétrie et sa bilatéralité, ainsi que par l’absence de tremblement au repos pour la majorité des patients. Cependant, plusieurs cas de tremblement au repos ont été rapportés dans la documentation scientifique6. La prise d’alcool diminuerait les tremblements de manière transitoire pour près de la moitié des patients atteints de TE, mais non pour ceux atteints de MP. Bien que cette réponse à l’alcool soit caractéristique en cas de TE, elle est peu spécifique de cette maladie et peut être également observée dans le cas de plusieurs autres types de troubles du mouvement, tels que la dystonie focale et la dystonie myoclonique7.
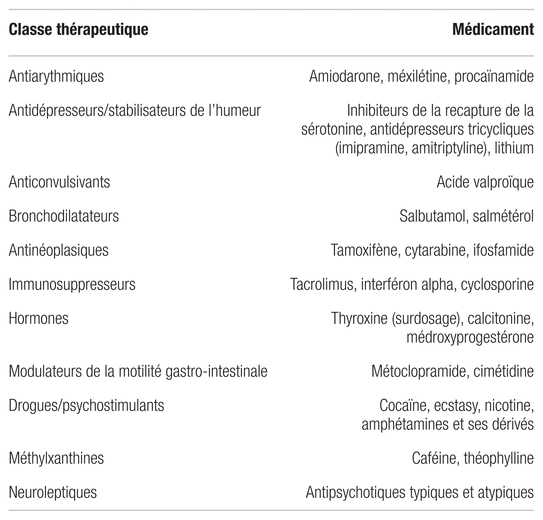
L’examen clinique permet d’orienter le diagnostic en précisant la topographie et le type de tremblement (cinétique, postural ou au repos)4,5. Il permet aussi de distinguer un tremblement de type TE d’un tremblement dû à une réponse physiologique exagérée causée par une stimulation adrénergique provoquée par l’anxiété ou par plusieurs troubles endocriniens ou métaboliques, comme l’hyperthyroïdie et l’hypoglycémie4,5. Certains médicaments peuvent également induire un tremblement postural et cinétique (pour plus d’information, consultez la section « mesures non pharmacologiques » et le tableau II)4,5.
Tableau II Médicaments pouvant causer un tremblement cinétique ou postural86
Les examens neurophysiologiques peuvent être utiles lorsque l’examen clinique n’est pas concluant, bien qu’ils demeurent peu utilisés en pratique4,5. Ils permettent notamment de différencier un tremblement atypique (p. ex. myoclonies) d’un tremblement postural ou cinétique. Lors des tests, un enregistrement accélérométrique est effectué afin d’évaluer la mécanique du mouvement4,5. Cette technique est couramment utilisée dans les essais cliniques portant sur le TE pour évaluer les changements d’amplitude des tremblements. L’électromyographie (EMG) est une méthode qui permet d’évaluer l’activité rythmique, la fréquence, la durée et le type d’activation de façon plus exacte, mais elle est rarement utilisée en clinique4,5. L’EMG sert également à préciser les muscles qui sont impliqués dans le tremblement et permet d’exclure certains diagnostics différentiels, comme le tremblement cérébelleux ou myoclonique4,5.
Outre les mesures effectuées par accélérométrie, d’autres outils comme les échelles d’évaluation de la sévérité clinique des symptômes – plus communément appelées tremor rating scales dans la documentation scientifique – sont également fréquemment utilisés dans les essais cliniques pour évaluer l’évolution temporelle de la maladie ou pour quantifier la réponse à un traitement pharmacologique. L’échelle standardisée Fahn-Tolosa-Marin, qui n’existe que depuis le début des années 90, est l’une des plus utilisées dans les essais cliniques portant sur le TE8. Le test se divise en trois grandes parties. Dans la première, le clinicien évalue la localisation et l’amplitude du tremblement selon un score de 0 (aucun) à 4 (sévère avec une amplitude de plus de 4 cm). Dans la deuxième partie du test, le médecin évalue les fonctions motrices comme écrire, dessiner et l’aptitude à verser de l’eau d’un verre à un autre. Dans la troisième partie, il apprécie les habilités fonctionnelles comme manger, s’habiller, parler, boire, ainsi que les activités sociales, selon un score de 0 (normal) à 4 (sévère)8.
Les mécanismes physiopathologiques du TE restent peu connus. L’hypothèse actuelle est que le cervelet, qui participe au contrôle de la motricité et des gestes fins, pourrait jouer un rôle clé dans l’apparition de la maladie1. Certains auteurs évoquent l’hypothèse d’un dysfonctionnement du rythme des oscillations électriques de la voie cérébello-thalamocorticale générés par l’olive bulbaire inférieure1. Toutefois, les connaissances actuelles ne permettent pas de savoir s’il s’agit d’une cause ou d’une conséquence du TE. Par ailleurs, bien qu’auparavant considéré comme bénin, certaines études nous amènent à se demander si le TE ne serait pas une maladie avec une composante neurodégénérative9–11. Par exemple, des études neuropathologiques réalisées à partir de cervelets provenant de patients atteints de TE décédés ont mis en évidence certains signes de dégénérescence touchant les cellules de Purkinje9. L’hypothèse actuelle est que ces anomalies conduiraient à une perte en transmission GABAergique dans la voie cérébello-thalamo-corticale12. Ce qu’il faut retenir est que les médicaments contre les tremblements agissent au sein du système nerveux central (SNC) et visent des cibles qui se trouveraient dans les structures de cet axe, soit l’olive bulbaire inférieure, le cervelet ou le thalamus.
L’étiologie exacte du TE n’est pas connue à ce jour. Le TE est souvent décrit comme un ensemble de maladies hétérogènes d’origine multifactorielle dans la documentation scientifique1.
L’hérédité pourrait jouer un rôle dans un bon nombre de cas de TE. En effet, près de 50 à 70 % des patients atteints de TE présenteraient des antécédents familiaux au premier ou au deuxième degré1. Cependant, la caractérisation des bases génétiques du TE représente un grand défi. Les connaissances actuelles ne permettent pas de mettre en cause un seul gène déterminé, puisque plusieurs variantes de gènes différents pourraient conduire à un phénotype similaire. Des polymorphismes du gène DRD3 codant pour les récepteurs à dopamine D3 localisés dans les ganglions de la base et du gène HS1 binding protein-3 (HSl-BP3) ont été observés dans certaines familles atteintes de TE familial. Toutefois, le rôle de ces gènes dans la pathogenèse du TE demeure controversé13. À l’inverse, certaines études génomiques ont montré une forte corrélation entre des polymorphismes génétiques des gènes leucine-rich repeat and Ig domain containing 1 (LINGO-1) et solute carrier family 1, member 2 (SLC1A2 variante rs3794087) et le risque d’être atteint de TE14,15. LINGO-1 est une protéine transmembranaire, exprimée dans les neurones et les oligodendrocytes, qui empêche la régénération de l’axone16. Des analyses post mortem ont montré que les niveaux de cette protéine étaient plus élevés dans le cortex cérébelleux de sujets atteints de TE que dans celui de sujets sains10. Le gène SLC1A2 code pour la protéine excitatory amino acid transporter 2 (EAAT2) qui est un transporteur glial du glutamate régulant les taux de neurotransmetteurs excitateurs dans le milieu extracellulaire. Cependant, l’implication de ces protéines dans l’apparition du TE est encore loin d’être bien établie17,18.
Plusieurs patients sont atteints d’une forme dite sporadique de TE, en raison de l’absence d’antécédent familial. Plusieurs facteurs comme l’âge avancé, le sexe (homme), l’origine ethnique (caucasien) et les polymorphismes génétiques ont été associés à un risque accru d’apparition de la maladie1. Les facteurs environnementaux pourraient également contribuer à la survenue du TE1. Certaines neurotoxines, comme les alcaloïdes de type β-carboline, pourraient provoquer un TE en inhibant l’activité des récepteurs GABAergiques1,13. Des niveaux anormalement élevés d’harmane, un alcaloïde β-carboline d’origine végétale, ont été observés dans le plasma de patients atteints de TE19. Les alcaloïdes de type β-carboline se retrouvent dans divers aliments, notamment dans la viande cuite pendant longtemps à haute température ainsi que dans certaines plantes20. L’exposition aux pesticides, aux organofluorés ou aux métaux lourds augmenterait également le risque de TE13.
Les traitements disponibles sont uniquement symptomatiques et ne permettent donc pas de guérir la maladie. Le recours à la pharmacothérapie est utile pour améliorer la qualité de vie du patient lorsque les symptômes deviennent invalidants. Toutefois, elle ne permet pas une suppression complète des tremblements dans la majorité des cas et ne fonctionne pas pour tous les patients. En effet, on estime que près de 30 à 50 % des patients ne répondent pas aux traitements de première ligne21. L’essai de médicaments « hors indication » est donc chose courante dans le traitement du TE. Cependant, il est primordial d’exclure les éventuels facteurs iatrogènes avant de commencer un traitement pharmacologique (voir tableau II).
Une revue de la documentation scientifique portant sur la pharmacothérapie du tremblement essentiel a été effectuée au moyen d’une recherche d’articles scientifiques à partir de Pubmed entre 1975 et 2015 en utilisant les mots-clés suivants: adult, alprazolam, atenolol, benzodiazepines, botulinum toxin, clonazepam, deep brain stimulation, diazepam, essential tremor, gabapentin, lorazepam, metoprolol, nadolol, pediatrics, pharmacotherapy, phenobarbital, primidone, propranolol, sotalol, thalamotomy, topiramate. Les lignes directrices de l’American Academy of Neurology (AAN) sur les traitements du tremblement essentiel, révisées en 2011, ont également été consultées à titre de référence21. Les études sélectionnées comprennent principalement des essais cliniques à répartition aléatoire contrôlés par placébo ou par un autre agent pharmacologique. Certaines études ouvertes et séries de cas ont également été sélectionnées lorsqu’aucune donnée issue d’études à répartition aléatoire contrôlées n’était disponible.
En 2011, un comité d’experts de l’AAN a publié une mise à jour des recommandations de 2005 sur les traitements médicaux et pharmacologiques du TE (tableau I)21,22. La primidone et le propranolol demeurent à ce jour les traitements dont l’efficacité pour la maîtrise des tremblements des membres supérieurs, particulièrement des mains et des avant-bras, a été la mieux établie (niveau de recommandation A)21,22. Aucun changement n’a été apporté aux recommandations sur le topiramate après la publication de deux essais cliniques réalisés respectivement auprès de 208 et de 62 patients en 2006 et en 2008 (niveau de recommandation B)21,23,24. La clozapine, le zonisamide, l’olanzapine et la prégabaline ont été ajoutés à la liste des traitements qu’il n’est pas possible de promouvoir ou de déconseiller en raison des données existantes insuffisantes (niveau de recommandation U)21. Enfin, en 2015, le diazépam et le lorazépam ont été ajoutés à la liste des traitements dont l’efficacité n’a pas été établie par des essais comparatifs à répartition aléatoire (niveau de recommandation U)25.
Tableau I Classification de l’American Academy of Neurology des traitements du tremblement essentiel20,24
Le propranolol et la primidone sont utilisés comme traitements de première ligne du TE21. Jusqu’à présent, les essais cliniques ont démontré leur supériorité par rapport aux autres agents pharmacologiques, selon les évaluations effectuées à l’aide d’échelles mesurant le degré de sévérité clinique des symptômes et selon les données d’accélérométrie. L’efficacité du propranolol serait comparable à celle de la primidone, sauf en cas de tremblement de la tête, pour lequel le propranolol serait supérieur selon certaines études21,26–28. La primidone et le propranolol sont parfois utilisés en combinaison afin d’optimiser la maîtrise des symptômes pour les patients qui ne répondent pas de façon satisfaisante à la monothérapie21,29.
Mécanisme d’action
Le propranolol est un antagoniste β1- et β2-adrénergique non sélectif couramment utilisé comme agent de premier recours dans le traitement du TE21. À ce jour, il s’agit du seul traitement approuvé à détenir l’indication officielle par Santé Canada et la Food and Drug Administration (FDA) aux États-Unis. Le mécanisme par lequel il améliore le contrôle des tremblements n’est pas entièrement compris. On ne sait pas si l’action du propranolol est liée à un effet central ou périphérique. Certains auteurs avancent qu’il agirait préférentiellement en bloquant les récepteurs β 2- adrénergiques des fibres musculaires périphériques, bien que certaines données montrent que les antagonistes sélectifs β1 comme l’aténolol puissent également faire preuve d’une certaine efficacité30–32.
Évaluation de l’efficacité dans les essais cliniques
Le propranolol s’est avéré efficace pour réduire l’amplitude des tremblements des membres supérieurs de l’ordre de 50 à 60 % (intervalle: 32 à 75 %) pour 50 à 70 % des patients22,33. Jusqu’à maintenant, plus de 30 études menées auprès de plus de 500 patients au total ont évalué son efficacité pour traiter le TE22. En 2005, l’AAN lui a attribué un niveau de recommandation A selon les résultats positifs de 12 études à répartition aléatoire22. Son effet sur les tremblements de la tête et de la voix serait toutefois plus modeste23. Le propranolol a été évalué à des doses se situant entre 60 et 320 mg par jour21,22,31,34,35. Les avantages apportés par ce médicament seraient maximaux lorsque la dose quotidienne est comprise entre 160 et 320 mg par jour34. Cependant, pour certains patients, une dose de 120 mg pourrait être suffisante pour maîtriser les tremblements de façon optimale35. À l’opposé, il n’y a pas de données probantes en faveur de l’utilisation d’une dose supérieure à 320 mg31. Une telle dose expose le patient à un risque accru d’effets indésirables sans amélioration significative des symptômes34.
En raison de son absorption rapide, la prise ponctuelle d’une faible dose de propranolol (10 à 20 mg) est possible, à prendre 30 à 60 minutes avant une activité dans le cas où un patient présenterait des tremblements légers qui n’interféraient qu’avec certaines activités36. La forme à libération prolongée du propranolol aurait une efficacité similaire à la forme régulière et peut donc être envisagée pour faciliter la prise du médicament37,38. L’efficacité à long terme du propranolol n’a pas été étudiée. Par conséquent, des ajustements périodiques de doses peuvent s’avérer être nécessaires, selon l’évolution de la maladie ou la fréquence des effets indésirables22,35,39.
Effets indésirables
Les effets indésirables les plus fréquemment rapportés sont la fatigue, les étourdissements, la bradycardie, l’hypotension et les dysfonctions sexuelles38–40. Le propranolol est contre-indiqué pour les patients souffrant de troubles de la conduction cardiaque, de bradycardie, d’insuffisance cardiaque décompensée, d’asthme ou qui présentent un risque de bronchospasmes. Le caractère hautement lipophile du propranolol facilite son passage à travers la barrière hémato-encéphalique, ce qui entraine des effets sur le SNC; son utilisation à long terme est donc limitée, en particulier pour les patients gériatriques41. Les effets démontrés sur le SNC sont la confusion, la dépression, l’insomnie et les cauchemars. Les essais cliniques rapportent des taux d’abandon allant jusqu’à 20 %, survenant plus fréquemment dans les groupes de patients qui prenaient une dose quotidienne supérieure à 120 mg37,38.
Conclusion
Le propranolol demeure le premier choix de traitement pour les patients atteints de TE, sauf en cas de contre-indication.
Mécanisme d’action
La primidone est un anticonvulsivant de la famille des barbituriques utilisé comme traitement de première ligne du TE21,22. Le mécanisme d’action par lequel la primidone agit sur les tremblements est complexe et peu compris. La primidone est métabolisée en phényl-éthyl-malonamide (PEMA) et en phénobarbital, un anticonvulsivant commercialisé pour le traitement de l’épilepsie généralisée et focale42. Auparavant, on avait déduit que l’effet thérapeutique de la primidone sur le tremblement soit dû principalement à l’action de son principal métabolite, le phénobarbital, un potentialisateur du système GABAergique43,44. Toutefois, les résultats des essais cliniques évaluant l’efficacité du phénobarbital ne confirment pas clairement cette hypothèse43,44. Deux autres études à répartition aléatoire contrôlées par placébo, de courte durée, menées respectivement auprès de 13 et de 15 patients atteints de TE, ont montré que la primidone avait une efficacité supérieure au phénobarbital seul, malgré des taux sériques de phénobarbital inférieurs à ceux de la primidone28,45. Ces deux mêmes études ont montré que le phénobarbital n’était pas plus efficace que le placébo, ce qui laisse penser que la molécule mère (primidone) possède une activité pharmacologique qui lui est propre et qui serait en partie responsable de son effet thérapeutique28,45. L’une des hypothèses actuelles est que la primidone bloquerait l’activation des canaux sodiques et calciques voltage-dépendants, résultant en une diminution de l’amplitude du tremblement46.
Évaluation de l’efficacité dans les essais cliniques
La primidone administrée à des doses allant de 50 à 1 000 mg par jour a été associée à une baisse moyenne de 50 à 60 % (intervalle: 42–76 %) de l’amplitude du tremblement pour près de 50 % des patients21,22,33. L’AAN lui a attribué un niveau de recommandation A en se basant sur les résultats de 12 essais cliniques incluant au total 218 patients21,22. La primidone serait particulièrement efficace pour le traitement du tremblement des membres supérieurs, mais ses effets sur les tremblements de la tête, des cordes vocales ou de la langue sont mitigés47,48. Les études n’ont pas évalué l’efficacité à long terme (au-delà de 12 mois) de ce médicament. Néanmoins, une perte d’efficacité aurait été observée chez certains patients suivis pendant une période de 12 mois, possiblement due à l’évolution de la maladie49. Un ajustement des doses peut donc s’avérer nécessaire au cours d’un traitement à long terme.
Effets indésirables
La fréquence des effets indésirables en début de traitement est un facteur qui limite considérablement l’utilisation de ce médicament, particulièrement en gériatrie. Les effets de toxicité aigus, qui surviennent généralement dans les premières 12 à 72 heures du traitement, requièrent un arrêt de traitement pour près de 10 à 25 % des patients27,47,50. Une combinaison de symptômes de gravité variable, comme les étourdissements, l’ataxie, la sédation ainsi que les nausées et les vomissements, survient fréquemment en début de traitement27,47. Une étude incluant 40 patients avait montré que le fait de commencer le traitement avec une faible dose du médicament (62,5 mg) n’avait pas de conséquences sur la fréquence de ces effets toxiques aigus50. Cependant, en pratique, on préconise tout de même une titration très progressive des doses par précaution. La primidone n’est disponible au Canada que sous la forme de comprimés sécables de 125 mg ou de 250 mg. La dose initiale recommandée est de 31,25 mg (soit 1/4 d’un comprimé de 125 mg) au coucher42. La majorité des patients qui répondent de manière positive au traitement obtiennent une maitrise optimale de leurs tremblements à une dose de 250 mg par jour51. L’utilisation de fortes doses – jusqu’à 750 à 1 000 mg par jour – est controversée depuis que l’administration d’une faible dose de primidone (250 mg par jour) a été associée à une efficacité non inférieure et à un meilleur profil d’innocuité comparativement à l’utilisation d’une forte dose (750 mg par jour) sur une période de 12 mois dans une étude réalisée auprès de 113 patients et publiée en 200351.
L’innocuité à long terme de la primidone demeure mal établie. Une étude comparant la primidone (50–250 mg par jour) et le propranolol (80–160 mg par jour) sur une période de 12 mois semble indiquer que la primidone pourrait être mieux tolérée que le propranolol sur le long terme42. Le suivi de la concentration sérique de la primidone et de son principal métabolite, le phénobarbital, n’est pas effectué de façon systématique, car il n’existe pas de taux cibles propres au traitement du TE. En raison des faibles doses administrées (autour de 250 mg par jour), le dosage de la primidone n’est réalisé que pour les patients montrant des signes de surdosage (nausées, vomissements, ataxie, somnolence, nystagmus, etc.)42. Le suivi des concentrations plasmatiques permet de vérifier si un surdosage pourrait expliquer l’apparition de certains symptômes.
Interactions médicamenteuses
Une attention particulière doit être portée aux interactions médicamenteuses potentielles. La primidone (phénobarbital) est un puissant inducteur du cytochrome P450, plus particulièrement des isoenzymes CYP1A2, 2B6, 2C8, 3A4, 2C9 et 2C19, qui peut considérablement perturber le métabolisme d’un bon nombre de médicaments, comme la warfarine et les contraceptifs oraux42.
Conclusion
Tout comme le propranolol, la primidone est associée à une recommandation de niveau A. Toutefois, pour la personne âgée, notamment polymédicamentée, le traitement par primidone doit être employé avec prudence car il entraine plus d’effets indésirables que le traitement par propranolol. Selon le type de patient (p. ex. patient âgé), certains cliniciens préfèreront d’abord tenter un traitement par des agents de seconde ligne avant d’envisager d’utiliser la primidone.
Les études semblent montrer une supériorité des antagonistes non sélectifs (propranolol, sotalol) comparativement aux antagonistes sélectifs (métoprolol, aténolol)30–32,40,52,53.
Aténolol
La substitution du propranolol par un antagoniste β-adrénergique sélectif pourrait être envisagée pour un patient qui ne tolère pas le propranolol ou qui présente un risque de bronchospasmes, bien que dans ce dernier cas on privilégiera d’autres options thérapeutiques. L’aténolol demeure l’antagoniste β-adrénergique sélectif le mieux évalué, avec trois études à répartition aléatoire à double insu et contrôlées par placébo30,31,40. Les évaluations cliniques et les tests d’accélérométrie montrent une amélioration du tremblement de l’ordre de 24 à 38 % pour les patients (n = 9–24) qui ont reçu l’aténolol à des doses variant de 50 à 150 mg par jour30,31,40.
SotalolLe sotalol est à la fois un antagoniste β-adrénergique non sélectif et un antiarythmique de classe III. Il est indiqué principalement dans le traitement de certaines arythmies. Deux études portant respectivement sur neuf et 24 patients ont évalué son efficacité contre le TE31,40. L’utilisation de doses comprises entre 75 et 200 mg pourrait entrainer une diminution de l’ordre de 30 à 50 % de la sévérité des symptômes, selon les évaluations cliniques31,40. Bien que le sotalol semble bien toléré dans les études, il demeure peu utilisé dans le traitement du TE en raison de ses propriétés pro-arythmiques31,40,54. En effet, plusieurs cas d’arythmies ventriculaires et de prolongation dose-dépendante de l’intervalle QT corrigé (QTc) ont été signalés chez des patients traités avec le sotalol54. Le sotalol ne doit donc pas être utilisé de façon systématique en raison de son profil d’innocuité.
Conclusion
Plusieurs autres antagonistes β-adrénergiques, comme le métoprolol, le pindolol et le nadolol ont été étudiés dans le cadre des traitements du TE, mais ils demeurent peu utilisés, soit en raison d’un manque de données concernant leur efficacité, soit parce que les essais cliniques ont montré leur inefficacité25. Le propranolol est l’antagoniste β-adrénergique dont l’efficacité contre le TE a été la mieux évaluée. Il demeure le traitement de première intention.
Mécanisme d’action
Le topiramate est l’un des anticonvulsivants les mieux évalués dans le traitement du TE. Les lignes directrices américaines l’ont classé parmi les traitements de deuxième intention et lui ont attribué un niveau de recommandation B d’après les résultats de trois études comparatives à répartition aléatoire21–24,55. Son mode d’action sur les tremblements est complexe et mal défini, mais il pourrait être lié à une modulation du système GABAergique et à un blocage des canaux sodiques56.
Évaluation de l’efficacité dans les essais cliniques
Le topiramate permettrait une amélioration clinique des tremblements d’environ 30 à 40 %27. Il a été étudié en monothérapie ou comme adjuvant à des doses allant jusqu’à 400 mg par jour (médiane: 375 mg par jour; moyenne: 292 mg par jour)24. Une étude multicentrique incluant 208 patients a montré une diminution moyenne de 29 % de la sévérité du tremblement, évaluée à l’aide de l’échelle de Fahn-Tolosa-Marin, comparativement à une amélioration moyenne de 16 % avec le placébo (p<0,001; intervalle de confiance à 95 % [IC95 %]:6,5–18,4) après 24 semaines de traitement incluant une période de 12 semaines à dose stable24. Étonnamment, quelques données anecdotiques qui proviennent de rapports de cas indiquent qu’une faible dose de topiramate (50 à 100 mg par jour) pourrait être suffisante pour maitriser les symptômes de certains patients57. Cependant, aucun essai clinique à répartition aléatoire n’a pu confirmer l’efficacité du topiramate à faible dose58. Il n’y aurait pas de corrélation entre la concentration plasmatique du médicament et son efficacité23,24.
Effets indésirablesLe profil d’innocuité du topiramate est un facteur qui limite fortement son utilisation. Plusieurs études ont rapporté un taux d’abandon pouvant atteindre 30 à 40 %, en raison des effets indésirables23,24,55. La perte d’appétit, la fatigue, les paresthésies, les nausées et les troubles de l’attention ou de la concentration sont des effets indésirables fréquemment signalés dans les études. Des troubles de la parole et un ralentissement psychomoteur ont également été observés chez certains patients23,24,55. Plusieurs cas d’acidose métabolique et d’hyperchlorémie ont été signalés durant la prise du médicament. Le topiramate augmenterait l’excrétion rénale de HCO3- en inhibant l’anhydrase carbonique. Le suivi devrait donc comprendre une surveillance des gaz veineux et de la chlorémie59. Enfin, il est important de mentionner aux patients de maintenir un apport hydrique adéquat pour diminuer le risque (rare) de néphrolithiase59.
Interactions médicamenteuses
Le topiramate a relativement peu d’effets sur le métabolisme des autres médicaments59. Cependant, une hausse de 25 % de la concentration plasmatique de phénytoïne a été signalée pour certains patients, possiblement due à l’inhibition (faible) du CYP2C1959. De plus, à haute dose (plus de 200 mg par jour), le topiramate est également un faible inducteur du CYP3A4. Ce médicament peut entrainer une baisse significative du taux plasmatique des œstrogènes contenus dans les contraceptifs oraux, ce qui diminue l’efficacité de ces derniers59. Le topiramate est principalement éliminé par excrétion rénale sous forme inchangée (70 %) et doit être utilisé avec précaution en cas d’insuffisance rénale modérée à sévère. Une réduction de 50 % de la dose est recommandée lorsque la clairance de la créatinine est inférieure à 70 ml/min59.
Conclusion
Le topiramate semble un bon choix de traitement de deuxième ligne sur le plan de l’efficacité. Toutefois, son principal inconvénient est qu’il requiert une titration lente et progressive sur plusieurs semaines afin de limiter ses effets indésirables59.
Mécanisme d’action
La gabapentine est un anticonvulsivant dérivé de l’acide aminé γ-aminobutyrique (ou GABA) utilisé comme agent de deuxième ligne en monothérapie21,22. L’AAN lui a attribué un niveau de recommandation B en se fondant sur les résultats, bien que mitigés, de trois essais cliniques à répartition aléatoire et contrôlés par placébo21,22,60–62. Son mécanisme d’action contre le TE n’est pas entièrement connu. Bien qu’il s’agisse d’un analogue du GABA, la gabapentine ne se lie pas directement aux récepteurs GABAA ou GABAB63. Certains auteurs avancent qu’elle agirait en bloquant l’activation des canaux calciques et sodiques voltage-dépendants et en amplifiant l’action du GABA dans le SNC63.
Évaluation de l’efficacité dans les essais cliniques
La gabapentine a été évaluée en monothérapie ou en traitement adjuvant à des doses variant de 1 200 à 3 600 mg par jour60–62. Une seule des trois études a montré une amélioration clinique significative des symptômes, évaluée selon une échelle objective et standardisée. Dans une étude publiée en 2006 qui incluait 16 patients, Gironell et coll. ont montré que la gabapentine, utilisée en monothérapie à une dose de 1 200 mg par jour, diminuait de l’ordre de 40 % la sévérité clinique du tremblement, selon les évaluations effectuées à l’aide de l’échelle Fahn-Tolosa-Marin. Son efficacité serait similaire à une dose de 120 mg de propranolol et serait supérieure à celle du placébo60. Dans cette même étude, une diminution de l’ordre de 77 % de l’amplitude du tremblement a été rapportée après 15 jours de traitement, selon les mesures obtenues par accélérométrie60. À l’inverse, deux autres études ayant évalué l’efficacité de la gabapentine à des doses variant de 1 800 à 3 600 mg par jour, dans le cadre d’une polythérapie, rapportent une amélioration clinique modeste61,62. Dans l’étude menée par Ondo et coll., l’efficacité de la dose de 3 600 mg n’a pas été démontrée supérieure à celle de 1 800 mg61. Enfin, aucune de ces études n’a montré de corrélation entre la concentration plasmatique de gabapentine et son efficacité clinique60–62. D’autres études à répartition aléatoire portant sur un plus grand nombre de patients sont requises afin de mieux évaluer l’efficacité réelle de la gabapentine en monothérapie ou comme traitement adjuvant.
Effets indésirables
Les principaux effets indésirables rapportés dans les études sont la fatigue, les étourdissements, la nausée et la somnolence. Le traitement est généralement bien toléré et le taux d’abandons liés aux effets indésirables est relativement faible60–62.
Interactions médicamenteuses
La gabapentine n’est pas métabolisée par les CYP450 et elle n’influe pas sur le métabolisme des autres médicaments64. Son élimination se fait entièrement par excrétion rénale sous forme inchangée dans l’urine. Un ajustement de la dose est requis en cas d’insuffisance rénale, lorsque la clairance de la créatinine est inférieure à 60 ml/min64.
Conclusion
La gabapentine reste un choix valable en cas d’échec thérapeutique ou lorsque le patient présente des contre-indications aux agents de première ligne.
Mécanisme d’action
Les benzodiazépines (BZD) sont parfois utilisées pour aider à maitriser le TE21,22. Leur effet pharmacologique serait dû à la potentialisation de l’activité GABAergique de par leur action agoniste sur les récepteurs GABAA63. L’alprazolam et le clonazépam sont les seules BZD dont l’efficacité a été évaluée par des études contrôlées par placébo, bien que ces études présentent certaines limites méthodologiques65–67.
Alprazolam
L’alprazolam, qui est couramment utilisé dans les troubles paniques, est la BZD la mieux évaluée dans les études portant sur le TE. L’AAN lui a attribué un niveau de recommandation B en raison des résultats de deux études à répartition aléatoire à double insu, contrôlées par placébo21,22,65,66. Dans ces deux études, qui incluaient respectivement 22 et 24 patients, une diminution significative de la sévérité des tremblements de l’ordre de 30 % (25–34 %), évaluée sous forme de score clinique, a été rapportée à des doses d’alprazolam variant de 0,125 mg à 3 mg par jour65,66. Son effet anxiolytique et son début d’action rapide (Tmax ≈ 1 h) peuvent être utiles pour les patients qui nécessitent une thérapie intermittente durant des activités sociales ou des situations stressantes, lorsque le tremblement devient invalidant46,65.
Clonazépam
Le clonazépam pourrait également être utile pour certains patients qui présenteraient un tremblement à prédominance cinétique67. Dans une étude portant sur 14 patients, le clonazépam pris à une dose de 0,5 à 6 mg par jour a été associé à une diminution de l’ordre de 30 à 60 % de la sévérité des tremblements de type cinétique. Toutefois, aucun effet sur les tremblements posturaux n’a été observé67.
Autres benzodiazépines
D’autres BZD, comme le diazépam et le lorazépam, sont parfois utilisées dans le traitement du TE. Toutefois, aucune étude contrôlée par placébo n’a été effectuée. Les données actuelles ne permettent pas d’appuyer ni de s’opposer à l’utilisation de ces BZD dans ce contexte25.
Effets indésirables
Les BZD semblent relativement bien tolérées dans les études à court terme65–67. Les effets indésirables les plus fréquemment signalés dans les études portant sur le TE sont la fatigue et la sédation65–67. Cependant, des symptômes cognitifs, comme une confusion et des troubles mnésiques, sont parfois observés chez certains patients qui consomment des BZD, en particulier les personnes âgées68.
Conclusion
Le niveau de preuve est insuffisant pour que l’on puisse recommander les BZD en monothérapie, surtout sur le long terme25,69. Il serait préférable de limiter leur utilisation à un traitement d’appoint pour les patients qui ne répondent pas de façon satisfaisante aux agents pharmacologiques usuels en monothérapie ou pour les patients pour lesquels une prise occasionnelle suffit pour maîtriser les symptômes. De plus, en raison du risque potentiel d’abus et de dépendance, les BZD doivent être utilisées avec prudence et doivent être évitées lorsque l’on peut avoir recours à d’autres alternatives thérapeutiques.
La nimodipine, un médicament de la classe des dihydropyridines et bloqueur des canaux calciques de type L, a été évaluée dans une seule étude70. L’AAN lui a attribué un niveau de recommandation C (efficacité possible) malgré les résultats mitigés de l’étude. Parmi les 16 patients inclus dans l’étude, seulement huit d’entre eux ont signalé une amélioration de leurs tremblements. En raison du faible niveau de preuve de son efficacité, la nimodipine n’est pas couramment utilisée dans la pratique clinique courante. Elle demeure néanmoins une option thérapeutique qui peut être envisagée en cas d’échec d’un traitement avec des agents de première et de deuxième ligne.
Plusieurs autres médicaments ont été étudiés dans le traitement du TE. Dans la majorité des cas, le manque d’études ou des données contradictoires font que les données probantes sont insuffisantes pour statuer sur leur efficacité (tableau I)21,22,25.
Mécanisme d’action
La toxine botulique de type A est sécrétée par Clostridium botulinum, la bactérie responsable du botulisme, une maladie responsable de paralysies musculaires71. L’injection locale intramusculaire de toxine botulique A purifiée, un agent paralytique neuromusculaire, bloque l’action des nerfs des muscles en inhibant la libération d’acétylcholine (un neurotransmetteur excitateur) dans la jonction neuromusculaire. Cette inhibition bloque la contraction musculaire et provoque une relaxation des muscles71. Cette technique est utilisée comme option de traitement du TE pour les patients qui présentent un tremblement résistant aux agents pharmacologiques oraux21,22.
Formulations commercialisées au Canada
La toxine botulique de type A est commercialisée sous la forme de trois formulations différentes: onabotulinumtoxineA (BotoxMD), incobotulinumtoxineA (XeominMD) et abobotulinumtoxineA (DysportMD)72. Les toxines botuliques de type A de ces trois formulations ne sont pas bioéquivalentes72. Elles se distinguent par leur procédé de fabrication et par leur poids moléculaire respectif, qui peuvent moduler la pharmacocinétique de la molécule et ainsi nécessiter des ajustements de doses72. Jusqu’à présent, l’onabotulinumtoxineA est la seule formulation ayant été évaluée adéquatement par des essais cliniques pour le traitement du TE73–76.
Évaluation de l’efficacité dans les essais cliniques
L’onabotulinumtoxineA aurait une efficacité modeste pour soulager le tremblement des mains21. Quelques données montrent certains avantages thérapeutiques contre le tremblement postural des mains74. Toutefois, aucun effet sur le tremblement cinétique n’a été observé74. Ce médicament serait particulièrement utile pour les patients qui présentent un tremblement de la tête ou de la voix21,75,76. Les doses d’onabotulinumtoxineA évaluées dans les études sont très variables d’un patient à l’autre et dépendent principalement du type de muscles affectés par les tremblements74–76. Les injections peuvent être répétées tous les trois ou quatre mois pour conserver l’effet thérapeutique. La dose cumulative ne doit toutefois pas dépasser 400 unités tous les trois mois71.
Effets indésirables
Certains effets indésirables, comme une douleur au site d’injection et la perte de force musculaire, sont fréquemment rapportés71,74–76. Dans le cas des injections dans les cordes vocales, les patients signalent fréquemment une dysphonie et des difficultés de déglutition et, plus rarement, des difficultés respiratoires71,74–76.
Conclusion
L’onabotulinumtoxineA demeure une option thérapeutique intéressante à envisager avant la chirurgie lorsque les agents pharmacologiques oraux ne sont pas efficaces pour un patient qui présente un tremblement des cordes vocales ou de la tête. Des études supplémentaires sont nécessaires afin de mieux évaluer l’efficacité de cette molécule contre le tremblement des mains.
Traitements chirurgicaux
Dans les cas plus sévères de TE résistants à la pharmacothérapie, certains patients peuvent bénéficier d’interventions chirurgicales. L’expertise du neurochirurgien est essentielle pour qu’il puisse déterminer si le patient est un bon candidat à la chirurgie, en raison des risques de complications opératoires. La stimulation cérébrale profonde (SCP) et la thalamotomie sont deux interventions qui se sont montrées efficaces pour le traitement du TE sévère21,77–81.
Stimulation cérébrale profonde
La SCP unilatérale ou bilatérale du noyau ventral intermédiaire du thalamus (VIM) est une technique parfois utilisée pour les patients atteints de TE sévère réfractaire aux traitements pharmacologiques. La SCP est recommandée comme première approche chirurgicale pour le traitement du TE21. Cette intervention permettrait d’obtenir une amélioration clinique de l’ordre de 30 à 90 % selon la localisation du tremblement33,77–80. L’effet perdurerait pendant plus de cinq ans pour certains patients79. Toutefois, dans plusieurs cas, une tolérance à la SCP apparaît, entrainant une recrudescence des symptômes qui nécessite un ajustement du voltage et de la fréquence des impulsions électriques33,77. Les effets indésirables les plus fréquemment rapportés sont la dysarthrie, les céphalées, les paresthésies, les dystonies et, parfois, les troubles d’équilibre33,77–79. Ces complications peuvent être atténuées par un réajustement des paramètres de réglage des électrodes33. La SCP est une procédure invasive qui comporte certains risques opératoires pour le patient. Le recours à cette technique repose sur l’évaluation du rapport risques/avantages pour le patient.
Thalamotomie
La thalamotomie est une intervention chirurgicale qui consiste à créer une lésion unilatérale ou bilatérale irréversible dans le noyau VIM du thalamus. Cette technique permettrait de réduire de façon significative les tremblements pour 80 à 90 % des patients atteints de TE, voire même de supprimer ces tremblements33,80. Les effets indésirables les plus fréquemment rapportés sont une dysarthrie, une aphasie, une confusion, une somnolence, une faiblesse et une paralysie faciale. Le recours à la thalamotomie bilatérale n’est pas recommandé, car elle entraîne un risque de complications plus fréquentes et graves81. Aujourd’hui, la SCP est préférée à cette chirurgie qui est associée à un risque accru de complications neurologiques80.
Thalamotomie par bistouri à rayons gamma ou par ultrasons
La thalamotomie par bistouri à rayons gamma ou la thalamotomie par ultrasons sont deux techniques prometteuses constituant des options thérapeutiques possibles pour un patient présentant un fort risque de complications et qui ne peuvent pas recevoir un traitement par SCP ou par thalamotomie chirurgicale classique33,82–84. Malgré les données encourageantes, d’autres essais cliniques comparatifs portant sur un plus grand nombre de patients sont nécessaires pour évaluer l’efficacité et l’innocuité à long terme de ces deux techniques82–85.
Plusieurs facteurs sont connus pour exacerber les tremblements, notamment l’anxiété, l’hyperthyroïdie, le tabagisme, le sevrage d’alcool, la caféine et l’utilisation de certains médicaments (tableau II)40,85,86. Certaines mesures peuvent être proposées au patient, comme l’arrêt de la consommation de tabac ou une limite de la consommation de caféine, car elles peuvent contribuer à diminuer significativement les tremblements. Si le patient présente des troubles anxieux, le pharmacien peut discuter avec lui de différentes mesures non pharmacologiques qu’il peut utiliser, comme les techniques de détente, la méditation et le yoga, et des avantages qu’il pourrait en retirer en ce qui concerne la maîtrise des tremblements.
L’efficacité de la pharmacothérapie du TE chez les enfants et les adolescents est peu présente dans la documentation scientifique. L’absence d’essai clinique à répartition aléatoire contrôlé par placébo est problématique. Les recommandations reposent donc uniquement sur quelques données anecdotiques issues d’un nombre très limité de rapports de cas87. Cela peut s’expliquer par le fait que dans la majorité des cas, le recours à un traitement pharmacologique est rarement requis avant l’adolescence puisque, durant l’enfance, les symptômes sont généralement légers et interfèrent peu ou pas du tout avec les habilités fonctionnelles de la vie quotidienne, comme écrire, dessiner, prendre un objet et manger88. En 2009, Ferrara et Jankovic ont élaboré un algorithme de traitement du TE adapté aux enfants et l’ont publié dans la revue Pediatrics Drugs88.
Le propranolol serait l’agent de première ligne pour certains enfants et adolescents atteints de TE83. Une série de cas publiés par Louis et coll. rapportent que cinq des 19 patients âgés entre cinq et 18 ans (médiane: 14 ans) recevaient un traitement pharmacologique, à savoir du propranolol, de la primidone ou du clonazépam87. Deux des trois patients ayant reçu une monothérapie de propranolol à une dose se situant entre 20 et 60 mg par jour ont rapporté avoir bien répondu au traitement. Toutefois, aucune mesure objective n’a été utilisée pour quantifier l’efficacité de ces traitements dans cette population, contrairement à ce qui a été fait dans les études réalisées chez l’adulte87. Dans les cas où un traitement est entrepris, la dose initiale de propranolol recommandée est de 0,5 à 1 mg/kg/jour et peut être augmentée progressivement jusqu’à 4 mg/kg/jour selon l’efficacité et le degré de tolérance du traitement88. Le propranolol peut être pris de façon régulière ou intermittente, selon les besoins du patient.
Les traitements de seconde ligne comprennent la primidone, le topiramate, la gabapentine, les benzodiazépines (clonazépam) et la toxine botulique A88. Toutefois, il s’agit de recommandations provenant de données issues de rapports de cas portant sur un très petit nombre de patients ou obtenues par extrapolation des résultats des études réalisées auprès de patients adultes88. Dans une série de cas publiée par Jankovic et coll. en 2004, seulement deux des neuf patients traités avec la primidone ont répondu de façon positive au traitement89. Le clonazépam, le topiramate et la gabapentine n’ont jamais été étudiés comme traitement du TE chez l’enfant ou l’adolescent, bien qu’ils soient couramment utilisés pour traiter l’épilepsie. L’utilisation de la toxine botulique de type A n’a jamais été évaluée chez les enfants atteints de TE88. Néanmoins, il existe certaines données d’innocuité portant sur son utilisation pour d’autres indications, comme la spasticité infantile90.
Le recours systématique à la pharmacothérapie n’est pas recommandé. Seuls les enfants qui ont des tremblements plus sévères nuisant aux activités quotidiennes doivent être traités. Le TE est un handicap pouvant faire l’objet d’intimidation à l’école. Il est important d’expliquer à l’enfant qu’il n’est pas seul à souffrir de cette maladie. Certaines mesures d’aide à l’école peuvent être utiles, comme l’aide à la prise de notes.
Le manque de données probantes est un problème courant pour un bon nombre de médicaments testés comme traitement du TE. Les études publiées comportent plusieurs limites méthodologiques, comme un petit nombre de patients et une courte durée de traitement. De plus, les méthodes utilisées pour quantifier l’efficacité du médicament ne sont pas toujours bien définies. L’un des plus grands problèmes, signalé notamment par Deuschl et coll. en 2011, est la diversité des méthodes utilisées pour quantifier l’effet d’un médicament sur le tremblement33.
Ce n’est qu’au début des années 90 que des échelles d’évaluation standardisées – comme l’échelle Fahn-Marin- Tolosa (FMT) qui n’a été validée officiellement qu’en 2007 – ont été progressivement intégrées aux protocoles des essais cliniques afin de permettre une évaluation plus objective du traitement33,91. L’efficacité d’un traitement évaluée par accélérométrie n’est pas égale à l’efficacité évaluée selon une échelle de type FMT. Par exemple, dans l’étude Gironell et coll. en 1999, la gabapentine a été associée à une amélioration du tremblement de l’ordre de 77 % selon l’accélérométrie, comparativement à 39 % selon l’échelle FMT60. L’interprétation des résultats peut donc s’avérer complexe lorsque les études utilisent des méthodologies distinctes. Néanmoins, les lignes directrices élaborées par l’AAN en fonction du niveau de preuve scientifique ont permis de déterminer les traitements pharmacologiques les plus susceptibles d’être efficaces chez les patients atteints de TE (voir tableau III)20,24.
Tableau III Principaux traitements utilisés pour le tremblement essentiel46,85
Le pharmacien joue un rôle pivot dans le suivi de l’observance et de la persistance au traitement sur le long terme, deux problèmes fréquents associés au traitement de maladies chroniques. Le tableau IV offre des ressources à ce sujet pour les patients13,92–94.
Tableau IV Ressources disponibles pour les patients13,92–94
Le choix du traitement dépend principalement de la localisation du tremblement, des antécédents médicaux du patient et du profil d’effets indésirables des médicaments. Dans la majorité des cas, les traitements disponibles sont uniquement symptomatiques et ne permettent pas la résolution complète des symptômes. Puisqu’il existe une très grande variabilité interindividuelle de réponse à un même traitement, il est impossible de prévoir l’efficacité d’un traitement pour un patient donné. Il est donc important d’établir des objectifs thérapeutiques réalistes.
Les travaux du laboratoire sur le tremblement essentiel sont financés par l’Association des personnes concernées par le tremblement essentiel (APTES) et par l’International Essential Tremor Foundation (IETF). Aucun financement direct en relation avec le présent article n’a été déclaré par les auteurs. Jessica Virgili est récipiendaire d’une bourse salariale de Merck Canada, des fonds d’enseignement et de recherche de la Faculté de pharmacie de l’Université Laval (FER) et du Centre de recherche du Centre hospitalier universitaire de Québec (Desjardins). Frédéric Calon est récipiendaire d’une bourse salariale des Fonds de recherche du Québec – Santé (FRQ-S).
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Boutin E, Vaugoyeau M, Eusebio A, Azulay JP, Witjas T. News and controversies regarding essential tremor. Rev Neurol (Paris) 2015;171:415–25.
2. Louis ED, Ferreira JJ. How common is the most common adult movement disorder? Update on the worldwide prevalence of essential tremor. Mov Disord 2010;25:534–41.
3. Jain S, Lo SE, Louis ED. Common misdiagnosis of a common neurological disorder: how are we misdiagnosing essential tremor? Arch Neurol 2006;63:1100–4.
4. Deuschl G, Bain P, Brin M. Consensus statement of the Movement Disorder Society on Tremor. Ad Hoc Scientific Committee. Mov Disord 1998;13(suppl. 3):2–23.
5. Bain P, Brin M, Deuschl G, Elble R, Jankovic J, Findley L et coll. Criteria for the diagnosis of essential tremor. Neurology 2000;54(suppl. 4):S7.
6. Louis ED, Asabere N, Agnew A, Moskowitz CB, Lawton A, Cortes E et coll. Rest tremor in advanced essential tremor: a post-mortem study of nine cases. J Neurol Neurosurg Psychiatry 2011;82:261–5.
7. Mostile G, Jankovic J. Alcohol in essential tremor and other movement disorders. Mov Disord 2010;25:2274–84.
8. Fahn S, Tolosa E, Concepcion M. Clinical rating scale for tremor. Dans: Jankovic J, Tolosa E, éd. Parkinson’s Disease and Movement Disorders, 2e éd. Vol. 1993. Baltimore: Williams and Wilkins; pp. 271–80.
9. Choe M, Cortes E, Vonsattel JP, Kuo SH, Faust PL, Louis ED. Purkinje cell loss in essential tremor: random sampling quantification and nearest neighbor analysis. Mov Disord 2016;31:393–401.
10. Delay C, Tremblay C, Brochu E, Paris-Robidas S, Emond V, Rajput AH et coll. Increased LINGO1 in the cerebellum of essential tremor patients. Mov Disord 2014;29:1637–47.
11. Beliveau E, Tremblay C, Aubry-Lafontaine E, Paris- Robidas S, Delay C, Robinson C et coll. Accumulation of amyloid-beta in the cerebellar cortex of essential tremor patients. Neurobiol Dis 2015;82:397–408.
12. Paris-Robidas S, Brochu E, Sintes M, Emond V, Bousquet M, Vandal M et coll. Defective dentate nucleus GABA receptors in essential tremor. Brain 2012;135:105–16.
13. Association des personnes concernées par le tremblement essentiel (APTES). Site internet officiel de l’APTES. [en ligne] http://www.aptes.org/ (site visité le 6 juin 2016).
14. Kuhlenbaumer G, Hopfner F, Deuschl G. Genetics of essential tremor: meta-analysis and review. Neurology 2014;82:1000–7.
15. Thier S, Lorenz D, Nothnagel M, Poremba C, Papengut F, Appenzeller S et coll. Polymorphisms in the glial glutamate transporter SLC1A2 are associated with essential tremor. Neurology 2012;79:243–8.
16. Jepson S, Vought B, Gross CH, Gan L, Austen D, Frantz JD et coll. LINGO-1, a transmembrane signaling protein, inhibits oligodendrocyte differentiation and myelination through intercellular self-interactions. J Biol Chem 2012;287:22184–95.
17. Yu SW, Chen CM, Chen YC, Chang CW, Chang HS, Lyu RK et coll. SLC1A2 variant is associated with essential tremor in Taiwanese population. PLoS One 2013;8:e71919.
18. Garcia-Martin E, Martinez C, Alonso-Navarro H, Benito-Leon J, Lorenzo-Betancor O, Pastor P et coll. No association of the SLC1A2 rs3794087 allele with risk for essential tremor in the Spanish population. Pharmacogenet Genomics 2013; 23:587–90.
19. Louis ED, Zheng W, Mao X, Shungu DC. Blood harmane is correlated with cerebellar metabolism in essential tremor: a pilot study. Neurology 2007;69:515–20.
20. Louis ED, Zheng W, Jiang W, Bogen KT, Keating GA. Quantification of the neurotoxic beta-carboline harmane in barbecued/grilled meat samples and correlation with level of doneness. J Toxicol Environ Health A 2007;70:1014–9.
21. Zesiewicz TA, Elble RJ, Louis ED, Gronseth GS, Ondo WG, Dewey RB, Jr., et coll. Evidence-based guideline update: treatment of essential tremor: report of the Quality Standards subcommittee of the American Academy of Neurology. Neurology 2011;77:1752–5.
22. Zesiewicz TA, Elble R, Louis ED, Hauser RA, Sullivan KL, Dewey RB, Jr., et coll. Practice parameter: therapies for essential tremor: report of the Quality Standards Subcommittee of the American Academy of Neurology. Neurology 2005;64:2008–20.
23. Connor GS, Edwards K, Tarsy D. Topiramate in essential tremor: findings from double-blind, placebo-controlled, crossover trials. Clin Neuropharmacol 2008;31:97–103.
24. Ondo WG, Jankovic J, Connor GS, Pahwa R, Elble R, Stacy MA et coll. Topiramate in essential tremor: a double-blind, placebo-controlled trial. Neurology 2006;66:672–7.
25. Zesiewicz TA, Kuo SH. Essential tremor. Systematic Review 1206. BMJ Clin Evid 2015. [en ligne] http://clinicalevidence.bmj.com.acces.bibl.ulaval.ca/x/systematic-review/1206/overview.html (site visité le 24 février 2016).
26. Koller WC. Propranolol therapy for essential tremor of the head. Neurology 1984;34:1077–9.
27. Findley LJ, Cleeves L, Calzetti S. Primidone in essential tremor of the hands and head: a double blind controlled clinical study. J Neurol Neurosurg Psychiatry 1985;48:911–5.
28. Sasso E, Perucca E, Fava R, Calzetti S. Quantitative comparison of barbiturates in essential hand and head tremor. Mov Disord 1991;6:65–8.
29. Koller W, Biary N, Cone S. Disability in essential tremor: effect of treatment. Neurology 1986;36:1001–4.
30. Larsen TA, Teravainen H, Calne DB. Atenolol vs. propranolol in essential tremor. A controlled, quantitative study. Acta Neurol Scand 1982;66:547–54.
31. Leigh PN, Jefferson D, Twomey A, Marsden CD. Beta-adrenoreceptor mechanisms in essential tremor; a double-blind placebo controlled trial of metoprolol, sotalol and atenolol. J Neurol Neurosurg Psychiatry 1983;46:710–5.
32. Larsen TA, Teravainen H. Beta 1 versus nonselective blockade in therapy of essential tremor. Adv Neurol 1983;37:247–51.
33. Deuschl G, Raethjen J, Hellriegel H, Elble R. Treatment of patients with essential tremor. Lancet Neurol 2011;10:148–61.
34. Koller WC. Dose-response relationship of propranolol in the treatment of essential tremor. Arch Neurol 1986;43:42–3.
35. Dupont E, Hansen HJ, Dalby MA. Treatment of benign essential tremor with propranolol. A controlled clinical trial. Acta Neurol Scand 1973;49:75–84.
36. Calzetti S, Findley LJ, Gresty MA, Perucca E, Richens A. Effect of a single oral dose of propranolol on essential tremor: a double-blind controlled study. Ann Neurol 1983;13:165–71.
37. Koller WC. Long-acting propranolol in essential tremor. Neurology 1985;35:108–10.
38. Cleeves L, Findley LJ. Propranolol and propranolol-LA in essential tremor: a double blind comparative study. J Neurol Neurosurg Psychiatry 1988;51:379–84.
39. Koller WC, Vetere-Overfield B. Acute and chronic effects of propranolol and primidone in essential tremor. Neurology 1989;39:1587–8.
40. Jefferson D, Jenner P, Marsden CD. Beta-adrenoreceptor antagonists in essential tremor. J Neurol Neurosurg Psychiatry 1979;42:904–9.
41. Neil-Dwyer G, Bartlett J, McAinsh J, Cruickshank JM. Beta-adrenoceptor blockers and the blood-brain barrier. Br J Clin Pharmacol 1981;11:549–53.
42. Association des pharmaciens du Canada. Monographie des barbituriques. [en ligne] https://www-e-therapeutics-ca.acces.bibl.ulaval.ca/search (site visité le 24 février 2016).
43. Baruzzi A, Procaccianti G, Martinelli P, Riva R, Denoth F, Montanaro N et coll. Phenobarbital and propranolol in essential tremor: a double-blind controlled clinical trial. Neurology 1983;33:296–300.
44. Findley LJ, Cleeves L. Phenobarbitone in essential tremor. Neurology 1985;35:1784–7.
45. Sasso E, Perucca E, Calzetti S. Double-blind comparison of primidone and phenobarbital in essential tremor. Neurology 1988;38:808–10.
46. Hedera P, Cibulcik F, Davis TL. Pharmacotherapy of essential tremor. J Cent Nerv Syst Dis 2013;5:43–55.
47. Gorman WP, Cooper R, Pocock P, Campbell MJ. A comparison of primidone, propranolol, and placebo in essential tremor, using quantitative analysis. J Neurol Neurosurg Psychiatry 1986;49:64–8.
48. Nida A, Alston J, Schweinfurth J. Primidone therapy for essential vocal tremor. JAMA Otolaryngol Head Neck Surg 2015:1–5.
49. Sasso E, Perucca E, Fava R, Calzetti S. Primidone in the long-term treatment of essential tremor: a prospective study with computerized quantitative analysis. Clin Neuropharmacol 1990;13:67–76.
50. O’Suilleabhain P, Dewey RB, Jr. Randomized trial comparing primidone initiation schedules for treating essential tremor. Mov Disord 2002;17:382–6.
51. Serrano-Duenas M. Use of primidone in low doses (250 mg/day) versus high doses (750 mg/day) in the management of essential tremor. Double-blind comparative study with one-year follow-up. Parkinsonism Relat Disord 2003;10:29–33.
52. Calzetti S, Findley LJ, Gresty MA, Perucca E, Richens A. Metoprolol and propranolol in essential tremor: a double-blind, controlled study. J Neurol Neurosurg Psychiatry 1981;44:814–9.
53. Calzetti S, Findley LJ, Perucca E, Richens A. Controlled study of metoprolol and propranolol during prolonged administration in patients with essential tremor. J Neurol Neurosurg Psychiatry 1982;45:893–7.
54. Neuvonen PJ, Elonen E. The role of concentration-effect relationships in the QTc interval prolongation: case sotalol. Br J Clin Pharmacol 2015;79:1040–1.
55. Connor GS. A double-blind placebo-controlled trial of topiramate treatment for essential tremor. Neurology 2002;59:132–4.
56. White HS, Brown SD, Woodhead JH, Skeen GA, Wolf HH. Topiramate modulates GABA-evoked currents in murine cortical neurons by a nonbenzodiazepine mechanism. Epilepsia 2000;41(suppl. 1):S17–20.
57. Zesiewicz TA. Low-dose topiramate (Topamax) in the treatment of essential tremor. Clin Neuropharmacol 2007;30:247–8.
58. Frima N, Grunewald RA. A double-blind, placebo-controlled, crossover trial of topiramate in essential tremor. Clin Neuropharmacol 2006;29:94–6.
59. Janssen.Inc. Monographie du topiramate (TopamaxMD), Toronto (Ontario). [en ligne] https://www.janssen.com/canada/sites/www_janssen_com_canada/files/product/pdf/top03042015cpmf_nc.pdf (site visité le 25 février 2016).
60. Gironell A, Kulisevsky J, Barbanoj M, Lopez-Villegas D, Hernandez G, Pascual-Sedano B. A randomized placebo-controlled comparative trial of gabapentin and propranolol in essential tremor. Arch Neurol 1999;56:475–80.
61. Ondo W, Hunter C, Vuong KD, Schwartz K, Jankovic J. Gabapentin for essential tremor: a multiple-dose, double-blind, placebo-controlled trial. Mov Disord 2000;15:678–82.
62. Pahwa R, Lyons K, Hubble JP, Busenbark K, Rienerth JD, Pahwa A et coll. Double-blind controlled trial of gabapentin in essential tremor. Mov Disord 1998;13:465–7.
63. Gironell A. The GABA hypothesis in essential tremor: lights and shadows. Tremor Other Hyperkinet Mov 2014;4:254.
64. Pfizer.Inc. Monographie du gabapentin (NeurontinMD), Kirkland (Québec). [en ligne] http://www.pfizer.ca/sites/g/files/g10028126/f/201512/GDgabapentin_PM_190327_21Dec2015_E.pdf (site visité le 25 février 2016).
65. Gunal DI, Afsar N, Bekiroglu N, Aktan S. New alternative agents in essential tremor therapy: double-blind placebo-controlled study of alprazolam and acetazolamide. Neurol Sci 2000;21:315–7.
66. Huber SJ, Paulson GW. Efficacy of alprazolam for essential tremor. Neurology 1988;38:241–3.
67. Biary N, Koller W. Kinetic predominant essential tremor: successful treatment with clonazepam. Neurology 1987;37:471–4.
68. Quevillon F, Bédard M. Benzodiazépines: conséquences sur le fonctionnement mnésique des personnes âgées. Santé mentale au Québec 2003;28:23–41.
69. Bruno E, Nicoletti A, Quattrocchi G, Filippini G, Zappia M, Colosimo C. Alprazolam for essential tremor. Cochrane Database Syst Rev 2015;12:CD009681.
70. Biary N, Bahou Y, Sofi MA, Thomas W, al Deeb SM. The effect of nimodipine on essential tremor. Neurology 1995;45:1523–5.
71. Allergan I. Monographie de l’onabotulinumtoxineA (BotoxMD), Markham (Ontario). [en ligne] http://www.allergan.ca/assets/pdf/ca_botox_pm_fr.pdf (site visité le 25 février 2016).
72. Ravenni R, De Grandis D, Mazza A. Conversion ratio between Dysport and Botox in clinical practice: an overview of available evidence. Neurol Sci 2013;34:1043–8.
73. Hallett M, Albanese A, Dressler D, Segal KR, Simpson DM, Truong D et coll. Evidence-based review and assessment of botulinum neurotoxin for the treatment of movement disorders. Toxicon 2013;67:94–114.
74. Brin MF, Lyons KE, Doucette J, Adler CH, Caviness JN, Comella CL et coll. A randomized, double masked, controlled trial of botulinum toxin type A in essential hand tremor. Neurology 2001;56:1523–8.
75. Pahwa R, Busenbark K, Swanson-Hyland EF, Dubinsky RM, Hubble JP, Gray C et coll. Botulinum toxin treatment of essential head tremor. Neurology 1995;45:822–4.
76. Justicz N, Hapner ER, Josephs JS, Boone BC, Jinnah HA, Johns MM 3rd. Comparative effectiveness of propranolol and botulinum for the treatment of essential voice tremor. Laryngoscope 2016;126:113–7.
77. Putzke JD, Uitti RJ, Obwegeser AA, Wszolek ZK, Wharen RE. Bilateral thalamic deep brain stimulation: midline tremor control. J Neurol Neurosurg Psychiatry 2005;76:684–90.
78. Borretzen MN, Bjerknes S, Saehle T, Skjelland M, Skogseid IM, Toft M et coll. Long-term follow-up of thalamic deep brain stimulation for essential tremor—patient satisfaction and mortality. BMC Neurol 2014;14:120.
79. Schuurman PR, Bosch DA, Merkus MP, Speelman JD. Long-term follow-up of thalamic stimulation versus thalamotomy for tremor suppression. Mov Disord 2008;23:1146–53.
80. Schuurman PR, Bosch DA, Bossuyt PM, Bonsel GJ, van Someren EJ, de Bie RM et coll. A comparison of continuous thalamic stimulation and thalamotomy for suppression of severe tremor. N Engl J Med 2000;342:461–8.
81. Koller W, Hristova A. Efficacy and safety of stereotaxic surgical treatment of tremor disorders. Eur J Neurol 1996;3:507–14.
82. Witjas T, Carron R, Krack P, Eusebio A, Vaugoyeau M, Hariz M et coll. A prospective single-blind study of Gamma knife thalamotomy for tremor. Neurology 2015;85:1562–8
83. Ohye C, Higuchi Y, Shibazaki T, Hashimoto T, Koyama T, Hirai T et coll. Gamma knife thalamotomy for Parkinson disease and essential tremor: a prospective multicenter study. Neurosurgery 2012;70:526–35.
84. Elias WJ, Huss D, Voss T, Loomba J, Khaled M, Zadicario E et coll. A pilot study of focused ultrasound thalamotomy for essential tremor. N Engl J Med 2013;369:640–8.
85. Soland V. L’essentiel du tremblement essentiel… en dix questions. Le médecin du Québec 2012;47:23–9.
86. Arbaizar B, Gomez-Acebo I, Llorca J. Postural induced-tremor in psychiatry. Psychiatry Clin Neurosci 2008;62:638–45.
87. Louis ED, Dure LSt, Pullman S. Essential tremor in childhood: a series of nineteen cases. Mov Disord 2001;16:921–3.
88. Ferrara J, Jankovic J. Epidemiology and management of essential tremor in children. Paediatr Drugs 2009;11:293–307.
89. Jankovic J, Madisetty J, Vuong KD. Essential tremor among children. Pediatrics 2004;114:1203–5.
90. Goldstein EM. Safety of high-dose botulinum toxin type A therapy for the treatment of pediatric spasticity. J Child Neurol 2006;21:189–92.
91. Stacy MA, Elble RJ, Ondo WG, Wu SC, Hulihan J, TRS Study Group. Assessment of interrater and intrarater reliability of the Fahn-Tolosa-Marin Tremor Rating Scale in essential tremor. Mov Disord 2007;22:833–8.
92. APTES (association des personnes concernées par le tremblement essentiel). [en ligne] http://www.aptes.org/communaute/groupes-desoutien/ (site visité le 6 juin 2016).
93. Fondation internationale du tremblement essentiel. [en ligne] http://www.essentialtremor.org/international/francais/index.php (site visité le 6 juin 2016).
94. Essential Tremor Canada. [en ligne] essential-tremorcanada. org (site visité le 6 juin 2016).
PHARMACTUEL, Vol. 49, No. 3, 2016