Karl Dufresne1,2, Camille Petit2,3, Denis Lebel4, B.Pharm., M.Sc., FCSHP, Jean-François Bussières5,6, B.Pharm., M.Sc., M.B.A., FCSHP
Reçu le 14 avril 2016; Accepté après révision le 12 septembre 2016
Résumé
Objectif : Situer les principales exigences réglementaires et normatives en matière de traçabilité du circuit du médicament aux États-Unis, en Europe et au Canada. L’objectif secondaire est d’illustrer les mesures de traçabilité en place au sein du Centre hospitalier universitaire Sainte-Justine au Québec.
Mise en contexte : L’émergence de la contrefaçon de médicaments et la mise à jour des exigences en recherche clinique ont contribué à la révision du cadre normatif entourant la traçabilité des médicaments.
Résultats : Les exigences réglementaires sont plus élevées aux États-Unis et en Europe qu’au Canada. Pour sécuriser le circuit du médicament, les États-Unis ont adopté une sérialisation par dose alors que l’Europe exige une sérialisation par format. La traçabilité d’un médicament repose sur une sérialisation de chaque dose ou format, et nécessite le regroupement des éléments suivants dans une base de données : numéro unique, nom du médicament, nom du fabricant, numéro de lot et date de péremption. Cette sérialisation peut être soutenue par identification par radiofréquence ou par codes-barres en deux dimensions, ce qui entraîne des coûts importants. Au Canada, aucune sérialisation n’est exigée. Seuls des registres papier sont exigés. Au Centre hospitalier Sainte-Justine, des efforts de traçabilité sont amorcés.
Conclusion : Les États-Unis et l’Europe ont adopté des changements législatifs qui obligent le recours au code-barres 2D qui indiquent le numéro de lot et la date de péremption pour assurer la traçabilité du médicament. Le Canada n’exige pour le moment que le code-barres à une dimension. Il est possible d’assurer la traçabilité en recherche, mais il est difficile de l’implanter en soins usuels.
Mots clés : Circuit du médicament, distribution, recherche clinique, sérialisation, traçabilité
Abstract
Objective: To situate the main regulatory and normative requirements concerning traceability in the medication circuit in the United States, Europe and Canada. The secondary objective was to present the traceability measures in place at Centre hospitalier universitaire Sainte-Justine in Quebec.
Background: The emergence of drug counterfeiting and the updating of clinical research requirements have led to an overhaul of the normative framework for drug traceability.
Results: The United States and Europe have stricter regulatory requirement than Canada. To secure the medication circuit, the United States has adopted dose serialization, whereas Europe requires package serialization. Drug traceability is based on the serialization of each dose or package, where the following are entered into a database: a unique number, the drug’s name, the manufacturer’s name, the lot number and the expiry date. This serialization can be supported by radiofrequency or 2D barcode identification, which entails significant costs. No serialization is required in Canada, only paper log books. Traceability initiatives have started at the Centre hospitalier universitaire Sainte-Justine.
Conclusion: The United States and Europe have adopted legislative changes requiring the use of 2D barcodes to ensure drug traceability, including the lot number and expiry date. At this point in time, only 1-D barcodes are required in Canada. Traceability can be provided in a research context, but it is difficult to institute in the context of usual care.
Keywords: Clinical research, distribution, medication circuit, serialization, traceability
Selon le Grand Dictionnaire terminologique, on définit la traçabilité comme étant la « capacité de trouver, pour un objet donné, la trace de chacune des étapes de sa conception, de sa fabrication et de sa distribution ainsi que la provenance de ses composants. La traçabilité permet d’abord de veiller au contrôle de la qualité de tout le circuit de production d’un bien, quel qu’il soit. »1.
Le circuit du médicament est complexe et comporte au moins 54 étapes2. Afin de sécuriser le circuit, un cadre législatif et normatif détaillé propose de nombreuses pratiques organisationnelles requises et d’autres bonnes pratiques3,4. La sécurité du patient et la protection contre les produits issus de la contrefaçon sont des éléments qui ont motivé le développement de la traçabilité des médicaments5. De nouveaux besoins visant à s’adapter à l’évolution de ce cadre réglementaire émergent afin de soutenir le circuit du médicament. En ce qui concerne la qualité et la conformité du médicament, les intervenants de santé souhaitent notamment limiter les risques de contrefaçon des médicaments achetés sur le marché canadien6. En matière de recherche et de pharmacovigilance, les autorités exigent davantage de traçabilité des doses dispensées, dont le numéro du produit, le numéro du fabricant et le numéro de lot7,8. Concernant la logistique, les intervenants de santé veulent optimiser la gestion des dates de péremption9. Quant à la gestion des risques, les gestionnaires des risques et les professionnels de santé veulent profiter des nouvelles technologies pour retrouver la trace des différents actes effectués et des intervenants concernés.
Ce code-barres correspond au Global Trade Item Number (GTIN) soit un code numérique à 14 chiffres, dont la mention (01) qui confirme qu’il s’agit d’un code GTIN, suivie du numéro du fabricant à cinq chiffres, du format d’emballage à deux chiffres, du numéro du produit chez le fabricant à cinq chiffres et d’un chiffre vérificateur de somme de la séquence numérique, soit un code à dix chiffres qui correspond au code universel de produit. Certains fabricants apposent plus d’un GTIN sur leurs formats de vente (p. ex. certains fournisseurs de solutés apposent un GTIN de produit (01), mais aussi un code-barres de numéro du lot précédé de la mention (10) et un code-barres de la date de péremption précédé de la mention (17)). L’utilisation de multiples codes-barres n’est pas pratique et oblige l’utilisateur à lire chacun des codes-barres avant de trouver une information précise.
Bien qu’une majorité d’intervenants soit en faveur d’une traçabilité accrue mentionnant le numéro de lot et la date de péremption du produit utilisé, cette traçabilité n’est pas possible à large échelle, étant donné que la mention de ces deux éléments n’est pas intégrée à l’étiquetage par code-barres des médicaments au Canada10. Une lecture visuelle et une retranscription de ces données sont inapplicables à l’échelle d’un département de pharmacie, compte tenu des milliers, voire des millions de doses dispensées. En outre, les intervenants du réseau de la santé ne demandent pas nécessairement une sérialisation par dose, parce qu’ils n’en voient pas réellement les avantages au quotidien.
Nous nous sommes intéressés à l’état des lieux en matière de traçabilité dans le cadre du circuit du médicament à l’échelle mondiale, comme aux États-Unis et en Europe, et à l’échelle locale, soit au Canada avec l’exemple d’un centre hospitalier universitaire québécois.
Il s’agit d’une revue de la littérature de 1970 à nos jours. L’objectif principal est de situer les principales exigences réglementaires et normatives en matière de traçabilité du circuit du médicament aux États-Unis, en Europe et au Canada. L’objectif secondaire est d’illustrer les mesures de traçabilité en place au sein du Centre hospitalier universitaire Sainte-Justine au Québec.
Afin de déterminer les principales exigences réglementaires et normatives en matière de traçabilité du circuit du médicament aux États-Unis, en Europe et au Canada, nous avons consulté et extrait des sites web de la Food and Drug Administration, de l’European Medicine Agency et de Santé Canada des documents pertinents à partir de la stratégie de recherche suivante : [traçabilité, traceability, numéro de lot, lot number, date de péremption, expiration date, chaîne d’approvisionnement du médicament, drug supply chain, étiquetage, labelling, codes-barres, barcode, GTIN]. Nous avons effectué cette recherche sur PubMed, Google Scholar et Google. À partir des documents consultés, nous avons établi un fil chronologique des actes liés à la traçabilité du médicament de 1974 à 2016.
Afin d’illustrer les mesures de traçabilité en place au sein du CHU Sainte-Justine, en avril 2016, nous avons recensé par observation directe les différentes approches de gestion de la traçabilité. L’équipe de recherche a ensuite examiné les possibilités envisagées dans les prochaines années en tenant compte des changements réglementaires, des améliorations de processus et des ajouts d’équipements.
Le concept de traçabilité existe depuis l’Antiquité11. Il a d’abord permis d’assurer la traçabilité des actes notariés au moyen de la signature authentique des parties, le lieu et la date. Le concept de traçabilité s’est précisé avec l’évolution de l’agriculture et des élevages. Il était nécessaire au 19e siècle de marquer le bétail afin d’en identifier plus facilement le propriétaire. Plus tard, le marquage des bêtes a permis d’établir un lien entre certains animaux et les risques infectieux et de contamination. Dans le domaine de la santé et du médicament, le concept de traçabilité est apparu au 20e siècle, et il a été mis en évidence dans plusieurs pays au début des années 90, notamment avec le scandale du sang contaminé12. Le tableau présentant le profil chronologique des actes clés liés à l’histoire de la traçabilité du médicament est disponible en annexe.
Avec le développement d’organismes réglementaires entourant la recherche, la fabrication et la mise en marché, les éléments relatifs à la traçabilité ont inclus progressivement le nom du fabricant, le nom, le numéro de lot et la date de péremption des matières premières et des produits finis. Avec l’émergence de la contrefaçon médicamenteuse, l’idée d’une sérialisation (similaire à celle du numéro apposé sur un billet de banque) a fait son chemin, et l’industrie pharmaceutique fait la promotion d’une sérialisation par format ou par dose afin de faciliter la détection de médicaments contrefaits.
Le tableau présentant le profil des principales exigences réglementaires et normatives en matière de traçabilité du circuit du médicament aux États-Unis et en Europe est disponible en annexe.
Au Canada, les dispositions relatives à la traçabilité des médicaments reposent sur la Loi sur les aliments et drogues, sa réglementation et ses lignes directrices (p. ex. bonnes pratiques cliniques, bonnes pratiques de fabrication, bonnes pratiques de pharmacovigilance)7,8,13,14. En ce qui concerne la recherche clinique et la fabrication, les éléments exigés en termes de traçabilité comportent le nom du fabricant, le nom du médicament, le numéro de lot et la date péremption8,13,15. Aucune sérialisation par format ou par dose n’est exigée bien qu’elle soit offerte par certains promoteurs en recherche clinique. Quant à l’étiquetage du médicament, il doit inclure notamment le nom du fabricant, le nom du médicament, la quantité, le numéro de lot et la date de péremption. Des codes-barres peuvent être apposés sur l’étiquette s’ils ne nuisent pas à sa conformité9. Si les fabricants sont tenus de tenir un registre de vente mentionnant les lots et les dates de péremption, cette obligation n’est pas applicable aux grossistes et aux pharmaciens d’établissements et d’officine. Il arrive toutefois qu’un grossiste soit en mesure de recevoir et de transmettre les données relatives aux numéros de lots et dates de péremption de stocks lorsque ces renseignements sont contenus dans une transaction électronique. Ainsi, lors d’un retrait du marché, le fabricant doit être en mesure d’aviser les pharmaciens du numéro de lot et de la date de péremption concernés. Toutefois, le pharmacien procédant à ce retrait doit faire un examen visuel des stocks résiduels sans prise en compte des stocks dispensés. En 2008, Lovis propose une revue de littérature sur la traçabilité dans le domaine de la santé5. Bien que les premiers articles scientifiques publiés aient été recensés dès 1967, l’auteur note un essor à partir des années 2000. De tous les articles recensés, la majorité provient des États-Unis contre un seul du Canada. L’auteur confirme le besoin croissant d’assurer la traçabilité des personnes et des biens, dont les médicaments, dans le circuit hospitalier malgré les nombreux défis et obstacles. Il détermine huit avantages offerts par une traçabilité adéquate en santé, soit l’amélioration de l’efficience de la chaîne logistique, la prévention des erreurs, les enjeux de santé publique, les enquêtes médicolégales, la recherche et l’épidémiologie clinique, la gestion de processus, la facturation et la prévention de la contrefaçon. En outre, l’auteur souligne plusieurs enjeux d’ordre éthique, politique, pratique et technologique.
Dans la littérature, on retrouve peu de données sur la traçabilité appliquée spécifiquement au circuit du médicament. Quelques fabricants de médicaments ont eu recours à la détection par radiofréquence afin d’accroître la traçabilité de certains produits, de la production à la dispensation par le pharmacien (p. ex. ViagraMD Pfizer)16,17. Quelques auteurs soulignent l’importance de la traçabilité dans le cadre d’audits de pratique18. Martinez-Pérez et coll. illustrent la mise en place d’un suivi de la traçabilité en utilisant la détection par radiofréquence19,20. Méthot et coll. rappellent l’importance d’assurer la traçabilité de toutes les doses de médicaments dispensées dans le cadre de la recherche clinique21
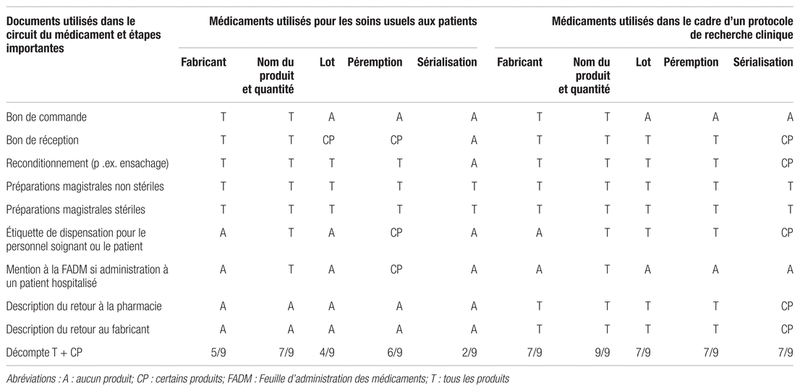
Enfin, le tableau I illustre les mesures de traçabilité en place au sein de notre établissement et présente la description et le profil des éléments tracés pour les soins usuels offerts aux patients et en recherche clinique au Centre hospitalier universitaire Sainte-Justine. La traçabilité est possible sans que les données de traçabilité ne soient accessibles en temps réel pour un usager. Par exemple, l’ensachage de formes orales solides ne permet pas toujours la mention du nom du fabricant sur le sachet. Toutefois, la mention du numéro de lot et de la date de péremption d’une dose donnée sur un sachet permet de retrouver le nom du fabricant en consultant la base de données de l’ensacheuse.
Tableau I Description et éléments tracés pour les soins usuels offerts aux patients et en recherche clinique au Centre hospitalier universitaire Sainte-Justine (2016)
De façon générale, il est possible de tracer le nom du produit et la quantité utilisée tout au long du circuit du médicament. Le nom du fabricant est généralement traçable à la pharmacie, mais il ne l’est pas au chevet du patient. Les numéros de lots et la date de péremption peuvent être tracés lorsqu’il s’agit d’une préparation magistrale. Une application web locale permet de lire systématiquement les codes-barres GTIN du produit commercial et d’inscrire le numéro de lot et la date de péremption du fabricant pour chaque dose de préparations magistrales stériles et non stériles. En oncologie, un module web permet d’indiquer la date et l’heure de réception à la pharmacie et de début d’utilisation de chaque médicament, ainsi que le numéro du lot et la date de péremption. Ce module permet de répondre aux exigences de traçabilité en recherche clinique, mais il offre les mêmes renseignements pour les soins usuels. Bien qu’il ne s’agisse pas d’une traçabilité à la dose, chaque dose administrée comporte elle aussi une date et une heure d’administration et un appairage des données est possible en tout temps étant donné l’archivage de l’historique de toutes les réceptions et utilisations. À la différence des soins usuels prodigués aux patients, la recherche clinique exige une traçabilité complète, comportant le nom du fabricant, le nom du produit, la quantité, le numéro de lot, la date de péremption. De plus en plus de protocoles de recherche prévoient un numéro de sérialisation par dose. Lorsque ce numéro de sérialisation est disponible en recherche clinique, il doit être systématiquement tracé.
Cette revue de la littérature présente un état des lieux de la traçabilité des médicaments. Les États-Unis et la communauté européenne ont fait le choix de sécuriser leur circuit du médicament en introduisant le concept de sérialisation, ce qui facilitait la traçabilité complète du médicament. Les Américains ont fait le choix de sérialiser chaque dose de médicaments tandis que les Européens ont choisi de sérialiser chaque format de médicaments. Cette différence n’est pas étonnante compte tenu des modes de dispensation propres à chaque environnement juridique. Aux États-Unis, la distribution unitaire quotidienne de médicaments est largement répandue et les organismes de certification, les cliniciens et les patients s’attendent à cette sérialisation par dose. Aux États-Unis encore, une majorité d’établissements utilisent des lecteurs de code-barres pour confirmer l’identité de l’intervenant de santé et du patient ainsi que le nom du médicament à administrer. Le remplacement des codes-barres 1D (c.-à-d. numéro GTIN sans numéro de lot et date de péremption) par des codes-barres 2D avec lot et péremption nécessite le remplacement des lecteurs, mais ne change pas le processus de soins infirmiers. La décision de sérialiser chaque dose de médicament n’est sans doute pas étrangère à l’épidémie de méningites fongiques survenue dans 20 États américains en 2012–2013. Cette contamination fongique de trois lots de préparations magistrales du New England Compounding Center (novembre 2012, décembre 2012, février 2013) a infecté 753 patients, dont 64 sont décédés22.
En Europe, la distribution globale est encore largement pratiquée et la pharmacie dispense souvent le médicament aux unités de soins en format plutôt qu’en dose. Il revient au personnel soignant de prélever la dose requise à partir d’une feuille d’administration de médicaments en version papier ou électronique issue de retranscriptions manuscrites ou d’un prescripteur électronique. La sérialisation du format apparaît suffisante compte tenu du nombre limité d’établissements ayant recours à la distribution unitaire nominative.
Au Canada, force est de constater un retard législatif. À notre connaissance, les travaux menés jusqu’à maintenant ne permettent que l’utilisation conforme de code-barres 1D de type GTIN permettant l’identification du produit.
Notre revue met en évidence un nombre très limité d’articles relatifs à la traçabilité des médicaments et particulièrement en établissement de santé. Bien que les pharmaciens soient conscients de l’utilité d’assurer une pleine traçabilité des doses de médicaments achetées, préparées, validées et dispensées tant à l’officine qu’à l’hôpital, il apparaît peu réaliste d’atteindre cet objectif sans exigence juridique et sans une utilisation plus optimale des technologies.
Au centre hospitalier universitaire Sainte-Justine, des efforts ont été faits pour satisfaire aux exigences en matière de traçabilité et même pour les surpasser. Nous pensons utile de faire connaître ces initiatives afin de contribuer à accroître l’intérêt pour ces solutions pratiques et de favoriser leur déploiement. S’il est possible d’assurer manuellement une traçabilité complète de tous les éléments décrits précédemment en recherche clinique compte tenu du nombre circonscrit de protocoles et de doses dispensées, il est impensable de penser pouvoir assurer une traçabilité complète de toutes les doses de médicaments en indiquant les numéros de lots et les dates de péremption à toutes les étapes du circuit du médicament, et ce, sans codes-barres 2D, qui comportent le numéro de lot, la date de péremption, probablement un numéro de sérialisation lié à une banque de données, des outils logiciels et des lecteurs codes-barres. En outre, on peut envisager le réétiquetage local avec code-barres 2D complet, lorsque cela sera possible. Les départements de pharmacie qui procèdent au réemballage de médicaments aux fins de dispensation par robot peuvent accroître leur capacité de traçabilité. Ainsi, nos travaux ont mis en évidence l’état actuel de la situation et le chemin à parcourir. De plus, cette revue de la littérature a démontré la nécessité de discuter avec les fournisseurs de logiciels informatiques afin d’améliorer nos processus de traçabilité et d’informatisation. Par exemple, la mise en place d’une interface bidirectionnelle entre un grossiste et un établissement de santé devrait prévoir l’échange des numéros de lots et des dates de péremption lors de transactions, lorsque cette pratique sera applicable. Les logiciels utilisés en soutien aux préparations magistrales devraient permettre, le cas échéant, l’inscription manuelle ou par lecture de code-barres conformes indiquant les numéros de lots et dates de péremption. L’utilisation de l’identification par radioétiquette devrait être envisagée pour certains éléments du circuit du médicament, étant donné que les radioétiquettes permettent la sérialisation et la référence à une base de données comportant tous les éléments de traçabilité.
Cette réflexion vise en somme à sensibiliser les pharmaciens hospitaliers canadiens à l’évolution législative aux États-Unis et en Europe portant sur la traçabilité et ses enjeux. Bien que le Canada accuse un retard législatif, il est raisonnable de penser que les changements apportés au marché américain profiteront rapidement au marché canadien si les intervenants requièrent un accès comparable à ces codes-barres 2D et à la sérialisation par dose de médicaments.
Les États-Unis et l’Europe ont adopté des changements législatifs importants qui obligent le recours au code-barres 2D indiquant le numéro de lot et la date de péremption pour assurer la traçabilité du médicament. Le Canada accuse un retard et n’exige pour le moment que le code-barres 1D. En outre, cette revue de la littérature jumelée à l’observation du fonctionnement du Centre hospitalier universitaire Sainte-Justine montre qu’il est possible d’assurer la traçabilité en recherche, mais qu’il est difficile de l’implanter à large échelle en soins usuels.
Cet article comporte une annexe; elle est disponible sur le site de Pharmactuel (www.pharmactuel.com).
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Office québécois de la langue française. Grand dictionnaire terminologique. Traçabilité. [en ligne] http://www.granddictionnaire.com/ficheOqlf.aspx?Id_Fiche=8369893 (site visité le 31 mars 2016).
2. Groupe de travail sur l’introduction de systèmes automatisés et robotisés utilisés pour la distribution des médicaments dans les établissements de santé au Québec. Les systèmes automatisés et robotisés utilisés pour la distribution des médicaments dans les établissements de santé au Québec. Rapport et recommandations du groupe de travail. [en ligne] http://publications.msss.gouv.qc.ca/acrobat/f/documentation/2005/05-719-01.pdf (site visité le 31 mars 2016).
3. Ordre des pharmaciens du Québec. Normes de pratique et lignes directrices. [en ligne] http://www.opq.org/fr-CA/publications/normes-de-pratiqueet-lignes-directrices/ (site visité le 31 mars 2016).
4. Agrément Canada Gestion des médicaments. [en ligne] https://accreditation.ca/fr/gestion-desm%C3%A9dicaments (site visité le 31 mars 2016).
5. Lovis C. Traceability in healthcare: crossing boundaries. Yearb Med Inform 2008:105–13.
6. Santé Canada. Politique sur les produits de santé de contrefaçon (POL-0048). [en ligne] http://www.hc-sc.gc.ca/dhp-mps/compli-conform/activit/pol_0048_counterfeit-contrefacon-fra.php (site visité le 31 mars 2016).
7. Santé Canada. Bonnes pratiques cliniques. [en ligne] http://www.hc-sc.gc.ca/dhp-mps/compliconform/clini-pract-prat/index-fra.php (site visité le 31 mars 2016).
8. Santé Canada. Lignes directrices sur les bonnes pratiques de pharmacovigilance. [en ligne] http://www.hc-sc.gc.ca/dhp-mps/compli-conform/gmp-bpf/docs/gui-0102_gvp-fra.php (site visité le 31 mars 2016).
9. Santé Canada. Ligne directrice – Étiquetage des médicaments pharmaceutiques destinés à l’usage humain. [en ligne] http://www.hc-sc.gc.ca/dhp-mps/prodpharma/applic-demande/guide-ld/label_guide_ld-fra.php (site visité le 31 mars 2016).
10. Institut canadien pour la sécurité des patients. La codification à barres permet de franchir une étape de plus vers une utilisation plus sécuritaire des médicaments au Canada [en ligne] https://www.ismp-canada.org/fr/codage_barres/download/codification_barres_presse_fev2010.pdf (site visité le 10 avril 2016).
11. Blancou J. A history of the traceability of animals and animal products. Rev Sci Tech 2001;20:413–25.
12. Zénova A, Paulhus C. Le scandale du sang contaminé. Radio-Canada. [en ligne] http://ici.radio-canada.ca/nouvelles/dossiers/sang/ (site visité le 31 mars 2016).
13. Santé Canada. Bonnes pratiques de fabrication. [en ligne] http://www.hc-sc.gc.ca/dhp-mps/compli-conform/gmp-bpf/index-fra.php (site visité le 15 août 2016).
14. Gouvernement du Canada. Loi sur les aliments et drogues (L.C.R. (1985), ch. F-27). [en ligne] http://laws-lois.justice.gc.ca/fra/lois/f-27/ (site visité le 18 août 2016).
15. Gouvernement du Canada. Règlement sur les aliments et drogues, C.R.C., ch. 870, C.05.001. [en ligne] http://laws-lois.justice.gc.ca/fra/reglements/C.R.C.,_ch._870/page-121.html#h-255 (site visité le 17 août 2016).
16. Taylor D. RFID in the pharmaceutical industry: addressing counterfeits with technology. J Med Syst 2014;38:141.
17. Gohring N. Pfizer to use RFID tags on Viagra to prevent fakes. Computerworld. Jan 9th, 2006. [en ligne] http://www.computerworld.com/article/2561273/enterprise-resource-planning/pfizer-to-use-rfid-tags-on-viagra-to-prevent-fakes.html (site visité le 17 août 2016).
18. Veyrier M, Bachalat N, Guenegou AL, Anne B, Leglise P, Huchon Becel D. Securing the therapy management during the leave permissions for the elderly patients. Ann Pharm Fr 2016;74:212–21.
19. Martínez Pérez M, Cabrero-Canosa M, Vizoso Hermida J, Carrajo García L, Llamas Gómez D, Vázquez González G et coll. Application of RFID technology in patient tracking and medication traceability in emergency care. J Med Syst 2012;36:3983–93.
20. Martínez Pérez M, Vázquez González G, Dafonte C. Safety and traceability in patient healthcare through the integration of RFID technology for intravenous mixtures in the prescription-validation-elaboration-dispensation-administration circuit to day hospital patients. Sensors (Basel) 2016;16:1–23.
21. Méthot J, Brisson D, Gaudet D. On-site management of investigational products and drug delivery systems in conformity with Good Clinical Practices (GCPs). Clinical Trials 2012;9:265–71.
22. Centers for Disease Control and Prevention. Multistate outbreak of fungal meningitis and other Infections [en ligne] http://www.cdc.gov/hai/outbreaks/meningitis.html (site visité le 31 mars 2016).
PHARMACTUEL, Vol. 50, No. 3, 2017