Marie-Ange Audet1, Élisabeth Forest1, Mihaela Friciu2, B.Pharm., M.Sc., Jean-Marc Forest3, B.Pharm., DPH, M.Sc., Grégoire Leclair4, B.Pharm., Ph.D.
Reçu le 10 juillet 2016; Accepté après révision par les pairs le 6 septembre 2016
Résumé
Objectif : Établir la compatibilité du citrate de caféine injectable avec 99 autres médicaments lors d’une administration en Y.
Méthode : Le citrate de caféine dosé à 20 mg/mL (équivalant à 10 mg/mL de caféine base) a été combiné (ratio 1:1) à 99 médicaments injectables non dilués (10 mL chacun) à la température ambiante. Chaque préparation a été réalisée deux fois. La première a subi une évaluation visuelle et un test de dénombrement des particules par obstruction de lumière immédiatement après le mélange. Ces tests ont été répétés quatre heures après le mélange en utilisant la seconde préparation. Pour être considérés comme compatibles, les mélanges ne devaient pas présenter de précipitation ou tout autre changement observable (turbidité, cristaux, formation de gaz, changement de couleur) et devaient respecter la spécification établie par la norme USP <788> 1.B, à la fois au temps zéro et quatre heures après le mélange.
Résultats : Au total, 80 des 99 médicaments injectables testés avec le citrate de caféine se sont révélés compatibles à la fois visuellement à l’œil nu et à l’aide du compteur de particules selon la norme USP <788>. L’incompatibilité des 19 autres médicaments a pu être vérifiée visuellement, car elles étaient nettement visibles. Mais dans le cas du propofol, il n’a pas été possible de démontrer sa compatibilité.
Conclusion : Un certain nombre de médicaments se sont révélés compatibles lorsqu’ils sont mélangés dans un ratio de 1:1 avec le citrate de caféine. Il faut cependant prendre en considération le fait que seuls les critères physiques ont été pris en compte dans cette étude.
Mots clés : Administration en Y, caféine, compatibilité
Abstract
Objective: To determine the compatibility of injectable caffeine citrate with 99 other drugs during Y-site administration.
Method: Caffeine citrate solution 20 mg/mL (equivalent to 10 mg/mL of caffeine base) was combined (1:1 ratio) with 99 undiluted injectable drugs (10 mL each) at room temperature. Each preparation was made in duplicate. One of the test samples underwent a visual evaluation and a light obscuration particle count test immediately after mixing. Four hours after mixing, these tests were repeated on the other test sample. To be considered compatible, a mixture had to be free of precipitate or any other observable change (turbidity, crystals, gas formation or colour change) and had to meet the specification for Test 1.B of standard USP <788>, both at time 0 and 4 hours after mixing.
Results: In all, 80 of the 99 injectable drugs tested with caffeine citrate were found to be compatible with it, both visually, with the unaided eye, and with the particle counter, as per standard USP <788>. We were able to ascertain the incompatibility of the other 19 drugs visually because it was visibly evident. The compatibility of propofol could, however, not be determined.
Conclusion: A certain number of drugs tested were found to be compatible with caffeine citrate when they were mixed in a ratio of 1:1. We must take into consideration that only physical criteria were used in this evaluation.
Keywords: Caffeine, compatibility, Y-site administration
Le citrate de caféine (C14H18N4O9) injectable à 20 mg/mL contient l’équivalent de 10 mg/mL de caféine base (C8H10N4O2)1. Cette méthylxanthine est bien connue pour ses propriétés stimulantes du système nerveux central. Elle est également utilisée pour le traitement de l’apnée du nourrisson chez les prématurés et est l’un des médicaments les plus utilisés en néonatologie. Les xanthines sont largement employées à cet effet depuis le début des années 19701. L’apnée est un problème fort répandu chez les prématurés de moins de 36 semaines. La caféine est administrée par voie intraveineuse, généralement sur une période de trois à cinq minutes, car la voie entérale est parfois difficile à cet âge. La caféine est un antagoniste des récepteurs de l’adénosine, ce qui se traduit par une stimulation cardiovasculaire et respiratoire. Elle provoque la libération d’adrénaline et l’augmentation de la dopamine. Plusieurs mécanismes d’action sont proposés pour expliquer l’effet de la caféine sur l’apnée. Il semble que l’augmentation de la sensibilité du système nerveux central aux élévations de CO2 soit la plus efficace pour prévenir les épisodes d’apnée. De plus, la caféine induit une augmentation de la ventilation en accroissant le volume inspiratoire ainsi qu’une amélioration de la saturation des gaz sanguins. La caféine est la base xanthine possédant l’effet stimulant le plus puissant du système nerveux central1.
Les données sur la compatibilité de la caféine avec d’autres médicaments injectables sont incomplètes et parfois cliniquement insuffisantes2–4. Les tests en Y sont habituellement réalisés par examen visuel et non à l’aide d’un compteur de particules. Nous rapportons ici une étude visuelle, couplée à des observations faites à l’aide d’un compteur de particules. Elle porte sur la compatibilité du citrate de caféine injectable avec 99 autres médicaments principalement utilisés par voie intraveineuse lors d’une administration en Y.
Le citrate de caféine commercial (Sandoz, lot EM6977) utilisé lors de l’étude a été fourni en flacons de 5 mL et contenait l’équivalent de 10 mg/mL de caféine base dans de l’eau stérile pour injection.
Le citrate de caféine a été mélangé successivement à 99 autres médicaments injectables présentés dans les tableaux I et II. Les médicaments nécessitant une dissolution ont été préparés avec de l’eau stérile pour injection, sauf si la monographie demandait d’utiliser du chlorure de sodium à 0,9 %. Tous les médicaments, y compris le citrate de caféine, ont été testés à leur concentration maximale, initiale ou originale; c’est-à-dire selon la concentration commerciale de départ, afin de simuler le degré de risque maximum des problèmes cliniques potentiels. Concernant les médicaments contenus dans des ampoules de verre, une aiguille munie d’un filtre de 5 μm a servi au prélèvement dudit médicament, dans le but d’éviter de confondre un débris de verre avec un précipité.
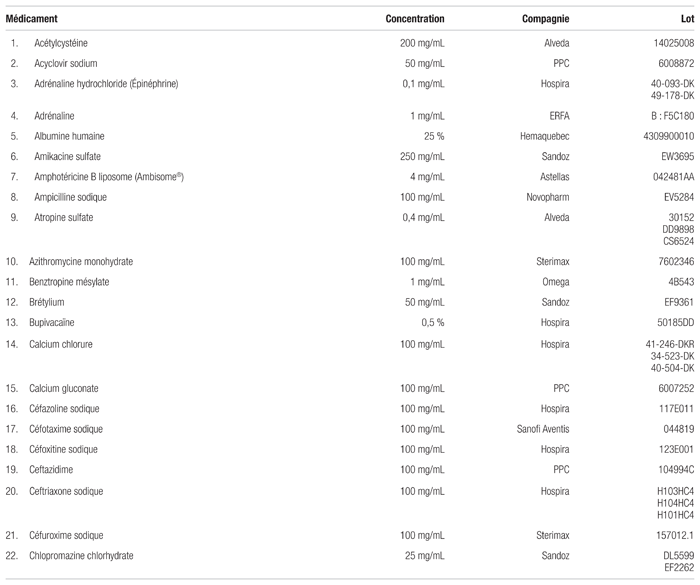
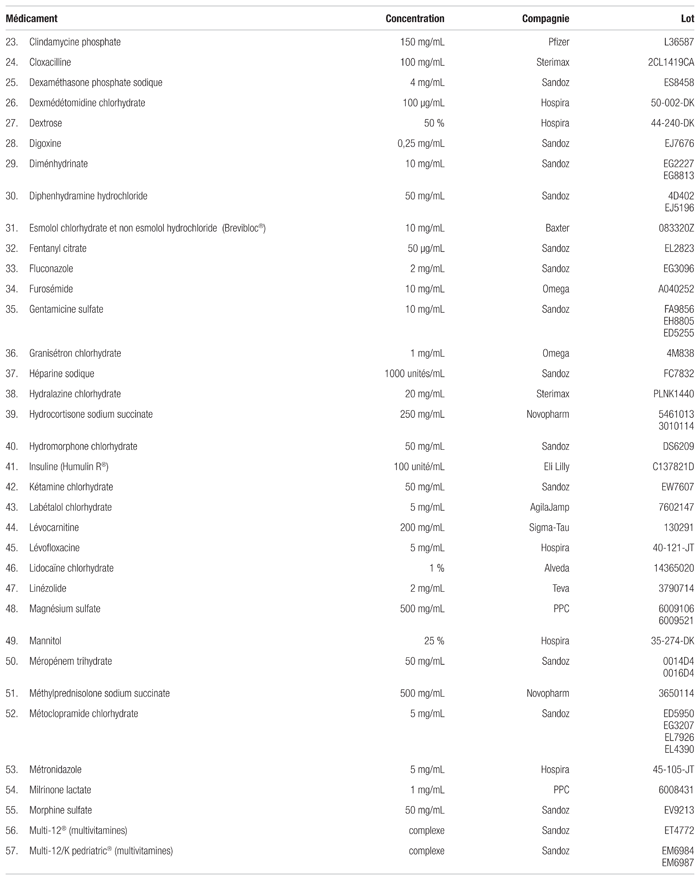
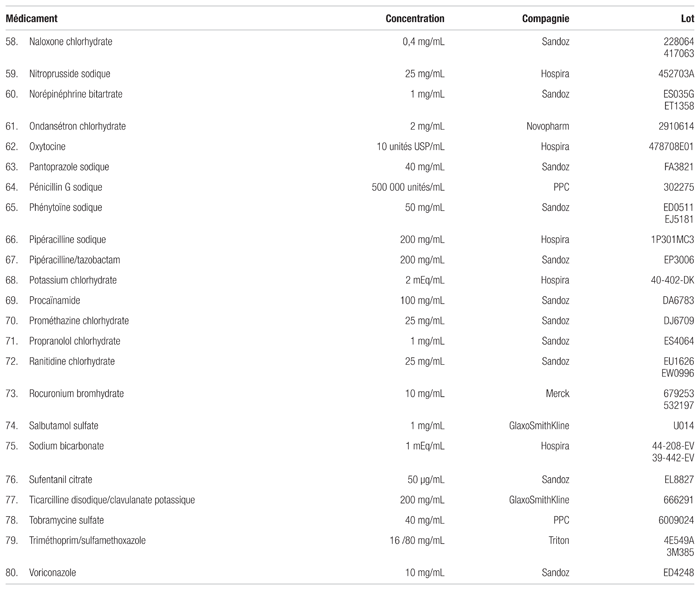
Tableau I Médicaments compatibles avec la caféine injectable dosée à 10 mg/mL (20 mg/mL en citrate) pour administration en Y (respectant la norme USP <788> 1.B)


Tableau II Médicaments incompatibles avec la caféine injectable dosée à 10 mg/ml (20 mg/mL en citrate) pour administration en Y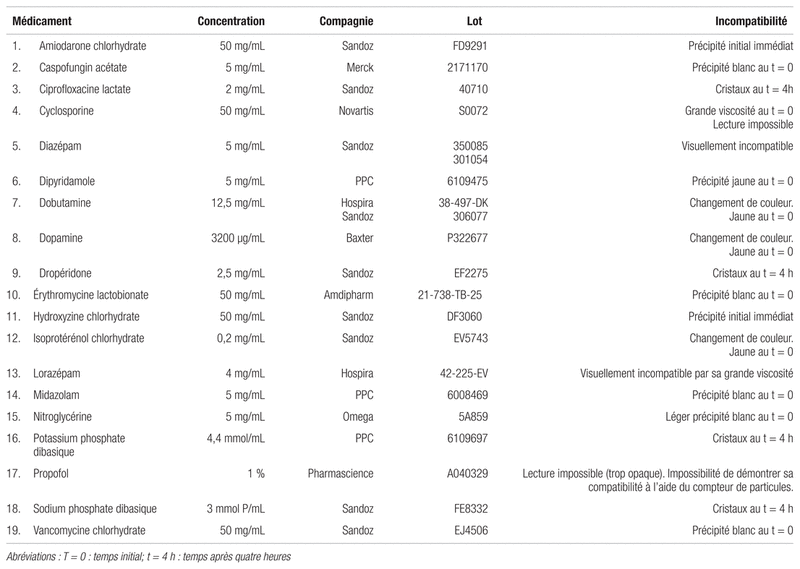
Tous les tests ont été effectués sous une lumière fluorescente et naturelle et à la température ambiante (21 ± 2 °C, pièce climatisée). Toutes les manipulations en vue de passer les solutions au compteur de particules ont été réalisées sous hotte de laboratoire pour limiter les risques de contamination par l’air, tel que le propose l’USP <788>. Tous les mélanges ont été réalisés en duplicata à l’aide de seringues stériles de 30 mL de polypropylène (BD). Un volume de 10 mL de citrate de caféine était mélangé manuellement par inversion à 10 mL du médicament à tester. Immédiatement après le mélange du citrate de caféine et du médicament testé, une évaluation visuelle à l’œil nu contre un fond blanc puis noir avait lieu afin de déceler tout changement d’aspect qui serait un signe d’incompatibilité, soit la formation d’un précipité, de bulles de gaz, un changement de couleur, de turbidité ou de viscosité directement dans la seringue. Pour vérifier la viscosité, le chercheur agitait légèrement l’échantillon afin d’en évaluer le comportement. En l’absence de ces signes, il soumettait l’un des deux échantillons à une mesure sur un compteur de particules. Les mélanges présentant une incompatibilité détectable visuellement n’ont pas subi de tests à l’aide du compteur de particules pour éviter de contaminer inutilement l’instrument. Quatre heures plus tard, le deuxième échantillon a subi la même procédure. Cet intervalle de temps permettait de simuler avec un petit excès la durée de contact de deux médicaments lors des injections simultanées à de très faibles débits, comme c’est parfois le cas pour les prématurés8–15. La durée de séjour maximale dans les tubulures de deux médicaments administrés en Y est d’environ trois heures8–15.
Le dénombrement des particules dans les solutions a été réalisé à l’aide de l’appareil LS-20 Liquid Particle Counter (Lighthouse Worldwide Solutions, Medford, OR, USA), un compteur de particules analysant les données selon la norme USP <788> 1.B5–6. L’appareil fonctionne en mesurant la diminution de l’intensité lumineuse d’un laser. Le logiciel intégré convertit la mesure en comptage de particules en se basant sur une courbe de calibration. Pour tester les petits volumes, on recommande d’analyser quatre portions supérieures à 5 mL chacune et d’éliminer la première lecture5. Dans notre contexte, le volume des échantillons était de 20 mL, les quatre premiers millilitres servaient à rincer l’appareil. L’analyse était ensuite réalisée sur trois fois 5 mL. Cette procédure permettait de laisser 1 mL dans l’appareil à la fin du test afin d’éviter d’aspirer de l’air lors de l’analyse de la dernière fraction. Cette manière de procéder facilitait les manipulations et réduisait la quantité totale de médicaments utilisés7.
La compatibilité visuelle, déterminée lors des évaluations, se limitait à observer à l’œil nu la présence ou non de particules, de bulles de gaz, d’une augmentation de turbidité ou de viscosité. Tout changement observable était considéré comme un signe d’incompatibilité7–15.
La spécification établie par l’USP <788> a servi au dénombrement particulaire. Elle stipule que les solutions parentérales et injectables fournies en volume nominal de moins de 100 mL (USP <788> test 1.B) réussissent le test de compatibilité si le nombre de particules présentes dans les unités testées par contenant n’excède pas 6000 particules de plus de 10 μm et 600 de plus de 25 μm par contenant de 20 mL, soit le volume total préparé dans notre cas6. C’est sur la base de cette norme que s’appuie l’interprétation de toutes les valeurs7.
Les manipulations portaient sur un volume total de 20 mL. Ainsi, le nombre de particules de plus de 10 μm ne devait pas dépasser 300 particules/mL, soit 6000 particules divisées par le volume total de 20 mL. De plus, le nombre de particules de plus de 25 μm ne devait pas dépasser 30 particules/mL, soit 600 particules divisées par le volume total de 20 mL6.
Le citrate de caféine s’est révélé compatible avec 80 des 99 médicaments (voir le tableau I). Ces mélanges n’ont montré aucune incompatibilité visuelle et répondaient aux spécifications établies par l’USP <788> 1.B immédiatement après le mélange (t = 0) et après quatre heures (t = 4). Juste après leur préparation, les mélanges jugés compatibles présentaient, un nombre de particules de plus de 10 μm se situant entre 0,84 et 127,53/mL. Le nombre de particules de plus de 25 μm se situait entre 0,00 et 63,37/mL. Après quatre heures, le nombre de particules de plus de 10 μm se situait entre 0,80 et 43,39/mL et celui des particules de plus de 25 μm, entre 0,00 à 5,75/mL.
Par contre, 19 des médicaments testés se sont révélés incompatibles avec la caféine (voir le tableau II), selon les spécifications adoptées dans cette étude. La majorité d’entre eux étaient visuellement incompatibles, puisqu’il était possible d’observer soit des précipités dans six mélanges de médicaments incompatibles, soit la formation de cristaux dans quatre mélanges incompatibles. Un de ces médicaments nécessiterait une plus grande dilution, soit la cyclosporine qui, même mélangée au citrate de caféine au taux de 1:1, présentait une grande viscosité, ce qui empêchait la lecture de la solution au compteur de particules. Le propofol à 1 % étant pour sa part trop opaque pour être lu à l’aide de l’appareil, aucun résultat n’a pu être obtenu à son sujet. Seuls cinq médicaments, qui ne montraient pas de présence visible de précipité ou de cristaux, parmi ceux ayant révélé une incompatibilité par changement de couleur, ont pu être analysés au test du compteur de particules. Il s’agit du diazépam, de la dobutamine, de la dopamine, de l’isoprotérénol et du lorazépam. Ces substances ont réussi le test au t = 0, soit un nombre de particules de taille égale ou supérieure à 10 μm par mL situé entre 89,35 et 16841,56. Quant aux particules de taille égale ou supérieure à 25 μm, il y en avait entre 1,97 et 45,57. Au t = 4, le nombre de particules de taille égale ou supérieure à 10 μm allait de 45,64 à 12 551,20 et celui des particules égales ou supérieures à 25 μm, de 5,81 à 46,35. Les résultats démontrent donc une compatibilité quant à la taille, mais une incompatibilité visuelle3,5.
Dans cette étude, le type de manipulations de mélanges en Y utilisé comme méthode de simulation de l’administration intraveineuse en clinique s’apparente à celui utilisé dans de nombreuses autres études de compatibilité7–16. Ce modèle, reconnu dans la littérature médicale, stipule que deux solutions administrées conjointement par injection en Y se rencontrent en un ratio de 1:13. Les médicaments ont tous été testés à concentration maximale, initiale ou originale, soit un ratio de un pour un, sur la base du principe voulant que les médicaments ne précipitant pas à haute concentration ne le feront généralement pas à une concentration inférieure. Toutes les préparations ont été testées immédiatement et quatre heures après le mélange, ce qui est la méthode classique utilisée lors des tests de compatibilité quand l’administration est en Y7–16.
En comparant les présents résultats avec ceux disponibles dans la littérature scientifique, on constate plusieurs concordances et certaines différences de résultats de compatibilité entre le citrate de caféine et d’autres médicaments injectables. Selon l’édition courante du Handbook on Injectable Drugs, plus d’une vingtaine de concordances existent entre ces résultats et ceux de l’étude. Par contre, sept discordances sont notables, car les résultats mentionnés dans le Handbook diffèrent des nôtres. Il faut mentionner que le Handbook on Injectable Drugs ne cite qu’une seule étude, celle de Mitchell et Gailey et que celle-ci date de 199916. Cette étude fut exclusivement réalisée par observation visuelle et par manipulation des échantillons mélangés dans un ratio de un pour un16. De plus, plusieurs compositions médicamenteuses pourraient avoir évolué depuis presque 20 ans. Ainsi, l’acyclovir de l’époque était sous forme lyophilisée et non solubilisée comme actuellement. Par ailleurs, le pantoprazole d’origine contenait de l’acide éthylène diamine tétra-acétique (EDTA). Les différences dans les résultats des comptages peuvent donc s’expliquer non pas par le principe actif en cause mais bien par les différents excipients ajoutés ou retirés, ou encore tout simplement par le type de sel de médicament utilisé. Une autre différence importante consiste en ce que la solution injectable utilisée lors des tests de Mitchell et Gailey était de fabrication magistrale et non commerciale. Sa composition pouvait donc être différente de la solution injectable utilisée dans notre étude. De plus, la dobutamine, la dopamine et l’isoprotérénol ont été jugés compatibles dans l’étude de Mitchell et Gailey. Ces substances se sont également révélées compatibles dans notre étude, mais seulement pour le nombre de particules. Par contre, ces trois médicaments ont pris une teinte jaunâtre au contact du citrate de caféine, et nous avons donc déterminé qu’ils étaient incompatibles. Quant à l’hydralazine, absente de l’étude de Mitchell, elle est connue pour changer de couleur lors de mélanges, mais ceci ne représenterait pas une dégradation chimique, et nous avons jugé que ce mélange était compatible3. La vancomycine, reconnue comme compatible dans l’étude de Mitchell, forme rapidement un précipité visible, ce qui rend inutile le comptage des particules. Enfin, le lorazépam, lui aussi reconnu comme compatible dans l’étude de Mitchell, a donné un mélange turbide indiquant une précipitation confirmée par le comptage des particules. Il est donc considéré incompatible. Certains doutes subsistent, comme pour l’amiodarone et l’hydroxyzine qui, bien qu’elles soient compatibles, ont précipité immédiatement lors du mélange pour se dissiper à la suite de l’augmentation du volume jusqu’à l’obtention du mélange moitié-moitié avec le citrate de caféine. Par précaution, ces deux substances sont classées dans les incompatibilités. Les résultats de l’étude sont clairs pour la phénytoïne, qui est ici compatible avec le citrate de caféine alors qu’elle est souvent incompatible lors de mélanges3.
Notons que le propofol à 1 % est une préparation opaque qui ne peut être analysée avec le compteur de particules. À défaut de pouvoir confirmer sa compatibilité, nous l’avons classé parmi les médicaments incompatibles.
Pour leur part, les tables de Trissel ne traitent pas de la caféine injectable et de ses compatibilités, bien que le Handbook on Injectable Drugs en fasse mention3–4.
L’utilité d’une méthode fiable, sensible, quantitative et objective, telle que celle utilisant le compteur de particules pour réaliser les tests de compatibilité, a été démontrée une fois de plus, tout comme dans l’article portant sur la compatibilité de la cloxacilline7. Dans cette dernière étude, le compteur de particules avait permis de détecter des préparations incompatibles qui n’avaient pas été détectées à l’œil nu. Cette méthode permet aussi de confirmer la compatibilité de mélanges visuellement compatibles. C’est le compteur de particules qui a permis de détecter ou confirmer l’incompatibilité des mélanges de citrate de caféine au lorazépam et au diazépam, leur incompatibilité n’ayant pas été détectée clairement à l’œil nu. Ainsi, il est important d’utiliser un compteur de particules pour tester les mélanges qui ne présenteraient pas de changements perceptibles à l’œil nu. Cependant, l’observation visuelle permet de détecter très rapidement les changements d’aspect.
Des 99 médicaments testés, 80 se sont révélés compatibles lorsqu’ils sont mélangés dans un ratio de 1:1 avec le citrate de caféine, les deux substances étant à leur concentration maximale, initiale ou originale. Il faut toutefois prendre en considération le fait que seuls les critères physiques sont pris en compte ici, ce qui ne permet pas de garantir l’efficacité clinique de mélanges reconnus compatibles.
Tout le matériel, y compris les nombreux médicaments, a été fourni par le département de pharmacie du CHU Sainte-Justine. Le citrate de caféine a été gracieusement fourni par Sandoz Canada.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Dr Patrice Hildgen, professeur retraité, Faculté de pharmacie, Université de Montréal, pour la relecture finale du document ainsi que la compagnie pharmaceutique Sandoz Canada pour le don des fioles de caféine injectable nécessaires à l’étude.
1. Beauchamp D. Revue de l’utilisation de la caféine dans le traitement de l’apnée-bradycardie chez le nouveau-né. Pharmactuel 1988;21:28–30.
2. Micromedex Healthcare series. Monographie de la caféine. Thomson Micromedex, 1974–2013. [en ligne] http://www.thomsonhc.com (site visité le 6 août 2015).
3. Trissel LA. Trissel’s tables of physical compatibility. 1ère éd. Lake Forest: Multimatrix;1996. 590p.
4. ASHP. Handbook on injectable drugs. 18e éd. Bethesda: American Society of Health-System Pharmacists;2015.1254 p.
5. Manuel d’instruction de l’appareil du LS-20 Liquid Particle Counter (Lighthouse Worldwide Solutions, Medford, OR).
6. <788> Particulate matter in injections. In : United States Pharmacopeia. USP 36. Rockville, MD; United States Pharmacopeia; 2012. p.350–3.
7. Sullivan T, Forest JM, Leclair G. Compatibility of cloxacillin sodium with selected intravenous drugs during simulated Y-site administration. Hosp Pharm 2015;50:214–20.

8. Ferreira E, Forest JM, Hildgen P. Compatibilité du dimenhydrinate injectable pour l’administration en Y. Pharmactuel 2004;37:17–20.
9. Péré H, Chassé V, Forest JM, Hildgen P. Compatibilité du pantoprazole injectable lors d’administration en Y. Pharmactuel 2004;37:193–6.
10. Pelletier É, Forest JM, Hildgen P. Compatibilité de la kétamine injectable lors de l’administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2006;39:71–5.
11. Pelletier É, Forest JM, Hildgen P. Compatibilité des mélanges de morphine et de kétamine ou d’hydromorphone et de kétamine injectables lors de leur administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2007;40(suppl 2):23–7.
12. Tollec S, Touzin K, Pelletier É, Forest JM. Évaluation visuelle de la compatibilité physique de la naloxone avec d’autres médicaments intraveineux usuels. Pharmactuel 2013;46:16–22.
13. Legris ME, Valiquette ME, Lavoie A, Forest JM, Leclair G. Compatibilité physique par évaluation visuelle du salbutamol injectable lors de son administration en Y. Pharmactuel 2011;44:14–8.
14. Forest JM, Hildgen P. Compatibilité de l’acétylcystéine injectable lors d’administration en Y avec d’autres médicaments usuels. Pharmactuel 2014;47:161–6.
15. Legris ME, Lavoie A, Forest JM, Hildgen P. Compatibilité par évaluation visuelle du thiopental injectable lors de son administration en Y avec des médicaments usuels. Pharmactuel 2014;47:167–72.
16. Mitchell AL, Gailey RA. Compatibility of caffeine citrate with other medications commonly used in a neonatal intensive care unit. Journal of Pediatric Pharmacy Practice 1999;4:239–42.
17. United State. Pharmacopoeia XXV National Formulary 20 Rockville, MD, US Pharmacopeia Convention Inc.:2002. 2675 p.
PHARMACTUEL, Vol. 50, No. 1, 2017