Camille Cotteret1,2, Hélène Roy3, B.Pharm., M.Sc., Denis Lebel4, B.Pharm., M.Sc., FCSHP, Philippe Ovetchkine5, MD, Jean-François Bussières6,7, B.Pharm., M.Sc., MBA, FCSHP
Reçu le 10 août 2016; Accepté après révision le 15 septembre 2016
Résumé
Objectif : Décrire et commenter l’évolution de la consommation d’antimicrobiens en pédiatrie au sein d’un centre hospitalier universitaire de 2010–2011 à 2014–2015.
Méthode : Il s’agit d’une étude descriptive, transversale et rétrospective. Nous avons calculé les doses définies journalières/1000 jours-présence et le nombre de jours de traitement/1000 jours-présence pour tous les antimicrobiens et pour chaque année financière de l’étude. Le calcul des ratios entre l’année 2010–2011 et l’année 2014–2015 permet de mesurer l’évolution de la consommation.
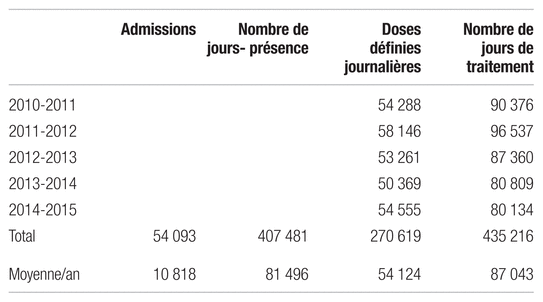
Résultats : Durant la période de l’étude, on compte 54 093 admissions et 407 481 jours-présence. On note l’augmentation de la consommation de pipéracilline/tazobactam (ratio respectivement de 2,1 et 2 pour les doses définies journalières/1000 jours-présence et le nombre de jours de traitement/1000 jours-présence), des antituberculeux (ratios : 1,2 et 1,5), des antiviraux (ratio : 1,4 pour le nombre de jours de traitement/1000 jours-présence) et du linézolide (ratio : 5,7 pour le nombre de jours de traitement/1000 jours-présence). L’hémato-oncologie, les soins intensifs et la chirurgie sont les unités de soins les plus consommatrices d’antimicrobiens.
Conclusion : Cette étude descriptive transversale conclut à la stabilité du profil de la consommation des antimicrobiens en pédiatrie de 2010–2011 à 2014–2015 avec toutefois des variations de consommation spécifiques à certains antimicrobiens.
Mots clés : Antibiogouvernance, antimicrobiens, doses définies journalières, nombre de jours de traitement, pédiatrie
Abstract
Objective: To describe and comment on changes in antimicrobial consumption in pediatrics at a university hospital from 2010–2011 to 2014–2015.
Method: This was a cross-sectional, retrospective descriptive study. We calculated the number of daily defined doses per 1000 patient-days and the number of treatment days per 1000 patient-days for all the antimicrobials for each fiscal year of the study. Ratios were calculated between the year 2010–2011 and the year 2014–2015 to ascertain changes in consumption.
Results: There were 54,093 admissions and 407,481 patient-days during the study period. There was an increase in the consumption of piperacillin/tazobactam (a ratio of 2.1 and 2 for the daily defined doses per 1000 patient-days and the number of treatment days per 1000 patient-days, respectively), antitubercular drugs (ratios: 1.2 and 1.5), antivirals (ratio: 1.4 for the number of treatment days per 1000 patient-days) and linezolid (ratio: 5.7 for the number of treatment days per 1000 patient-days). Hematology/oncology, intensive care and surgery were the care units with the highest consumption of antimicrobials.
Conclusion: This cross-sectional descriptive study shows a stable profile of antimicrobial consumption in pediatrics from 2010–2011 to 2014–2015, although there were some variations in consumption specific to certain antimicrobials.
Keywords: Antibiotic stewardship, antimicrobials, daily defined doses, number of treatment days, pediatrics
Depuis quelques décennies, on s’intéresse à la consommation des antimicrobiens et aux meilleurs indicateurs possible, capables de décrire les variations de cette consommation1. Au départ, l’intérêt était principalement économique et visait à encadrer l’utilisation de nouveaux antimicrobiens émergents (p. ex. : premiers antibiotiques à large spectre, émergence des antifongiques). Avec le temps, l’Organisation mondiale de la santé (OMS), plusieurs organismes de santé publique, des équipes de recherche et des cliniciens ont noté l’émergence de résistances aux antimicrobiens, et ils ont associé cette résistance notamment à la consommation des antimicrobiens. En 2014, l’OMS a publié un premier rapport global sur la résistance aux antimicrobiens, en faisant de ce problème l’une de ses priorités d’action2.
Plusieurs organismes militent pour la surveillance de l’utilisation des antimicrobiens. De nombreuses sociétés savantes recommandent la mise en place d’un programme de gestion des antimicrobiens3–7. Au Canada, Agrément Canada a fait de la gestion des antimicrobiens une pratique organisationnelle requise depuis 20138. Tous ces organismes recommandent notamment de se doter d’un outil de surveillance de la consommation des antimicrobiens basé sur le nombre de doses définies journalières par jour-présence et le nombre de jours de traitement par jour-présence9. Au Québec, une circulaire administrative exige, depuis 2011, la mise en oeuvre d’un programme de surveillance de l’usage des antibiotiques en établissement de santé10. Les données recueillies localement, au sein de chaque établissement, ne sont toutefois pas encore recueillies et exploitées par le ministère de la Santé et des Services sociaux à des fins d’analyse et de diffusion. Quelques fabricants de logiciels vendent des solutions facilitant l’extraction des données de consommation d’antimicrobiens au sein des établissements de santé canadiens tandis que d’autres établissements produisent eux-mêmes ces rapports à partir des dossiers pharmacologiques informatisés.
Afin d’optimiser le bon usage des antimicrobiens et d’encourager les analyses comparatives entre établissements et patientèles, nous nous sommes intéressés à l’analyse de la consommation des antimicrobiens en pédiatrie.
Il s’agit d’une étude descriptive, transversale et rétrospective. L’objectif principal est de décrire et de commenter l’évolution de la consommation d’antimicrobiens au sein d’un centre hospitalier universitaire (CHU) durant une période de cinq ans de 2010–2011 à 2014–2015.
L’étude a été menée au Centre hospitalier universitaire Sainte-Justine, qui compte 500 lits. Toutes les doses d’antimicrobiens systémiques dispensées aux patients hospitalisés en pédiatrie entre le 1er avril 2010 et le 31 mars 2015 ont été incluses. Ont été exclues, les doses d’antirétroviraux, d’antiparasitaires, d’antimicrobiens administrées par nébulisation ou voie topique ainsi que toutes les doses d’antimicrobiens de la patientèle d’obstétrique-gynécologie. Le protocole de recherche a été approuvé par le comité d’éthique de l’Hôpital.
Les données de consommation d’antimicrobiens ont été extraites du dossier pharmacologique informatisé des patients (GesphaRxMD, CGSI TI, Québec, Qc, Canada). Les doses sont dispensées de façon quotidienne. Une dose d’antimicrobiens dispensée n’est pas forcément administrée lorsque le traitement cesse en cours d’hospitalisation.
À partir des données de consommation, nous avons établi le profil du nombre de doses définies journalières et du nombre de jours de traitement par antimicrobien, par unité de soins et globalement11. Nous avons utilisé les doses définies journalières de référence proposées par l’OMS12. Les données sur les antimicrobiens, dont la dose définie journalière de référence n’était pas disponible pour la voie administrée, n’ont pas été extraites. Nous avons établi des conversions basées sur la littérature médicale pour les antimicrobiens dont la dose définie journalière de référence n’avait pas la même unité de mesure que les formats utilisés à l’hôpital.
Afin d’établir le profil de consommation par antimicrobien, nous avons calculé le nombre de doses définies journalières et le nombre de jours de traitement par 1000 jours-présence. Le nombre de jours-présence a été extrait du profil statistique des admissions de l’établissement. Le profil de consommation a été établi par antimicrobien, par unité de soins et par année. Enfin, pour décrire l’évolution de la consommation, nous avons établi un ratio du nombre de doses définies journalières/1000 jour-présence entre 2014–2015 et 2010–2011 (écart sur une période de cinq ans). Nous avons procédé de la même manière pour le nombre de jours de traitement/1000 jours-présence. Un ratio inférieur à 0,8 ou supérieur à 1,2 (soit une variation d’au moins 20 %) est considéré comme étant important et nécessitant une évaluation du comité de gestion des antimicrobiens, pour faire en sorte que la variation soit connue et expliquée. Nous avons établi des statistiques descriptives et calculé le coefficient de corrélation.
La description du profil de consommation des antimicrobiens portait sur cinq exercices financiers consécutifs de 2010–2011 à 2014–2015 et incluait 53 antibiotiques, 10 antiviraux et huit antifongiques. Le tableau I regroupe le nombre d’admissions, de journées d’hospitalisation, de doses définies journalières et de jours de traitement aux antimicrobiens durant la période de l’étude.
Tableau I Profil de consommation des antimicrobiens pour la période à l’étude
De 2010–2011 à 2014–2015, il n’existe aucune différence importante de consommation en doses définies journalières/1000 jours-présence par classe d’antibiotiques, d’antifongiques et d’antiviraux (tableau II). Toutefois, on a noté des augmentations importantes de consommation de 18 antimicrobiens. L’augmentation la plus importante en valeur absolue s’est produite pour l’association pipéracilline/tazobactam. En termes de ratio (2015/2010), l’augmentation la plus importante a été observée pour le valganciclovir (ratio = 12,5). On a noté des baisses importantes de consommation pour presque autant d’antimicrobiens. La plus importante diminution en valeur absolue concernait la gentamicine et en termes de ratio le céfuroxime et l’itraconazole (ratio = 0,2).
Tableau II Profil de consommation par antimicrobien de 2010–2011 à 2014–2015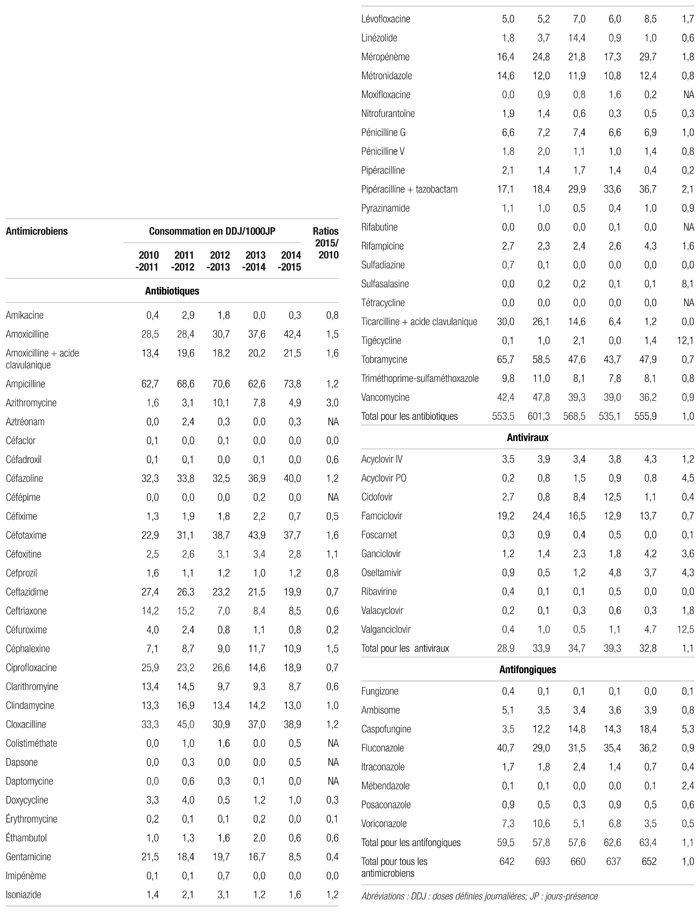
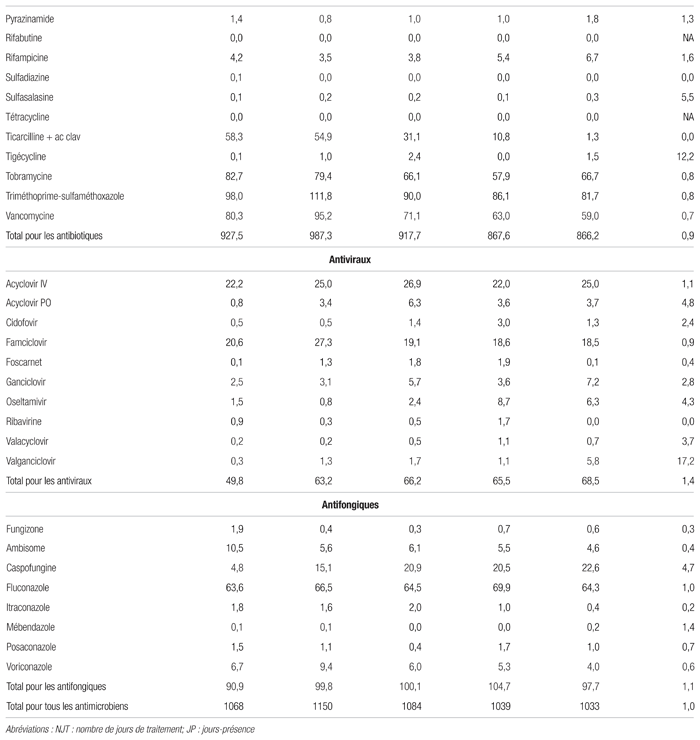
De 2010–2011 à 2014–2015, on n’a pas noté de différence importante de consommation en nombre de jours de traitement/1000 jours-présence par classe d’antibiotiques et d’antifongiques (tableau III). La consommation d’antiviraux a augmenté de façon importante entre 2010–2011 et 2014–2015 (ratio = 1,4). On a noté des hausses importantes de consommation de 20 antimicrobiens, dont 15 communs à ceux observés avec la mesure des doses définies journalières/1000 jours-présence. L’augmentation la plus importante en valeur absolue touchait l’association pipéracilline/tazobactam et en termes de ratio (2015/2010) le valganciclovir (ratio = 17,2). On a noté des baisses importantes de la consommation de presque autant d’antimicrobiens. La plus importante diminution en valeur absolue concernait la gentamicine et en termes de ratio le céfuroxime et l’itraconazole (ratio = 0,2).
Tableau III Profil de consommation par antimicrobien de 2010–2011 à 2014–2015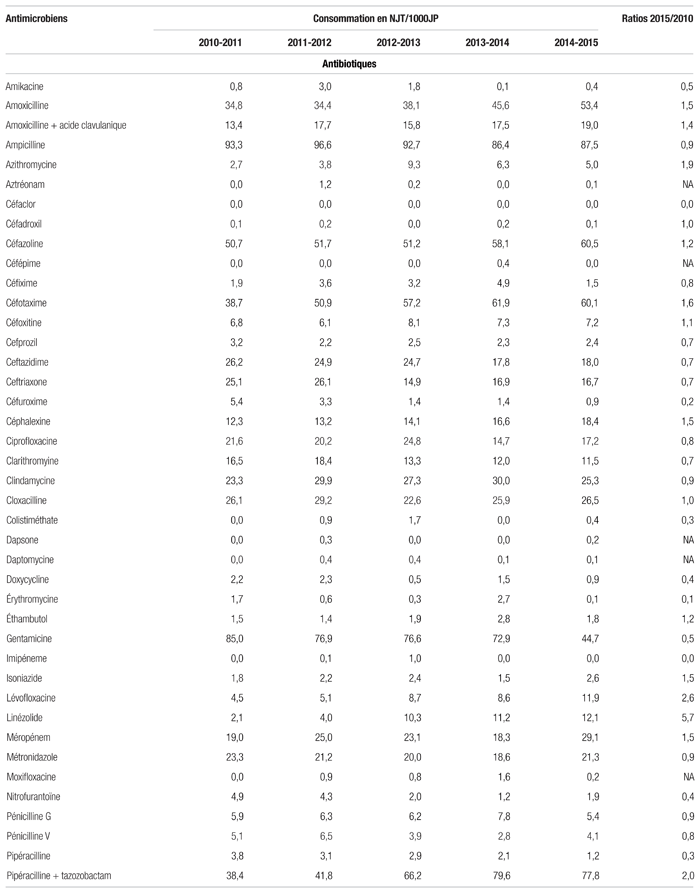
Le tableau IV présente le profil de consommation en doses définies journalières/1000 jours-présence par unité de soins de 2010–2011 à 2014–2015. De 2010–2011 à 2014–2015, on n’a pas noté de variations importantes dans les sept unités de soins présentés.
Tableau IV Profils de consommation d’antimicrobiens par unité de soins de 2010–2011 à 2014–2015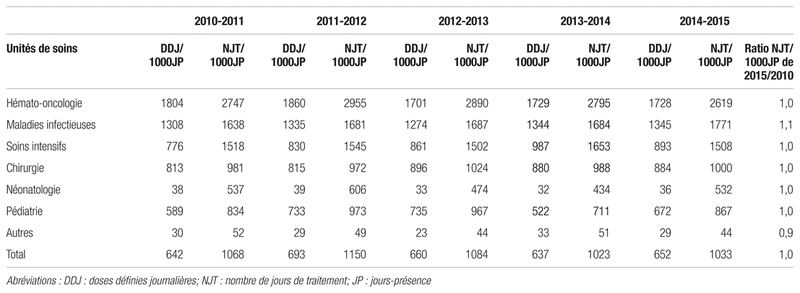
La figure 1 présente le profil des ratios de consommation entre 2014–2015 et 2010–2011 par classe d’antimicrobiens.
|
|
||
|
Figure 1 Profil des ratios de consommation entre 2014–2015 et 2010–2011 par classe d’antimicrobiens |
||
Cette étude descriptive, transversale et rétrospective a mis en évidence le profil de consommation des antimicrobiens en pédiatrie au sein d’un CHU mère-enfant canadien. Ces données ont été analysées dans le cadre de notre programme d’antibiogouvernance (appelé localement depuis plus de 20 ans Comité de revue d’utilisation des antimicrobiens) et d’un rapport annuel dont les caractéristiques ont été décrites précédemment13,14.
Notre étude a mis en évidence un nombre total stable de doses définies journalières/1000 jours-présence et de nombre de jours de traitement/1000 jours-présence pour les cinq années qu’a duré l’étude. Toutefois, en comparant les données de 2014–2015 à celles de la précédente décennie, on a noté des variations importantes15,16. Ces hausses plus importantes étaient avant tout liées à la tertiarisation des soins, telle que la proportion plus élevée de patients en soins tertiaires, l’augmentation du nombre de greffes, etc.
Le profil de consommation (antibiotiques, antiviraux, antifongiques) est resté globalement stable au cours des cinq dernières années. Toutefois, le profil d’une vingtaine d’antimicrobiens comportait des variations importantes (ratio inférieur à 0,8 ou supérieur à 1,2). Chaque variation a fait l’objet d’une évaluation par les membres du Programme d’antibiogouvernance.
Les causes de ces variations de consommation d’antimicrobiens (en nombre de jours de traitement/1000 jours-présence) peuvent être multiples. Certaines sont associées à des changements du marché : l’augmentation de pipéracilline/tazobactam (ratio de 2,0) a été liée au retrait du marché de l’association ticarcilline/acide clavulanique; la réduction de la gentamicine (0,5) a été liée à une pénurie prolongée. Par ailleurs, d’autres antimicrobiens ont pu être privilégiés pour le traitement des infections à Gram négatif, notamment les céphalosporines de 3e génération ou l’association pipéracilline/tazobactam. D’autres variations de consommation peuvent être dues à une augmentation de la prévalence de certaines infections, comme la tuberculose, qui a entraîné des hausses d’isoniazide (1,5), de pyrazinamide (1,3), de rifampicine (1,6) bien que le nombre de jours de traitement/1000 jours-présence demeurait faible. Des saisons de grippe plus virulente et les nouvelles recommandations des sociétés savantes expliquent en partie le recours accru à l’oseltamivir au cours des dernières années (traitement plus rapide des patients hospitalisés présentant des symptômes grippaux). L’augmentation de l’utilisation de linézolide (5,7) a été liée à l’émergence de résistances à la vancomycine en néonatologie.
Certaines variations de consommation des antimicrobiens sont liées à des changements de pratique ou de protocoles. La hausse de l’usage de caspofungine (4,7) a été liée à l’utilisation moins systématique du fluconazole, notamment dans l’unité d’hémato-oncologie. La caspofungine présente l’intérêt d’être moins hépatotoxique et d’avoir moins d’interactions médicamenteuses que le fluconazole, notamment lors de chimiothérapies. La hausse de la consommation de plusieurs antiviraux est associée à l’utilisation préventive ou plus énergique d’antiviraux dans différentes indications (p. ex. : prophylaxie pour les patients ayant subi une greffe de moelle osseuse, traitement des cytomégalovirus congénitaux). Le recours accru à la lévofloxacine (2,6) a été lié à une exigence d’un protocole de recherche pour le traitement des leucémies aigües lymphoblastiques.
En ce qui concerne le profil de consommation par secteur de soins, il est également resté stable au cours des cinq dernières années. Sans surprise, les unités d’hémato-oncologie, de maladies infectieuses et de soins intensifs pédiatriques étaient les unités les plus consommatrices d’antimicrobiens en termes de nombre de jours de traitement/1000 jours-présence, compte tenu des patientèles traitées. Les valeurs relativement élevées en chirurgie s’expliquent par l’antibioprophylaxie et les causes infectieuses qui prédominent dans les maladies chirurgicales (p. ex. : ostéite, appendicite, abcès). Cette stabilité peut s’expliquer notamment par la mise en place d’un programme structuré d’antibiogouvernance visant une surveillance périodique d’utilisation, la publication de règles d’utilisation, la revue des pratiques et les activités de formation/d’information17. De plus, la présence décentralisée des pharmaciens dans toutes les équipes de soins contribue à l’usage optimal des antimicrobiens au sein de l’établissement.
Il existe relativement peu de données sur le profil de consommation des antimicrobiens en pédiatrie. Le profil de consommation des antibiotiques en nombre de jours de traitement/1000 jours-présence a été évalué auprès de 32 hôpitaux pédiatriques américains18. La consommation globale de ces hôpitaux était de 698 jours de traitement/1000 jours-présence en 2010 contre 928 jours de traitement/1000 jours-présence dans notre établissement pour la même période. Les auteurs ne fournissent pas de données détaillées permettant de vérifier l’étendue des données (p. ex. : écart-type, intervalle) ou la durée de séjour. Il est probable que la durée de séjour dans les hôpitaux américains soit inférieure à notre établissement. Ceci ne signifie pas que le nombre de jours de traitement total (y compris l’hospitalisation et la partie ambulatoire) soit inférieur. Le profil de consommation des antibiotiques en nombre de jours de traitement/1000 jours-présence a été évalué dans un hôpital pédiatrique américain de 120 lits (Mayo Clinic Children Hospital, Rochester, MN, USA)19. La consommation globale était de 815 jours de traitement/1000 jours-présence en 2010, une valeur qui se rapproche de celle de notre établissement. La consommation des antibiotiques et antifongiques a été évaluée dans un centre hospitalier pédiatrique canadien (Alberta Children Hospital, Calgary, AB, Canada) de 2010–2011 à 2013–201420. Les auteurs rapportent une diminution de 19 % du nombre de jours de traitement/100 jours-présence de 2010–2011 à 2013–2014. Après la conversion de leurs données, le ratio du nombre de jours de traitement/1000 jours-présence est plus faible à Calgary qu’au sein de notre établissement (757 c. 972 en 2013–2014).
Enfin, il faut noter que le calcul du ratio de nombre de jours de traitement/jours-présence est préférable à celui des doses définies journalières/jours-présence en pédiatrie, étant donné que les doses varient selon le poids21–24. Toutefois, nous avons présenté les données selon les deux ratios disponibles pour faciliter les comparaisons, car certains établissements ne sont pas en mesure de générer les deux types de ratios, et parce que le ministère de la Santé et des Services sociaux exige ces deux ratios, peu importe la mission de l’établissement.
Bien que les données recueillies et présentées dans cet article aient été exigées depuis plusieurs années dans le cadre d’une mesure administrative québécoise, elles sont encore relativement peu utilisées à des fins de comparaisons interétablissement. Plusieurs facteurs expliquent ce retard d’implantation. Il existe une variété de logiciels utilisés pour le dossier pharmacologique informatisé, et il n’existe pas de cadre juridique canadien indiquant une façon précise de générer les données. En outre, plusieurs considèrent que ces données sont peu utiles, les données brutes de consommation (p. ex. : nombre de fioles ou de comprimés ou encore nombre de mg dispensés) étant suffisantes pour informer l’équipe d’antibiogouvernance des tendances. Il nous parait raisonnable d’affirmer que les données de consommation d’antimicrobiens seront pleinement utiles aux cliniciens des établissements de santé lorsqu’elles seront systématiquement exigées et qu’elles seront partagées et discutées entre tous les intervenants sur une base récurrente. Si les comparaisons entre les pays sont intéressantes et peuvent contribuer à enrichir la réflexion entourant le bon usage des antimicrobiens, il faut rappeler que la fréquence de l’usage des agents infectieux et leurs taux de résistance varient en fonction de la géographie et qu’une interprétation utile des données de consommation se fait dans un contexte géographique donné et en fonction des antimicrobiens disponibles sur ce marché.
Il faut aussi noter enfin qu’il serait possible d’explorer les ratios de doses définies journalières/1000 jours-présence en tenant compte des effets indésirables25 ou encore des incidents et accidents liés à la médication26.
Cette étude comporte des limites. Les données recueillies découlaient des doses dispensées et non des doses administrées. Il est possible que les ratios calculés aient surestimé la consommation réelle. Toutefois, le département de pharmacie dispense tous les médicaments en dose unitaire quotidienne, l’effet de cette surestimation est donc sans doute limité. Les ratios de doses définies journalières/1000 jours-présence et de nombre de jours de traitement/1000 jours-présence ne tiennent pas compte de la posologie et de la fréquence d’administration. De plus, ce type d’analyse ne tient pas compte des indications et des taux de résistance. Toutes ces données méritent d’être prises en considération si l’on veut établir un profil complet de la consommation des antimicrobiens et de la pertinence de leur utilisation.
Cette étude descriptive transversale fait état de la stabilité du profil global de consommation des antimicrobiens en pédiatrie au sein d’un centre hospitalier universitaire mère-enfant de 2010–2011 à 2014–2015 avec toutefois des variations de consommation spécifiques à certains antimicrobiens. Plusieurs facteurs peuvent expliquer ces variations et l’utilisation d’indicateurs, tels que les doses définies journalières/1000 jours-présence et le nombre de jours de traitement/1000 jours-présence ne peuvent suffire à estimer et à expliquer toutes les tendances de consommation au sein d’une structure. Le Programme d’antibiogouvernance est donc un acteur clé dans le bon usage des antimicrobiens.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Hekster YA, Vree TB, Goris RJ, Boerema JB. The defined daily dose per 100 bed-days as a unit of comparison and a parameter for studying antimicrobial drug use in a university hospital. A retrospective study of the effects of guidelines and audit on antimicrobial drug use. J Clin Hosp Pharm 1982;7:251–60.
2. Organisation Mondiale de la Santé. Antimicrobial resistance Global Report on Surveillance 2014 [en ligne] http://apps.who.int/iris/bitstream/10665/112642/1/9789241564748_eng.pdf?ua=1 (site visité le 10 août 2016).
3. Magsarili HK, Girotto JE, Bennett NJ, Nicolau DP. Making a case for pediatric antimicrobial stewardship programs. Pharmacotherapy 2015; 35:1026–36.
4. Ibrahim OM, Polk RE. Antimicrobial use metrics and benchmarking to improve stewardship outcomes: methodology, opportunities, and challenges. Infect Dis Clin North Am 2014;28:195–214.
5. Dik JW, Vemer P, Friedrich AW, Hendrix R, Lo-Ten-Foe JR, Sinha B et coll. Financial evaluations of antibiotic stewardship programs-a systematic review. Front Microbiol 2015;6:317.

6. Disease Control and Prevention. Core Elements of Hospital Antibiotic Stewardship Programs; [en ligne] http://www.cdc.gov/getsmart/healthcare/implementation/core-elements.html (site visité le 10 août 2016).
7. Agence de la santé publique du Canada. Résistance et recours aux antimicrobiens au canada cadre d’action fédéral [en ligne] http://canadiensensante.gc.ca/alt/pdf/drugs-products-medicaments-produits/buying-using-achat-utilisation/antibiotic-resistance-antibiotique/antimicrobialframework-cadre-antimicrobiens-fra.pdf (site visité le 10 août 2016).
8. Agrément Canada. Pratiques organisationnelles requises [en ligne] http://accreditation.ca/sites/default/files/por-livret-2015-fr.pdf (site visité le 10 août 2016).
9. Organisation Mondiale de la Santé. Guidelines for ATC classification and DDD assignment 2016 [en ligne] http://www.whocc.no/filearchive/publications/2016_guidelines_web.pdf (site visité le 10 août 2016).
10. Ministère de la Santé et des Services sociaux. Mise en oeuvre d’un programme de surveillance de l’usage des antibiotiques en établissement de santé [en ligne] http://msssa4.msss.gouv.qc.ca/fr/document/d26ngest.nsf/d1ff67a9711c03238525656b00166b21/64dda98c0e305cc4852578b70065be3c?OpenDocument (site visité le 10 août 2016).
11. Collaborating Centre for Drug Statistics Methodology (WHO). Guidelines for ATC classification and DDD assignment 2013 [en ligne] http://www.whocc.no/filearchive/publications/1_2013guidelines.pdf (site visité le 10 août 2016).
12. World Health Organisation. ATC/DDD Index 2016 [en ligne] http://www.whocc.no/atc_ddd_index/ (site visité le 10 août 2016).
13. Guillot J, Bérard C, Roy H, Ovetchkine P, Lebel D, Bussières JF. Surveillance des antimicrobiens : élaboration d’un rapport type : l’expérience d’un CHU mère-enfant. Pharmactuel 2014;47:210–3.
14. Bérard C, Froger-Guillot J, Roy H, Ovetchkine P, Lebel D, Bussières JF. L’expérience d’un CHU mère-enfant en gérance des antimicrobiens : données sources et traitement de données aux fins d’élaborer un rapport de surveillance. Annales de l’Unité de recherche en pratique pharmaceutique 2014: 6 novembre: 1–10. [en ligne] http://www.indicible.ca/urpp/20141106_DDD8a_Annales.pdf (site visité le 10 août 2016).
15. Guillot J, Schott A, Lebel D, Roy H, Ovetchkine P, Bussières JF. Usefulness of defined daily dose and days of therapy in pediatrics and obstetrics-gynecology: a comparative analysis of antifungal drugs (2000–2001, 2005–2006, and 2010–2011). J Ped Pharmacol Ther 2014;19:196–201.
16. Guillot J, Schott A, Lebel D, Roy H, Ovetchkine, Bussières JF. A comparative analysis of antibiotic and antiviral drug use in pediatrics and obstetrics-gynecology over 12 years (2000–2001, 2005–2006 and 2012–2013) using defined daily doses and days of therapy. Annales de l’Unité de recherche en pratique pharmaceutique 20150; 10 septembre : 1–12. [en ligne] http://www.indicible.ca/urpp/20150910_DDD3_Annales.pdf (site visité le 10 août 2016).
17. Hersh AL, De Lurgio SA, Thurm C, Lee BR, Weissman SJ, Courter JD et coll. Antimicrobial stewardship programs in freestanding children’s hospitals. Pediatrics 2015; 135:33–9.
18. Gerber JS, Kronman MP, Ross RK, Hersh AL, Newland JG, Metjian TA et coll. Identifying targets for antimicrobial stewardship in children’s hospitals. Infect Control Hosp Epidemiol 2013; 34:1252–8
19. Levy ER, Swami S, Dubois SG, Wendt R, Banerjee R. Rates and appropriateness of antimicrobial prescribing at an academic children’s hospital, 2007–2010. Infect Control Hosp Epidemiol 2012; 33:346–53.
20. Dalton BR, MacTavish SJ, Bresee LC, Rajapakse N, Vanderkooi O, Vayalumkal J et coll. Antimicrobial use over a four-year period using days of therapy measurement at a Canadian pediatric acute care hospital. Can J Infect Dis Med Microbiol 2015; 26:253–8.

21. Fortin E, Fontela PS, Manges AR, Platt RW, Buckeridge DL, Quach C. Measuring antimicrobial use in hospitalized patients: a systematic review of available measures applicable to paediatrics. J Antimicrob Chemother 2014;69:1447–56.
22. Rose L, Coulter MM, Chan S, Hossain J, Di Pentima MC. The quest for the best metric of antibiotic use and its correlation with the emergence of fluoroquinolone resistance in children. Pediatr Infect Dis J 2014; 33:e158–61.
23. Haug JB, Reikvam Å. WHO defined daily doses versus hospital-adjusted defined daily doses: impact on results of antibiotic use surveillance. J Antimicrob Chemother 2013;68:2940–7.
24. Raastad R, Tvete IF, Abrahamsen TG, Berild D, Leegaard TM, Walberg M et coll. A worrying trend in weight-adjusted paediatric antibiotic use in a Norwegian tertiary care hospital. Acta Paediatr 2015;104:687–92.
25. Bérard C, Lebel D, Roy H, Bussières JF. Antimicrobial medications incidents and accidents and consumption in 2012—2013. Can J Hosp Pharm 2015;68:69–70.
26. Hamad A, Cavell G, Wade P, Hinton J, Whittlesea C. Risk of medication safety incidents with antibiotic use measured by defined daily doses. Int J Clin Pharm 2013;35:772–9.
PHARMACTUEL, Vol. 50, No. 3, 2017