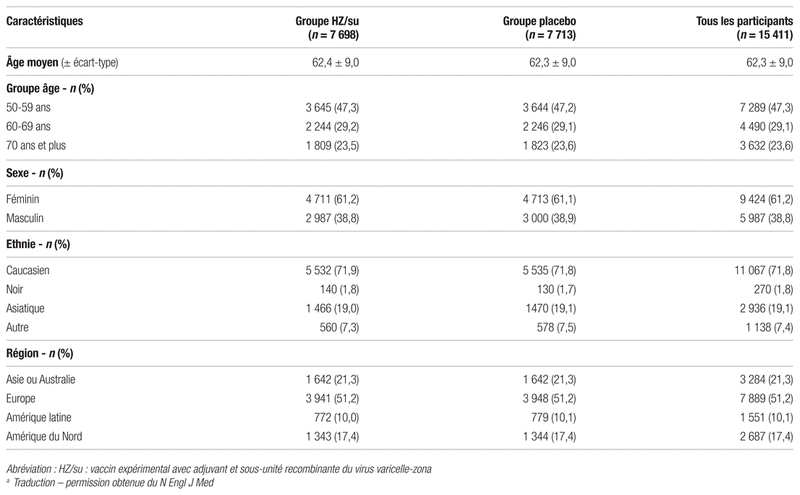
Tableau II Résultats d’efficacitéa
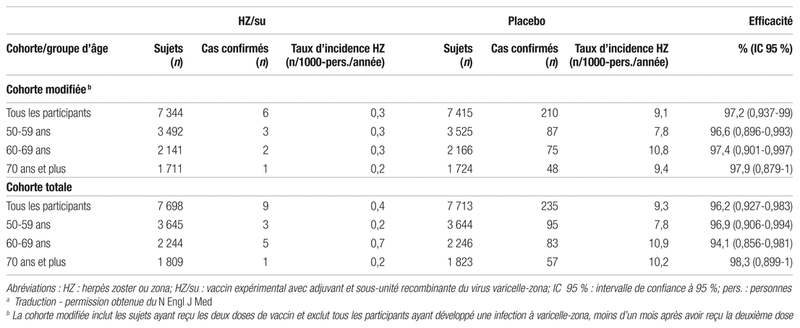
Tableau III Effets indésirables et réactogénicitéa
Frédérique Bouthot1,2,3, Pharm.D., M.Sc., Arianne Lareau1,2,4, Pharm.D., M.Sc., Catherine Lemieux1,5,6, Pharm.D., M.Sc.
1Candidate à la Maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction de l’article, Hôpital de la Cité-de-la-Santé, Laval (Québec) Canada;
3Pharmacienne, Centre intégré de santé et de services sociaux de Laval, site Hôpital de la Cité-de-la-Santé, Laval (Québec), Canada;
4Pharmacienne, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Santa Cabrini, Montréal (Québec), Canada;
5Résidente en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux du Nord-de-l’Île-de-Montréal, site de l’Hôpital du Sacré-Coeur de Montréal, Montréal (Québec) Canada;
6Pharmacienne, Centre intégré universitaire de santé et de services sociaux du Nord-de-l’Île-de-Montréal, site Hôpital Fleury, Montréal (Québec), Canada
Reçu le 6 septembre 2016; Accepté après révision par les pairs le 22 mars 2017
Titre de l’article : Efficacy of an adjuvanted herpes zoster subunit vaccine in older adults. N Engl J Med 2015;372:2087-961.
Auteurs : Lal H, Cunningham AL, Godeaux O, Chlibek R, Diez-Domingo J, Hwang SJ et coll.
Commanditaires : L’étude a été financée par GlaxoSmithKline (GSK) Biologicals qui a développé le vaccin étudié.
Cadre de l’étude : Le zona est causé par la réactivation de l’infection latente au virus varicelle-zona (VVZ). Au Canada, on estime que 130 000 nouveaux cas de zona surviennent chaque année, 17 000 cas de névralgies postherpétiques, 20 décès et 2 000 hospitalisations associés au zona2. Le risque de développer un zona augmente avec l’âge en raison de l’affaiblissement de l’immunité à l’égard du VVZ, deux tiers des cas surviennent chez des patients de plus de 50 ans2,3. Les personnes qui risquent le plus de développer un zona sont généralement âgées et immunosupprimées2,3. La névralgie postherpétique est une complication invalidante qui justifie une prévention2,4. Un vaccin vivant atténué, souche Oka/Merck, est déjà disponible sur le marché, mieux connu sous le nom de ZostavaxMD. Un nouveau vaccin avec adjuvant (HZ/su) a été développé par la compagnie GSK comme solution de remplacement du ZostavaxMD. À la suite des résultats favorables des études de phase I et II, une étude de phase III (ZOE-50) a évalué l’efficacité de deux doses du vaccin avec adjuvant pour réduire le risque de réactivation du VVZ comparativement au placebo pour les personnes âgées de 50 ans et plus5,6. Une autre étude de phase III (ZOE-70) a été menée parallèlement afin de comparer le même objectif dans une cohorte de sujets de 70 ans et plus. À noter que certaines données de la cohorte de ZOE-50 sont utilisées dans l’étude ZOE-70 pour évaluer l’efficacité du vaccin HZ/su en vue de réduire le nombre de cas de névralgie postherpétique chez les personnes de 50 ans et plus7. Le présent article présente les résultats de l’étude ZOE-50.
Protocole de recherche : Il s’agit d’une étude de phase III, multicentrique, à répartition aléatoire, contrôlée contre placebo et à double insu. Les participants à l’étude étaient répartis en deux groupes dans un ratio 1:1 par un système de répartition aléatoire centralisé stratifié selon la région géographique et leur âge (50–59 ans; 60–69 ans; 70 ans et plus). Cette étude a été menée dans 18 pays d’Europe, d’Amérique latine, d’Asie, en Australie et en Amérique du Nord. L’objectif de l’étude était d’évaluer l’efficacité, l’immunogénicité et l’innocuité du vaccin avec adjuvant HZ/su pour les adultes âgés de 50 ans et plus.
Patients : Pour être inclus, les patients devaient avoir 50 ans ou plus et être jugés capables par l’investigateur d’accomplir les démarches liées au protocole de recherche, telles que remplir les documents et se présenter aux suivis. Les principaux critères d’exclusion étaient : un antécédent de zona, une vaccination antérieure contre la varicelle ou le zona, une immunosuppression secondaire à une maladie ou à une thérapie, une allergie à un composant du vaccin, une espérance de vie estimée à moins de quatre ans, avoir reçu un produit sanguin trois mois avant la vaccination, une maladie aiguë ou une fièvre lors du recrutement, avoir reçu une autre immunisation 30 jours avant ou après la vaccination (à l’exception du vaccin contre l’influenza administré huit jours avant ou 14 jours après l’administration du HZ/su ou du placebo).
Interventions : Les sujets du groupe expérimental recevaient le vaccin HZ/su contenant 50 μg de glycoprotéine E VVZ recombinant avec le système adjuvant liposomal AS01B. Les sujets du groupe placebo recevaient une solution saline dosée à 0,9 %. Le régime posologique correspondait à un total de deux doses de 0,5 mL injectées dans le muscle deltoïde à deux mois d’intervalle. Puisque l’apparence du vaccin et du placebo différait et pour respecter le double insu, la vaccination était administrée par du personnel qui ne participait pas activement à l’étude. La durée minimale de suivi prévue était de 30 mois après la dernière dose de vaccin. Un mois après la seconde vaccination commençait le suivi mensuel, et une visite annuelle était prévue.
Les résultats des analyses statistiques sont présentés selon deux cohortes de patients. La cohorte totale englobait tous les sujets qui avaient reçu au moins la première dose prévue selon la répartition aléatoire. La cohorte modifiée comportait seulement les sujets ayant reçu les deux doses de vaccin et excluait tous les participants ayant développé un zona moins d’un mois après avoir reçu la deuxième dose.
Points évalués : L’objectif primaire de cette étude était d’évaluer l’efficacité du vaccin HZ/su pour réduire le risque de zona chez les adultes de 50 ans et plus. Tous les cas de zona suspectés, définis comme l’apparition d’une éruption cutanée unilatérale accompagnée de douleur, étaient évalués en moins de 48 heures. Les participants devaient noter leurs symptômes, faire photographier leur éruption cutanée et faire prélever un échantillon de trois lésions différentes en vue d’une analyse par réaction en chaîne par polymérase (PCR). Si les trois cultures n’étaient pas disponibles ou négatives à VVZ et bêta-actine, le diagnostic final était déterminé par cinq membres d’un comité de vérification.
L’efficacité selon la tranche d’âge, la sécurité et le profil de réactogénicité du vaccin constituaient des objectifs secondaires qui ont aussi été soumis à une évaluation. Les effets indésirables locaux ou systémiques survenant dans la semaine suivant la vaccination étaient recensés dans un journal de bord. Ce journal était rempli pour tous les sujets de plus de 70 ans ainsi que par certains sujets plus jeunes sélectionnés aléatoirement (sous-groupe réactogénicité). Toute réaction indésirable non sollicitée dans les 30 jours qui suivaient une injection ainsi que l’apparition d’effets indésirables graves jusqu’à 12 mois après la deuxième vaccination étaient aussi prises en compte.
Résultats : La période de recrutement s’est étendue du 2 août 2010 au 21 juillet 2011, et l’étude a pris fin en juillet 2015. Parmi les 16 160 patients recrutés, 15 411 ont été répartis aléatoirement : 7 698 dans le groupe vaccin HZ/su et 7 713 dans le groupe placebo. Au total, 8 926 sujets ont été assignés au sous-groupe réactogénicité. La plupart des sujets (96 %) ont reçu les deux doses prévues, soit 7 361 sujets dans le groupe vaccin HZ/su et 7 436 sujets dans le groupe placebo. Les caractéristiques des sujets étaient similaires entre les deux groupes (voir tableau I). Au cours de la période de suivi moyenne de 3,2 ans, six cas de zona ont été confirmés dans le groupe vaccin comparativement à 210 cas dans le groupe placebo, pour un taux d’incidence respectivement de 0,3 et de 9,1 sur 1000 personnes/année dans la cohorte modifiée. Le nombre nécessaire de sujets à traiter (NNT) pour éviter un cas de zona sur trois ans est de 37. Une efficacité globale de 97,2 % (intervalle de confiance à 95 % [IC 95 %] 0,937–0,99; p < 0,001) a été obtenue. Les différents résultats d’efficacité sont présentés au tableau II. En ce qui concerne les objectifs secondaires, 84,4 % des sujets du groupe vaccin et 37,8 % des sujets du groupe placebo ont rapporté des réactions indésirables dans les sept jours suivant le traitement, la plupart étant des effets indésirables d’intensité faible à modérée. On a noté des effets indésirables de grade 3, c’est-à-dire altérant le fonctionnement quotidien, chez 17 % des sujets du groupe vaccin et 3,2 % du groupe placebo. La proportion des sujets ayant eu un effet indésirable grave, une maladie immunitaire potentielle ou un décès est similaire dans les deux groupes (voir tableau III).
Tableau I Caractéristiques des sujets inclus dans la cohorte totale a

Tableau II Résultats d’efficacitéa

Tableau III Effets indésirables et réactogénicitéa

ZOE-50 est une étude d’envergure qui prend en compte plus de 15 000 patients, et les résultats obtenus sont intéressants. Le devis de l’étude, soit un essai à répartition aléatoire contrôlé, multicentrique et international, contribue à la pertinence des résultats. La similarité entre les deux groupes à l’étude et l’analyse par intention de traiter (ITT) sont aussi des points forts de cette étude. D’autre part, la stratification selon l’âge a permis de démontrer une efficacité statistiquement significative pour chacun des groupes. De plus, les critères utilisés pour déterminer un cas de zona étaient bien décrits, reproductibles et permettaient l’analyse de tous les cas potentiels.
En ce qui concerne les points faibles de l’étude, la validité externe des résultats est limitée par les sujets exclus de ZOE-50, dont les patients immunosupprimés, ceux avec un antécédent de zona ou une vaccination antérieure contre la varicelle ou le zona. Seulement 17 % des sujets sont nord-américains et 38 % sont des hommes. Un certain nombre de sujets n’ont reçu qu’une dose de vaccin, soit 337 patients (4,4 %) dans le groupe expérimental et 277 patients (3,6 %) dans le groupe placebo. De plus, l’étude est financée par la compagnie pharmaceutique commercialisant le vaccin et l’induction de biais est possible. Il est discutable du point de vue éthique d’avoir effectué une étude contre placebo alors que le vaccin vivant atténué est disponible et efficace.
Le maintien de l’efficacité du vaccin HZ/su pour les patients d’un âge avancé est le principal avantage clinique soulevé par les auteurs. En effet, l’étude démontre une efficacité significative pour les patients les plus âgés (96,6 % dans le groupe 50–59 ans, 97,4 % dans celui de 60–69 ans et 97,9 % dans celui de 70 ans et plus), alors qu’une perte d’efficacité du ZostavaxMD a été constatée dans l’étude pivot Shingles prevention study8. Cet essai à répartition aléatoire, comptant 38 546 sujets de 60 ans et plus, a démontré une efficacité de 51,3 % contre le zona8. L’efficacité diminuait avec l’âge, soit de 63,9 % dans le groupe de 60–69 ans et de 37,6 % dans celui de 70 ans et plus8. Quant à l’étude ZEST, l’efficacité du ZostavaxMD était de 69,8 % dans le groupe 50–59 ans9. L’efficacité du vaccin indépendamment de l’âge des patients vaccinés avec le HZ/su représente un avantage clinique étant donné que la fréquence du zona augmente avec le vieillissement, tout comme la fréquence et la gravité de ses complications2. À noter qu’une étude comparative entre le vaccin HZ/su et le ZostavaxMD se terminera en décembre 201910. Les résultats seront certainement intéressants, puisqu’une différence d’efficacité significative pourrait justifier la pertinence de la commercialisation du nouveau vaccin. L’étude Shingles prevention study, portant sur 38 546 sujets âgés de 60 ans et plus, a montré un risque relatif (RR) de 0,51 (IC 95 %:0,44–0,58) et un NNT de 59 sur trois ans pour le ZostavaxMD8. À titre de comparaison, pour le vaccin HZ/su, un RR de 0,04 (IC 95 %:0,02–0,10) et un NNT de 37 sur une période de trois ans sont calculés à partir d’un échantillon de 14 759 sujets vaccinés et âgés de 50 ans et plus. Une revue systématique Cochrane publiée récemment recense les études sur les vaccins contre le zona, spécifiquement les données des patients de 60 ans et plus. Les résultats présentés montrent que l’efficacité du vaccin recombinant avec un adjuvant pourrait être supérieure au vaccin vivant atténué11.
D’autre part, l’utilisation d’un vaccin recombinant serait théoriquement plus sécuritaire pour les personnes immunosupprimées comparativement à un vaccin vivant atténué12–14. D’ailleurs, selon la monographie, le ZostavaxMD est contre-indiqué pour les patients immunodéprimés, car son administration pourrait entraîner une maladie disséminée résultant d’une réplication du virus d’un vaccin vivant15–18. Dans des études cliniques de phase I et II, le vaccin HZ/su a démontré un profil d’innocuité acceptable et a suscité une réponse immunogène chez un certain nombre de patients immunodéprimés. En effet, il a été étudié sur des patients infectés par le virus de l’immunodéficience humaine (n = 123) et des receveurs de cellules hématopoïétiques autologues (n = 121)19,20. La vaccination contre le zona pourrait donc potentiellement être utilisée pour une population qui risque davantage la réactivation du VVZ, toutefois des études supplémentaires sont requises.
Malgré ces avantages, la nécessité d’une deuxième dose, le coût, le risque théorique de maladie immunitaire, l’absence de données sur le maintien de l’efficacité dans le temps et les effets indésirables sont des désavantages potentiels du vaccin HZ/zu. D’abord, la nécessité d’administrer une deuxième dose pourrait être une limite en clinique et potentiellement diminuer l’efficacité du vaccin par inobservance. Des données supplémentaires pourraient permettre de vérifier si l’efficacité est significative avec une seule dose de vaccin. À noter, qu’un faible pourcentage de personnes âgées sont vaccinées contre le zona au Canada, le coût associé est sans doute une limite à la vaccination. Il est important de savoir que le ZostavaxMD coûte plus de 175 $ et n’est pas remboursé par la plupart des compagnies d’assurance au Canada21. Les contacts que nous avons pris avec GSK Biologicals n’ont fourni aucune information, car l’entreprise ne divulgue pas les coûts associés à la production du nouveau vaccin ni un éventuel prix de vente. On peut toutefois s’attendre à ce qu’un vaccin avec un adjuvant et utilisant des sous-unités recombinantes soit plus cher. Par ailleurs, l’exacerbation ou le déclenchement d’une maladie à médiation immunitaire est une préoccupation hypothétique des auteurs en raison de l’effet immunostimulant de l’adjuvant AS01B22–24. Selon les résultats publiés actuellement, il n’y aurait pas plus de maladies immunitaires potentielles chez les sujets recevant le vaccin HZ/su que chez les sujets du groupe placebo. Enfin, la durée de protection à long terme demeure inconnue pour le moment, étant donné la durée moyenne de suivi de 3,2 ans de l’étude ZOE-50. Ainsi, il est impossible de se prononcer sur la nécessité d’une dose de rappel. Une étude de phase II a démontré la persistance d’une réponse immunitaire six ans après la vaccination25. Enfin, une étude postcommercialisation à long terme sera de mise advenant la mise en marché du médicament afin de permettre la surveillance des effets indésirables dans la population générale.
L’étude ZOE-70, publiée en septembre 2016, vient appuyer les résultats de l’étude ZOE-50 en montrant la similarité d’efficacité entre le vaccin HZ/su et le ZostavaxMD pour réduire le risque de réactivation du VVZ, soit de 89,8 % dans la cohorte modifiée7. De plus, les résultats de cette étude démontrent aussi que l’efficacité du vaccin HZ/su ne semble pas être affectée par l’âge, pendant une période de quatre ans après la deuxième dose de vaccin. Une étude sur le long terme sera nécessaire pour confirmer ces résultats. L’un des objectifs primaires du ZOE-70 était d’évaluer la réduction du risque de névralgie postherpétique du vaccin comparativement au placebo. Les auteurs ont observé une efficacité supérieure du vaccin HZ/su pour cet objectif par rapport à celle obtenue par le ZostavaxMD dans l’étude Shingles prevention study8. Une étude comparative entre ces deux vaccins sera nécessaire afin de conclure si cette différence résulte d’une meilleure efficacité du vaccin HZ/su ou d’une différence entre les populations de ces deux études.
Le vaccin HZ/su sera une solution de remplacement à prendre en considération pour la prévention du zona chez les patients immunocompétents lorsqu’il sera approuvé par Santé Canada et disponible sur le marché canadien. Des études supplémentaires portant sur des patients immunodéprimés permettront de valider l’aspect sécurité du médicament pour cette population. La durée de l’effet devra aussi être évaluée à l’aide d’études à long terme. Comme le ZostavaxMD est commercialisé au Canada depuis 2009, il sera intéressant d’obtenir les résultats de l’étude comparative des deux vaccins, qui est présentement en cours10,26. Si le nouveau vaccin est approuvé, il sera important d’examiner les avantages et inconvénients propres aux deux solutions, tels que la nécessité de deux doses plutôt qu’une avec le vaccin HZ/su. Les coûts associés à ces médicaments et les conséquences pharmacoéconomiques possibles de la prévention du zona et de ses complications sont aussi à prendre en compte.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique en pharmacie de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et collaborateurs. Une autorisation écrite a été obtenue de ces personnes.
1. Lal H, Cunningham AL, Godeaux O, Chlibek R, Diez-Domingo J, Hwang SJ et coll. Adjuvanted herpes zoster subunit vaccine in older adults. N Engl J Med 2015;372:1576–7.
2. Gouvernement du Canada. Guide canadien d’immunisation. : Partie 4 - Agents d’immunisation active. Vaccin contre le zona. [en ligne] https://www.canada.ca/fr/sante-publique/services/publications/vie-saine/guide-canadien-immunisation-partie-4-agents-immunisation-active/page-8-vaccin-contre-zona.html (site visité le 11 mars 2017).
3. Cohen J. Herpes Zoster. N Engl J Med 2013;369:255–63.

4. Johnson RW, Bouhassira D, Kassianos G, Leplege A, Schmader KE, Weinke T. The impact of herpes zoster and post-herpetic neuralgia on quality-of-life. BMC Med 2010;8:37.

5. Chlibek R, Smetana J, Pauksens K, Rombo L, Van den Hoek JA, Richardus JH et coll. Safety and immunogenicity of three different formulations of an adjuvanted varicella-zoster virus subunit candidate vaccine in older adults: a phase II, randomized, controlled study. Vaccine 2014;32:1745–53.
6. Leroux-Roels I, Leroux-Roels G, Clement F, Vandepapeliere P, Vassilev V, Ledent E et coll. A phase 1/2 clinical trial evaluating safety and immunogenicity of a varicella zoster glycoprotein E subunit vaccine candidate in young and older adults. J Infect Dis 2012;206:1280–90.
7. Cunningham AL, Lal H, Kovac M, Chlibek R, Hwang SJ, Díez-Domingo J et coll. Efficacy of the herpes zoster subunit vaccine in adults 70 years of age or older. N Engl J Med 2016;375:1019–32.
8. Oxman MN, Levin MJ, Johnson GR, Schmader KE, Straus SE, Gelb LD et coll. A vaccine to prevent herpes zoster and postherpetic neuralgia in older adults. N Engl J Med. 2005;352:2271–84.
9. Schmader KE, Levin MJ, Gnann JW Jr, McNeil SA, Vesikari T, Betts RF et coll. Efficacy, safety, and tolerability of herpes zoster vaccine in persons aged 50–59 years. Clin Infect Dis 2012;54:922–8.

10. U.S. National Institutes of Health. Clinicaltrials. gov; Comparison of a live herpes zoster vaccine and a recombinant vaccine in 50–59 and 70–85 year olds. [en ligne] https://clinicaltrials.gov/ct2/show/record/NCT02114333 (site visité le 15 mars 2017).
11. Gagliardi AM, Andriolo BN, Torloni MR, Soares BG. Vaccines for preventing herpes zoster in older adults. Cochrane Database Syst Rev. 2016;3:CD008858.
12. Clark TG, Cassidy-Hanley D. Recombinant subunit vaccines: potentials and constraints. Dev Biol (Basel) 2005;121:153–63.
13. Plotkin SA. Vaccines: past, present and future. Nat Med 2005;11:S5–11.
14. Oxman MN. Zoster vaccine: current status and future prospects. Clin Infect Dis 2010;51:197–213.
15. Merck Canada Inc. Monographie de produit : Zostavax II. [en ligne] http://www.merck.ca/assets/en/pdf/products/ZOSTAVAX_II-PM_E.pdf (site visité le 30 mars 2017).
16. Harpaz R, Ortega-Sanchez IR, Seward JF. Prevention of herpes zoster: recommendations of the Advisory Committee on Immunization Practices (ACIP). [en ligne] https://www.cdc.gov/mmwr/preview/mmwrhtml/rr5705a1.htm (site visité le 12 mars 2017).
17. Hales CM, Harpaz R, Ortega-Sanchez I, Bialek SR. Centers for Disease Control Prevention: Update on recommendations for use of herpes zoster vaccine. [en ligne] https://www.cdc.gov/mmwr/preview/mmwrhtml/mm6333a3.htm (site visité le 12 mars 2017).
18. Ministère de la Santé et des Services sociaux. Protocole d’immunisation du Québec, Édition 6. Gouvernement du Québec, 2013. [en ligne] http://publications.msss.gouv.qc.ca/msss/document-000105/ (site visité le 15 avril 2017).
19. Berkowitz EM, Moyle G, Stellbrink HJ, Schurmann D, Kegg S, Stoll M et coll. Safety and immunogenicity of an adjuvanted herpes zoster subunit candidate vaccine in HIV-infected adults: a phase 1/2a randomized, placebo-controlled study. J Infect Dis 2015;211:1279–87.
20. Stadtmauer EA, Sullivan KM, Marty FM, Dadwal SS, Papanicolaou GA, Shea TC et coll. A phase 1/2 study of an adjuvanted varicella-zoster virus subunit vaccine in autologous hematopoietic cell transplant recipients. Blood 2014;124:2921–9.

21. McKesson Canada. PharmaClik. [en ligne] https://clients.mckesson.ca (site visité le 8 août 2017).
22. Garcon N, Van Mechelen M. Recent clinical experience with vaccines using MPL- and QS-21-containing adjuvant systems. Expert Rev Vaccines 2011;10:471–86.
23. Tavares Da Silva F, De Keyser F, Lambert PH, Robinson WH, Westhovens R, Sindic C. Optimal approaches to data collection and analysis of potential immune mediated disorders in clinical trials of new vaccines. Vaccine 2013;31:1870–6.
24. Didierlaurent AM, Collignon C, Bourguignon P, Wouters S, Fierens K, Fochesato M et coll. Enhancement of adaptive immunity by the human vaccine adjuvant AS01 depends on activated dendritic cells. J Immunol 2014;193:1920–30.
25. Chlibek R, Pauksens K, Rombo L, van Rijckevorsel G, Richardus JH, Plassmann G et coll. Long-term immunogenicity and safety of an investigational herpes zoster subunit vaccine in older adults. Vaccine 2016;34:863–8.
26. Gouvernement du Canada. Base de données sur les produits pharmaceutiques. [en ligne] https://produits-sante.canada.ca/dpd-bdpp/info.do?code=80146&lang=fr (site visité le 13 mars 2017).
PHARMACTUEL, Vol. 50, No. 3, 2017