
Sabrina Almassy1,2,3, Pharm.D., M.Sc., Raphaël Coutu1,4,5, Pharm.D., M.Sc., Alexandre Mathieu1,2,6, Pharm.D., M.Sc.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résident en pharmacie, Centre hospitalier de l’Université de Montréal, Montréal (Québec) Canada;
3Pharmacienne, Centre intégré universitaire de santé et de services sociaux de l’Estrie, site Institut universitaire de gériatrie de Sherbrooke, Sherbrooke (Québec) Canada;
4Résident en pharmacie au moment de la rédaction de l’article, Centre intégré universitaire de santé et de services sociaux de l’Estrie, site Centre hospitalier universitaire de Sherbrooke, Sherbrooke (Québec) Canada;
5Pharmacien, Centre intégré universitaire de santé et de services sociaux de l’Estrie, site Centre hospitalier universitaire de Sherbrooke, Sherbrooke (Québec) Canada;
6Pharmacien, Centre hospitalier de l’Université de Montréal, Montréal (Québec) Canada
Reçu le 5 septembre 2016; Accepté après révision par les pairs le 22 décembre 2016
Titre de l’article : On demand preexposure prophylaxis in men at high risk for HIV-1 infection. N Engl J Med 2015;373:2237-22461.
Auteurs : Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I et coll.
Commanditaires : Cette étude a été financée principalement par l’Agence nationale de recherche sur le sida et les hépatites virales (ANRS). La Fondation Bill et Melinda Gates, le Fonds de cotation Pierre Bergé pour la prévention ainsi que le Réseau canadien des essais cliniques sur le virus de l’immunodéficience humaine (VIH) ont également contribué au financement de l’étude. Le laboratoire Gilead a fourni les comprimés d’emtricitabine/ténofovir disoproxil fumarate (TDF-FTC, TruvadaMD) et de placebo et a également financé les analyses de pharmacocinétique. Il n’a pas participé à la collecte ou à l’analyse des données ni à l’écriture du manuscrit, mais on ne voit aucune mention de sa participation ou non à la rédaction du protocole.
Cadre de l’étude : Malgré des progrès importants, la prévention des infections au VIH demeure un défi de taille pour la santé publique. Au Canada, vers la fin de l’année 2014, plus de 75 500 personnes vivaient avec le VIH2. Bien que le nombre de nouveaux cas par année ait diminué légèrement, 2570 personnes ont été infectées par le virus en 20142. Plus de la moitié des nouveaux cas sont des hommes ayant des relations sexuelles avec d’autres hommes (HARSAH)2,3. Malgré la diminution totale des nouvelles infections, on observe une tendance à la hausse des diagnostics chez les HARSAH de 15 à 24 ans3. Les mesures de prévention actuelles sont loin d’être parfaites; de nouvelles stratégies sont donc nécessaires pour diminuer davantage la propagation du virus. Une méthode intéressante a fait son apparition il y a quelques années, la prophylaxie préexposition (PrEP)4. Elle consiste à prendre une thérapie antirétrovirale avant d’avoir un contact qui risque de transmettre le VIH4. La combinaison de cette prophylaxie avec les méthodes habituelles (utilisation du préservatif et changement des comportements sexuels) permettrait de réduire la transmission de l’infection4,5. Plusieurs études ont été effectuées à travers la planète afin d’évaluer l’efficacité de ce procédé dans plusieurs populations (HARSAH, couples sérodiscordants, femmes exposées à un risque élevé de contracter le VIH et utilisateurs de drogues injectables)4. L’essai à répartition aléatoire contrôlé Preexposure chemoprophylaxis for HIV prevention in men who have sex with men (iPrEx) a permis de confirmer l’efficacité de cette stratégie préventive pour les HARSAH ayant des niveaux sériques détectables de ténofovir-emtricitabine5,6. Plusieurs autres études tentant d’évaluer l’efficacité de la PrEP à dose quotidienne ont rencontré des problèmes d’adhésion au traitement7–9. L’utilisation de cette mesure de prévention dans des conditions réelles peut cependant présenter des difficutés, étant donné que la prise en continu du médicament est associée à des effets secondaires potentiels et à des coûts importants4. La prise de comprimés selon l’exposition sexuelle du patient permettrait potentiellement d’améliorer l’adhésion et d’obtenir un meilleur rapport coût-efficacité. De plus, certaines données rapportent que l’activité sexuelle de la majorité des HARSAH a lieu un ou deux jours par semaine et est planifiée10. Une prophylaxie « sur-demande » est donc plus attrayante que la prise en continu du médicament pour cette population.
Dans leur article intitulé « Intervention préventive de l’exposition aux risques avec et pour les gays » (IPERGAY), les auteurs évaluaient l’efficacité de la PrEP sur demande pour les HARSAH1. Il s’agit d’une des premières études à évaluer ce type de régime prophylactique.
Protocole de recherche : L’étude était un essai comparatif multicentrique (six sites en France et un au Canada) à double insu et à répartition aléatoire. Elle devait se dérouler en deux phases. Durant la première partie, les investigateurs désiraient recruter plus de 300 patients afin d’évaluer la faisabilité de l’étude. Le recrutement pour cette phase a eu lieu du 22 février 2012 au 23 octobre 2014. Pour la deuxième phase, 1600 volontaires devaient être recrutés.
La répartition aléatoire a été effectuée à l’aide de blocs de quatre à taille fixe, stratifiée en fonction du pays de résidence des sujets. L’approbation du projet a été obtenue par les comités d’éthique de chaque centre. Les participants étaient attribués soit au groupe TDF-FTC, soit au groupe placebo avec un ratio 1:1. Un suivi était prévu quatre et huit semaines après l’entrée dans l’étude, puis toutes les huit semaines. Cependant, à la suite de l’arrêt prématuré de l’étude PROUD en raison de la grande efficacité de la prophylaxie pour réduire la transmission du VIH, une analyse intermédiaire a été demandée11. Le protocole de recherche de la présente étude a alors dû être modifié pour retirer le groupe placebo et offrir la prophylaxie sur demande à tous les patients.
Patients : Les participants ne devaient pas être infectés par le VIH de type 1 ou 2 lors de leur entrée dans l’étude. Ils devaient être âgés d’au moins 18 ans et être des hommes ou des femmes transgenres ayant des relations sexuelles avec des hommes et être exposés à un risque élevé d’infection au VIH, défini par les auteurs comme ayant un antécédent de relations sexuelles anales non protégées avec au moins deux partenaires durant les six derniers mois.
Les critères d’inclusion et d’exclusion principaux figurent dans le tableau I.
Tableau I Critères d’inclusion et d’exclusion (liste non exhaustive)a

Interventions
Durant la phase en double aveugle, les patients étaient attribués aléatoirement au groupe TDF-FTC ou placebo. Lorsqu’ils prévoyaient avoir un rapport sexuel, les patients devaient prendre le produit avec de la nourriture, comme suit :
Quand les patients désiraient reprendre une nouvelle prophylaxie, la dose de charge de deux comprimés n’était pas nécessaire lorsque la prise du dernier comprimé datait de moins d’une semaine (dans ce cas, les patients prenaient seulement un comprimé au départ). Les patients des deux groupes ont reçu des instructions selon le modèle RESPECT lors de leur inclusion dans l’essai et à chaque visite de suivi12. Cet accompagnement comprenait également la distribution de préservatifs et de gels lubrifiants gratuits.
À la première rencontre puis tous les six mois, les patients étaient soumis à un dépistage de la syphilis, de la gonorrhée et de la chlamydia. Ils étaient traités selon un protocole préétabli. Les vaccins contre l’hépatite A et B étaient aussi offerts aux participants exposés à un risque d’infection.
Des rencontres entre les dates prévues de suivi étaient également disponibles pour les participants intéressés afin de renforcer leur adhésion. Durant ces visites, on faisait le décompte des comprimés, et le candidat recevait des conseils sur l’adhésion. Les visites fournissaient aussi la possibilité de faire des tests plasmatiques afin de détecter le VIH-1 et 2 et de mener plusieurs analyses biochimiques.
Points évalués : L’objectif principal de l’étude IPERGAY consistait à comparer l’incidence des nouveaux diagnostics de VIH-1 dans le groupe PrEP à la demande et dans le groupe placebo parmi les HARSAH exposés à un risque élevé d’infection par le VIH. Le diagnostic d’infection au VIH était défini par la détection d’antigènes p24 ou d’anticorps contre le VIH au moyen du test de dosage de l’immunoabsorption par enzyme liée. La détection d’acide ribonucléique du VIH dans le plasma au moyen de la réaction en chaîne par polymérase permettait également le diagnostic d’infection au VIH.
Les objectifs secondaires de l’étude étaient nombreux. Ils comprenaient, entre autres, l’évolution caractéristique sociocomportementale des sujets (comportements sexuels) durant l’essai, l’innocuité du traitement, l’adhésion au traitement ainsi que les caractéristiques de l’infection par le VIH chez les sujets infectés.
Les calculs effectués par les auteurs prévoyaient une taille d’échantillon de 1900 patients afin d’analyser les résultats de l’objectif primaire.
Résultats : Au total, 414 des 445 patients potentiels répondaient aux critères d’inclusion de l’étude. Parmi ceux-ci, 400 ont eu un résultat négatif au test de détection du VIH et ont pris part à l’étude. Les caractéristiques des personnes retenues étaient semblables dans les deux groupes selon les auteurs (voir tableau II).
Tableau II Caractéristiques des patients au début de l’étudea
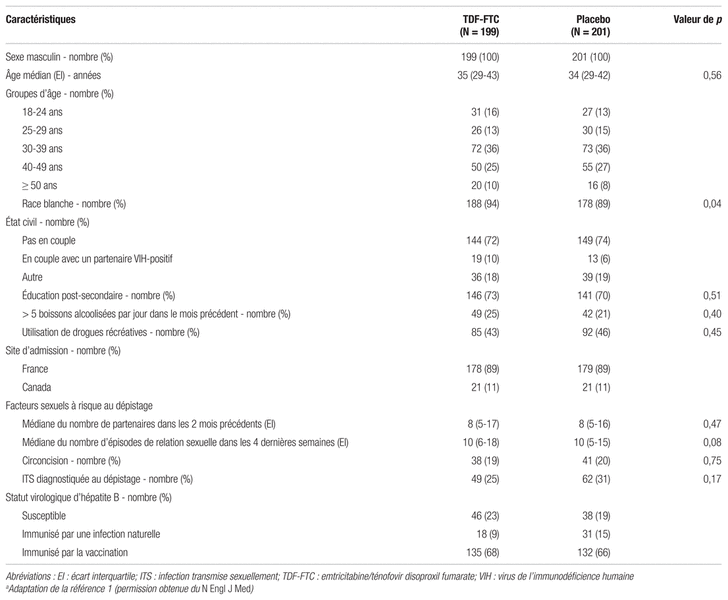
Les patients ont été suivis pendant 32 mois durant la période de double aveugle, soit du 22 février 2012 au 23 octobre 2014 (431,3 personnes-année). Lors de l’étude, une séroconversion a été observée chez 19 patients, dont trois avant la répartition aléatoire. Dans l’analyse en intention de traiter modifiée, 16 patients ont développé l’infection : deux dans le groupe TDF-FTC (incidence de 0,91 par 100 personnes-année) et 14 dans le groupe placebo (incidence de 6,60 par 100 personnes-année). On constate donc une diminution relative de l’incidence de nouvelle infection au VIH-1 de 86 % (intervalle de confiance à 95 % [IC95 %]:0,40–0,98, p = 0,002) avec la PrEP sur demande de TDF-FTC. Le résultat primaire permettait d’obtenir un NNT de 18 en faveur de la PrEP. Les deux patients du groupe TDF-FTC ayant développé le virus avaient des taux sériques d’antirétroviraux (ARV) indécelables, et le décompte des comprimés démontrait leur non-adhésion au régime posologique. Aucune mutation induisant des résistances n’a été détectée chez les patients ayant développé l’infection au cours de l’étude.
Durant l’étude, les sujets des deux groupes ont pris le même nombre de comprimés par mois (médiane identique de 15 comprimés, p = 0,57). En tout, l’adhésion au médicament a été évaluée sur 1212 relations sexuelles de 319 patients. Une proportion de 28 % des participants n’ont pris ni le médicament ni le placebo, 29 % ont pris le médicament prescrit, de manière sous-optimale et 43 % ont pris le médicament prescrit correctement.
Les auteurs, qui ont comparé les habitudes sexuelles (nombre, type de relations sexuelles récentes, port du condom lors de relations sexuelles anales) au début et durant l’étude ont conclu qu’elles n’avaient pas changé. Cet aspect a été aussi évalué à l’aide des entrevues structurées assistées par ordinateur. Il y avait toutefois une petite diminution du nombre de partenaires sexuels dans les deux derniers mois dans le groupe placebo comparativement au groupe traitement (8 dans le groupe TDF-FTC et 7,5 dans le groupe placebo; p = 0,001). L’incidence de nouvelles infections transmises sexuellement durant le suivi était semblable dans les deux groupes (41 % dans le groupe TDF-FTC et 33 % dans le groupe placebo; p = 0,10).
Tous les patients ayant reçu au moins une dose étaient inclus dans l’analyse de l’innocuité. Les effets secondaires rapportés étaient évalués selon l’échelle de sévérité de l’ANRS. Concernant les toxicités de grade trois et quatre, aucune différence significative n’a été détectée entre les deux groupes. Davantage d’effets secondaires gastro-intestinaux (nausées, vomissements, diarrhées, douleurs abdominales) ont été détectés dans le groupe recevant le traitement actif comparativement au placebo (14 % contre 5 % p = 0,002). Une élévation de la créatinine sérique a été observée chez 35 patients (18 %) du groupe TDF-FTC comparativement à 20 (10 %) du placebo (p = 0,03). Ces augmentations étaient presque exclusivement de grade un (augmentation de la créatinine de un à 1,5 fois la limite supérieure à la normale) (18 % contre 9 %), avec un seul cas de grade deux (plus de 1,5 à trois fois la limite supérieure à la normale) a été observé dans le groupe placebo. Aucune de ces augmentations n’a mené à un arrêt du traitement.
Depuis octobre 2014, l’étude est ouverte sur recommandation du conseil de surveillance des données et de l’innocuité de l’étude PROUD11. Les résultats de la phase ouverte pour la période de novembre 2014 à juin 2016 ont été révélés dans un abrégé. Sur les 362 patients qui ont continué l’étude, un seul patient ayant cessé la prise des antirétroviraux a été infecté par le VIH. L’incidence était donc de 0,3 par 100 personnes-année (IC 95 %:0–1,67)13. Durant cette phase, les patients ont pris en moyenne 18 comprimés par mois. Entre la phase randomisée et la phase ouverte, il n’y avait pas de changements dans les habitudes sexuelles des patients à l’exception d’une diminution de l’utilisation du condom lors des relations sexuelles anales13.
Les données probantes montrent que la PrEP est une méthode intéressante pour prévenir l’apparition de nouveaux cas d’infection au VIH dans la population des HARSAH. La prise quotidienne de TDF-FTC a été approuvée récemment par Santé Canada (février 2016) pour réduire le risque de transmission sexuelle du VIH. Les personnes exposées à un risque élevé d’infection par le VIH peuvent prendre ce médicament en association avec des pratiques sexuelles plus sécuritaires. L’utilisation « sur demande » de cette stratégie semble prometteuse au vu des résultats de la phase à double aveugle de l’essai clinique. Cette étude démontre que la prise de TDF-FTC « sur demande » est supérieure au placebo pour prévenir l’apparition de nouvelles infections à VIH.
La méthodologie de l’étude correspondait aux objectifs de l’essai. La validité externe de cette étude est discutable. La majorité des patients inclus dans l’étude étaient des hommes caucasiens provenant uniquement de France (89 %) ou de Montréal (11 %) et ayant eu de nombreux rapports sexuels. Ceci limite l’applicabilité des résultats, notamment aux patients ayant des rapports sexuels moins fréquents.
Les auteurs prévoyaient obtenir 951 patients dans chaque groupe (1902 au total), la puissance statistique n’était donc pas atteinte au moment de la publication de l’étude. Bien que les auteurs aient considéré de nombreux facteurs confondants pour l’essai (nombre de partenaires, nombre de relations sexuelles, circoncision, autres ITS), certains facteurs de risque de transmission du virus ont été omis (perçage génitaux, activités sexuelles pouvant causer des lésions anorectales, etc.)14.
En octobre 2014, le groupe placebo de l’étude a été dissous et le TDF-FTC a été offert à tous les participants après l’arrêt d’un autre essai clinique réalisé au Royaume-Uni sur la PrEP (étude PROUD)11. Cette dernière étude a démontré une incidence très élevée des nouvelles infections à VIH du groupe ne prenant pas le TDF-FTC11. Le reste de l’étude IPERGAY se déroulera donc de manière ouverte et la validité interne en sera affectée. À la base, il était éthiquement discutable de comparer la prophylaxie à un placebo compte tenu des données probantes existantes sur le sujet. La comparaison du TDF-FTC à une prophylaxie quotidienne aurait été préférable, bien qu’il aurait été difficile sur le plan méthodologique d’organiser un tel essai.
Cette étude présente plusieurs limites. Étant donné la brièveté du suivi (médiane de 9,3 mois), l’efficacité du traitement a pu être surestimée, puisque l’adhésion des patients est souvent meilleure en début de traitement. Malgré ce fait, l’adhésion des patients était loin d’être parfaite. En effet, moins de 50 % de ceux-ci ont utilisé la prophylaxie de manière adéquate. Un problème de compréhension est peut-être survenu chez les participants, mais les auteurs ne rapportent pas de raison précise. Se pourrait-il que les patients aient trouvé la posologie trop complexe? Si tel était le cas, il faudrait évaluer un schéma thérapeutique plus simple. De plus, l’évaluation des effets secondaires à long terme n’a pas pu être réalisée de manière optimale, étant donné la brièveté du suivi. On ne peut donc pas savoir si l’utilisation sur demande du TDF-FTC pourrait également mener à une détérioration de la fonction rénale ou à des syndromes de Fanconi.
Par ailleurs, peu de patients ont été infectés par le VIH au cours de l’étude. Le hasard pourrait donc influencer considérablement les résultats rapportés par les auteurs. Bien qu’aucun patient n’ait présenté de résistance aux ARV, l’échantillon était trop faible pour exclure hors de tout doute que la prophylaxie sur demande ne contribue pas à l’acquisition de mutations par le pathogène. Un cas de nouveau diagnostic de VIH a été rapporté au Canada chez un homme prenant la PrEP en continu. La souche ayant infecté le patient présentait plusieurs mutations offrant une résistance au TDF-FTC. Bien que cette méthode de prévention montre une efficacité élevée, elle n’offre pas de protection contre certaines souches mutantes du virus15.
Dans l’étude iPrEx, la prise en continu d’un comprimé de TDF-FTC (200 mg d’emtricitabine combiné avec 300 mg de ténofovir disoproxil fumarate) par jour comparativement au placebo permettait de réduire les nouvelles infections par le VIH de 44 % (IC95 %:0,13–0,63, p = 0,005)5. L’observance des patients à la combinaison d’ARV semblait avoir un lien avec l’efficacité, puisqu’une minorité de patients ayant été contaminés lors de l’étude avaient un niveau détectable de FTC ou de TDF dans le sang5,6. Fait à noter, les autres études réalisées sur la PrEP portaient sur des populations différentes, soit les couples hétérosexuels, les femmes, ainsi que les utilisateurs de drogue intraveineuse (avec ténofovir seul)7,8,16–18.
Dans l’essai IPERGAY, la diminution relative était de 86 %, ce qui est supérieur aux résultats de iPrEx. Cependant, tout comme dans cette étude, l’adhésion au traitement semble avoir joué un rôle, puisque les nouvelles infections diagnostiquées dans le groupe TDF-FTC touchaient des patients n’ayant pas pris les comprimés.
Plusieurs parties des résultats reposent sur des données pouvant être subjectives. L’évaluation des habitudes sexuelles se faisait au moyen d’un questionnaire soumis au patient. Un biais de désirabilité sociale a donc pu teinter les résultats et probablement être à l’origine de leur sous-estimation. Finalement, les patients des deux groupes ayant pris en moyenne 15 comprimés par mois, les résultats d’efficacité ne peuvent pas être extrapolés à des hommes ayant des relations sexuelles moins fréquentes, qui prendraient donc moins de comprimés chaque mois. L’efficacité serait peut-être meilleure pour les patients prenant le traitement plus fréquemment étant donné l’élévation des concentrations plasmatiques (ce qui se rapproche d’une prise continue). Malgré la grande efficacité du régime utilisé dans l’essai, la validité externe limite l’applicabilité des résultats de l’étude dans un contexte réel.
En conclusion, la phase en double aveugle de l’essai IPERGAY a démontré une supériorité statistiquement significative des comprimés de TDF-FTC en PrEP sur demande comparativement au placebo. Le profil de tolérance au médicament était bon.
Les résultats sont prometteurs, et ce schéma thérapeutique pourrait offrir une nouvelle méthode de prévention du VIH à ce groupe d’utilisateurs aux prises avec cette infection problématique. Cependant, moins de la moitié des régimes prophylactiques ont été pris de manière optimale durant l’étude. Les lignes directrices de PrEP des États-Unis ne recommandent pas la prise sur demande, mais elles n’ont pas subi de mises à jour récentes19. Un communiqué du Center for disease control (CDC) publié en février 2016 mentionne que, pour le moment, la recommandation porte uniquement sur la prise quotidienne du TDF-FTC20. Au Canada, la PrEP a été approuvée en février 2016, seulement en prise continue21. En France, la prescription du TDF-FTC est autorisée de manière quotidienne ou intermittente depuis novembre 201522. Cependant, les lignes directrices européennes de l’EACS recommandent maintenant la PrEP sur demande pour les HARSAH exposés à un risque élevé d’infection au VIH23. Selon nous, les recommandations ne devraient pas changer pour le moment, et l’utilisation quotidienne de la PrEP devrait continuer d’être recommandée.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables. Une autorisation écrite a été obtenue de ces personnes.
1. Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I et coll. On-demand preexposure prophylaxis in men at high risk for HIV-1 infection. N Engl J Med 2015;373:2237–46.
2. CATIE. L’épidémiologie du VIH au Canada.[en ligne] http://www.catie.ca/sites/default/files/epi%20hiv%20FR%202015%2012%2010.pdf (site visité le 12 mars 2016).
3. Institut national d’excellence en santé et en services sociaux. Gouvernement du Québec. Programme de surveillance de l’infection par le virus de l’immunodéficience humaine (VIH) au Québec, Rapport annuel 2014.[en ligne] https://www.inspq.qc.ca/pdf/publications/2066_programme_surveillance_vih.pdf (site visité le 12 mars 2016).
4. Spinner CD, Boesecke C, Zink A, Jessen H, Stellbrink HJ, Rockstroh JK et coll. HIV pre-exposure prophylaxis (PrEP): a review of current knowledge of oral systemic HIV PrEP in humans. Infection 2016;44:151–8.
5. Grant RM, Lama JR, Anderson PL, McMahan V, Liu AY, Vargas L et coll. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men. N Engl J Med 2010;363:2587–99.

6. Marcus JL, Buisker T, Horvath T, Amico KR, Fuchs JD, Buchbinder SP et coll. Helping our patients take HIV pre-exposure prophylaxis (PrEP): a systematic review of adherence interventions. HIV Med 2014;15:385–95.

7. Van Damme L, Corneli A, Ahmed K, Agot K, Lombaard J, Kapiga S et coll. Preexposure prophylaxis for HIV infection among African women. N Engl J Med 2012;367:411–22.

8. Marrazzo JM, Ramjee G, Richardson BA, Gomez K, Mgodi N, Nair G et coll. Tenofovir-based pre-exposure prophylaxis for HIV infection among African women. N Engl J Med 2015;372:509–18.

9. Martin M, Vanichseni S, Suntharasamai P, Sangkum U, Mock PA, Leethochawalit M et coll. The impact of adherence to preexposure prophylaxis on the risk of HIV infection among people who inject drugs. AIDS 2015;29:819–24.
10. Groupe interassociatif traitements et recherche thérapeutique (TRT-5). Projet d’essai de traitement antirétroviral en prophylaxie pré-exposition chez des homosexuels masculins, rapport de consultation communautaire décembre 2010. [en ligne] http://www.trt-5.org/IMG/pdf/TRT-5_-_Rapport_Consultation_communautaire_PrEP_FINAL_pdf (site visité le 12 mars 2016).
11. McCormack S, Dunn DT, Desai M, Dolling DI, Gafos M, Gilson R et coll. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet 2016;387:53–60.

12. Centers for disease control and prevention. RESPECT.[ en ligne] https://effectiveinterventions.cdc.gov/en/highimpactprevention/Interventions/RESPECT.aspx (site visité le 12 mars 2016).
13. Molina JM, Charreau I, Spire B, Cotte L, Chas J, Capitant C et coll. Efficacy of on demand PrEP with TDF-FTC in the ANRS IPERGAY open-label extension study.[en ligne] http://programme.aids2016.org/Abstract/Abstract/2564 (site visité le 8 novembre 2016).
14. Agence de la santé publique du Canada. Risque de transmission du VIH : Sommaire des données scientifiques 2012.[en ligne] http://www.cocqsida.com/assets/files/ressources/ASPC_RISQUE%20DE%20TRANSMISSION%20DU%20VIH-FR_21fev2013.pdf (site visité le 9 avril 2016).
15. Ryan B. PrEP fails in gay man adhering to daily truvada, he contracts drug-resistant HIV. [en ligne] https://www.poz.com/article/prep-fails-gay-man-adhering-daily-truvada-contracts-drugresistant-hiv (site visité le 8 août 2016).
16. Baeten JM, Donnell D, Ndase P, Mugo NR, Campbell JD, Wangisi J et coll. Antiretroviral prophylaxis for HIV prevention in heterosexual men and women. N Engl J Med 2012;367:399–410.

17. Thigpen MC, Kebaabetswe PM, Paxton LA, Smith DK, Rose CE, Segolodi TM et coll. Antiretroviral preexposure prophylaxis for heterosexual HIV transmission in Botswana. N Engl J Med 2012;367:423–34.
18. Choopanya K, Martin M, Suntharasamai P, Sangkum U, Mock PA, Leethochawalit M, et coll. Antiretroviral prophylaxis for HIV infection in injecting drug users in Bangkok, Thailand (the Bangkok Tenofovir Study): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet. 2013;381:2083–90.
19. US Public Health. Preexposure prophylaxis for the prevention of HIV infection in the United States - 2014.[en ligne] https://www.cdc.gov/hiv/pdf/prepguidelines2014.pdf (site visité le 8 août 2016).
20. Centers for disease control and prevention. CROI 2015 media statements.[en ligne] http://www.cdc.gov/nchhstp/newsroom/2015/croimedia-statement.html (site visité le 8 août 2016).
21. Gilead Sciences, Inc. Monographie de produit: Truvada.[en ligne] http://www.gilead.ca/pdf/ca/truvada_pm_french.pdf (site visité le 8 août 2016).
22. Sidaction. La PrEP, mode d’emploi.[en ligne] https://www.sidaction.org/actualites/la-prepmode-demploi-572 (site visité le 8 août 2016).
23. European AIDS clinical society. Guidelines version 8.0 October 2015.[en ligne] http://www.eacsociety.org/files/guidelines_8_0-english_web.pdf (site visité le 8 août 2016).
PHARMACTUEL, Vol. 50, No. 3, 2017