Catherine Awad1,2,3, B.Pharm., M.Sc, Isabelle Baltazar1,3,4, Pharm.D., M.Sc, Annie Galarneau1,2, Pharm.D., M.Sc.
1Candidate au programme de maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction, Centre universitaire de santé McGill, Montréal (Québec) Canada;
3Pharmacienne, Centre intégré de santé et de services sociaux de la Montérégie-Ouest - Hôpital Anna-Laberge, Châteauguay (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction, Hôpital Cité-de-la-Santé de Laval, Laval (Québec) Canada
Reçu le 5 septembre 2016; Accepté après révision par les pairs le 7 février 2017
Titre de l’article : Effect of beta-blocker dose on survival after acute myocardial infarction. J Am Coll Cardiol 2015;66:1431-411.
Auteurs : Goldberger JJ, Bonow RO, Cuffe M, Liu L, Rosenberg Y, Shah PK et coll.
Commanditaires : Cette étude a été commanditée par le National Heart, Lung and Blood Institute, qui a nommé un comité pour surveiller son déroulement.
Cadre de l’étude : La recommandation d’utiliser les bêta-bloqueurs après un syndrome coronarien aigu (SCA) est basée sur de nombreuses études2,3,4. Une méta-analyse effectuée en 1999 sur plus de 50 000 patients issus d’études à répartition aléatoire contrôlées a notamment démontré une diminution de la mortalité de 23 %. De plus, après deux ans de traitement, le nombre de patients à traiter était de 42 pour éviter un décès, ce qui appuyait l’usage à ce stade d’un bêta-bloqueur sur une période prolongée2. Cependant, la méta-analyse de Bangalore et coll. séparant les études à répartition aléatoire contrôlées selon l’ère dans laquelle elles ont été faites (pré reperfusion vs reperfusion) a soulevé des questions en ne parvenant pas à démontrer une diminution de la mortalité cardiovasculaire sous l’effet des bêta-bloqueurs parmi les patients ayant subi un SCA sans dysfonction du ventricule dans l’ère des reperfusions3.
Différentes agences recommandent toujours l’usage des bêta-bloqueurs pendant et après un SCA pour tous les patients sans contre-indications5–7. Les données probantes recommandent encore de continuer indéfiniment l’utilisation du bêta-bloqueur en présence de dysfonction systolique ventriculaire gauche ou d’insuffisance cardiaque7–10. En absence de ces dernières, il n’y a pas de consensus sur la durée ni même sur les avantages de la prise de bêta-bloqueurs après un infarctus du myocarde (IM)5–10.
Bien que les recommandations officielles ne proposent pas de doses spécifiques de bêta-bloqueurs, les doses utilisées dans les études sont généralement des doses visées7. En termes de doses étudiées, on parle notamment du métropolol dosé à 200 mg/jour, du carvédilol à 50 mg/jour, de l’aténolol à 100 mg/jour et du propranolol à 180 mg/jour4,11–14. Cependant, les doses de bêta-bloqueurs utilisées en clinique sont souvent beaucoup plus faibles que celles étudiées15,16. Une étude prospective française a démontré un taux d’utilisation de bêta-bloqueurs de 90,2 % un an après le SCA, alors qu’une étude américaine similaire a observé un taux de 60 à 70 %. Cependant, seulement 38,1 % et 12 % des patients atteignaient respectivement celles préconisées dans ces études15,16. Des effets indésirables, tels que l’hypotension et la diminution des durées de séjour à la suite d’un IM figurent parmi les facteurs limitant la titration des doses de bêta-bloqueurs16.
L’étude OBTAIN (Outcomes of Beta-Blocker Therapy After Myocardial INfarction) permet d’aborder l’hypothèse de Bangalore, à savoir si la prise de bêta-bloqueur améliore la survie3. D’autre part, elle permet d’explorer l’effet de la dose de bêta-bloqueur sur la survie; question qui n’avait été que très peu abordée.
Protocole de recherche : Entreprise en 2007, l’étude OBTAIN est un registre observationnel prospectif multicentrique (26 centres aux États-Unis et un au Canada) recueillant des données détaillées sur les doses de bêta-bloqueurs de tout patient ayant eu un IM pour accompagner l’étude PACE-MI (PACEmaker and Beta-blocker Therapy Post-Myocardial Infarction)1,17. Les données de cette étude ont révélé une utilisation presque universelle des bêta-bloqueurs, mais à des doses correspondant le plus souvent à moins de 25 % des doses utilisées dans les essais cliniques. À la fin de l’étude en 2009, il a été décidé de poursuivre la tenue du registre pour évaluer la survie des patients sur au moins deux ans afin de tester l’hypothèse selon laquelle il existe une relation dose-réponse qui favorise un effet bénéfique des bêta-bloqueurs sur la survie. Le protocole a été modifié pour inclure l’évaluation de la survie. Des sites qui avaient entrepris cette étude à l’origine, 21 ont continué leur participation (dont le site canadien), ce qui représente 92 % des patients du registre initial. Cinq autres sites américains ont également été recrutés. L’étude a été approuvée par le comité d’éthique de chaque site.
Patients : Les patients admis pour un IM dans les centres participants étaient inscrits dans un registre. Le diagnostic de l’IM reposait soit sur une élévation des créatines kinases de plus de deux fois la limite supérieure normale ou sur une élévation des troponines de plus de trois fois la limite supérieure normale. À ce critère devait s’ajouter soit une douleur à la poitrine (ou autre symptôme laissant supposer un IM) ou des changements à l’électrocardiogramme pouvant signifier un IM. Les données collectées comportaient les caractéristiques démographiques de base, les données sur les hospitalisations, le type et la dose du bêta-bloqueur prescrit au congé ainsi que de l’information concernant l’IM subi par le patient.
Interventions : Le bêta-bloqueur et la dose étaient choisis par le médecin traitant. Les doses de bêta-bloqueurs prescrites à la sortie d’hôpital, déterminées en fonction de la dose administrée, ont servi à répartir les patients en cinq groupes : pas de bêta-bloqueur (BB), entre 0 % et 12,5 % (BB-0-12,5), entre 12,5 % et 25 % (BB-12,5-25), entre 25 % et 50 % (BB-25-50) et plus de 50 % (BB-50) de la dose visée.
Points évalués : L’objectif primaire de cette étude visait la durée de survie jusqu’à la mort, toutes causes confondues, avec une survie censurée à deux ans. La survie était évaluée un an et deux ans après l’IM au moyen d’une revue des dossiers, d’une communication directe avec le patient ou sa famille et de la consultation de fichiers administratifs. Un suivi à plus long terme de la survie après trois ans a pu être effectué dans certains sites ayant participé au registre original.
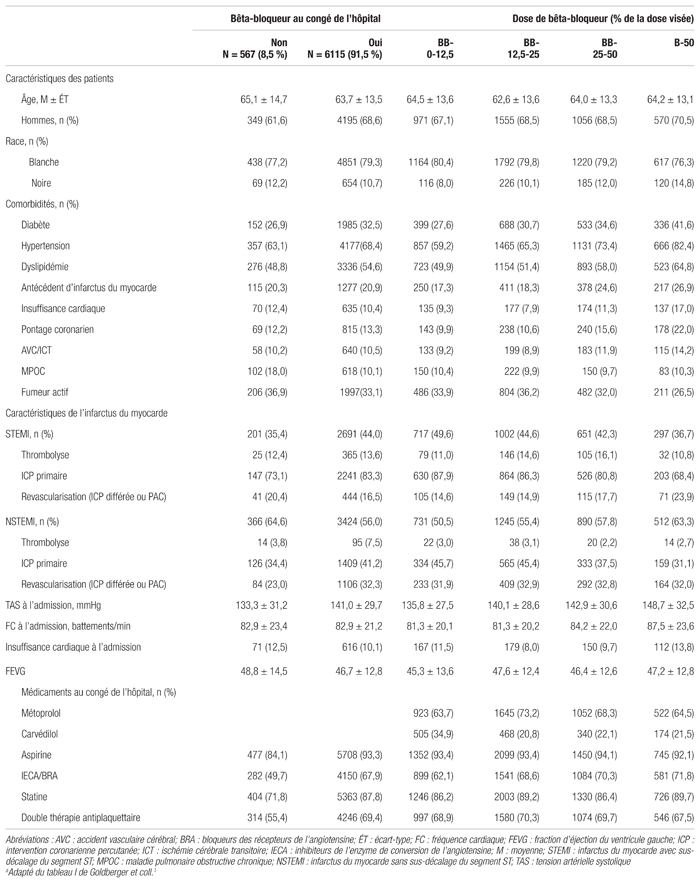
Résultats : Le registre comptait 7057 patients. De ce nombre, 332 sont décédés à l’hôpital et 43 ont été perdus au suivi. Le tableau I montre les caractéristiques des 6682 patients ayant quitté l’hôpital. La plupart des caractéristiques étaient différentes entre les groupes. Il y avait notamment davantage de sujets de race noire dans le groupe BB-50 que dans les autres groupes (14,8 % dans le groupe BB-50 comparativement à 8 % dans le groupe BB-0-12,5). De plus, les patients du groupe BB-50 avaient en général un profil de comorbidités plus lourd, ils présentaient davantage d’hypertension, de dyslipidémie, d’insuffisance cardiaque, d’antécédents d’IM et de pontages aortocoronariens (PAC). Les caractéristiques de l’IM démontraient également quelques disparités entre les quatre groupes. Le pourcentage d’IM avec une élévation du segment ST (STEMI) était plus élevé dans le groupe BB-0-12,5 (49,6 %) comparativement au groupe BB-50 (36,7 %). Par ailleurs, le taux de reperfusions par intervention coronarienne percutanée (ICP) était plus élevé dans le groupe recevant une faible dose de bêta-bloqueur; par exemple 45,7 % des patients du groupe BB-0-12,5 ayant fait un IM sans élévation du segment ST ont subi une ICP comparativement à 31,1 % dans le groupe BB-50. Cette tendance a aussi été observée parmi les patients ayant fait un STEMI. Notons enfin qu’un plus grand nombre de patients ayant reçu un bêta-bloqueur au congé avaient fait un STEMI et présentaient plus souvent du diabète, de l’hypertension et de la dyslipidémie que ceux n’en ayant pas reçu. Ces derniers étaient toutefois plus souvent atteints de maladie pulmonaire obstructive chronique (MPOC).
Tableau I Caractéristiques des sujets stratifiées selon l’usage de bêta-bloqueursa

La durée médiane du suivi était de 2,1 années. Au total, 567 (8,5 %) patients ont quitté l’hôpital sans bêta-bloqueur. Les raisons fournies pour ne pas leur administrer de bêta-bloqueurs comportaient l’hypotension (26 %), les désordres du système de conduction (16 %), les maladies pulmonaires (17 %), l’insuffisance cardiaque (9 %), l’utilisation de drogue (5 %), l’invalidité (5 %) ou autres (22 %). Quant aux patients ayant reçu une prescription de bêta-bloqueur au congé, ils se répartissaient comme suit : 24 % (groupe BB-0-12,5), 37,2 % (BB-12,5-25), 25,5 % (BB-25-50) et 13,4 % (BB-50). Quelques modifications de doses de bêta-bloqueurs ont dû être apportées au cours de la première année qui a suivi leur congé. Douze pour cent (12 %) des patients du groupe BB-50 ont été traités par la suite avec une dose de bêta-bloqueur égale ou inférieure à 25 % de celle visée. Par ailleurs, 4 % des patients assignés au groupe BB-12,5-25 ont reçu plus de 50 % de la dose visée.
La prise de bêta-bloqueurs, toutes doses confondues, était associée à une diminution de la mortalité de 45 % par rapport au groupe de patients n’ayant pas pris de bêta-bloqueur (intervalle de confiance à 95 % [IC 95 %] 0,33-0,55). Le nombre de sujets à traiter (NNT) calculé est de 10. Comparativement au groupe BB-50, l’analyse multivariée étendue n’a pas démontré de différence statistiquement significative du risque de décès dans les trois autres groupes de traitement aux bêta-bloqueurs (voir tableau II). Dans l’analyse multivariée étendue, des covariables supplémentaires étaient prises en compte, telles que la revascularisation à l’hôpital, les antécédents d’IM, de PAC, d’insuffisance cardiaque chronique, de MPOC, d’insuffisance rénale terminale ainsi que l’indice de masse corporelle.
Tableau II Rapport de risque ajusté pour l’analyse primaire et l’analyse secondairea
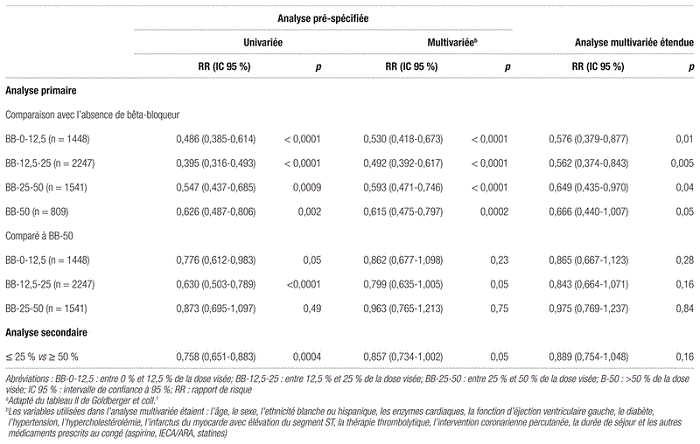
Tableau III Variables utilisées dans les analyses multivariées

La comparaison entre les patients ayant reçu une dose élevée de bêta-bloqueur (plus de 50 % de la dose visée) et ceux ayant reçu une faible dose (égale ou inférieure à 25 % de la dose visée), révélait que le RR non ajusté faisait état d’une diminution de la mortalité parmi les sujets prenant de faibles doses (RR non ajusté : 0,758; IC 95 % : 0,651–0,883, p = 0,0004). L’analyse multivariée ajustée et celle étendue ajustée pour les variables supplémentaires ont également démontré une influence avantageuse des doses faibles sur la mortalité. Cependant, ces résultats n’étaient pas statistiquement significatifs (RR ajusté : 0,857; IC 95 % : 0,734–1,002, p = 0,05; RR ajusté étendu : 0,889; IC 95 %:0,754–1,048, p = 0,16).
Bien que les bêta-bloqueurs aient amélioré la survie globale des patients de l’étude, les doses plus élevées ne semblaient pas augmenter les chances de survie. Ce résultat nous amène à nous questionner sur les doses à viser pour les patients qui ont fait un IM.
L’étude OBTAIN comporte plusieurs points forts, dont sa grande taille d’échantillon de patients provenant de plusieurs centres, l’inclusion de patients ayant subi un ICP, le traitement médical relativement optimal des patients, l’évaluation de l’effet à plus long terme par rapport à d’autres études ainsi que la possibilité de généraliser les résultats à la population cible.
Cette étude présente cependant plusieurs limites. Puisqu’il s’agit d’un registre, la répartition des patients dans chaque groupe n’était pas faite de façon aléatoire. La décision de prescrire, ainsi que le choix de l’agent et de la dose, était laissée au médecin traitant selon le patient, sans être spécifiée à priori. Ceci a pu induire un biais d’indication : le médecin était peut-être plus enclin à prescrire une dose plus élevée aux patients plus malades, plus à risque ou aux patients n’ayant pas eu de reperfusion rapide par ICP. D’ailleurs, les caractéristiques des patients n’étaient pas réparties de façon uniforme entre les groupes; il est donc bel et bien possible que les différences cliniques entre les patients aient dicté la dose de bêta-bloqueur. Il n’est pas exclu que l’état d’un patient plus malade soit aussi plus difficile à contrôler et que celui-ci soit plus enclin à mourir.
Le taux de reperfusion plus élevé dans le groupe de bêta-bloqueur à faible dose brouille aussi les pistes : est-ce que la différence de mortalité est due à la reperfusion? Heureusement, l’analyse multivariée présentée par la suite a tout de même permis de contrôler un grand nombre de variables potentiellement confondantes. Une certaine confusion résiduelle subsiste néanmoins en raison des variables confondantes qui n’ont pas été mesurées, notamment l’étendue de la maladie coronarienne et les valeurs atteintes de la fréquence cardiaque et de la tension artérielle. Par ailleurs, l’analyse multivariée effectuée avec l’ensemble étendu des variables a permis de contrôler davantage de facteurs pertinents, notamment l’indice de masse corporelle, les antécédents d’IM et de PAC. Somme toute, les deux ensembles de variables utilisés pour les analyses multivariées ont l’avantage de prendre en compte beaucoup de variables qui étaient inégalement réparties entre les groupes et qui, pour certaines d’entre elles, avaient un effet indépendant sur la survie. De plus, l’analyse de sensibilité multivariée et du score de propension étudiant la survie à trois ans continuait de démontrer que la pleine dose ne procurait aucun avantage supplémentaire. Il n’y a toutefois pas d’information sur le nombre de patients inclus dans cette analyse.
Soulignons un point négatif de l’analyse concernant la présentation des courbes de survie de Kaplan-Meier non ajustées. Compte tenu du nombre important de variables confondantes détecté par la présence de groupes non comparables et du possible biais d’indication, ces courbes ne permettent pas de tirer de conclusion.
Les analyses sont basées sur l’utilisation de la dose reçue au moment du congé, sans prise en compte des ajustements de doses subséquents, ce qui entraîne aussi un biais qu’il n’est malheureusement pas possible de contrôler. Comme chaque patient peut avoir une augmentation ou une diminution de sa dose au fil du temps, il est possible que certains patients aient été mal classés. Que le changement de dose ait eu lieu quelques semaines après la sortie d’hôpital ou deux ans plus tard influencera aussi l’importance du biais, mais cette information n’est pas disponible. Bien que les auteurs concluent que seule une minorité de patients ont eu une augmentation de dose, il n’y a malgré tout que 52,4 % des patients qui ont gardé la même dose après deux ans. L’ampleur des changements de doses n’est pas connue; reste à savoir si elle était suffisante pour entraîner un changement de catégorie de plusieurs patients. Ce genre de biais pourrait avoir pour effet de masquer ou de diminuer la force d’une association.
En ce qui concerne le suivi, la durée du suivi médian de 2,1 années semble un peu courte pour permettre l’évaluation de l’objectif primaire de survie. De plus, l’absence de paramètres cliniques, tels que la tension artérielle et la fréquence cardiaque, ajoute un point négatif à cette étude. La titration de la dose étant laissée au médecin traitant, aucune information n’est disponible sur la façon dont elle a été faite et les raisons pour lesquelles un changement de dose était nécessaire. Une analyse complète aurait nécessité la comparaison entre les groupes de la proportion de patients atteignant les cibles cliniques ou, minimalement, l’obtention des données sur la pression artérielle après le début du traitement. En effet, l’étude ne clarifie pas à quel point l’effet bénéfique des bêta-bloqueurs est lié à leur efficacité à réduire la pression artérielle et la fréquence cardiaque. D’ailleurs, à ce sujet, une méta-analyse d’essais à répartition aléatoire contrôlés laisse entendre qu’une relation existe entre la réduction de la fréquence cardiaque au repos et les avantages cliniques, entre autres sur la mortalité cardiaque et la mortalité toutes causes confondues18. En présentant l’atteinte des doses sans en présenter leur efficacité, les auteurs sont-ils passés à côté d’une partie de la réponse? L’absence de ces informations reste un point négatif qui empêche une analyse en profondeur et l’utilisation concrète de l’information fournie par cette étude. Il est aussi à noter que l’observance des patients à leur traitement n’a pas été mesurée; les effets de l’inobservance sont probablement plus importants lors d’omission de doses élevées de bêta-bloqueurs que lors d’omission de faibles doses.
Peu d’études se sont penchées sur les conséquences de doses considérées comme sous-thérapeutiques. En 1998, l’étude rétrospective de Barron démontrait une meilleure réduction de la mortalité cardiovasculaire dans le groupe recevant des doses 50 % inférieures à celles visées. On observait dans ce groupe une tendance à une meilleure revascularisation et à une réduction de thrombolyses19. Selon l’étude de Grall et coll., l’utilisation de bêta-bloqueur en prévention secondaire de STEMI améliorait la survie à un an seulement chez les patients souffrant de dysfonction ventriculaire; les doses 50 % supérieures à celles visées étaient plus efficaces que celles 50 % inférieures à la dose visée ou que l’absence de bêta-bloqueur. Certaines variables importantes étaient néanmoins exclues du modèle d’analyse malgré une distribution inégale entre les groupes16. Dans la présente étude, comme il n’y avait pas de stratification selon la dysfonction ventriculaire (fraction d’éjection moyenne entre 45 et 48 % à l’arrivée), il n’est pas possible de comparer les résultats avec ceux de l’étude de Grall.
Somme toute, les résultats de cette étude se veulent rassurants quant à la pratique actuelle, selon laquelle la plupart des patients ne reçoivent en général qu’une fraction des doses étudiées dans les essais cliniques. En effet, les paramètres hémodynamiques du patient ou des problèmes de tolérance empêchent souvent de titrer jusqu’aux doses visées. De plus, certains patients bénéficient possiblement d’un suivi moins étroit que d’autres, comme les patients ne présentant pas d’insuffisance cardiaque ou d’autres comorbidités, telles que la MPOC et le diabète.
Bien que cette étude ne permette pas de conclure à une quelconque relation entre la dose de bêta-bloqueur après un IM et la mortalité, il semble d’emblée qu’il n’y ait pas d’effet délétère à en donner une dose plus faible. Il y aurait cependant un désavantage à ne pas en donner du tout. Cette étude permet d’établir l’équipoise clinique, c.-à-d. qu’il n’est actuellement pas possible de déterminer à priori quelle dose est la meilleure en ce qui a trait au risque de décès. Il est possible qu’il n’existe pas de dose optimale unique pouvant convenir à tous les patients ayant subi un IM. Les doses pourraient plutôt être individualisées selon les paramètres cliniques, tels que la fréquence cardiaque, l’absence de symptômes angineux et la tolérance du patient.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et les collaborateurs. Une autorisation écrite a été obtenue de ces personnes.
1. Goldberger JJ, Bonow RO, Cuffe M, Liu L, Rosenberg Y, Prediman K et coll. Effect of betablocker dose on survival after acute myocardial infarction. J Am Coll Cardiol 2015;66:1431–41.

2. Freemantle N, Cleland J, Young P, Mason J, Harrison J. Beta blockade after myocardial infarction: systematic review and meta regression analysis. BMJ 1999;318:1730–7.

3. Bangalore S, Makani H, Radford M, Thakur M, Toklu B, Katz SD et coll. Clinical outcomes with b-blockers for myocardial infarction: a meta-analysis of randomized trials. Am J Med 2014;127:939–53.
4. Hjalmarson A, Elmfeldt D, Herlitz J, Holmberg S, Malek I, Nyberg G et coll. Effect on mortality of metoprolol in acute myocardial infarction: A double-blind randomised trial. Lancet 1981; 2:823–7.
5. O’Gara PT, Kushner FG, Ascheim DD, Casey DE, Chung MK, de Lemos JA et coll. 2013 ACCF/ AHA guideline for the management of ST-elevation myocardial infarction: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2013;61:e78–140.
6. Amsterdam EA, Wenger NK, Brindis RG, Casey DE, Ganiats TG, Holmes DR et coll. 2014 AHA/ ACC Guideline for the management of patients with non–ST-elevation acute coronary syndromes: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines. J Am Coll Cardiol 2014;64:e139–228.
7. National Institute for Health and Care Excellence, 2013. Myocardial infarction: cardiac rehabilitation and prevention of further MI. [en ligne] https://www.nice.org.uk/guidance/cg172/resources/myocardial-infarction-cardiac-rehabilitation-and-prevention-of-further-mi-35109748874437 (site visité le 15 mars 2016).
8. ESC-STEMI Steg G, James SK, Atar D, Badano LP, Blömstrom-Lundqvist C, Borger MA et coll. ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J 2012;33 :2569–619.
9. ESC-NSTEMI Roffi M, Patrono C, Collet J-P, Mueller C, Valgimigli M, Andreotti F et coll. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation. Eur Heart J 2016;37:267.
10. Smith SC, Benjamin EJ, Bonow RO, Braun LT, Creager MA, Franklin BA et coll. AHA/ACCF secondary prevention and risk reduction therapy for patients with coronary and other atherosclerotic vascular disease: 2011 update: a guideline from the American Heart Association and American College of Cardiology Foundation. J Am Coll Cardiol 2011;58:2432–46.
11. Dargie H, Colucci W, Ford I, Lopez Sendon JL, Remme W, Sharpe N et coll. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: The CAPRICORN randomised trial. Lancet 2001; 357:1385–90.
12. ISIS-1 (First international study of infarct survival) collaborative group. Randomised trial of intravenous atenolol among 16 027 cases of suspected acute myocardial infarction: ISIS-1: First International Study of Infarct Survival Collaborative Group. Lancet 1986;2:57–66.
13. Viskin S, Kitzis I, Lev E, Zak Z, Heller K, Villa Y et coll. Treatment with beta-adernergic blocking agents after myocardial infarction: from randomized trials to clinical practice. J Am Coll Cardiol 1995;25:1327–32.
14. B-Blocker Heart Attack Trial Research Group. A randomized trial of propranolol in patients with acute myocardial infarction: I. Mortality results. JAMA 1982;247:1707–14.
15. Arnold SV, Spertus JA, Masoudi FA, Daugherty SL, Maddox TM, Li Y et coll. Beyond medication prescription as performance measures: optimal secondary prevention medication dosing after acute myocardial infarction. J Am Coll Cardiol 2013;62:1791–801.

16. Grall S, Biere L, Le Nezet M, Bouvier JM, Lucas-Chauvelon P, Richard C et coll. Relationship between beta-blocker and angiotensin-converting enzyme inhibitor dose and clinical outcome following acute myocardial infarction. Circ J 2015;79:632–40.
17. Goldberger JJ, Bonow RO, Cuffe M, Dyer A, Greenland P, Rosenberg Y et coll. Post-myocardial infarction beta-blocker therapy: the bradycardia conundrum. Rationale and design for the Pacemaker & beta-blocker therapy post-MI (PACE-MI) trial. Am Heart J 2008;155:455–64.
18. Cucherat, M. Quantitative relationship between resting heart rate reduction and magnitude of clinical benefits in myocardial infarction: a meta-regression of randomized clinical trials. Eur Heart J 2007;28:3012–9.
19. Barron H, Viskin S, Lundstrom R, Swain B, Truman A, Wong C et coll. B-Blocker dosages and mortality after myocardial infarction: data from a large health maintenance organization. Arch Intern Med 1998;158:449–53.
PHARMACTUEL, Vol. 50, No. 2, 2017