
Roxanne Bournival1,2,3, Pharm.D., M.Sc., Antoine Cantin-Lafleur1,4,5, Pharm.D., M.Sc., Jean-François Patenaude-Monette1,4,6, B.Pharm., M.Sc.
1Candidat au programme de maîtrise en pharmacothérapie avancée, au moment de la rédaction, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie, au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux de l’Estrie - Centre hospitalier universitaire de Sherbrooke, Sherbrooke (Québec) Canada;
3Pharmacienne, Centre intégré universitaire de santé et de services sociaux de l’Estrie - Centre hospitalier universitaire de Sherbrooke, Sherbrooke (Québec) Canada;
4Résident en pharmacie, au moment de la rédaction, Hôpital du Sacré-Cœur de Montréal, Montréal (Québec) Canada;
5Pharmacien, Centre intégré universitaire de santé et de services sociaux du Nord-de-l’Île-de-Montréal, Montréal (Québec) Canada;
6Pharmacien, Centre intégré universitaire de santé et de services sociaux du Nord-de-l’Île-de-Montréal, Hôpital Fleury, Montréal (Québec) Canada
Reçu le 8 septembre 2016; Accepté après révision par les pairs le 14 novembre 2016
Titre de l’article : Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117-281.
Auteurs : Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S et coll. Pour le groupe d’étude EMPA-REG.
Commanditaires : L’étude a été financée par les compagnies pharmaceutiques Eli Lilly et Boehringer Ingelheim. Cette dernière a aussi participé à la conception du protocole de recherche et à l’analyse des données.
Cadre de l’étude : En 2015, 3,4 millions de Canadiens souffraient de diabète, et on prévoit que cinq millions en seront atteints en 2025. Entre 90 et 95 % des diabétiques ont un diabète de type 2 (DB2)2. Cette maladie comporte son lot de complications possibles : rétinopathies, néphropathies, neuropathies et événements macrovasculaires (infarctus du myocarde [IM] et accidents vasculaires cérébraux [AVC])3,4. Le contrôle précoce de la glycémie des patients permet de réduire la fréquence et la progression de complications microvasculaires et de réduire le risque de maladies macrovasculaires. Toutefois, les cibles à viser demeurent controversées5–11. Ainsi, l’objectif principal étudié dans les essais cliniques portant sur de nouvelles thérapies hypoglycémiantes vise généralement la baisse du taux d’hémoglobine glyquée (HbA1c) en tant que marqueur intermédiaire. Cependant, considérant que, par le passé, certaines molécules ont été associées à des risques cardiovasculaires, la Food and Drug Administration (FDA) exige depuis 2008 des preuves que les nouveaux médicaments pour le DB2 n’entraînent pas de risques cardiovasculaires12. D’un côté, pensons aux avantages de la metformine13,14. D’un autre côté, pensons au risque d’insuffisance cardiaque associé aux thiazolidinediones et à la saxagliptine15,16. L’étude EMPA-REG évalue donc les effets de l’empagliflozine, un agent de la classe des inhibiteurs du sodium-glucose cotransporteur 2 (SGLT2), sur la mortalité et la morbidité cardiovasculaire.
Protocole de recherche : Il s’agit d’une étude de phase III, multicentrique (590 sites dans 42 pays), à répartition aléatoire selon un ratio 1:1:1 (empagliflozine dosée à 10 mg, à 25 mg et groupe témoin), contrôlée par placebo, avec des groupes parallèles et à double insu. Les blocs de répartition aléatoire ont été stratifiés selon l’HbA1c, l’indice de masse corporelle (IMC), la région géographique et le débit de filtration glomérulaire estimé (DFGe). L’étude est basée sur un protocole de non-infériorité avec une marge prédéfinie à 1,3, tel que le demande la FDA12. Un test de supériorité en progression hiérarchique était prévu en cas d’atteinte de la non-infériorité. L’étude devait se poursuivre jusqu’à ce que l’objectif primaire soit atteint par au moins 691 patients pour assurer une puissance de 90 % avec une erreur alpha de 0,0249 unilatérale. Les analyses statistiques étaient effectuées en intention de traiter modifiée (mITT), c’est-à-dire que tous les patients devaient avoir reçu au moins une dose. De plus, les patients sans événement étaient censurés à la dernière date où ils avaient été déclarés sans événement.
Patients : Les patients ont été recrutés entre septembre 2010 et avril 2013. Il s’agissait d’adultes atteints de DB2 et présentant une maladie cardiovasculaire établie. Les critères d’inclusion et d’exclusion sont présentés au tableau I.
Tableau I Principaux critères d’inclusion et d’exclusiona

Interventions : Les patients ont été répartis de façon aléatoire soit dans le groupe placebo, dans celui de l’empagliflozine à 10 mg ou dans celui de l’empagliflozine à 25 mg, les substances étant administrées une fois par jour après une phase ouverte avec placebo et une répartition préalable aléatoire de deux semaines. Les visites de contrôle se faisaient toutes les quatre semaines jusqu’à la semaine 16, puis toutes les 12 semaines jusqu’à la semaine 52, puis toutes les 14 semaines jusqu’à la visite finale, moment où le traitement prenait fin. Une dernière visite était planifiée 30 jours après la fin de l’étude. L’évaluation portait sur l’efficacité (mesures de glycémies, HbA1c, bilan lipidique, tour de taille, etc.), l’innocuité (effets secondaires rapportés, événements cardiovasculaires) et l’adhésion à la médication. Les patients poursuivaient leur traitement de base pour le diabète, et il était interdit de le modifier pendant les 12 premières semaines de l’étude sauf en cas d’hyperglycémie à jeun confirmée (plus de 13,3 mmol/L) ou en cas d’autre nécessité médicale. Après la semaine 12, les cliniciens étaient invités à ajuster le traitement de base du diabète pour qu’il atteigne les cibles glycémiques selon les lignes directrices locales. Tout au long de l’étude, ils étaient aussi invités à traiter les facteurs de risque cardiovasculaire, soit l’hypertension et la dyslipidémie, selon les lignes directrices locales.
Points évalués : L’objectif primaire était un composite de décès d’origine cardiovasculaire, d’IM non fatal (à l’exclusion des IM silencieux) ou d’AVC non fatal. L’objectif secondaire principal se composait d’un événement de l’objectif primaire ou d’une hospitalisation pour une angine instable. Les autres objectifs secondaires pertinents englobaient la mortalité cardiovasculaire, l’IM silencieux, l’hospitalisation pour insuffisance cardiaque et la revascularisation coronarienne. Chaque élément de l’objectif primaire subissait aussi une évaluation séparée en tant qu’objectif secondaire. Deux comités d’adjudication indépendants évaluaient les événements cardiovasculaires et les décès : l’un analysait les événements cardiovasculaires et l’autre, les événements neurologiques, tels que le demande la FDA. L’évaluation de l’innocuité reposait sur l’apparition d’effets indésirables durant le traitement ainsi que dans les sept jours qui suivaient la dernière dose reçue. Les hypoglycémies, les infections urinaires, les infections génitales, les déplétions volémiques, les insuffisances rénales aiguës, les fractures osseuses, les acidocétoses diabétiques et les événements thromboemboliques étaient les effets indésirables qui intéressaient spécialement les investigateurs.
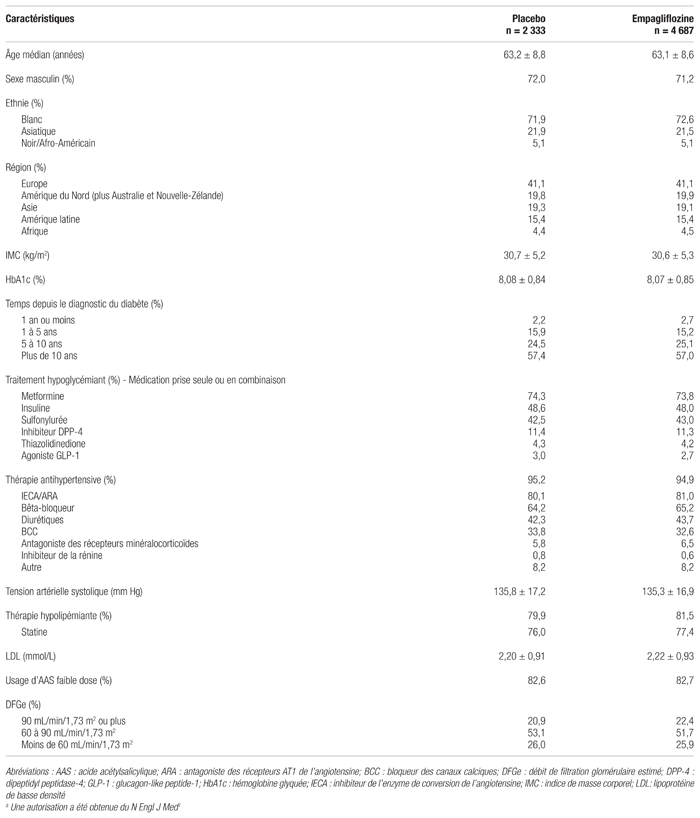
Résultats : À noter que, comme il n’y a pas de différence statistiquement significative entre les résultats des groupes d’empagliflozine dosée à 10 et à 25 mg, ils sont présentés ensemble. Sur les 11 531 patients évalués, 7 028 ont été répartis aléatoirement, et 7 020 ont été inclus dans l’analyse. Parmi les patients ayant cessé le traitement prématurément, 683 faisaient partie du groupe placebo (29 %) et 1 097 des groupes empagliflozine (23 %). Les raisons de cessation étaient similaires entre les groupes, les principales étant les effets secondaires ou le refus de poursuivre l’étude (non dû à des effets secondaires). Au total, 211 patients n’ont pas achevé l’étude (67 patients dans le groupe placebo [2,9 %] et 144 patients dans les groupes empagliflozine [3,1 %]). Il y a eu 28 pertes au suivi (11 patients dans le groupe placebo et 17 patients dans les groupes empagliflozine). Le nombre de patients dont l’information sur le statut vital était manquante était donc négligeable. Les patients ont bénéficié d’un suivi moyen de 3,1 ans et ont reçu la médication durant une moyenne de 2,6 ans. Le tableau II résume les principales caractéristiques de base des patients. Les caractéristiques des patients, y compris celles rapportées dans l’étude, mais qui ne sont pas présentées ici par souci de concision, étaient semblables, ce qui rendait les groupes de traitement comparables. Aucune information n’a été fournie sur l’adhésion à la médication. La majorité des patients remplissaient le critère de risque cardiovasculaire en raison d’une maladie coronarienne ou d’un antécédent d’IM. Les patients recevaient en général plusieurs médicaments indiqués pour contrôler ces facteurs de risque cardiovasculaire. De plus, au cours de l’étude, le traitement des patients a requis l’ajout d’inhibiteurs de l’enzyme de conversion de l’angiotensine (IECA) ou d’antagonistes des récepteurs AT1 de l’angiotensine (ARA) (27,4 % des patients dans le groupe placebo contre 23,6 % dans les groupes empagliflozine), des bêta-bloqueurs (respectivement 18,0 % et 15,9 %) et de l’acide acétylsalicylique (AAS) ( respectivement 17,2 % et 15,7 %).
Tableau II Caractéristiques de la population au début de l’étudea
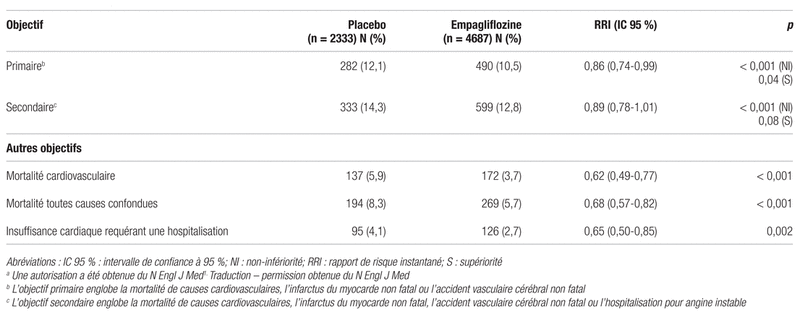
Le tableau III résume les résultats obtenus. Les événements constituant l’objectif primaire ont été moins fréquents dans les groupes empagliflozine (10,5 %) que dans le groupe placebo (12,1 %), et ce, de façon statistiquement significative. Cela représente une diminution relative de 14 % des événements (rapport de risque instantané [RRI]:0,86; intervalle de confiance à 95 % [IC 95 %]:0,74–0,99, p < 0,001 pour non-infériorité et p = 0,04 pour supériorité). Les événements relatifs à l’objectif secondaire principal se sont produits chez 12,8 % des patients des groupes empagliflozine et chez 14,3 % des patients du groupe placebo, soit une diminution relative de 11 % des événements (RRI:0,89;IC 95 %:0,78–1,01, p < 0,001 pour non-infériorité et p = 0,08 pour supériorité). La mortalité de cause cardiovasculaire a diminué de 38 % (RRI:0,62;IC 95 %:0,49–0,77, p < 0,001) et la mortalité toutes causes confondues, de 32 % (RRI:0,68;IC 95 %:0,57–0,82, p < 0,001) dans les groupes empagliflozine. Le nombre de patients à traiter (NNT) était de 39 sur une période de trois ans pour prévenir un décès. Le risque d’hospitalisation pour insuffisance cardiaque a diminué de 35 % (RRI:0,65;IC 95 %:0,50–0,85, p = 0,002).
Tableau III Principaux résultats de sécurité cardiovasculairea
Une analyse de sensibilité portant sur la mortalité toutes causes confondues a démontré un avantage significatif de l’empagliflozine sur le placebo (RRI:0,77; IC 95 %:0,65–0,93, p = 0,005). Dans cette analyse, tous les patients perdus au suivi dans les groupes empagliflozine ont été considérés comme décédés, et tous les patients perdus au suivi du groupe placebo ont été considérés comme vivants.
Les analyses de sous-groupes ont démontré que les avantages n’étaient pas constants dans tous les sous-groupes en ce qui concerne l’objectif primaire, mais qu’ils l’étaient dans tous les sous-groupes pour ce qui a trait à la mortalité de cause cardiovasculaire. En effet, cette composante de l’objectif primaire a semblé être le facteur qui rendait l’avantage significatif.
La proportion de patients ayant eu des effets indésirables quelconques, graves ou ayant mené à l’arrêt du traitement était similaire dans les deux groupes. Cependant, on a rapporté un plus grand nombre d’infections génitales dans les groupes empagliflozine (6,4 %) que dans le groupe placebo (1,8 %; p < 0,001).
Il faut aussi mentionner qu’à la semaine 12, l’HbA1c était respectivement inférieure en moyenne de 0,54 % (IC 95 %:0,49–0,58) et de 0,60 % (IC 95 %:0,55–0,64) dans les groupes empagliflozine dosée à 10 et à 25 mg comparativement au groupe placebo. La différence s’atténuait pour obtenir respectivement, à la semaine 206, une diminution moyenne de 0,24 % (IC 95 %:0,08–0,40) et de 0,36 % (IC 95 %:0,20–0,51).
L’étude EMPA-REG est basée sur un protocole de recherche fiable. La mesure des covariables des groupes de traitement était comparable initialement. La taille de l’échantillon était adéquate et permettait de penser que la répartition aléatoire a probablement réduit les biais de confusion. Le suivi moyen de 3,1 années peut sembler minimal pour assurer l’innocuité à long terme d’un médicament sur le système cardiovasculaire, mais cette durée est conforme aux recommandations de la FDA. Cependant, la supériorité de l’empagliflozine par rapport au placebo, plutôt que sa simple innocuité, peut nous rassurer en ce sens. Les intervalles de confiance étaient suffisamment étroits pour conclure à la non-infériorité puis à la supériorité de l’empagliflozine en matière d’innocuité sur le système cardiovasculaire par rapport au placebo.
Les courbes de survie de Kaplan-Meier, qui ne sont pas présentées ici, se séparent tôt dans l’étude et de façon évidente. De plus, la différence d’HbA1c, même si elle est significative, ne peut expliquer complètement cette différence du taux de mortalité cardiovasculaire précoce. En effet, les études portant sur les cibles glycémiques démontrent que les taux d’HbA1c influencent difficilement le taux de mortalité ou le font à long terme13,14. Le taux d’HbA1c est significativement plus bas dans les groupes empagliflozine, tel que nous l’avons mentionné précédemment, mais cette différence tend à diminuer au fur et à mesure que les courbes de Kaplan-Meier se séparent de plus en plus. Ainsi, les résultats de cette étude semblent montrer qu’il est possible d’améliorer la survie des patients indépendamment des cibles glycémiques. De plus, au cours de l’étude, les patients du groupe placebo ont reçu davantage d’IECA, d’ARA, de bêta-bloqueurs et d’AAS que les patients du groupe empaglifozine. Cela aurait donc pu atténuer l’effet apparent de l’empagliflozine, mais celui-ci était malgré tout statistiquement significatif.
Par ailleurs, le protocole de l’étude prévoyait dès le départ une analyse mITT alors qu’il s’agit d’une étude de non-infériorité, ce qui n’est pas adéquat. Il aurait fallu une analyse per protocole et, dans le cas présent, une analyse « tel que traité » aurait été aussi requise car, avec la cessation prématurée du traitement actif de 23 % des patients, la ressemblance entre les groupes augmente et favorise la non-infériorité apparente17. Les analyses prévues ont tout de même été faites en mITT, ce qui favorise la non-infériorité des groupes empagliflozine. Cependant, la supériorité a été démontrée par la suite, ce qui peut justifier l’analyse mITT comme seule analyse.
Ensuite, l’effet sur la mortalité cardiovasculaire semble a priori intéressant. Il faut cependant mentionner que les principales catégories de décès évités dans les groupes empagliflozine sont les morts subites et les décès d’« autres causes cardiovasculaires ». Cette dernière catégorie regroupe des décès non évaluables mais présumés d’origine cardiovasculaire par convention. Ainsi, l’effet protecteur de l’empagliflozine n’est pas majoritairement dû à une diminution de la mortalité à la suite d’événements macrovasculaires (IM ou AVC). De plus, les taux d’AVC non fatals et d’IM non fatals ne sont pas affectés significativement. L’avantage de l’empagliflozine en ce qui concerne la mortalité cardiovasculaire semble donc atypique. À la lumière de cette étude, cet effet ne serait généralisable qu’aux patients présentant un risque cardiovasculaire élevé. Ainsi, l’empagliflozine est peut-être en train de se tailler une place de choix pour le traitement du diabète dans cette population. L’effet de l’empagliflozine sur la mortalité toutes causes confondues est attrayant avec un NNT de 39. À titre comparatif, il y avait un NNT de 56 pour prévenir le décès dans l’étude « Heart Protection Study », portant sur la simvastatine à 40 mg pour les patients présentant un risque cardiovasculaire élevé18. Cette étude comprenait beaucoup de patients diabétiques coronariens, et les avantages de la simvastatine pour prévenir les événements cardiovasculaires majeurs étaient constants dans les analyses de sous-groupes.
De plus, cette étude semble montrer que l’empaglifozine serait sécuritaire et possiblement même bénéfique pour les patients insuffisants cardiaques ayant un diabète concomitant. Cependant, il est possible que l’effet sur le risque d’hospitalisation pour insuffisance cardiaque soit en partie dû à la diurèse glycosurique et que les avantages spécifiques soient moindres en concomitance avec un diurétique de l’anse. Il ne s’agit pas non plus d’une étude visant spécifiquement les insuffisants cardiaques, ces résultats doivent donc être interprétés prudemment. Malgré tout, l’empagliflozine pourrait être une molécule à prendre davantage en considération pour le traitement du diabète des insuffisants cardiaques, mais il faudrait avoir davantage de données pour le confirmer et pour évaluer l’interaction pharmacodynamique possible avec les diurétiques de l’anse dans cette population.
L’empagliflozine ne semble pas être la seule molécule qui présente un avantage inattendu. En effet, une diminution absolue de la mortalité de 1,4 % toutes causes confondues pour un NNT de 72 avec l’utilisation du liraglutide contre le placebo a été observée dans l’étude LEADER, une étude très similaire à EMPA-REG. La mortalité était de 8,2 % dans le groupe liraglutide et de 9,6 % dans le groupe placebo pour un RRI de 0,85 (IC 95 %:0,74–0,97, p = 0,02). De même, la mortalité cardiovasculaire est l’objectif le plus significatif et le risque d’IM ou d’AVC ne diminue pas sous l’effet du liraglutide19.
À noter que des études évaluant la sécurité cardiovasculaire de l’usage de la dapagliflozine (DECLARE-TIMI58) et de la canagliflozine (CANVAS) sont toujours en cours. Leurs résultats permettront d’élucider s’il s’agit d’un effet de classe.
Enfin, l’avantage apparent de l’empagliflozine soulève de nombreuses questions quant aux mécanismes possibles. Puisque les bienfaits des deux doses étudiées sont semblables malgré une différence du contrôle glycémique entre les deux, d’autres hypothèses sont à explorer. Celles-ci sont nombreuses, dont un effet global sur des paramètres physiologiques multiples, une augmentation de la sécrétion endogène de glucagon qui aurait un effet inotrope positif, une amélioration de l’oxydation des acides gras par le myocarde, un effet néphroprotecteur qui aurait une action bénéfique sur les fonctions cardiovasculaires ou encore la toxicité relative des autres hypoglycémiants reçus par les patients du groupe placebo20. Ceci reste également à élucider.
L’innocuité cardiovasculaire de l’empagliflozine semble certaine. L’effet protecteur de l’empagliflozine sur la mortalité et les hospitalisations pour insuffisance cardiaque offre un avantage potentiel pour la population des patients diabétiques présentant un risque cardiovasculaire élevé. Cependant, l’origine de cet effet protecteur demeure à élucider. Cette étude et les études à venir sur la sécurité cardiovasculaire des hypoglycémiants oraux modifieront la façon de sélectionner les traitements des patients diabétiques, car il semble maintenant que l’espérance de vie puisse être améliorée indépendamment des cibles glycémiques.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs remercient les responsables et les collaborateurs pour les commentaires reçus lors de la rédaction de cet article. Une autorisation écrite a été obtenue des personnes qui sont l’objet de nos remerciements.
1. Zinman B, Wanner C, Lachin JM, Fitchett D, Bluhmki E, Hantel S et coll. Empagliflozin, cardiovascular outcomes, and mortality in type 2 diabetes. N Engl J Med 2015;373:2117–28.
2. Agence de la santé publique du Canada. Le diabète au Canada : Perspective de santé publique sur les faits et chiffres. [en ligne] http://www.phac-aspc.gc.ca/cd-mc/publications/diabetes-diabete/facts-figures-faits-chiffres-2011/introduction-fra.php#Typ (site visité le 3 août 2016).
3. Shamoon H, Duffy H, Fleischer N, Engel S, Saenger P, Strelzyn M et coll. The effect of intensive treatment of diabetes on the development and progression of long-term complications in insulin-dependent diabetes mellitus. N Engl J Med 1993;329:977–86.
4. Haffner SM, Lehto S, Rönnemaa T, Pyörälä K, Laakso M. Mortality from coronary heart disease in subjects with type 2 diabetes and in non-diabetic subjects with and without prior myocardial infarction. N Engl J Med 1998;339:229–34.
5. Gerstein HC, Miller ME, Byington RP, Goff DC, Bigger JT, Buse JB et coll. Effects of intensive glucose lowering in type 2 diabetes. N Engl J Med 2008;358:2545–59.

6. Patel A, MacMahon S, Chalmers J, Neal B, Billot L, Woodward M et coll. Intensive blood glucose control and vascular outcomes in patients with type 2 diabetes. N Engl J Med 2008;358:2560–72.
7. Duckworth W, Abraira C, Moritz T, Reda D, Emanuele N, Reaven PD et coll. Glucose control and vascular complications in veterans with type 2 diabetes. N Engl J Med 2009;360:129–39.
8. Nathan DM, Cleary PA, Backlund JY, Genuth SM, Lachin JM, Orchard TJ et coll. Intensive diabetes treatment and cardiovascular disease in patients with type 1 diabetes. N Engl J Med 2005;353:2643–53.

9. Holman RR, Paul SK, Bethel MA, Matthews DR, Neil HAW. 10-year follow-up of intensive glucose control in type 2 diabetes. N Engl J Med 2008;359:1577–89.
10. Hayward RA, Reaven PD, Wiitala WL, Bahn GD, Reda DJ, Ge L et coll. Follow-up of glycemic control and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2015;372:2197–206.
11. Zoungas S, Chalmers J, Neal B, Billot L, Li Q, Hirakawa Y et coll. Follow-up of blood-pressure lowering and glucose control in type 2 diabetes. N Engl J Med 2014;371:1392–406.
12. U.S. Department of health and human, services food and drug administration, center for drug evaluation and research. Guidance for industry-diabetes mellitus-evaluating cardiovascular risk in new antidiabetic therapies to treat type 2 diabetes. [en ligne] http://www.fda.gov/downloads/drugs/guidancecomplianceregulatoryinformation/guidances/ucm071627.pdf (site visité le 3 août 2016).
13. Turner RC, Holman RR, Cull CA, Stratton IM, Matthews DR, Frighi V et coll. Intensive blood-glucose control with sulphonylureas or insulin compared with conventional treatment and risk of complications in patients with type 2 diabetes (UKPDS 33). Lancet 1998;352:837–53.
14. Turner RC, Holman RR, Cull CA, Stratton IM, Matthews DR, Frighi V et coll. Effect of intensive blood-glucose control with metformin on complications in overweight patients with type 2 diabetes (UKPDS 34). Lancet 1998;352:854–65.
15. Home PD, Pocock SJ, Beck-Nielsen H, Gomis R, Hanefeld M, Jones NP et coll. Rosiglitazone evaluated for cardiovascular outcomes – an interim analysis. N Engl J Med 2007;357:28–38.
16. Scirica BM, Bhatt DL, Braunwald E, Steg PG, Davidson J, Hirshberg B et coll. Saxagliptin and cardiovascular outcomes in patients with type 2 diabetes mellitus. N Engl J Med 2013;369:1317–26.
17. U.S. Department of health and human, services food and drug administration, center for drug evaluation and research. Guidance for industry - non inferiority clinical trial. [en ligne] http://www.fda.gov/downloads/Drugs/.../Guidances/UCM202140.pdf (site visité le 4 août 2016).
18. Collins R, Armitage J, Parish S, Sleight P, Peto R, Meade T et coll. MRC/BHF Heart protection study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: a randomised placebo-controlled trial. Lancet 2002;360:7–22.
19. Marso SP, Daniels GH, Brown-Frandsen K, Kristensen P, Mann JFE, Nauck MA et coll. Liraglutide and cardiovascular outcomes in type 2 diabetes. N Engl J Med 2016;375:311–22.

20. Inzucchi SE, Zinman B, Wanner C, Ferrari R, Fitchett D, Hantel S et coll. SGLT-2 inhibitors and cardiovascular risk : proposed pathways and review of ongoing outcome trials. Diab Vasc Dis Res 2015;12:90–100.

PHARMACTUEL, Vol. 50, No. 1, 2017