
Camille Oostdyke Girouard1,2, Pharm.D., M.Sc., Mélyse D. Chénier1,3, Pharm.D., M.Sc., Cynthia Béchard1,4, Pharm.D., M.Sc.
1Candidate à la Maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Pharmacienne, Centre intégré de santé et de services sociaux de la Montérégie-Ouest, site Salaberry-de-Valleyfield (Québec) Canada;
3Pharmacienne, Centre intégré de santé et de services sociaux de Lanaudière, site Hôpital Pierre-Le Gardeur, Terrebonne (Québec) Canada;
4Pharmacienne, Centre intégré de santé et de services sociaux des Laurentides, site Hôpital de Saint-Eustache, Saint-Eustache (Québec) Canada
Reçu le 8 septembre 2016; Accepté après révision par les pairs le 9 juin 2017
Titre de l’article : A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015;373:11-221.
Auteurs : Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M et coll.
Commanditaires : Cette étude a été financée par Novo Nordisk, qui a participé à l’analyse statistique des données, a fourni les médicaments et a assuré une assistance éditoriale et rédactionnelle.
Cadre de l’étude : L’obésité est un phénomène grandissant qui affecte environ un Canadien sur quatre2. L’obésité se définit par un indice de masse corporelle (IMC) supérieur ou égal à 30 kg/m2 alors qu’un IMC de 25 à 29,9 correspond à de l’embonpoint3. Les risques de maladies cardiovasculaires, de diabète et de mortalité toutes causes confondues augmentent de manière proportionnelle à l’IMC et une perte de poids, ne serait-ce que de 5 à 10 %, permet de les réduire4. La pharmacothérapie pour le traitement de l’obésité peut être envisagée lorsque les modifications des habitudes de vie seules ne suffisent pas à faire perdre du poids ou à maintenir une perte de poids à des patients qui ont un IMC supérieur ou égal à 30 kg/m2 ou un IMC supérieur ou égal à 27 kg/m2 avec présence de comorbidités4,5. En dernier recours, lors d’échec de toutes les mesures comportementales et médicamenteuses, il est possible d’envisager la chirurgie bariatrique pour les patients ayant un IMC supérieur ou égal à 40 kg/m2 ou un IMC supérieur ou égal à 35 kg/m2 accompagné de comorbidités5. Les options de traitement de l’obésité sont limitées au Canada et comprennent principalement l’orlistat et certains médicaments utilisés pour le diabète (metformine, inhibiteurs du cotransporteur sodium-glucose de type 2 et liraglutide)6. Aux États-Unis, d’autres traitements sont approuvés, comme le lorcaserin, l’association naltrexone-bupropion et l’association phentermine-topiramate6. Le liraglutide est un analogue du glucagon-like peptide (GLP-1) humain et agoniste du récepteur GLP-1. Il est indiqué dans le traitement du diabète de type 2 à une dose uniquotidienne de 1,2 à 1,8 mg par voie sous-cutanée7. Cette molécule agit aussi sur la perte de poids par ses effets de prolongation de la satiété et de diminution de l’appétit8. Cette étude avait pour but d’évaluer l’efficacité et l’innocuité du liraglutide à la dose de 3 mg, administré une fois par jour en concomitance avec une diète hypocalorique (−500 kcal par jour) et de l’activité physique pour la perte de poids des patients obèses et non diabétiques.
Protocole de recherche : Il s’agit d’une étude à répartition aléatoire, contrôlée par placebo, à double insu, multicentrique, internationale, avec un plan de traitement parallèle et réalisée sur une période de 56 semaines. Les patients étaient initialement répartis aléatoirement selon un ratio 2:1 soit dans le groupe traitement ou le groupe placebo, avec une stratification selon la présence ou non de prédiabète lors de la période de recrutement et selon l’IMC (supérieur ou égal à 30 ou inférieur à 30). Après une période d’extension de 12 semaines, une deuxième répartition aléatoire dans le groupe liraglutide a été effectuée selon un ratio 1:1 (poursuite du traitement ou changement pour le placebo). Les patients étaient suivis toutes les deux semaines jusqu’à la semaine huit, puis environ tous les mois. L’étude s’est déroulée du 1er juin 2011 au 18 mars 2013.
Patients : Les patients admissibles devaient être âgés de plus de 18 ans et avoir un IMC supérieur ou égal à 30 kg/m2 ou supérieur ou égal à 27 kg/m2 avec une hypertension ou une dyslipidémie concomitante traitée ou non. De plus, leur poids devait être stable durant les trois mois précédant l’étude. Les patients étaient entre autres exclus s’ils étaient diabétiques, s’ils utilisaient des médicaments connus pour causer une perte ou un gain de poids cliniquement significatif ou s’ils avaient un antécédent de chirurgie bariatrique, de pancréatite ou de maladie psychiatrique sévère. Une contre-indication à l’utilisation du liraglutide, telle qu’une histoire personnelle ou familiale de néoplasie endocrinienne multiple de type 2 ou de carcinome médullaire de la thyroïde était également un critère d’exclusion de l’étude.
Interventions : Les patients recevaient soit le liraglutide jusqu’à une dose uniquotidienne de 3 mg ou un placebo. Les sujets du groupe liraglutide débutaient à une dose de 0,6 mg et la dose était augmentée graduellement de 0,6 mg chaque semaine jusqu’à l’obtention de 3 mg. Les participants recevaient en outre des conseils mensuels sur les modifications des habitudes de vie et étaient encouragés à faire de l’activité physique pendant au moins 150 minutes hebdomadairement et à diminuer leur apport calorique quotidien d’environ 500 kcal.
Points évalués : L’objectif primaire visait à évaluer l’efficacité et l’innocuité du liraglutide comme adjuvant à une modification des habitudes de vie pour le traitement de l’embonpoint ou de l’obésité des adultes non diabétiques. L’efficacité a été évaluée par trois objectifs primaires, soit le changement de poids par rapport au poids de départ et la proportion de patients ayant perdu au moins 5 % et plus de 10 % de leur poids initial. Les objectifs secondaires d’efficacité évaluaient les changements des paramètres suivants après 56 semaines : IMC, tour de taille, paramètres de contrôle glycémique, biomarqueurs cardiométaboliques et qualité de vie associée à la santé. L’évaluation de la qualité de vie a été réalisée à l’aide du questionnaire court d’étude de la santé (SF-36) et du questionnaire abrégé d’impact du poids sur la qualité de vie. L’évaluation des effets secondaires a été réalisée à l’aveugle de façon prospective par des experts médicaux indépendants. En ce qui concerne la période d’extension de l’étude, celle-ci avait pour objectif d’évaluer la durabilité de l’effet du liraglutide et les effets indésirables liés à l’arrêt du traitement.
Résultats : Des 3731 patients ayant été répartis de manière aléatoire, 2487 ont reçu le liraglutide et 1244 ont reçu un placebo.
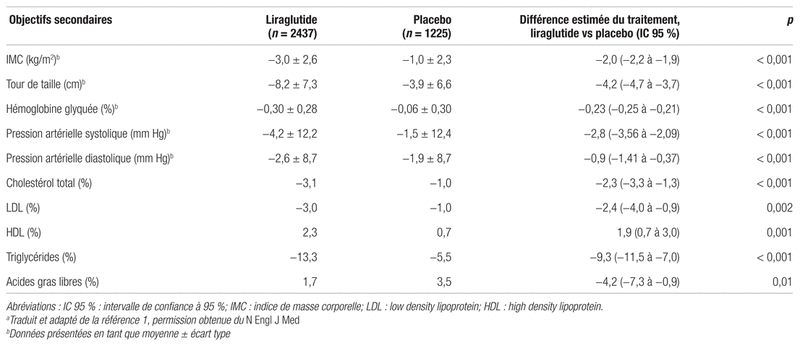
Au départ, les caractéristiques des patients étaient similaires dans les deux groupes (tableau I). Après 56 semaines, les patients du groupe liraglutide ont subi une perte de poids moyenne de 8,4 kg (écart-type 7,3 kg) tandis que les patients du groupe placebo ont perdu en moyenne 2,8 kg (écart-type 6,5 kg). Ces pertes de poids ont représenté respectivement 8 % (écart-type 6,7 %) et 2,6 % (écart-type 5,7 %) du poids corporel initial sous l’effet du liraglutide et du placebo. La différence de perte de poids de 5,6 kg des patients du groupe liraglutide comparativement à ceux du groupe placebo était statistiquement significative (intervalle de confiance à 95 % [IC 95 %] − 6 à − 5,1, p < 0,001). La perte de poids sous l’effet du liraglutide a été maintenue tout au long de l’étude, indépendamment du statut de prédiabète. Une plus grande proportion de patients du groupe liraglutide comparativement au groupe placebo ont enregistré une perte de poids d’au moins 5 % de leur poids initial (63,2 % contre 27,1 %, p <0,001) ou supérieure à 10 % de leur poids initial (33,1 % contre 10,6 %, p < 0,001). Le nombre de sujets à traiter selon cette étude est de trois pour obtenir une perte d’au moins 5 % du poids corporel initial et de cinq pour une perte supérieure à 10 % du poids corporel initial. En ce qui concerne les objectifs secondaires d’efficacité, après 56 semaines, une plus grande diminution du tour de taille, de l’IMC, des paramètres glycémiques et cardiométaboliques a été observée dans le groupe liraglutide comparativement au placebo. Une prévalence de prédiabète significativement plus basse a été observée dans le groupe liraglutide par rapport au placebo et le développement du diabète a été plus fréquent dans le groupe placebo (14 cas) comparativement au groupe traitement (quatre cas) (p < 0,001). Une hausse de la fréquence cardiaque de deux battements par minute a été notée chez les patients du groupe liraglutide (p < 0,001). Des scores de qualité de vie supérieurs ont également été rapportés dans le groupe liraglutide par rapport au placebo, sauf pour les effets secondaires du traitement. Le tableau II présente les principaux résultats des objectifs secondaires d’efficacité.
Tableau I Résumé des caractéristiques des patients au début de l’étudea

Tableau II Résumé des changements relatifs aux objectifs secondaires d’efficacité entre le début de l’étude et la semaine 56a
Les effets secondaires les plus fréquents dans le groupe liraglutide étaient les nausées (40,2 %), les diarrhées (20,9 %), la constipation (20,0 %) et les vomissements (16,3 %). La majorité (94 %) des effets secondaires étaient d’intensité légère à modérée et étaient rapportés principalement dans les quatre à huit premières semaines de traitement. Peu d’hypoglycémies ont été observées dans chaque groupe de traitement, soit 1,3 % dans le groupe liraglutide comparativement à 1 % dans le groupe placebo. Le nombre de cas de cholélithiases et de cholécystites était plus élevé dans le groupe liraglutide (2,5 %) comparativement au placebo (1 %). Ces conséquences étaient observées surtout chez les patients dont la perte de poids était plus importante et plus rapide. De plus, 11 cas de pancréatite (0,4 %) et 10 cas de cancer du sein (0,6 %) ont été rapportés dans le groupe liraglutide par rapport à un cas de pancréatite (moins de 0,1 %) et trois cas de cancer du sein (0,2 %) dans le groupe placebo. Enfin, trois cas de cancer de la thyroïde ont été observés dans le groupe liraglutide et aucun dans le groupe placebo.
Plus l’IMC est élevé, plus grand est le risque de morbidité et de mortalité4. La perte de poids des patients obèses est donc un enjeu important. Étant donné que les modifications des habitudes de vie seules suffisent rarement à permettre le maintien d’une perte de poids, les traitements pharmacologiques, tels que le liraglutide, pourraient prendre une place plus importante dans la prise en charge des patients obèses. Le liraglutide a déjà été évalué lors d’une étude de phase II effectuée sur 20 semaines auprès de patients obèses non diabétiques et a démontré une meilleure efficacité que l’orlistat et le placebo pour la perte de poids ainsi qu’un effet dose-dépendant9. Les avantages du liraglutide sur la perte de poids étaient maintenus lors de l’extension de l’étude de deux ans10.
Cette étude de phase III démontre la supériorité du liraglutide comparativement au placebo pour la perte de poids des patients obèses non diabétiques ainsi que des avantages sur les biomarqueurs cardiométaboliques, la qualité de vie et le contrôle glycémique. La prévalence du prédiabète était significativement plus basse avec le liraglutide comparativement au placebo à la semaine 56, et le développement du diabète était plus fréquent dans le groupe placebo (14 cas) par rapport au groupe traitement (quatre cas). Considérant que plus de 60 % des patients inclus étaient prédiabétiques au début de l’étude, les résultats démontrent qu’un traitement au liraglutide pourrait prévenir l’apparition du diabète chez les patients prédiabétiques. Cependant, des effets secondaires gastro-intestinaux sont survenus chez 40 % des patients traités au liraglutide et ces effets constituent la cause principale d’arrêt du traitement, soit 6,4 % des patients. La perte de poids plus importante dans le groupe liraglutide pourrait en partie être expliquée par la présence de nausées et de vomissements. Des analyses supplémentaires visant à évaluer le rôle qu’ont joué ces effets secondaires sur les résultats de perte de poids n’ont pas été réalisées dans cette étude. En outre, la survenue de ces effets indésirables peut amener à penser que les traitements ont difficilement pu être masqués pendant toute la durée de l’étude. L’innocuité du liraglutide à long terme demeure par ailleurs inconnue et les données actuelles se limitent à une période de deux ans10. Il est à noter que, dans cette étude, la survenue d’effets secondaires majeurs, tels les cholélithiases, les cholécystites, les pancréatites et les cancers du sein était plus fréquente dans le groupe liraglutide. De plus, une hausse de la fréquence cardiaque a été observée dans le groupe liraglutide, de manière statistiquement significative. D’autres études sont nécessaires afin de déterminer les effets cliniques de cette hausse. Concernant la généralisation des résultats, elle est peut-être plus limitée pour les patients ayant de multiples comorbidités ainsi que pour les personnes âgées, étant donné que l’âge moyen des sujets était de 45 ans. De plus, dans un contexte d’étude, la motivation et l’adhésion des patients au traitement et aux modifications des habitudes de vie peuvent être améliorées. Le liraglutide utilisé dans d’autres circonstances pourrait être moins efficace. Aucune information n’est fournie quant à l’adhésion des sujets ainsi qu’aux traitements concomitants dans cette étude. Enfin, la participation de la compagnie pharmaceutique dans le financement de l’étude peut faire l’objet de préoccupation éthique étant donné sa collaboration et son assistance à différentes étapes de l’étude, dont l’analyse statistique, le processus éditorial et rédactionnel.
La méthodologie de cette étude à répartition aléatoire contrôlée à double insu demeure une force et permet d’évaluer l’efficacité de ce nouveau traitement. Les objectifs sélectionnés sont pertinents et respectent les recommandations de la Food and Drug Administration pour l’élaboration d’une étude qui vise à développer un produit pour la perte de poids13. Vu les nombreuses données manquantes, les auteurs ont fait des analyses de sensibilité (imputations multiples) pour évaluer leurs effets potentiels sur les résultats. Ces analyses n’ont pas montré de différences dans les résultats, ce qui limite le biais de sélection. De plus, la taille de l’échantillon était calculée pour permettre une puissance de 99 %, ce qui est largement suffisant. Les données manquantes peuvent donc avoir une influence moindre sur les résultats. Par ailleurs, la pierre angulaire dans la prise en charge de l’obésité demeure les mesures non pharmacologiques, tels les changements des habitudes de vie et alimentaires. Les lignes directrices recommandent la pharmacothérapie en ajout à ces mesures4,5. Le choix du placebo comme traitement comparateur est ainsi pertinent et va dans le même sens que les recommandations de la littérature scientifique. La période de suivi était suffisamment longue pour évaluer l’efficacité de la molécule sur la perte de poids14.
Le liraglutide (SaxendaMD) est approuvé par Santé Canada, mais n’a pas été évalué par l’Institut national d’excellence en santé et en services sociaux (INESSS) et n’est pas couvert par le Régime général d’assurance médicaments (RGAM). Il coûte environ 365 $ par mois15. Son prix élevé et son mode d’administration sous-cutané sont donc à prendre en considération, surtout si un traitement est prévu à long terme. L’avantage de l’orlistat comparativement au SaxendaMD porte sur son mode d’administration par la voie orale et son coût moindre (environ 140 $/mois)16. L’orlistat doit toutefois être pris trois fois par jour et pourrait potentiellement être moins efficace que le liraglutide dosé à 3 mg9. Une récente méta-analyse prenant en compte 28 essais cliniques à répartition aléatoire et comptant 29 018 patients a démontré que différents traitements sont associés à une perte de poids statistiquement significative à 52 semaines comparativement au placebo, soit l’association phentermine-topiramate (8,8 kg), le liraglutide (5,3 kg), l’association naltrexone-bupropion (5 kg), le lorcaserin (3,2 kg) et l’orlistat (2,6 kg). Tous ces agents ont démontré une perte de poids possible d’au moins 5 % à 52 semaines. Cependant, la combinaison phentermine-topiramate et le liraglutide ont été associés à de meilleurs résultats avec une médiane de 75 % et 65 % des patients qui ont respectivement atteint une perte de poids d’au moins 5 %17.
Le liraglutide à la dose de 3 mg pris quotidiennement pendant 56 semaines en combinaison avec l’exercice physique et un régime hypocalorique permet une perte de poids statistiquement et cliniquement significative des patients obèses non diabétiques en comparaison avec un placebo.
Aucun financement en relation avec le présent article n’a été déclaré par les auteures.
Toutes les auteures ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteures n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Les auteures de cet article remercient les responsables et collaborateurs du cours de Communication scientifique à la maitrise en pharmacothérapie avancée de la Faculté de pharmacie de l’Université de Montréal. Une autorisation écrite a été obtenue de ces personnes.
1. Pi-Sunyer X, Astrup A, Fujioka K, Greenway F, Halpern A, Krempf M et coll. A randomized, controlled trial of 3.0 mg of liraglutide in weight management. N Engl J Med 2015;373:11–22.
2. Shields M, Tremblay MS, Laviolette M, Craig CL, Janssen I, Connor Gorber S. Condition physique des adultes au Canada: résultats de l’Enquête canadienne sur les mesures de la santé, 2007–2009. [en ligne] http://www.statcan.gc.ca/pub/82-003-x/2010001/article/11064-fra.htm (site visité le 19 mars 2016).
3. National Institutes of Health. Clinical guidelines on the identification, evaluation, and treatment of overweight and obesity in adults-The evidence report. Obes Res 1998;6(suppl. 2):51–209.
4. Jensen MD, Ryan DH, Apovian CM, Ard JD, Comuzzie AG, Donato KA et coll. Guideline for the management of overweight and obesity in adults: a report of the American College of Cardiology/American Heart Association task force on practice guidelines and the obesity society. Circulation 2014;129:102–38.
5. Lau DC, Douketis JD, Morrison KM, Hramiak IM, Sharma AM, Ur E. Lignes directrices canadiennes de 2006 sur la prise en charge et la prévention de l’obésité chez les adultes et les enfants. CMAJ 2007;176:1103.

6. Apovian CM, Aronne LJ, Bessesen DH, McDonnell ME, Murad MH, Pagotto U et coll. Endocrine Society. Pharmacological management of obesity: an endocrine society clinical practice guideline. J Clin Endocrinol Metab 2015;100: 342–62.
7. Novo Nordisk. Monographie du liraglutide (Victoza). Toronto, Ontario. Juillet 2014.
8. Flint A, Raben A, Astrup A, Holst JJ. Glucagon-like peptide 1 promotes satiety and suppresses energy intake in humans. J Clin Invest 1998;101:515–20.

9. Astrup A, Rössner S, Van Gaal L, Rissanen A, Niskanen L, Al Hakim M et coll. Effects of liraglutide in the treatment of obesity: a randomised, double-blind, placebo-controlled study. Lancet 2009;374:1606–16.
10. Astrup A, Carraro R, Finer N, Harper A, Kunesova M, Lean ME et coll. Safety, tolerability and sustained weight loss over 2 years with the once-daily human GLP-1 analog, liraglutide. Int J Obes 2012;36:843–54.
11. Diabetes prevention program research group, Knowler WC, Fowler SE, Hamman RF, Christophi CA, Hoffman HJ et coll. 10-year follow-up of diabetes incidence and weight loss in the diabetes prevention program outcomes study. Lancet 2009;374:1677–86.

12. Douketis JD, Macie C, Thabane L, Williamson DF. Systematic review of long-term weight loss studies in obese adults: clinical significance and applicability to clinical practice. Int J Obes (Lond) 2005;29:1153–67.
13. Food and Drug Administration. Guidance for industry developing products for weight management. [en ligne] http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm071612.pdf (site visité le 19 mars 2016).
14. Lewis K. Liraglutide produces clinically significant weight loss in nondiabetic patients, but at what cost? JCOM 2015;22:394–6.
15. McKesson Canada. Détails du produit : Saxenda. [en ligne] https://clients.mckesson.ca/catalog?action=prodDetail&product=81963&randomToken=1460605864412 (site visité le 19 mars 2016).
16. McKesson Canada. Détails du produit : Xenical. [en ligne] https://clients.mckesson.ca/catalog?action=prodDetail&product=342022&randomToken=1460605979894 (site visité le 19 mars 2016).
17. Khera R, Murad MH, Chandar AK, Dulai PS, Wang Z, Prokop LJ et coll. Association of pharmacological treatments for obesity with weight loss and adverse events: a systematic review and meta-analysis. JAMA 2016;315:2424–34.

18. Nuffer WA, Trujillo MJ. Liraglutide: a new option for the treatment of obesity. Pharmacotherapy 2015;35:926–34.
PHARMACTUEL, Vol. 50, No. 4, 2017