|
|
||
|
Figure 1 Répartition des patients dans l’étude RESONATE-2a |
||
Anne Beaudry1,2,3, Pharm.D., M.Sc., Romy Laperrière1,2,4, Pharm.D., M.Sc., Marie-Philippe Pellerin1,2,5, Pharm.D., M.Sc., Louis-Philippe Grenier6,7, B.Pharm., M.Sc.
1Candidate au programme de maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction, Centre hospitalier universitaire de Québec-Université Laval, pavillon Hôtel-Dieu de Québec, Québec (Québec) Canada;
3Pharmacienne, Centre intégré de santé et de services sociaux du Bas-Saint-Laurent, site Hôpital régional de Rimouski, Rimouski (Québec) Canada;
4Pharmacienne, Centre intégré de santé et de services sociaux de la Montérégie-Est, site Hôpital Pierre-Boucher, Longueuil (Québec) Canada;
5Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, site Hôpital de La Malbaie, La Malbaie (Québec) Canada;
6Pharmacien, Centre hospitalier universitaire de Québec-Université Laval, pavillon Hôtel-Dieu de Québec, Québec (Québec) Canada;
7Professeur de clinique, Faculté de pharmacie, Université Laval, Québec (Québec) Canada
Reçu le 21 septembre 2016; Accepté après révision par les pairs le 11 novembre 2016
Titre de l’article : Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med 2015;373:2425-371.
Auteurs : Burger JA, Tedeschi A, Barr PM, Robak T, Owen C, Ghia P et coll. pour le groupe d’étude RESONATE-2.
Commanditaires : Cette étude a été financée par Pharmacyclics, LLC, qui a participé à la conception de l’étude, à la compilation des données, à la rédaction de l’article et au financement du soutien éditorial.
Cadre de l’étude : La leucémie lymphoïde chronique (LLC) est la leucémie la plus fréquemment diagnostiquée chez les adultes occidentaux2. Elle atteint généralement les gens âgés, dont l’âge médian au diagnostic est de 70 ans2. Le traitement de première intention recommandé par le National Cancer Care Network est une association de fludarabine, de cyclophosphamide et de rituximab (FCR) pour les patients jeunes et sans comorbidités3,4. Cette combinaison étant toutefois associée à des toxicités hématologiques et infectieuses importantes, une monothérapie à base de chlorambucil a longtemps été préférée pour le traitement des patients âgés5. Récemment, l’association du chlorambucil avec certains anticorps anti-CD20 (rituximab, obinutuzumab, ofatumumab) a démontré des avantages importants sur la survie sans progression de la maladie pour les patients âgés et porteurs de comorbidités significatives qui ne sont pas admissibles au traitement FCR6,7. Ces combinaisons sont donc désormais recommandées en première intention de traitement pour la population âgée, alors que l’utilisation du chlorambucil en monothérapie ne figure plus parmi les standards de traitement3.
L’ibrutinib est un inhibiteur du récepteur de l’antigène des lymphocytes B (BCR, B cell receptor). Il inhibe l’activité de la tyrosine kinase de Bruton dans les voies de signalisation du BCR, ce qui limite l’activation, la prolifération, la survie et l’écotaxie des lymphocytes B malins8–10. L’étude RESONATE a comparé l’ibrutinib à l’ofatumumab seul pour la LLC réfractaire ou récidivante et a démontré une réduction de 78 % du risque de décès ou de progression après un suivi médian de 9,4 mois11. La médiane de survie sans progression était de 8,1 mois dans le groupe ofatumumab et n’a pas été atteinte dans le groupe ibrutinib. Dans la sous-population des porteurs d’une délétion 17p, un facteur de mauvais pronostic, la médiane de survie sans progression était de 5,8 mois dans le groupe ofatumumab et n’a pas été atteinte dans le groupe ibrutinib. Cette étude a ainsi permis de positionner l’ibrutinib comme traitement de première intention pour les porteurs d’une délétion 17p ainsi que comme traitement de choix de la LLC réfractaire ou récidivante.
Protocole de recherche : RESONATE-2 est une étude clinique multicentrique de supériorité de phase III à répartition aléatoire et ouverte comparant l’ibrutinib au chlorambucil en première intention de traitement pour des patients âgés atteints d’une LLC ou d’un lymphome à petits lymphocytes (LPL).
Patients : À partir de 2013, 269 patients ont été recrutés dans 16 pays, majoritairement aux États-Unis. Les patients inclus devaient être âgés d’au moins 65 ans, être atteints d’une LLC ou d’un LPL nécessitant une thérapie selon les critères de l’International Workshop on Chronic Lymphocytic Lymphoma (iwCLL) et ne pas avoir reçu de traitement antérieur12. Les patients âgés entre 65 et 70 ans ne devaient pas être admissibles au traitement FCR. Les autres critères d’inclusion étaient les suivants : un statut de performance selon l’Eastern Cooperative Oncology Group (ECOG) entre 0 et 2, un pronostic vital supérieur à quatre mois, un décompte plaquettaire ≥ 50 × 109/L, un décompte absolu de neutrophiles ≥ 1,0 × 109/L, une fonction hépatique et rénale adéquate (aspartate aminotransférase (AST) et alanine aminotransférase (ALT) < 2,5 fois la limite supérieure normale; bilirubine totale < 1,5 fois la limite supérieure normale; clairance de la créatinine > 30 ml/min (selon Cockroft-Gault) et l’atteinte d’au moins un ganglion lymphatique. Les principaux critères d’exclusion étaient la présence d’une délétion 17p, une chirurgie majeure récente (moins d’un mois) et la prise de warfarine ou d’un inhibiteur puissant du CYP3A4/5.
Interventions : Les sujets ont été répartis aléatoirement selon un ratio 1:1 entre l’ibrutinib et le chlorambucil. L’ibrutinib était administré à une dose de 420 mg une fois par jour jusqu’à l’apparition de toxicités inacceptables ou jusqu’à progression de la maladie. Le chlorambucil était administré à une dose de 0,5 mg/kg aux jours 1 et 15 d’un cycle de 28 jours, avec titration jusqu’à 0,8 mg/kg si la tolérance était satisfaisante. Le traitement était poursuivi pendant un maximum de 12 cycles ou jusqu’à l’apparition de toxicités inacceptables, la progression de la maladie ou la détermination d’une absence de réponse par l’investigateur. En présence d’une maladie progressive, les patients étaient inclus dans une étude de suivi distincte de RESONATE-2.
L’étude devait se poursuivre durant un minimum de 12 mois. L’arrêt était prévu après la survenue de 81 décès ou cas de maladie progressive, ou lorsque le délai écoulé depuis la répartition aléatoire du dernier patient excéderait 15 mois.
Points évalués : L’objectif primaire de l’étude était la survie sans progression définie selon les critères de l’iwCLL modifiés pour la lymphocytose et était évalué par un comité indépendant13,14. Les objectifs secondaires étaient la survie globale, le taux de réponse globale, l’amélioration soutenue des variables hématologiques et la sécurité.
L’amélioration soutenue des variables hématologiques des patients cytopéniques était définie par l’augmentation du décompte plaquettaire à plus de 100 × 109/L, de l’hémoglobine à plus de 110 g/L ou du décompte absolu de neutrophiles à plus de 1,5 × 109/L. Pour les patients non cytopéniques, ce paramètre était défini comme l’augmentation d’au moins 50 % du décompte plaquettaire ou du décompte absolu de neutrophiles ou l’augmentation de l’hémoglobine d’au moins 20 g/L. Cette amélioration devait se maintenir pendant au moins 56 jours sans transfusion ou facteur de croissance.
La sécurité du traitement était évaluée par la survenue d’effets indésirables et le contrôle des valeurs de laboratoire, des signes vitaux et de l’électrocardiogramme. Les effets indésirables non hématologiques étaient répertoriés selon les Common Terminology Criteria for Adverse Events15. Les effets indésirables hématologiques étaient répertoriés selon les critères de l’iwCLL12.
Le suivi était effectué toutes les deux semaines durant les cycles 1 et 2, toutes les quatre semaines au cours des cycles 3 à 12 et toutes les huit semaines par la suite. La réponse au traitement était évaluée tous les quatre cycles en l’absence de progression de la maladie.
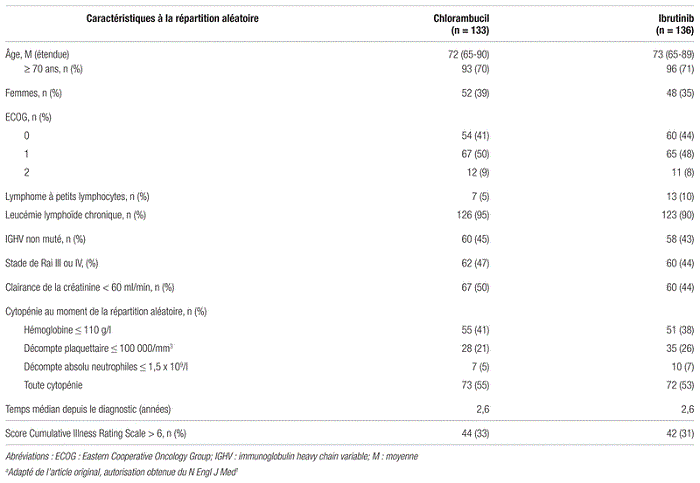
Résultats : Au total, 269 patients ont été répartis aléatoirement. De ce nombre, 136 patients ont été assignés à l’ibrutinib et 133 au chlorambucil (figure 1). Les caractéristiques de base étaient similaires dans les deux groupes, avec un âge médian de 73 ans (tableau I). Le suivi médian était de 18,4 mois. Au moment de l’analyse, 118 patients du groupe ibrutinib recevaient toujours le traitement, et 53 patients du groupe chlorambucil avaient terminé le maximum de 12 cycles. Trois patients sont décédés dans le groupe ibrutinib contre 17 dans le groupe chlorambucil.
Figure 1 Répartition des patients dans l’étude RESONATE-2a
aAdapté de l’article original, autorisation obtenue du N Engl J Med1
Tableau I Principales caractéristiques de base des patients inclus dans l’étude RESONATE-2a
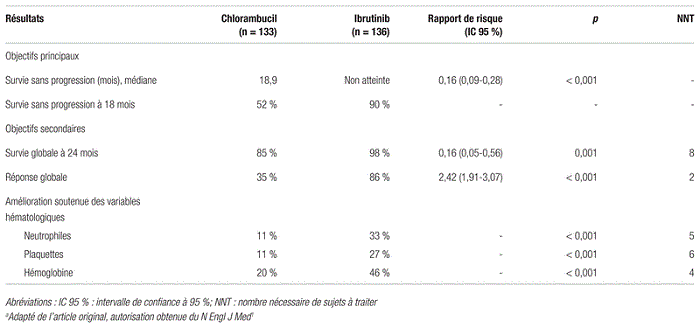
Efficacité : La médiane de survie sans progression, évaluée par le comité indépendant, n’a pas été atteinte dans le groupe ibrutinib et était de 18,9 mois dans le groupe chlorambucil, ce qui représente une réduction de 84 % du risque relatif de progression ou de décès (rapport des risques instantanés [RR] : 0,16; intervalle de confiance à 95 % [IC 95 %] 0,09–0,28, p < 0,001). Les données de l’évaluation des investigateurs sont cohérentes avec ces résultats. Des analyses de sous-groupes selon l’âge, le stade, le statut de performance et certains facteurs pronostiques présentent des résultats homogènes. La médiane de survie globale n’a été atteinte dans aucun groupe. Le taux de réponse globale a été de 86 % dans le groupe ibrutinib et de 35 % dans le groupe chlorambucil (p < 0,001). Les réponses étaient principalement partielles dans les deux groupes. Des gains concernant les variables hématologiques ont été observés parmi les patients du groupe ibrutinib. Les principaux résultats sont présentés au tableau II.
Tableau II Principaux résultats de l’étude RESONATE-2a portant sur l’efficacité
Sécurité : La période d’exposition médiane à l’ibrutinib était de 17,4 mois et de 7,1 mois au chlorambucil. Les arrêts de traitement liés aux effets indésirables sont survenus chez 9 % des patients sous ibrutinib et 23 % des patients sous chlorambucil. Les effets indésirables les plus fréquents sont présentés au tableau III.
Tableau III Principaux résultats de l’étude RESONATE-2a portant sur la sécurité
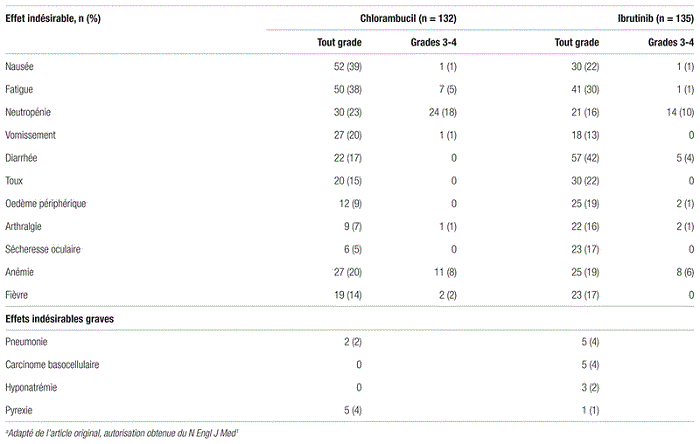
De l’hypertension artérielle de grade 3 a été observée chez 4 % des patients du groupe ibrutinib. Un traitement antihypertenseur a permis une stabilisation adéquate chez tous les patients qui en étaient atteints sans réduction ou arrêt du traitement. Huit patients (6 %) ont présenté de la fibrillation auriculaire de novo dans le groupe ibrutinib par rapport à un patient (< 1 %) dans le groupe chlorambucil. Cet effet indésirable a nécessité l’arrêt de l’ibrutinib pour deux patients. Sept des huit patients atteints présentaient des antécédents de maladies cardiovasculaires. Six patients (4 %) sous ibrutinib ont présenté une hémorragie majeure (deux hémorragies intracrâniennes, deux hémorragies intraoculaires, deux hémorragies liées à une procédure chirurgicale) par rapport à deux patients (2 %) sous chlorambucil. Cet effet indésirable a mené à l’arrêt de l’ibrutinib pour trois patients.
L’étude RESONATE-2 a démontré la supériorité de l’ibrutinib par rapport au chlorambucil pour le traitement de la LLC de patients âgés d’au moins 65 ans avec une diminution du risque de décès ou de progression de la maladie de 84 % aprés un suivi médian de 18,4 mois. Des avantages ont également été observés sur la survie globale, le taux de réponse globale et les variables hématologiques.
De nombreuses avancées ont été réalisées au cours des dernières années dans le traitement de la LLC pour les patients âgés ou atteints de comorbidités. L’étude CLL11 a comparé les combinaisons d’obinutuzumab-chlorambucil et de rituximab-chlorambucil au chlorambucil seul en première intention de traitement chez 781 patients qui n’étaient pas admissibles au traitement FCR6. Les résultats ont démontré une prolongation de la survie sans progression des patients ayant reçu un traitement d’association par rapport à la monothérapie (respectivement 26,7 mois, 16,3 mois et 11,1 mois,). La combinaison d’obinutuzumab-chlorambucil a quant à elle permis une prolongation de la survie globale par rapport à la monothérapie. Dans l’étude COMPLEMENT 1, la combinaison d’ofatumumab-chlorambucil s’est avérée supérieure au chlorambucil seul en première intention de traitement pour des patients qui n’étaient pas admissibles au traitement FCR (respectivement 22,4 mois et 13,1 mois,)7. La bendamustine a aussi démontré une prolongation de la survie sans progression par rapport au chlorambucil seul chez des patients de 75 ans et moins en l’absence de comorbidités significatives (respectivement 21,6 mois et 8,3 mois)16,17. Par la suite, l’étude MABLE a comparé les associations de rituximab-bendamustine et de rituximab-chlorambucil pour une population d’adultes non admissibles au traitement FCR18. Les résultats préliminaires suggèrent la supériorité du traitement à base de bendamustine au plan de la survie sans progression (respectivement 40 mois et 30 mois), bien qu’aucune différence n’ait été observée sur la survie globale. L’incidence des effets indésirables de grade 3 était supérieure parmi les patients ayant reçu l’association rituximab-bendamustine. Finalement, l’étude CLL10 a comparé l’association de rituximab-bendamustine au traitement FCR chez des patients ayant peu de comorbidités19. Les résultats n’ont pas permis de conclure à la non infériorité du traitement à base de bendamustine, mais ont démontré une diminution des toxicités avec ce régime. En somme, l’ensemble de ces études démontrent que le chlorambucil seul ne représente plus un choix optimal dans l’arsenal thérapeutique pour le traitement de première intention de la LLC.
Comparativement à ces résultats, on remarque que les données de l’étude RESONATE-2 montrent une durée de survie sans progression prolongée pour les patients du groupe chlorambucil par rapport aux études antérieures. Les auteurs attribuent cette différence à l’exclusion des patients atteints d’une délétion 17p. En effet, dans les études précédentes, les populations étudiées comptaient 5 à 10 % de porteurs de cette mutation à mauvais pronostic.
Concernant les toxicités de l’ibrutinib, les effets indésirables les plus fréquents dans le cadre de l’étude RESONATE-2 ont été la diarrhée, la fatigue et la toux; or les patients du groupe ibrutinib étaient exposés à une durée de traitement prolongée par rapport au groupe chlorambucil (respectivement 17,4 mois et 7,1 mois). Par rapport au chlorambucil, l’ibrutinib a engendré moins de nausées et de toxicités hématologiques. Ces dernières peuvent être limitantes, surtout lors de l’association du chlorambucil avec un anticorps anti-CD20. Cependant, les préoccupations concernant le risque de saignement et le développement de fibrillation auriculaire de novo d’abord soulevées dans l’étude RESONATE ont été confirmées. Dans cette précédente étude, 1 % des patients sous ibrutinib ont présenté une hémorragie majeure par rapport à 4 % dans l’étude RESONATE-211. L’utilisation de la warfarine était un critère d’exclusion dans les deux études, mais l’utilisation d’autres anticoagulants ou antiplaquettaires n’était pas précisée. L’âge médian de la population étudiée (67 ans vs 73 ans) a pu contribuer à la différence observée. Concernant la fibrillation auriculaire de novo, elle a été rapportée chez 5 % des patients dans l’étude RESONATE par rapport à 6 % dans la présente étude.
L’étude RESONATE-2 présente plusieurs forces. D’abord, la taille de l’échantillon obtenue représente une population intéressante. La population étudiée constituée de patients âgés atteints de comorbidités est représentative de la population rencontrée en clinique. La répartition aléatoire et l’évaluation de l’objectif primaire par un comité indépendant procurent à l’étude une bonne validité interne. Finalement, l’objectif principal de survie sans progression s’avère une issue clinique pertinente en oncologie pour évaluer l’efficacité d’un traitement.
L’étude présente également quelques faiblesses. Le comparateur utilisé dans l’étude, le chlorambucil seul, ne figure plus parmi les standards de traitement. Ainsi, bien que l’ibrutinib ait démontré des avantages sur le plan de la survie, les résultats permettent difficilement de le positionner dans l’arsenal thérapeutique. Une comparaison avec une association de chlorambucil et d’un anticorps anti-CD20 aurait été plus révélatrice. Par ailleurs, on note que 37 patients du groupe chlorambucil ont interrompu leur traitement à la suite d’une décision de l’investigateur ne figurant pas parmi les arrêts prévus au protocole. Ce nombre représente 47 % des arrêts de traitement du groupe chlorambucil et 28 % de tous les patients de ce groupe. Finalement, les résultats portant sur la survie au-delà de 18 mois sont à interpréter avec prudence vu le faible nombre de patients ayant fait l’objet d’un suivi prolongé.
En somme, l’étude RESONATE-2 a démontré la supériorité de l’ibrutinib par rapport au chlorambucil en première intention de traitement pour des patients âgés atteints d’une LLC. Les avantages importants observés sur le plan de la survie, de la réponse globale et des variables hématologiques montrent que cet agent constitue une option de traitement appropriée, bien qu’un risque non négligeable d’hémorragie et de fibrillation auriculaire soit présent. Des données comparatives avec une association de chlorambucil et d’un anticorps anti-CD20 sont toutefois souhaitables afin de positionner l’ibrutinib dans la pharmacothérapie actuelle.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Information sur les médicaments basée sur la preuve de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable Julie Méthot. Une autorisation écrite a été obtenue de cette personne.
1. Burger JA, Tedeschi A, Barr PM, Robak T, Owen C, Ghia P et coll. Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med 2015;373:2425–37.

2. Fabbri G, Dalla-Favera R. The molecular pathogenesis of chronic lymphocytic leukaemia. Nat Rev Cancer 2016;16:145–62.
3. National Comprehensive Cancer Network. NCCN Clinical practice guidelines in oncology. Non-Hodgkin’s lymphomas, version 2.2016. [en ligne] https://www.nccn.org/professionals/physician_gls/pdf/nhl.pdf (site visité le 10 avril 2016).
4. Fischer K, Bahlo J, Fink AM, Goede V, Herling CD, Cramer P et coll. Long-term remissions after FCR chemoimmunotherapy in previously untreated patients with CLL: updated results of the CLL8 trial. Blood 2016;127:208–15.
5. Eichhorst BF, Busch R, Stilgenbauer S, Stauch M, Bergmann MA, Ritgen M et coll. First-line therapy with fludarabine compared with chlorambucil does not result in a major benefit for elderly patients with advanced chronic lymphocytic leukemia. Blood 2009;114:3382–91.
6. Goede V, Fischer K, Busch R, Engelke A, Eichhorst B, Wendtner CM et coll. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014;370:1101–10.
7. Hillmen P, Robak T, Janssens A, Babu KG, Kloczko J, Grosicki S et coll. Chlorambucil plus ofatumumab versus chlorambucil alone in previously untreated patients with chronic lymphocytic leukaemia (COMPLEMENT 1): a randomised, multicentre, open-label phase 3 trial. Lancet 2015;385:1873–83.
8. Wiestner A. The role of B-cell receptor inhibitors in the treatment of patients with chronic lymphocytic leukemia. Haematologica 2015; 100:1495–507.

9. Tucker DL, Rule SA. A critical appraisal of ibrutinib in the treatment of mantle cell lymphoma and chronic lymphocytic leukemia. Ther Clin Risk Manag 2015;11:979–90.

10. Lee CS, Rattu MA, Kim SS. A review of a novel, Bruton’s tyrosine kinase inhibitor, ibrutinib. J Oncol Pharm Pract 2016;22:92–104.
11. Byrd JC, Brown JR, O’Brien S, Barrientos JC, Kay NE, Reddy NM et coll. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014;371:213–23.

12. Hallek M, Cheson BD, Catovsky D, Caligaris-Cappio F, Dighiero G, Döhner H et coll. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood 2008;111:5446–56.

13. Hallek M, Cheson BD, Catovsky D, Caligaris-Cappio F, Dighiero G, Döhner H et coll. Clarification of iwCLL criteria for a partial response to therapy (E-letters). Blood 2013;111:5446–56.
14. Cheson BD, Byrd JC, Rai KR, Kai NE, O’Brien SM, Flinn IW et coll. Novel targeted agents and the need to refine clinical end points in chronic lymphocytic leukemia. J Clin Oncol 2012;30:2820–2.

15. National Cancer Institute. Common terminology criteria for adverse events (CTCAE) version 4.03 (2010). [en ligne] http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf (site visité le 10 avril 2016).
16. Knauf WU, Lissichkov T, Aldaoud A, Liberati A, Loscertales J, Herbrecht R et coll. Phase III randomized study of bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukemia. J Clin Oncol 2009;27:4378–84.
17. Knauf WU, Lissitchkov T, Aldaoud A, Liberati A, Loscertales J, Herbrecht R et coll. Bendamustine compared with chlorambucil in previously untreated patients with chronic lymphocytic leukaemia: updated results of a randomized phase III trial. Br J Haematol 2012;159:67–77.
18. Michallet AS. Rituximab in combination with bendamustine or chlorambucil for the treatment of chronic lymphocytic leukemia: primary results from the randomised phase IIIb MABLE study. Présentée au XVI International Workshop on Chronic Lymphocytic Leukemia. Syndney, Australie, 6 au 9 septembre 2015.
19. Eichhorst B, Fink AM, Bahlo J, Busch R, Kovacs G, Maurer C et coll. First-line chemoimmunotherapy with bendamustine and rituximab versus fludarabine, cyclophosphamide, and rituximab in patients with advanced chronic lymphocytic leukemia (CLL10): an international, open-label, randomised, phase 3, non-inferiority trial. Lancet 2016;17:928–42.
PHARMACTUEL, Vol. 50, No. 2, 2017