|
|
||
|
Figure I Répartition des patients dans l’étudea |
||
Laurence Allard1,2,3, Pharm.D., M.Sc., Magali Laprise-Lachance1,4,5, B.Pharm., M.Sc., Mathieu Roy1,4,6, Pharm.D., M.Sc., Laurie T Sylvain1,4,7, Pharm.D., M.Sc.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction de l’article, Centre intégré universitaire de santé et services sociaux du Saguenay-Lac-Saint-Jean, site Hôpital de Chicoutimi, Chicoutimi (Québec) Canada;
3Pharmacienne, Centre intégré de santé et des services sociaux de la Gaspésie, site Hôpital de Maria, Maria (Québec) Canada;
4Résident en pharmacie au moment de la rédaction de l’article, Centre intégré de santé et des services sociaux de Chaudière-Appalaches, site Hôtel-Dieu de Lévis, Lévis (Québec) Canada;
5Pharmacienne, Centre intégré de santé et des services sociaux de Chaudière-Appalaches, site Hôtel-Dieu de Lévis, Lévis (Québec) Canada;
6Pharmacien, Uniprix Guy Desjardins pharmaciens inc., Lévis (Québec) Canada;
7Pharmacienne, Centre intégré universitaire de santé et des services sociaux de la Capitale-Nationale, site Hôpital régional de Portneuf, Saint-Raymond-de-Portneuf (Québec) Canada
Reçu le 26 septembre 2016; Accepté après révision par les pairs le 18 janvier 2017
Titre de l’article : Sulodexide for the prevention of recurrent venous thromboembolism: the sulodexide in secondary prevention of recurrent deep vein thrombosis (SURVET) study: a multicenter, randomized, double-blind, placebo-controlled trial. Circulation 2015;132:1891-71.
Auteurs : Andreozzi GM, Bignamini AA, Davi G, Palareti G, Matuska J, Holy M et coll. pour les investigateurs SURVET.
Commanditaires : Cette étude a été financée par Alfa Wassermann (Bologne, Italie), qui a fourni les capsules de sulodexide commercialement disponibles en Europe et qui a fabriqué un placebo d’apparence similaire. Alfa Wassermann n’a pas participé à la conception du protocole de l’étude ni à la collecte et à l’analyse de données ni à la rédaction de l’article.
Cadre de l’étude : La survenue d’une thromboembolie veineuse (TEV) peut être attribuable à plusieurs facteurs de risque bien connus qui peuvent être transitoires, héréditaires ou acquis2. Une immobilisation prolongée ou une hospitalisation, le fait d’avoir subi un trauma ou une chirurgie, être atteint d’une néoplasie, d’un trouble neurologique avec paralysie ou d’une thrombophilie sont quelques exemples de facteurs de risque de TEV2. De plus, les patients recevant certains médicaments, telle la chimiothérapie, ceux qui souffrent d’une maladie hépatique ou qui ont des veines varicosées, ceux qui portent un pacemaker ou un cathéter veineux central risquent également davantage de développer une TEV2. Il arrive parfois qu’un tel événement survienne en l’absence d’une cause identifiable; ces patients présentent un risque plus élevé de récurrence3.
Après tout épisode de TEV idiopathique non chirurgicale, que ce soit le premier ou une récurrence, on recommande d’anticoaguler le patient pendant trois mois au minimum et de poursuivre ou non le traitement selon le risque de saignement du patient3. Une anticoagulation à long terme est efficace pour réduire le risque de récurrence de TEV, mais elle expose le patient à un risque de saignement non négligeable. De plus, un antagoniste de la vitamine K (AVK), comme la warfarine, nécessite un suivi étroit du rapport international normalisé afin d’assurer l’efficacité et l’innocuité du médicament.
Le sulodexide est un glycosaminoglycane composé à 80 % d’héparine de faible poids moléculaire et à 20 % de sulfate de dermatane4. Il aurait des propriétés antithrombotiques et fibrinolytiques, sans comporter de risque de saignement significatif4. Ce médicament n’a toujours pas reçu l’approbation de Santé Canada ni de la Food and Drug Administration (FDA), mais pourrait être utilisé entre autres pour traiter l’albuminurie, pour prévenir un second infarctus et pour le traitement de la maladie vasculaire périphérique4. À ce jour, il est commercialisé en Europe, en Asie et en Amérique du Sud5. Le sulodexide serait bien toléré selon les données actuellement disponibles4. Des réactions cutanées, des effets indésirables digestifs et de rares hématomes ont été rapportés4.
Le fait de remplacer la warfarine par le sulodexide permettrait possiblement de réduire les consultations médicales pour saignements et de diminuer les coûts en soins de santé liés à l’ajustement des doses de warfarine et à la surveillance de la thérapie.
D’autres études parues, dont INSPIRE, AMPLIFY-EXT et RE-SONATE/RE-MEDY, ont exploré l’efficacité de l’aspirine et des anticoagulants oraux directs (AOD) en prévention secondaire de la TEV après un traitement anticoagulant initial comparativement à la warfarine ou au placebo6–8. Le sulodexide pourrait donc s’inscrire comme une autre option de traitement pour cette indication.
Protocole de recherche : Il s’agit d’un essai clinique multicentrique mené dans plusieurs pays et visant à évaluer l’efficacité et l’innocuité du sulodexide pour la prévention de la récurrence de la TEV à l’arrêt d’un AVK pour des patients ayant eu un premier épisode de TEV idiopathique. C’est une étude à répartition aléatoire, conduite à double insu, et le traitement a été comparé à un placebo par des groupes en parallèle.
Patients : Pour participer à cette étude, les patients devaient respecter les critères d’inclusion suivants : être âgés de 18 ans et plus, avoir eu une première thrombose veineuse profonde (TVP) proximale idiopathique ou une première embolie pulmonaire (EP) idiopathique, avoir été traité par un AVK pendant trois à 12 mois et avoir signé un formulaire de consentement. En présence d’au moins un des critères d’exclusion suivants, les patients étaient exclus de l’étude : hypertension pulmonaire persistante après l’embolie pulmonaire, néoplasie solide, maladie sanguine, syndrome des anticorps antiphospholipides, déficit congénital en antithrombine, insuffisance cardiaque respiratoire de classe NYHA III ou IV, hypersensibilité aux glycosaminoglycanes, femmes enceintes et allaitantes, femmes refusant de se soumettre à un test de grossesse et femmes utilisant des contraceptifs oraux ou refusant d’utiliser une contraception autre que les contraceptifs oraux.
Les patients ont été recrutés dans 43 sites situés dans sept pays d’Europe entre septembre 2010 et mai 2012. Les annexes supplémentaires n’apportent pas davantage d’information par rapport aux sites participants. Le suivi des patients se terminait en mai 2014.
Interventions : Une à 12 semaines après l’arrêt de l’AVK, les patients ont été assignés à deux groupes pendant deux ans. La répartition aléatoire a été effectuée par un ordinateur dans un ratio 1:1 par bloc de quatre, et les patients ont reçu soit le sulodexide à raison de 500 unités (deux capsules orales de 250 unités) deux fois par jour ou le placebo. Tous les patients ont été encouragés à porter des bas supports élastiques de classe II pendant les deux ans qui ont suivi le diagnostic d’une TVP proximale. Les investigateurs ont réitéré cette recommandation à chaque visite de suivi.
Les suivis avaient lieu tous les trois mois à partir de la répartition aléatoire et jusqu’à la fin des deux ans de traitement. Chaque visite comportait un examen. Entre ces rendez-vous, les patients étaient contactés par téléphone chaque mois. Ils étaient avisés de rapporter tout symptôme pouvant être lié à un manque d’efficacité (récurrence de TEV) ou à un problème d’innocuité (saignements). Dans tous les cas, des visites de suivi supplémentaires pouvaient avoir lieu si les patients signalaient des symptômes ou si ces derniers étaient révélés lors des appels téléphoniques. À cela s’ajoutait la réalisation d’une compilation des effets indésirables au traitement. Au terme de l’étude, les investigateurs ont pris contact avec les patients qui avaient quitté l’étude sans retirer formellement leur consentement en vue d’évaluer l’apparition de signes ou de symptômes qui pouvaient évoquer une TEV.
Points évalués : Sur le plan de l’efficacité, l’objectif primaire était la récurrence de TEV symptomatique confirmée de façon objective (y compris les TVP confirmées par ultrasonographie de compression et les EP confirmées par scintigraphie pulmonaire ou tomographie, qu’elles soient fatales ou non fatales). Les objectifs secondaires prenaient en compte la survenue des évènements suivants : thrombose veineuse distale, thrombose veineuse superficielle, infarctus du myocarde fatal ou non fatal, accident vasculaire cérébral, ischémie aiguë des membres inférieurs.
Sur le plan de l’innocuité, l’objectif primaire était la présence d’un saignement majeur ou cliniquement significatif, mais considéré comme non majeur. Un saignement majeur est un saignement fatal ou ayant eu lieu dans une région critique ou encore ayant requis une transfusion de deux unités de sang ou de concentrés de globules rouges. Un saignement cliniquement significatif se définit par tout saignement qui ne remplit pas les critères du saignement majeur, mais qui a requis une intervention médicale, une consultation avec un médecin, une interruption du médicament à l’étude ou un inconvénient/une perturbation des activités de la vie quotidienne.
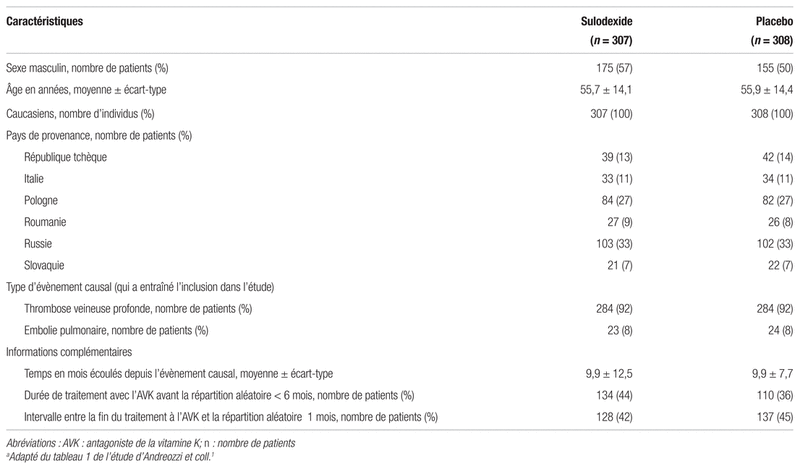
Résultats : La figure I de l’étude SURVET présente la répartition des patients de l’étude. Le tableau I décrit les principales caractéristiques des 615 patients enrôlés dans cette étude. Peu d’information est connue en ce qui a trait aux facteurs de risque de saignement ou de récurrence de thrombose.
Figure I Répartition des patients dans l’étudea
aAdaptée de la figure 1 de l’étude d’Andreozzi et coll.1
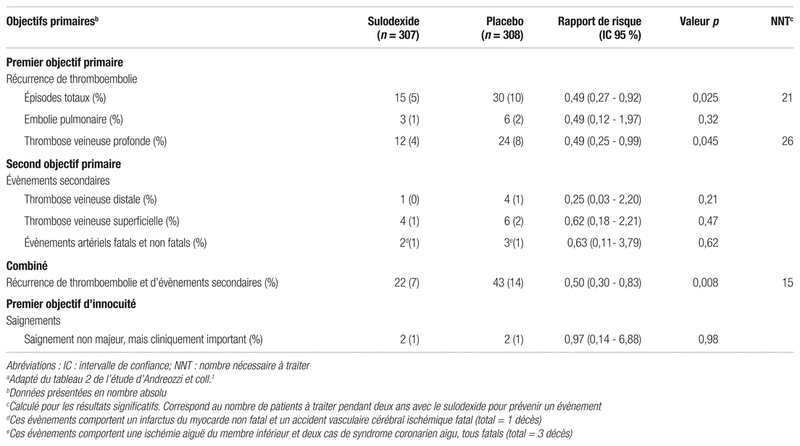
Tableau I Caractéristiques de base des patients inclus dans l’étude comparant le sulodexide au placeboa
Les caractéristiques des patients étaient similaires dans les deux groupes, à l’exception du nombre de patients qui avaient reçu un AVK durant moins de six mois. Cette différence était statistiquement significative (p = 0,044) et mène à l’observation que les patients du groupe sulodexide ont été traités moins longtemps avec un AVK que ceux du groupe placebo. Contrairement à ce qui était prévu au protocole, les patients ont été recrutés dans six pays plutôt que sept. L’étude ne précise pas le nom du pays éliminé. Les résultats obtenus dans la population en intention de traiter sont présentés au tableau II.
Tableau II Principaux résultats d’efficacité et d’innocuité de l’étude comparant le sulodexide au placeboa
Les résultats de l’étude concernant les objectifs primaires démontrent l’avantage du sulodexide comparativement au placebo pour réduire le risque de récurrence de TEV. En effet, le taux de récurrence de TEV (tous types confondus) a été de 5 % dans le groupe sulodexide, comparativement à 10 % dans le groupe placebo (rapport de risque [RR] : 0,49; intervalle de confiance à 95 % [IC 95 %] 0,27–0,92, p = 0,025; nombre nécessaire de patients à traiter pendant deux ans [NNT]:21). Ce même avantage concerne la réduction des TVP, soit 4 % de risque de récurrence parmi les patients traités avec le sulodexide versus 8 % avec le placebo (RR:0,49;IC 95 %:0,25–0,99, p = 0,045; NNT:26). Si l’on combine les deux objectifs primaires, soit la récurrence de TEV et la survenue d’évènements secondaires, encore une fois des résultats en faveur du sulodexide sont statistiquement significatifs. Le risque d’apparition de l’un de ces évènements s’élève à 7 % avec le médicament étudié comparativement à 14 % avec le placebo (RR:0,50;IC 95 %:0,30–0,83, p = 0,008; NNT:15). Les analyses ont démontré que le sexe masculin et l’âge étaient des facteurs de risque indépendants de la récurrence de TEV. Pour ce qui est des objectifs secondaires d’efficacité, ils ont été peu observés et n’ont pas été analysés ni présentés en détail dans l’article.
Sur le plan de l’innocuité du traitement, aucun patient n’a présenté de saignement majeur. Des saignements non majeurs (p. ex. saignement de nez, rectorragie) ont toutefois été relevés chez deux patients dans chaque groupe de traitement. De plus, bien que les effets secondaires n’aient pas été inclus dans les objectifs, ils ont été recueillis dans les deux groupes. Le nombre d’effets secondaires n’était pas significativement différent entre les deux groupes. Les douleurs aux extrémités, les récurrences de thrombose et les arthralgies étaient les plus fréquentes.
L’étude SURVET a démontré qu’un traitement au sulodexide en prévention secondaire de la TEV idiopathique serait plus efficace que le placebo, sans augmenter le risque de saignement. L’étude réalisée possède plusieurs forces. La méthodologie est assurément l’une d’entre elles. En effet, l’étude a été réalisée en double aveugle et contrôlée par placebo. La répartition aléatoire a été réalisée par ordinateur. Bien que l’étude ait été financée par la compagnie qui produit le médicament, cette dernière n’a participé ni à la conception, ni à la collecte, ni à l’analyse des données. Les résultats obtenus en termes de fréquence d’évènements thromboemboliques étaient comparables à ceux obtenus dans les autres études de prévention secondaire des TEV7–10. Plusieurs analyses de sous-groupes ont été conduites afin de déterminer des caractéristiques pouvant augmenter les risques de récurrence. Finalement, les auteurs de SURVET ont fait preuve de transparence en mentionnant certaines limites de l’étude.
En ce sens, il faut mentionner plusieurs de ces limites. Tout d’abord, il existe très peu d’information sur l’état de santé des patients inclus dans l’étude. Par conséquent, les facteurs de risque de récurrence de thrombose et de saignement ne sont pas rapportés, comme l’indice de masse corporelle, la présence de signes post-thrombose (hyperpigmentation, oedème ou rougeur à une jambe) et une élévation des D-dimères à 250 g/L ou plus pendant la prise de warfarine11. La prise d’aspirine n’est rapportée que dans l’annexe et ne semble pas avoir été prise en compte par les auteurs. Ensuite, le protocole a été enfreint à plusieurs reprises par certains sujets. Les violations de faible risque consistaient en des traitements avec un AVK plus longs que ceux définis par le protocole ou un intervalle plus court entre l’arrêt de l’anticoagulation et la répartition aléatoire. Les violations entraînant un risque élevé correspondaient à un traitement anticoagulant absent ou plus court ou un intervalle plus long entre la fin du traitement et la répartition aléatoire. Toutefois, selon l’étude, il n’y aurait pas d’association entre le risque de TEV et la durée d’exposition à l’AVK. Il y a également eu plus d’arrêts prématurés de traitement que ce qui avait été anticipé au début de l’étude, et le motif de ces arrêts de traitement n’a été que brièvement mentionné. L’étude a également évalué à environ 75 % l’observance des sujets, mais aucun moyen ne semble avoir été mis en place pour l’évaluer autrement que selon les dires des patients.
Il existe également certaines incertitudes relatives aux résultats. L’incidence des TEV était plus faible que les prévisions utilisées pour le calcul de la puissance statistique. En effet, ces calculs sont basés sur le fait qu’un nombre total de 620 patients permettrait d’atteindre une puissance de 90 % pour établir la supériorité du sulodexide comparativement au placebo. Comme le N des patients de cette étude est de 615, l’étude est relativement précise, sans toutefois atteindre la puissance de 90 %. De plus, les calculs de puissance statistique ont été effectués avec un taux de récidive de 17,5 % sur deux ans dans le groupe placebo. Puisque ce taux n’a pas été tout à fait atteint, cela vient également affecter négativement la puissance de l’étude. Lorsqu’on compare le taux de saignement majeur ou cliniquement significatif du groupe placebo de SURVET à celui d’autres études semblables, on remarque qu’il est beaucoup plus faible dans SURVET, ce qui pourrait expliquer qu’on n’a observé aucun saignement majeur12. Ceci pourrait résulter d’un manquement dans l’évaluation des saignements lors de l’étude ou de l’effet du hasard lié à une taille d’échantillon trop faible. Comme la prévention des saignements est importante pour cette population, peut-être même plus que la prévention des récidives de TEV, puisqu’ils augmentent la morbidité et la mortalité, les résultats de l’innocuité concernant le sulodexide doivent être interprétés avec prudence3. De plus, un faible nombre de patients a été inclus dans l’étude après une embolie pulmonaire. Il est alors difficile d’extrapoler les résultats pour cette cohorte de patients.
L’étude a été réalisée auprès de patients ayant vécu un premier incident thromboembolique. L’efficacité du sulodexide par rapport au placebo demeure donc inconnue après une récurrence de TEV.
La validité interne de l’étude doit également être remise en question. Il y a une grande variation du risque de récurrence selon les différents sites12. Cette variation peut être due à des facteurs de risque différents ou à des pratiques médicales différentes. Par exemple, la durée du traitement antithrombotique était variable d’un patient à un autre. Comme l’étude a été menée auprès d’une population uniquement européenne et caucasienne, la validité externe est très limitée. En effet, l’applicabilité des résultats à une population nord-américaine est inconnue.
Plusieurs autres études ont été menées pour trouver un traitement de remplacement efficace comportant un faible risque de saignement. L’étude SURVET s’inscrit dans la même lignée qu’ASPIRE et WARFASA9–10. Ces deux études avaient, elles aussi, pour objectif d’évaluer la place de l’aspirine pour la prévention secondaire des TEV idiopathiques pour des patients qui ont eu un premier épisode non provoqué de TEV ou d’EP et qui ont reçu un traitement anticoagulant initial allant de six semaines à 24 mois avec un AVK9,10. Lorsque les résultats de ces études sont pris individuellement, on voit que l’aspirine diminue le nombre de TEV comparativement au placebo9,10. La diminution du risque est statistiquement significative selon l’étude WARFASA, mais elle ne l’est pas selon l’étude ASPIRE9,10. Prises individuellement, ces deux études n’avaient pas la puissance statistique pour détecter l’effet de l’aspirine en fonction d’un objectif en particulier ou sur des sous-groupes de patients9,10. L’étude INSPIRE a permis de pallier cet aspect négatif en combinant les résultats des études ASPIRE et WARFASA6,9–10. L’efficacité de l’aspirine pour diminuer le risque de TEV est statistiquement significative et correspond à une diminution du risque relatif de 42 % de récurrence comparativement au placebo6.
Dans AMPLIFY-EXT, deux doses d’apixaban (2,5 mg deux fois par jour et 5 mg deux fois par jour) ont été comparées au placebo en ce qui a trait à l’efficacité et à l’innocuité pour prévenir une récurrence de TEV chez des patients qui avaient reçu préalablement un AVK en anticoagulothérapie pendant six à 12 mois7. Ces doses se sont révélées supérieures au placebo de manière statistiquement significative, soit une diminution du risque relatif de 67 % pour la dose de 2,5 mg et de 64 % pour celle de 5 mg7. Le risque de saignement majeur n’a pas augmenté, mais le risque de saignement cliniquement important était plus élevé, particulièrement avec la dose de 5 mg comparativement au placebo7. Le dabigatran a, quant à lui, été comparé à la warfarine dans l’étude RE-MEDY, ainsi qu’au placebo dans l’étude RE-SONATE pour son efficacité et son innocuité dans une prophylaxie à long terme après une TEV8. Les patients de ces deux études devaient avoir reçu une anticoagulation préalable pendant trois à 12 mois dans l’étude RE-MEDY et pendant six à 18 mois dans l’étude RE-SONATE8. Ces études ont démontré que le dabigatran dosé à 150 mg pris deux fois par jour n’est pas inférieur à la warfarine pour la réduction des TEV récurrentes et serait plus efficace que le placebo, tel que le démontre un rapport de cotes [RC] : 0,08; intervalle de confiance à 95 % [IC 95 %] 0,02–0,258. Le dabigatran entraînerait moins de saignements que la warfarine, mais plus que le placebo8. L’étude EINSTEIN-Extension a évalué l’efficacité et l’innocuité du rivaroxaban à 20 mg administré une fois par jour pendant une période supplémentaire de six à 12 mois en prévention secondaire d’une récurrence de TEV pour des patients ayant reçu une anticoagulothérapie préalable de six à 12 mois avec du rivaroxaban ou un AVK13. Les résultats obtenus sont statistiquement significatifs et montrent que le rivaroxaban est plus efficace que le placebo13. Le rivaroxaban entraîne une diminution du risque relatif de récurrence de TEV de 82 %13. Lorsque les saignements majeurs et les saignements cliniquement importants sont combinés, le rivaroxaban cause plus de saignements que le placebo et la différence est statistiquement significative. Par contre, lorsque les deux types de saignements sont analysés individuellement, le rivaroxaban cause plus de saignements majeurs et de saignements cliniquement importants que le placebo, mais la différence n’est plus significative13.
Le sulodexide et les AOD ont démontré une bonne efficacité en prévention secondaire de la TEV, mais le sulodexide pourrait engendrer un risque de saignement moindre.
Le sulodexide pourrait donc représenter un traitement intéressant pour la prévention secondaire d’une première TEV idiopathique. Son efficacité est supérieure à celle du placebo et son principal avantage pourrait être un faible taux de saignement. Puisque l’étude n’a pas été conçue pour détecter correctement les saignements, des études supplémentaires seront nécessaires afin de mieux évaluer l’innocuité du sulodexide. De plus, à l’heure actuelle, il n’est pas disponible au Canada. Par conséquent, il est difficile d’évaluer l’impact financier qu’un tel traitement pourrait comporter. Pour toutes ces raisons, les AOD et la warfarine seraient les agents à privilégier pour le traitement prévention secondaire de la TEV.
L’étude SURVET a démontré l’efficacité supérieure du sulodexide par rapport au placebo pour la prévention secondaire de la TEV idiopathique. Le sulodexide semble comporter un risque de saignement moindre, comparable au placebo, mais ce risque n’a pas été comparé à d’autres anticoagulants dans le cadre de cette étude, notamment les AOD. Il n’est cependant pas disponible au Canada, et plusieurs études supplémentaires seraient nécessaires pour confirmer son avantage par rapport aux autres anticoagulants en prévention secondaire de la TEV et en matière d’innocuité.
1. Andreozzi GM, Bignamini AA, Davi G, Palareti G, Matuska J, Holy M et coll. Sulodexide for the prevention of recurrent venous thromboembolism: The Sulodexide in Secondary Prevention of Recurrent Deep Vein Thrombosis (SURVET) Study: A multicenter, randomized, double-Blind, placebo-controlled trial. Circulation 2015;132:1891–7.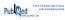

2. Heit JA, Silverstein MD, Mohr DN, Petterson TM, O’Fallon W, Melton L. Risk factors for deep vein thrombosis and pulmonary embolism: A population-based case-control study. Arch Intern Med 2000;160:809–15.
3. Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H et coll. Antithrombotic therapy for VTE Disease: CHEST guideline and expert panel report. Chest 2016;149:315–52.
4. Micromedex Healthcare Series. Monographie du sulodexide. Thomson Micromedex, 1074–2016. [en ligne] http://www.micromedexsolutions.com/home/dispatch (site visité le 28 mai 2016).
5. Lasierra-Cirujeda J, Coronel P, Aza M, Gimeno M. Use of sulodexide in patients with peripheral vascular disease. J Blood Med 2010;1:105–14.

6. Simes J, Becattini C, Agnelli G, Eikelboom JW, Kirby AC, Mister R et coll. Aspirin for the prevention of recurrent venous thromboembolism: the INSPIRE collaboration. Circulation 2014;130:1062–71.
7. Agnelli G, Buller HR, Cohen A, Curto M, Gallus AS, Johnson M et coll. Apixaban for extended treatment of venous thromboembolism. N Engl J Med 2013;368:699–708.
8. Schulman S, Kearon C, Kakkar AK, Schellong S, Eriksson H, Baanstra D et coll. Extended use of dabigatran, warfarin, or placebo in venous thromboembolism. N Engl J Med 2013;368:709–18.
9. Brighton TA, Eikelboom JW, Mann K, Mister R, Gallus A, Ockelford P et coll. Low-dose aspirin for preventing recurrent venous thromboembolism. N Engl J Med 2012;367:1979–87.
10. Becattini C, Agnelli G, Schenone A, Eichinger S, Bucherini E, Silingardi M et coll. Aspirin for preventing the recurrence of venous thromboembolism. N Engl J Med 2012;366:1959–67.
11. Rodger MA, Kahn SR, Wells PS, Anderson DA, Chagnon I, Le Gal G et coll. Identifying unprovoked thromboembolism patients at low risk for recurrence who can discontinue anticoagulant therapy. CMAJ 2008;179:417–26.

12. Blondon M, Bounameaux H. Secondary prevention of venous thromboembolism: One regimen may not fit all. Circulation 2015;132:1856–9.
13. Bauersachs R, Berkowitz SD, Brenner B, Buller HR, Decousus H, Gallus AS et coll. Oral rivaroxaban for symptomatic venous thromboembolism. N Engl J Med 2010;363:2499–510.
PHARMACTUEL, Vol. 50, No. 3, 2017