Hélène Cauchon-Lachance1,2, Pharm.D., Jean-Marc Forest3, B.Pharm., D.P.H., M.Sc.
Reçu le 28 septembre 2016; Accepté après révision le 10 mai 2017
Résumé
Objectif : L’objectif était de déterminer le degré approprié de protection contre la lumière que requièrent les médicaments utilisés au Centre hospitalier universitaire Sainte-Justine en vue d’optimiser les procédures actuelles.
Mise en contexte : Les fabricants mentionnent que beaucoup de médicaments doivent être protégés de la lumière. Ainsi, le personnel traitant doit prendre des précautions pour les conserver adéquatement. Ces précautions requièrent des ressources supplémentaires, notamment en temps et en matériel. Il serait donc intéressant de savoir si elles sont adéquates, insuffisantes ou excessives. Pour cela, 43 compagnies pharmaceutiques ont été interrogées dans le cadre d’un stage en octobre 2012 sur la photosensibilité de leurs molécules.
Résultats : Dans l’ensemble, les réponses des compagnies étaient assez décevantes. La plupart des entreprises se sont contentées de donner une réponse générale. Par contre, quelques renseignements pertinents nous ont permis de cesser de protéger de la lumière certains médicaments.
Conclusion : Dans l’ignorance du degré de photosensibilité de la plupart des médicaments, il faut faire en sorte de toujours garder les fioles et ampoules dans leur boîte d’origine et de garder la lumière des réfrigérateurs éteinte lorsqu’elle n’est pas indispensable. L’article rapporte également le nom des médicaments pour lesquels les précautions actuelles pourraient être revues à la baisse.
Mots clés : Médicaments, photosensibilité, protection de la lumière
Abstract
Objective: The objective of this project was to determine the appropriate level of light protection required for the drugs used at the Centre hospitalier universitaire Sainte-Justine, in order to optimize the current procedures.
Background: Manufacturers instruct, for many drugs, that they should be protected from light. Therefore, medical personnel should take precautions to store them properly. These precautions require additional resources, mainly in terms of time and equipment. It would be useful to know if they are adequate, insufficient or excessive. To this end, in October 2012, as part of a work term, 43 pharmaceutical companies were asked about the photosensitivity of their drugs.
Results: On the whole, the companies’ responses were rather disappointing. Most of them only gave a general answer. Nevertheless, some relevant information was obtained, on the basis of which the protection of certain drugs from light could be discontinued.
Conclusion: Not knowing the degree of photosensitivity of most drugs, one should always store vials and ampuls in their original box and keep refrigerator lights off when they are not needed. The article also mentions the drugs for which the current precautions could be revised downward.
Keywords: Drugs, light protection, photosensitivity
Bien des médicaments portent sur leur emballage la mention « protéger de la lumière ». Certaines compagnies écrivent plutôt « craint la lumière » et rares sont celles qui apportent un peu plus de précision comme « ne pas exposer directement aux rayons du soleil ». Au Centre hospitalier universitaire (CHU) Sainte-Justine, dès qu’un produit à servir doit être protégé de la lumière, il est mis dans un sac ambré opaque ou conservé dans le contenant d’origine en attendant d’être placé dans l’obscurité d’une cassette destinée au patient. Parmi les questions que soulèvent ces pratiques, notons :
Utilisons-nous parfois des précautions inutiles pour protéger certains médicaments portant une mention de sensibilité à la lumière?
Les précautions sont-elles insuffisantes par exemple pour les produits qui se trouvent déjà dans des fioles ambrées?
Qu’en est-il réellement de la stabilité de ces molécules à la lumière et à quel type d’éclairage la mise en garde s’applique-t-elle?
L’objectif de cet article vise à déterminer le degré approprié de protection contre la lumière requis pour les médicaments utilisés au CHU Sainte-Justine en vue d’optimiser les procédures actuelles.
Une recherche portant sur les dix dernières années a été effectuée en octobre 2012 dans PubMed et Medline pour faire le point sur l’état des connaissances. Dans un premier temps, la recherche a porté sur plusieurs combinaisons de Medical Subject Headings (MeSH), comme : drug storage, drug stability, light, light sensitivity ou les mots-clefs drug degradation et light protection. Puis elle s’est poursuivie par la consultation de la liste des médicaments du CHU Sainte-Justine dont la mention « protéger de la lumière » figure sur l’étiquette de la pharmacie pour connaître l’étendue actuelle de cette réalité au centre hospitalier.
Par la suite, une revue exhaustive de tous les contenants originaux et emballages commerciaux de l’ensemble des médicaments utilisés au CHU Sainte-Justine a eu lieu et a permis de repérer les mentions indiquant la nécessité d’une protection contre la lumière. Ont été exclus les médicaments de la pharmacie d’oncologie et ceux fabriqués directement au CHU Sainte-Justine sous forme magistrale, de même que les narcotiques qui ont été vérifiés et listés, mais non investigués auprès des fabricants. Puis a suivi la consultation de la monographie de tous les produits ne portant sur l’emballage aucune mention sur la manière de les conserver, notamment la section Storage and Stability1.
Enfin, les investigateurs ont relevé le nom de la compagnie fabriquant chaque produit muni d’une demande de protection contre la lumière ainsi que la couleur de la fiole ou de l’ampoule des produits injectables (claire ou ambrée). Ils ont pris contact avec 43 compagnies pharmaceutiques soit par courriel, soit par téléphone2. Ces courriels ou appels téléphoniques adressés aux compagnies pharmaceutiques comportaient une brève description de la situation, la liste de leurs médicaments concernés par l’étude et les questions suivantes relatives à chacun d’eux :
De quel type d’exposition à la lumière s’agit-il exactement?
L’étude de l’exposition à la lumière concerne-t-elle le produit sous forme de poudre, de comprimés, de liquide ou en dilution?
L’étude de l’exposition à la lumière s’appliquait-elle à la lumière incandescente, fluorescente, solaire?
Combien de temps le médicament était-il exposé et quelles modifications subissait-il au cours de cette exposition?
Dans le cas où le médicament est vendu dans un contenant ambré, ce matériau est-il suffisant pour le protéger de la lumière?
Ces questions concernaient un nombre de médicaments variant entre un et 65 avec une médiane de trois médicaments par compagnie. Quelques compagnies ne fabriquant qu’un seul médicament de la liste des produits répertoriés n’ont pas répondu dans le délai imparti pour l’étude soit les quatre semaines que durait le stage.
Parmi les médicaments utilisés au département de pharmacie du CHU Sainte-Justine, 345 sur environ 1800 portaient sur leur emballage la mention « à protéger de la lumière ».
À la suite des questionnaires envoyés par courriel et des échanges téléphoniques, 26 des 43 compagnies ont répondu aux questions, alors que 17 n’avaient pas répondu à la fin de la quatrième et dernière semaine. Parmi les 26 compagnies ayant répondu, six ont été capables d’apporter des précisions intéressantes sur la photosensibilité d’au moins un médicament de la liste qui leur avait été envoyée. Deux compagnies ont mentionné que les informations demandées étaient confidentielles. Six compagnies ont répondu que ces informations étaient trop anciennes et qu’elles avaient été archivées, bref que ce serait trop difficile d’y avoir accès. Sept compagnies ont répondu que, lorsqu’un médicament doit être protégé de la lumière, cela est valable pour tous les types de lumière, et ce, jusqu’au moment où le patient reçoit le médicament. Une compagnie a mentionné qu’elle écrivait cette mention alors qu’aucun test de photosensibilité n’avait été fait sur leur médicament. Une compagnie de génériques a affirmé qu’elle devait inscrire les mêmes paramètres de conservation que le médicament original. Enfin, deux compagnies ont éludé la question en donnant des renseignements sur la conservation en général sans lien avec la lumière.
Il existe un consensus entre les compagnies contactées sur le fait que les contenants ambrés bloquent une bonne partie des rayons lumineux et offrent beaucoup plus de protection que les contenants transparents. Mais il n’y a pas de consensus quant à savoir si ce matériau est suffisant pour considérer le produit comme protégé adéquatement de la lumière. Par ailleurs, les compagnies vendent certains produits injectables à protéger de la lumière dans des fioles ou des ampoules ambrées et d’autres dans des fioles ou des ampoules transparentes.
Les informations recueillies pour chacun des médicaments à protéger de la lumière se trouvent dans les tableaux I à IV. Le tableau I a été réalisé à l’aide des mentions sur les emballages et dans la monographie ou de l’information médicale qui précisaient que les rayons du soleil étaient le type de lumière problématique pour la stabilité du médicament1,2. Le tableau II est basé sur les recommandations de certaines compagnies de porter une attention particulière à la protection de certains de leurs médicaments très photosensibles2. Il ne représente donc absolument pas de manière exhaustive les molécules particulièrement sensibles à la lumière. Le tableau III regroupe toutes les données de photosensibilité plus précises qui ont pu être obtenues auprès des compagnies pharmaceutiques par courriel ou téléphone2. Notons que les compagnies ont fourni ces données à titre informatif seulement et ne recommandent en aucun cas des pratiques qui dérogent à leurs monographies. Enfin, le tableau IV (en annexe seulement sur le site du Pharmactuel) illustre l’ensemble des autres médicaments dont l’emballage ou la monographie mentionnaient de les protéger de la lumière, mais au sujet desquels les compagnies n’ont fourni aucune information supplémentaire1. Parmi ces derniers se trouvent des médicaments dont la compagnie a précisé ne pas les avoir testés, des médicaments qui ont été testés, mais pour lesquels aucun détail n’a pu être obtenu, des médicaments pour lesquels la compagnie n’a apporté aucune réponse ou des médicaments au sujet desquels l’information manque de précision, par exemple : « Ne pas exposer de manière excessive à la lumière ». Le terme « excessive » ne pouvant être défini, il faut considérer ces médicaments comme à protéger dans des contenants opaques.
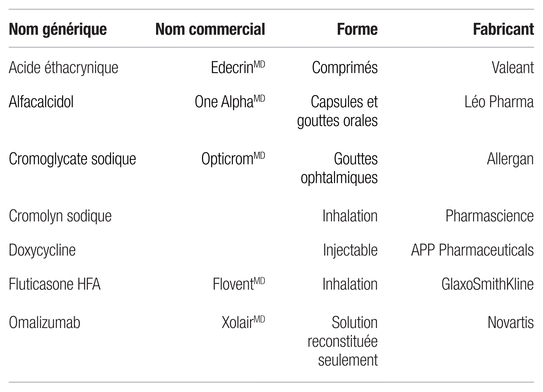
Tableau I Médicaments pour lesquels la monographie, l’emballage ou l’information médicale du fabricant précise qu’une protection contre les rayons du soleil est requise1,2
Tableau II Médicaments pour lesquels le service d’information médicale des compagnies a particulièrement insisté sur leur sensibilité à la lumière2
Tableau III Données obtenues du service d’information médicale des compagnies permettant une certaine latitude quant à la protection de la lumière2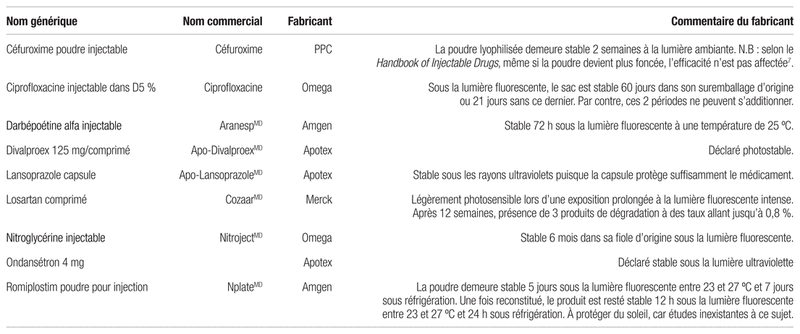
Pour ce qui est de la comparaison entre la liste actuelle des médicaments du CHU Sainte-Justine à protéger de la lumière et la liste obtenue à partir des emballages des compagnies, des divergences importantes ont été observées. En effet, les deux listes donnent un total d’environ 400 médicaments à protéger, mais seulement 10 % d’entre eux se trouvent sur les deux listes. Cinquante médicaments à protéger de la lumière, selon la liste du CHU Sainte-Justine, ne se trouvent pas dans la liste élaborée à partir des emballages. Enfin, il y a quelque 300 médicaments sur cette liste dont l’étiquette de la pharmacie ne porte aucune mention sur la protection contre la lumière.
Il existe très peu de documents exhaustifs sur le sujet publié dans PubMed et Medline. Nous n’avons trouvé que deux documents ayant le même objectif primaire que notre projet, soit la protection des médicaments contre la lumière. Ces deux articles présentent uniquement quelques médicaments et mentionnent s’ils sont sensibles à la lumière ou non3,4. Le premier, celui de Langner, ne concerne que des médicaments pour usage topique3. Le second concerne tous les médicaments de l’hôpital Morales Meseguer et fait le point sur le degré de protection requis contre la lumière durant l’entreposage lorsqu’ils ont été reconstitués4. Pour trouver leurs données, les auteurs se sont basés sur les caractéristiques de la molécule, les informations des compagnies et la littérature scientifique. Des détails précis sont fournis pour quelques molécules, mais pour la plupart, seule la mention « à protéger de la lumière » figure sans aucune autre précision. Mais même si les documents scientifiques sur la photosensibilité des médicaments sont rares, il est possible de trouver plusieurs articles mentionnant la photosensibilité d’une molécule en particulier.
Aucune corrélation ne peut être établie entre le fait que le médicament soit dans un contenant ambré ou non et s’il doit être protégé ou non. La mention de la protection contre la lumière peut concerner une seule, plusieurs ou toutes les formes pharmaceutiques d’un médicament. La seule compagnie avisée de cette réalité pour l’une de ses molécules n’avait pas de réponse pour expliquer la divergence de mention entre ses capsules et ses comprimés, qui comportaient l’énoncé « à protéger de la lumière », alors que sa poudre pour injection et sa suspension orale n’en comportaient pas. Il est possible que des excipients empêchent un principe actif de se dégrader à la lumière ou que l’analyse de toutes les formes pharmaceutiques n’ait pas été faite. La consultation du Handbook of Pharmaceutical Excipients n’a apporté aucune précision concluante capable de répondre à l’hypothèse concernant les excipients5. D’autre part, la compagnie pourrait considérer que le contenant d’un médicament donné bénéficie d’une protection suffisante, ce qui lui vaudrait le retrait de la mention. Or, dans un tel cas, le personnel administrant ou reconditionnant le produit aurait besoin d’être avisé afin d’en tenir compte. Enfin, il y a peut-être des lacunes dans le processus de décision d’inscrire ou non la mention « à protéger de la lumière ».
Il n’est pas rare de retrouver pour une molécule donnée et pour une même forme pharmaceutique des différences entre les compagnies. C’est le cas notamment des comprimés d’ondansétron pour lesquels Pharmascience recommande de les protéger de la lumière alors que ce n’est pas le cas de Sandoz et de GlaxoSmithKline. Même chose pour les comprimés d’atorvastatine, pour lesquels Ratiopharm semble être la seule compagnie à l’indiquer dans sa monographie. Il n’a pas été possible de savoir s’il existe entre eux une réelle différence de sensibilité à la lumière selon les excipients utilisés. Une compagnie peut également décider d’écrire cette mention uniquement pour des raisons de protection légale.
La prudence est de mise si l’on trouve des articles sur la photosensibilité d’une molécule ou si nous faisons nos propres tests de photosensibilité : les résultats trouvés risqueraient de ne s’appliquer qu’à la compagnie fabriquant le produit testé. Le sel utilisé peut également conduire à une différence. Par exemple, le succinate de méthylprednisolone (Solu-MedrolMD) devrait être protégé de la lumière, mais pas l’acétate de méthylprednisolone (Dépo-MedrolMD). Il y a également des incohérences possibles entre ce qui est écrit sur l’emballage et ce qui est écrit dans la monographie. Par exemple, la desmopressine pour injection (OctostimMD) et l’idursulfase pour injection (ElapraseMD) portent sur leur emballage la mention de les protéger de la lumière, mais rien de tel n’est indiqué dans leur monographie. L’inverse se produit pour l’insuline détémir (LevemirMD) : sa monographie indiquant de la protéger de la lumière, mais son emballage ne le mentionne pas.
Il y a aussi des divergences concernant plusieurs médicaments entre les sources d’information que nous avons utilisées. L’inscription dans la monographie provenant du Compendium des produits et spécialités pharmaceutiques en ligne (e-CPS), celle provenant de la Base de données sur les produits pharmaceutiques (BDPP) de Santé Canada et celle de la section « Storage and Stability » de Micromedex ne sont pas au diapason1. Il est rarement écrit « ce médicament ne nécessite pas de protection particulière contre la lumière », mais lors d’absence de commentaire exigeant de le protéger, c’est habituellement ce que l’on déduit par défaut. Quant aux vaccins, ils sont tous protégés de la lumière au CHU Sainte-Justine et c’est également ce que recommande le Protocole d’immunisation du Québec (PIQ)6. Par contre, fait intéressant, un peu moins de la moitié des monographies de ces vaccins mentionnent la nécessité de les protéger de la lumière.
Même avec l’obtention de données intéressantes sur la stabilité, il faudra toujours analyser le circuit de chaque médicament pour savoir si l’on peut retirer la mention de protection de la lumière. Par exemple, le retrait de la mention « protéger de la lumière » de l’étiquette de la darbépoétine alfa (AranespMD) est discutable car, bien qu’elle puisse demeurer stable 72 heures à la lumière ambiante, il y a un risque pour la stabilité du produit si tous les intervenants dans le parcours de ce médicament abaissent leur degré de précautions lors de sa manipulation. Mais comme le produit est conservé au réfrigérateur, son temps réel d’exposition est très limité au départ.
Pour expliquer les divergences entre la liste théorique actuelle des médicaments à protéger de la lumière au CHU Sainte-Justine et celle obtenue par le recensement des mentions sur les emballages de la pharmacie, de nombreuses hypothèses sont possibles. D’une part, l’étiquette de la pharmacie de certains médicaments ne se réfère pas toujours aux emballages commerciaux d’origine. Il peut s’agir de préparations magistrales, non investiguées dans le cadre de cet article, d’un oubli lors du recensement de l’information ou de l’absence des contenants d’origine lors de la collecte de l’information sur certains médicaments. D’autre part, ces divergences pourraient s’expliquer par l’absence de la mention « à protéger de la lumière » sur le contenant, soit parce que la compagnie ne l’a pas écrite, soit parce que le médicament ne nécessite tout simplement pas de protection. Puis, pour expliquer le fait qu’il y a des médicaments qui doivent être protégés selon les mentions inscrites sur les emballages et non selon les étiquettes de la pharmacie, on peut penser qu’il y a eu un suivi non optimal de la mention « à protéger de la lumière » sur les étiquettes de la pharmacie ou qu’il y a quelques mentions superflues sur certains des emballages. Le passage d’un original vers un générique au fil des années peut aussi expliquer nombre de divergences. De plus, les très nombreux changements de fournisseurs de génériques peuvent expliquer certaines discordances rencontrées. Il faudrait donc valider l’information avec les monographies des produits concernés et mettre à jour toutes les étiquettes, ce qui n’est pas une mince affaire.
Somme toute, la précision des réponses obtenues auprès des compagnies pharmaceutiques était étonnamment pauvre. Il est donc décevant de devoir continuer à prendre de nombreuses précautions sans savoir si elles sont réellement justifiées ou non pour maintenir la pleine efficacité d’un médicament donné. Cela dit, l’information ne peut provenir que des compagnies elles-mêmes, ce qui peut constituer un biais dans cette étude. Par ailleurs, il est légitime de penser qu’aucune organisation n’octroiera les moyens nécessaires pour faire des tests indépendants sur tous les médicaments existant sur le marché.
Il y a beaucoup d’éléments inconnus et de divergences sur la protection des médicaments de la lumière, notamment des divergences d’une compagnie à l’autre ou d’une forme pharmaceutique à l’autre, entre une monographie et l’emballage, et aussi entre les sources d’information. Quelques compagnies ont apporté des données intéressantes, mais la plupart n’ont pas été d’une très grande aide sur ce sujet. Il est néanmoins possible d’émettre quelques recommandations :
Étant donné que des fioles de médicaments dits sensibles à la lumière se trouvent parfois à l’extérieur de leur boîte d’origine, il faudrait toujours prendre l’habitude de laisser aussi longtemps que possible toute fiole ou ampoule, tous médicaments confondus, dans sa boîte d’origine fermée.
Le point précédent s’applique aussi aux médicaments conservés au réfrigérateur. De plus, il serait indiqué de ne pas laisser une lumière constamment allumée à l’intérieur des réfrigérateurs ou d’une chambre froide, mais plutôt de faire en sorte qu’elle s’allume et s’éteigne avec l’ouverture et la fermeture de la porte afin de limiter le temps d’exposition à la lumière.
On pourrait éliminer la mention « protéger de la lumière “ sur les médicaments du tableau I ou la modifier pour « Ce médicament peut tolérer la lumière intérieure, mais pas la lumière du soleil ».
On pourrait éliminer la mention « protéger de la lumière » sur les médicaments du tableau III.
Il reste énormément de recherche et de travail à faire sur ce sujet. S’adresser à nouveau aux compagnies pour l’obtention de détails sur la photosensibilité semble peine perdue, bien qu’il ne soit pas exclu que les compagnies n’ayant pas répondu aux questions puissent être interrogées à nouveau. En revanche, il serait possible de comparer les monographies aux emballages correspondants pour relever les incohérences. La réalisation d’une recherche plus approfondie sur le processus qui justifie la mention « protéger de la lumière » à appliquer ou non à un médicament serait profitable. Enfin, il serait utile d’investiguer les vaccins et les raisons de les protéger systématiquement de la lumière. Bref, il faudrait faire la lumière sur de nombreux points qui restent encore obscurs au sujet de la mention de protection des médicaments contre la lumière.
Cet article comporte une annexe; elle est disponible sur le site de Pharmactuel. (www.pharmactuel.com).
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’IMCJE pour la divulgation de conflit d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Les auteurs souhaitent remercier M. Grégoire Leclair, professeur à la Faculté de pharmacie de l’Université de Montréal, pour ses explications et ses judicieux conseils. Ils ont obtenu une autorisation écrite de sa part.
1. Association des pharmaciens du Canada. Service RxTx : plusieurs médicaments. [en ligne] https://www.pharmacists.ca/products-services/rxtx-fr/ (site visité en octobre 2012).
2. Service d’information médicale de différentes compagnies pharmaceutiques. Communications personnelles obtenues en octobre 2012.
3. Langner MD, Maibach HI. Many common drugs in dermatology are light, temperature, or moisture-sensitive. [en ligne] http://www.skintherapyletter.com/2009/14.1/2.html (site visité le 2 octobre 2012).
4. Sánchez-Quiles I, Nájera-Pérez MD, Espuny-Miró A, Titos-Arcos JC. Review of the stability of photosensitive medications. [en ligne] http://www.elsevier.es/en/revistas/farmacia-hospitalaria-121/review-of-the-stability-of-photosensitivemedications-90036075-revision-2011 (site visité le 2 octobre 2012).
5. Rowe RC, Sheskey PJ, Quinn ME. Handbook of pharmaceutical excipients. 6e éd.: Pharmaceutical Press; 2009. 888 pages.
6. Gouvernement du Québec. Protocole d’immunisation du Québec (PIQ), 6e éd., avril 2016. 514 pages. [en ligne] http://publications.msss.gouv.qc.ca/msss/document-000105/ (site visité en octobre 2012).
7. ASHP. Handbook on injectable drugs. 18e éd. Bethesda: American Society of Health-System Pharmacists; 2015. 1254 p.
PHARMACTUEL, Vol. 50, No. 3, 2017