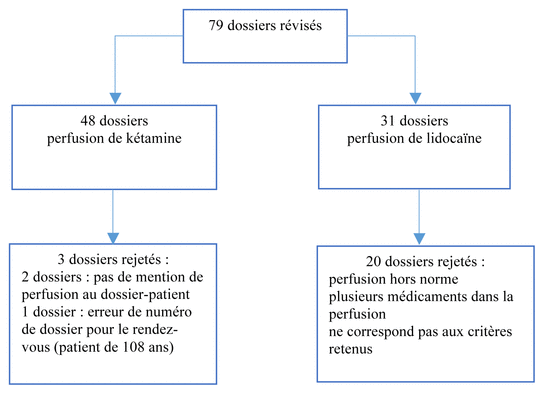
Figure 1 Sélection des dossiers – perfusions de lidocaïne et de kétamine
Andrée Néron1,2, B.Pharm., DPH, FOPQ, Grisell Vargas-Schaffer3,4,5,6, MD, Aline Boulanger7,8,9, MD, FRCP(C), Alain Watier10, MD, Brigitte Migneault11, MD, Jean Bourgouin5, MD, M.Sc., Lama Zakhour12, Jean-François Cabot13
Reçu le 9 juin 2017; Accepté après révision le 14 septembre 2017
Résumé
Objectif : L’objectif de cet article est d’évaluer la réponse clinique obtenue lors de l’administration par perfusion intraveineuse de kétamine et de lidocaïne à des patients affectés par une algie chronique. Pour ce faire, nous avons procédé à une revue de la pharmacologie et des indications thérapeutiques de ces agents à des fins antalgiques lorsqu’ils sont administrés par perfusion en clinique externe.
Mise en contexte : Les perfusions intraveineuses de kétamine et de lidocaïne sont offertes à une population de patients affectés par une douleur chronique réfractaire aux traitements conventionnels. Une analyse rétrospective portant sur 79 patients a permis d’évaluer la réponse clinique de ces malades ainsi que la qualité et la pertinence de ce type d’intervention.
Résultats : À l’aide des 56 dossiers retenus, nous avons procédé à une interprétation des données de 45 patients ayant reçu une perfusion de kétamine (n = 48) et de 11 patients ayant reçu une perfusion de lidocaïne (n = 31). Les diagnostics les plus fréquents favorisant l’usage de ces analgésiques sont le syndrome de douleur régionale complexe, les neuropathies, la sciatalgie, la cervicalgie. La diminution de l’intensité de la douleur de 31 % des patients sous kétamine était égale ou supérieure à 50 %, et dans 64 % des cas, elle était égale ou supérieure à 30 %. Dans le groupe lidocaïne, la diminution de l’intensité de la douleur de 45 % des patients était égale ou supérieure à 50 %, et pour 72 % des patients, elle était égale ou supérieure à 30 %.
Conclusion : Les perfusions de lidocaïne et de kétamine, administrées en milieu protégé, peuvent être des solutions intermédiaires ou de dernière ligne pour les cas de douleur réfractaire aux traitements conventionnels.
Mots clés : Douleur neuropathique, douleur réfractaire, kétamine intraveineuse, lidocaïne intraveineuse, syndrome de douleur régionale complexe
Abstract
Objective: The objective of this article is to evaluate the clinical response obtained with ketamine and lidocaine administered by intravenous infusion in patients with chronic pain. We reviewed the pharmacology of and the therapeutic indications for these agents for analgesic purposes when administered by infusion in an outpatient clinic.
Background: Intravenous infusions of ketamine and lidocaine are administered to a population of patients with chronic pain refractory to conventional treatments. Our patients’ clinical response and the quality and relevance of the intervention were studied by retrospective analysis in 79 patients.
Results: Of the 56 charts selected, we were able to interpret data for 45 patients who had received a ketamine infusion (n=48) and 11 patients who had received a lidocaine infusion (n=31). The most common diagnoses were complex regional pain syndrome, neuropathies, sciatica and neck pain. Thirty-one percent of the patients who had received ketamine experienced a 50% or greater reduction in pain intensity, and 64% experienced a 30% or greater decrease in the pain score. In the lidocaine group, 45% of the individuals treated reported a 50% or greater decrease in pain intensity, and 72% of them reported a 30% or greater decrease in this parameter.
Conclusion: Lidocaine and ketamine infusions administered in a protected setting can serve as an interim or last-resort solution in cases of pain refractory to conventional treatments.
Keywords: Complex regional pain syndrome, intravenous ketamine, intravenous lidocaine, neuropathic pain, refractory pain
La douleur chronique adopte très souvent un caractère mixte qui associe des éléments nociceptifs et neuropathiques, auxquels se greffe une dimension biopsychosociale très prégnante. Ces douleurs sont parfois difficiles à apaiser malgré une approche antalgique multimodale, ce qui oblige à recourir à des médicaments de derniers plans ou de sauvetage. La kétamine et la lidocaïne sont des agents de troisième ou de quatrième ligne en raison de leur mode d’administration et de leur indice thérapeutique. Ces deux médicaments, prescrits avec différents scénarios de prises, d’applications ou de perfusions, ont été employés au-delà des indications approuvées par les autorités sanitaires depuis que leur potentiel analgésique pour la douleur chronique a été rapporté1–7.
Une observation de la réponse analgésique a été effectuée par une analyse rétrospective de dossiers-patients (voir figure 1). Après approbation du directeur des services professionnels du Centre hospitalier de l’Université de Montréal (CHUM), et dans le plus grand respect du consentement éclairé, signé ou paraphé des patients nous autorisant à utiliser leurs données, une collecte de données rétrospective pour la période entre le 1er janvier et le 31 août 2015 a été réalisée.
|
|
||
|
Figure 1 Sélection des dossiers – perfusions de lidocaïne et de kétamine |
||
Les données nominatives ont été transférées dans un fichier Excel pour créer le répertoire des patients, faciliter la collecte et repérer les doublons. Par la suite, un pharmacien et une étudiante en pharmacie ont consulté et analysé les dossiers-patients afin de compléter l’information manquante. Un outil de travail a été développé pour consigner les informations pertinentes et faciliter la formulation de conclusions. La numérisation des dossiers ayant eu lieu en 2010, nous avons pris en compte la première perfusion administrée depuis cette date à chaque patient pris en compte pendant la période de recrutement - les dossiers papier antérieurs à cette date n’ayant pas été consultés.
L’administration d’une perfusion de l’un ou l’autre médicament est proposée à des patients dont la douleur est réfractaire à la médication et aux approches non pharmacologiques habituelles ou aux techniques plus effractives (techniques de bloc, infiltrations, thermolésions par radiofréquence, anesthésie régionale, etc.).
Les perfusions sont réalisées en clinique externe ambulatoire de la clinique de la douleur. Les patients candidats à un de ces médicaments ont reçu l’information pertinente du médecin de la clinique, et une fiche-conseil sur la kétamine leur a également été remise8. Quand ils arrivent à la clinique, les patients sont accompagnés, car ils ne doivent pas conduire de véhicule durant les 24 heures qui suivent le traitement. Ils sont accueillis en salle d’administration, et le personnel infirmier assure la surveillance selon le protocole établi. Un médecin de l’équipe est sur place et assume la supervision. Les patients qui reçoivent une perfusion de kétamine sont assis dans un fauteuil orthopédique, alors que ceux qui reçoivent la lidocaïne sont couchés sur une civière pendant la durée de la procédure.
Pendant la perfusion, les signes vitaux sont consignés sur la feuille d’observation toutes les 15 à 20 minutes; le patient peut quitter la clinique après une surveillance minimale de 30 minutes (tension artérielle [TA], pouls, saturation pulsée en oxygène [SPO2 %], rythme respiratoire [RR], amplitude respiratoire, monitorage cardiaque par électrocardiogramme (ECG) pour la lidocaïne, état de vigilance). L’intensité de la douleur est évaluée à l’aide de l’échelle numérique (0 – 10 où 0 signifie aucune douleur et 10 signifie la pire douleur imaginable) au début et à la fin de la perfusion. Cette valeur est revalidée aux visites subséquentes si elle a été consignée au dossier.
La kétamine est administrée dans 250 mL de NaCl 0,9 % et perfusée en deux heures à l’aide d’une pompe volumétrique. Une dose préventive de midazolam (1 à 3 mg par voie intraveineuse) est ajoutée à la perfusion afin d’éviter ou de juguler les effets indésirables centraux, notamment de types dissociatifs. La dose initiale est habituellement de 0,25 à 0,5 mg/kg de poids actuel et il est possible de l’augmenter progressivement selon la réponse clinique. Selon les particularités ou comorbidités du malade, cette dose peut être instaurée à une valeur plus faible (le plus souvent autour de 20 mg) et progressivement ajustée jusqu’à une dose maximale de 1 mg/kg, rarement au-delà de cette valeur.
Les perfusions de lidocaïne sont administrées en deux heures à l’aide d’une pompe volumétrique dans un volume de 250 mL de NaCl 0,9 %. La dose calculée varie de 2 à 4 mg/kg de poids actuel (certains reçoivent un bolus de 0,5 à 1 mg/kg de poids actuel en quelques minutes, puis la dose est complétée par une perfusion de deux heures). Selon la réponse clinique du patient, le schéma de répétition des perfusions varie d’une à quatre semaines (intervalle plus long si le soulagement est plus durable). L’intervalle possible entre deux administrations est tributaire des places disponibles en salle de traitement à la clinique. On cesse l’administration du médicament quand on n’observe aucune amélioration après quatre traitements consécutifs. En présence d’échec, une permutation pour un traitement par des perfusions de lidocaïne, et vice versa, peut alors être offerte.
Les données sont disponibles pour 45 des 48 patients ciblés qui ont reçu une perfusion de kétamine (26 femmes [moyenne 48 ans; écart-type : 12], 19 hommes [moyenne 53 ans; écart-type : 13]). L’âge moyen de la population étudiée est de 51 ans (écart type : 13) et la durée moyenne de la douleur est de 6 ans (1–19 ans; n = 36). Les patients sont affectés par différents types de douleur, les plus fréquents étant de type neuropathique (syndrome de douleur régionale complexe, neuropathies, sciatalgie, cervicalgie). La médication de base déjà prescrite pour traiter la douleur reste active et le patient continue de la prendre. La coanalgésie comprend l’acétaminophène, les opioïdes (dont la méthadone), les cannabinoïdes (y compris la marijuana), les gabapentinoïdes ou anticonvulsivants, les antidépresseurs, la kétamine par voie orale, les relaxants musculaires et les agents topiques. Diverses méthodes non pharmacologiques sont employées, et certains patients recevaient également des techniques effractives (données accessibles sur demande).
La poursuite du traitement s’échelonne sur une durée très variable (17 patients depuis au moins un an, dont sept depuis au moins quatre ans; un patient reçoit des perfusions depuis plus de cinq ans). Le nombre moyen de perfusions est de 19 traitements avec un écart de un à 98 traitements (neuf patients avec plus de 30 traitements; écart-type : 23). La dose moyenne administrée est de 48 mg par perfusion avec un écart de 20 à 150 mg (écart-type : 27) (dose initiale de 10 à 50 mg).
La réponse au traitement est difficile à objectiver en raison d’une appréciation variable et peu décrite (collecte rétrospective). Les résultats révèlent que l’intensité de la douleur de 64 % des patients (29/45) a diminué d’au moins 30 %; la proportion est de 31 % des patients (14/45) pour un soulagement de 50 % et plus. La durée de ce soulagement est de quelques heures à quelques jours (trois ou quatre jours), parfois quelques semaines (jusqu’à six semaines).
Hormis les éléments de monitorage prévus par le protocole clinique lors de la perfusion, les effets indésirables ont été relevés par cueillette passive lors de la visite et consignés au dossier.
On remarque des effets centraux (cauchemars [n = 1], somnolence [n = 4], euphorie [n = 2], hallucinations [n = 1], étourdissements [n = 5], effets centraux non décrits [n = 1]), engourdissement des lèvres et du menton [n = 1], diplopie [n = 1], nausées [n = 4], vomissements [n = 1], bradycardie [n = 1], bouffées vasomotrices [n = 1], augmentation de la douleur pendant la perfusion [n = 1; mécanisme inconnu], augmentation de la valeur aspartate aminotransférase (AST) [de 22 à 55 U/L en trois semaines; kétamine interrompue pendant trois mois puis reprise].
La majorité des patients n’ont subi aucune variation significative ou une variation sans conséquence clinique des paramètres visés (tension artérielle, pouls, % saturation en oxygène, fréquence respiratoire, somnolence indue).
Nous avons ciblé les données de 11 patients pouvant être interprétées. L’âge moyen est de 42 ans (écart-type : 9) et on retrouve neuf femmes (moyenne 40 ans; écart-type : 9) et deux hommes (moyenne 50 ans; écart-type : 10). La durée moyenne de la douleur est de 8 ans (2–19 ans; n = 9).
La poursuite du traitement s’échelonne sur une durée très variable (quatre patients traités depuis au moins un an, dont un depuis plus de quatre ans). Le nombre moyen de perfusions est de 21, l’écart se situant entre un et 93 traitements (trois patients ayant reçu plus de 30 traitements; écart-type : 26). La dose moyenne administrée est de 250 mg par perfusion avec un écart allant de 100 à 400 mg (écart-type : 93).
Huit patients sur onze (73 %) ont obtenu une diminution de l’intensité de la douleur d’au moins 30 %; la proportion est de 5/11 (45 %) patients ayant bénéficié d’un soulagement d’au moins 50 %. La durée de ce soulagement s’étend de trois jours à trois ou quatre semaines.
On note des étourdissements [n = 2], impression d’ébriété [n = 1], engourdissement péribuccal [n = 2], œdème aux mains et aux pieds [n = 1], oppression thoracique pendant 48 heures [n = 1], engourdissements des doigts et des mains [n = 1], picotements, engourdissements aux bras [n = 2], impression de se sentir bizarre [n = 1], hypotension [n = 2], somnolence [n = 2], légère diaphorèse [n = 1], bourdonnements [n = 1], rougeur du visage [n = 1], prurit [n = 1], goût métallique [n = 1], céphalée [n = 1] et douleur au site d’injection [n = 1].
La majorité des patients n’ont subi aucune variation significative des paramètres visés ou alors elle était sans conséquence (TA, pouls, SPO2%, RR, somnolence indue).
Malgré la difficulté d’établir clairement l’efficacité de la kétamine et de la lidocaïne à l’aide de données probantes (niveau de preuve) en raison de leurs multiples utilisations, ces analgésiques demeurent des fers de lance antalgiques pour soulager les douleurs rebelles et intolérables1.
La kétamine est un antagoniste non compétitif des récepteurs N-méthyl-D-aspartate (NMDA), récepteurs impliqués dans les phénomènes de sensibilisation des voies nociceptives. Elle peut prévenir la sensibilisation centrale déclenchée par la stimulation de la nociception périphérique et endiguer la survenue du phénomène de wind-up (amplification de la réponse à un stimulus répété), l’hyperesthésie, la douleur spontanée ainsi que l’allodynie2–5.
La molécule inhibe également la recapture neuronale des catécholamines et agit sur le système inhibiteur descendant, elle inhibe les récepteurs cholinergiques de type muscarinique et possède une action agoniste des récepteurs morphiniques de type mu et kappa6. Elle possède également un effet réactivateur ou inducteur des contrôles inhibiteurs diffus de la nociception pour rétablir l’équilibre physiologique entre les influences facilitatrices et inhibitrices de la douleur3,5,7.
De plus, il a été démontré que l’association de la kétamine aux opioïdes pouvait être salutaire. La kétamine potentialise l’effet antinociceptif des opioïdes et atténue les phénomènes de tolérance en plus de pouvoir contrer le phénomène d’hyperalgésie secondaire aux opioïdes. Certains auteurs ont pu observer une diminution significative et soutenue de la consommation d’opioïdes par leurs patients3,7,9–13.
Les techniques d’imagerie par résonnance magnétique ont démontré que, chez l’humain, la kétamine à dose analgésique réduit de façon concomitante l’activité du cortex insulaire et du thalamus, deux zones activées lors des stimulations nociceptives. Par ailleurs, la kétamine a démontré un effet répresseur lié à la dose sur le cortex somatosensoriel, l’insula et le cortex cingulaire antérieur, ce qui souligne les qualités modulatrices du médicament sur la composante affective de la douleur3,5. Quoique l’action supraspinale soit prépondérante, l’action spinale est également significative. La kétamine bloque les signaux afférents en provenance du tractus spinoréticulaire sans affecter la conduction par le tractus spinothalamique. La formation réticulaire médiane, le relais de la perception émotive de la douleur, et les noyaux thalamiques médians sont déprimés de façon sélective3.
L’emploi de la kétamine pour le soulagement de la douleur chronique est reconnu depuis des décennies malgré le fait que la médecine factuelle ait de la difficulté à établir clairement son efficacité par des études bien étayées (effet analgésique à doses généralement inférieures aux doses anesthésiques)5,7,11,14,15. Elle peut s’administrer en mode bolus, en perfusion courte et discontinue par voie sous-cutanée ou intraveineuse (p. ex. : pendant quatre à six heures, une fois par semaine) ou par perfusion longue pendant quelques jours à toutes les quelques semaines selon la réponse clinique, l’intervalle entre les perfusions pouvant être comblé par une prise par voie orale. L’administration de la kétamine par voie topique, buccale, sublinguale, rectale et intranasale est également employée en clinique, et le taux de succès lié à ces différents modes est fort variable1,3,9,10,11,14.
Des publications récentes sur la kétamine ont confirmé le bienfait analgésique de la kétamine pour plusieurs affections douloureuses chroniques et invalidantes, notamment pour celles comportant une composante neuropathique5. La molécule est le plus souvent utilisée dans les cas de syndrome de douleur régionale complexe, de fibromyalgie, de douleur ischémique, de névralgie postherpétique, de neuropathie périphérique, de douleur post-traumatique, de douleur neuropathique lésionnelle, de douleur fantôme, de douleur post accident vasculaire cérébral, de douleur post-trauma de moelle, de migraine et de douleur cancéreuse6,10,12,14,15.
L’effet analgésique peut perdurer longtemps après la fin de la perfusion chez certains malades (effet bimodal – répondeur/non-répondeur) ce qui témoigne d’un effet rémanent tributaire des propriétés lipophiles du médicament (distribution tissulaire extensive), des effets des métabolites actifs ou d’un reset des mécanismes endogènes permettant d’éteindre le signal douloureux pour quelque temps1,3,11. La pérennité de cet effet pourrait avoir un lien avec la durée de la perfusion, les perfusions sur quelques jours (quatre à 14 jours) pouvant entraîner un soulagement significatif de plusieurs semaines et nécessitant la répétition des perfusions à l’échéance de leurs effets. La perfusion courte et unique produit un effet analgésique rapide (passage efficace au système nerveux central), mais le plus souvent éphémère3,5,12,14,16. Certains auteurs ont par contre observé une corrélation positive entre la durée de la douleur (plusieurs années) et l’inefficacité du médicament alors qu’à contrario des doses peu élevées de kétamine peuvent être efficaces à long terme pour les patients chez qui la douleur s’est installée depuis peu de temps11,14.
Noppers et coll. ont analysé les résultats des études employant une dose de kétamine d’au moins 0,15 mg/kg. La majorité des essais révèlent une diminution de l’intensité douloureuse supérieure à 50 %, indépendamment de la dose, mais l’effet ne persiste pas au-delà de 48 heures après la fin de la perfusion d’une durée de 30 minutes à deux heures. Nous avons fait cette même observation auprès de plusieurs de nos patients malgré le fait que ce répit pharmacologique, aussi court soit-il, soit significatif pour la majorité d’entre eux. Les études révélant un soulagement supérieur ont utilisé un scénario de perfusion longue (perfusion continue pendant 4,2 jours; perfusion quotidienne de quatre heures pendant dix jours, vitesse de perfusion variant de 16 à 25 mg/h – certaines études révèlent des posologies plus élevées).
À la lumière de ces résultats, Noppers et coll. indiquent que la probabilité que l’effet analgésique dure plus de 48 heures avec une durée de perfusion de plus de dix heures est de 95 %. Cette probabilité monte à 99 % si la perfusion dure plus de 30 heures. Malheureusement, aucune étude n’a évalué les répercussions sur la fonctionnalité ou la qualité de vie4,14. Les publications laissent entendre qu’un apaisement de la douleur n’est pas nécessairement accompagné d’une amélioration de la fonctionnalité, alors que ceci est un but recherché pour nos malades5.
Le succès d’un relais par voie orale ou sublinguale est mal décrit, mais la réponse est également extrêmement variable. Le ratio de conversion pour effectuer le relais est aussi extrêmement variable. Pour une administration à long terme, le ratio de la voie parentérale varie de 1:1 à 1:5 où la dose par voie orale est la plus petite en raison de l’accumulation du métabolite actif (la biodisponibilité de la voie sublinguale – 40 % – est supérieure à celle de la voie orale – ~ 20 %). L’administration se fait en dose divisée. La préparation apothicaire sous forme de sirop, de pastilles-losanges ou de capsules pour ce mode de consommation est réalisée par le pharmacien. On peut également obtenir une forme buvable de kétamine en diluant le contenu des formes injectables dans un liquide sucré ou aromatisé comme un jus d’orange ou un cola8,11,14,17.
Les études préliminaires ainsi que plusieurs rapports de cas anecdotiques nous permettent d’observer que la kétamine apporte un bienfait et peut être une option intéressante pour le traitement de la dépression résistante aux traitements conventionnels (y compris les idées suicidaires). L’effet est percutant, robuste et immédiat (le bienfait apparaît parfois en une heure et perdure des semaines après l’administration). Cette qualité de la molécule pourrait donc exercer un double effet sur certains de nos patients3,5,17. Des études récentes ont montré qu’une seule perfusion de kétamine à la dose de 0,5 mg/kg réduisait les symptômes dépressifs et les idées suicidaires dans l’heure qui suivait la perfusion et que l’effet pouvait durer pendant trois à quatre jours chez des malades atteints de dépression profonde unipolaire ou bipolaire1,4.
Malgré le fait que la limite de la comparaison se bute à l’indication principale et au mode de perfusion, il est intéressant de constater que nos observations peuvent ressembler à l’expérience de certains de nos collègues européens. L’étude de Logerot et coll. relate l’expérience de l’efficacité et de l’innocuité sur le long terme d’un traitement hebdomadaire à la kétamine administrée par voie sous-cutanée en perfusion durant quelques heures en mode ambulatoire au domicile à des patients atteints de fibromyalgie (voie d’administration et indication non homologuées). Ces résultats d’une étude rétrospective révèlent que plus de 80 % des patients disent ressentir un bienfait qui a été consigné dans leur dossier, comme une efficacité globale (totale + partielle) satisfaisante. L’instauration du traitement est réalisée en milieu hospitalier avec une dose quotidienne de 50 mg par voie intraveineuse pendant cinq jours, suivie d’une dose de départ hebdomadaire de 50 mg par voie souscutanée à la maison. Les doses hebdomadaires semblent indépendantes de la durée du traitement, du sexe, de l’âge, du poids ou des autres pathologies potentiellement associées (corollaires impossibles à établir avec nos résultats, le protocole n’ayant pas été prévu pour cela). L’auteure soulève différentes questions intéressantes, notamment quant au schéma posologique et de surveillance1.
Les effets indésirables observés lors de notre collecte de données correspondent à ceux mentionnés dans la documentation scientifique18. Les effets centraux dissociatifs sont jugulés ou prévenus par l’administration prophylactique de midazolam. La fréquence et la gravité des effets psychomimétiques ne semblent pas corréler avec la dose. Au même titre que dans nos observations en clinique, Rouiller et coll. ont remarqué que ces effets secondaires surviennent avec d’autant plus d’acuité que le patient est anxieux et tendu17. Un agent agoniste des récepteurs alpha2-adrénergique, tel la clonidine ou un antipsychotique ou encore le recours à une perfusion prolongée, peut également être utile pour pallier ou juguler l’intensité de ce phénomène14. Quelques cas de toxicité hépatique et d’atteintes réversibles des voies biliaires ont été cités dans la documentation scientifique et, en conséquence, le suivi du bilan hépatique de nos malades est réalisé de façon épisodique, mais non systématique19,20. Les patients sont également questionnés pour révéler à l’anamnèse s’il y a présence d’un malaise urinaire et ainsi prévenir une complication rare de la kétamine (notification de cystite interstitielle liée le plus souvent à des doses élevées). Par ailleurs, les effets centraux, dont les risques délétères sur la mémoire (surtout la mémoire du travail et d’encodage de l’information) et sur le jugement à long terme, sont mal étayés et contradictoires, mais restent une préoccupation constante pour nos patients qui reçoivent un traitement de longue durée3,5,11,14.
La lidocaïne altère le potentiel de conductance cationique transmembranaire des neurones et des myocytes. Les canaux sodiques dépendants du voltage représentent la cible classique du médicament, mais plusieurs mécanismes ont été cités. Le médicament favorise une réduction des phénomènes de wind-up (emballement, hypersensibilité) des potentiels d’action au niveau spinal et donc une répression de l’allodynie et de l’hyperalgésie, une réduction de la douleur spontanée et de la dysesthésie7,11,21–24,26,28,29.
À titre analgésique, la lidocaïne est employée le plus souvent pour soulager la douleur neuropathique (névralgie postherpétique, diabétique), la radiculopathie lombosacrée, l’arthrose, le syndrome douloureux régional complexe, la douleur nociceptive (postopératoire, notamment viscérale), les migraines réfractaires, la cystite interstitielle (instillation), la fibromyalgie, la douleur fantôme, la douleur à la suite d’un accident vasculaire cérébral, la douleur post-trauma, une lésion spinale et la douleur liée au cancer.
Son efficacité comme analgésique pour soulager la douleur somatique ou viscérale nociceptive ou la douleur neuropathique est décrite et appuyée par de multiples études publiées depuis les années 1960 (y compris des études contrôlées et des méta-analyses)21–28.
La réponse clinique varie avec la condition neurologique, musculosquelettique ou viscérale à traiter, mais les douleurs neuropathiques qui comportent une composante périphérique (diabétique, post-trauma et notamment s’il y a un névrome organisé) sont plus sensibles au soulagement que, par exemple, les douleurs centrales ou celles dont les causes sont imprécises. Pour une même affection, deux patients ayant les mêmes caractéristiques pourront exprimer une réponse différente. Certains patients aux prises avec une douleur neuropathique résistante à tout traitement peuvent obtenir un apaisement important de la douleur pendant une durée allant jusqu’à plusieurs semaines11,21,25–27.
Les voies d’administration possibles sont multiples alors que les perfusions intraveineuses de courte durée précédées ou non d’un bolus sont d’actualité pour la douleur chronique non liée au cancer (3 à 5 mg/kg en 30 à 60 minutes; des doses plus élevées ont été rapportées – il existe une relation d’efficacité dose-réponse et concentration-réponse)11,21. Les modes d’administration comprennent : la voie intraveineuse bolus unique, intermittente, intraveineuse en perfusion courte (+/− bolus initial), intraveineuse ou sous-cutanée en perfusion continue, anesthésie par bloc nerveux, anesthésie régionale, la voie topique (timbre, pommade) ou la voie intranasale22,24,26,27.
La plupart des études évoquant les concentrations plasmatiques mentionnent une efficacité analgésique à des valeurs cibles entre 2 et 5 μg/mL. Des valeurs plus élevées sans signe de toxicité ou sans séquelles ont également été publiées11,24. Notre mode de pratique pour une perfusion unique exclut le suivi de la concentration plasmatique. L’expérience clinique et un suivi étroit pour reconnaître les signes annonciateurs d’une toxicité à la lidocaïne sont des incontournables pour ces cas (il n’y a parfois pas de gradation dans la manifestation des effets graves). En cas de suspicion de toxicité, la modification ou l’arrêt de la perfusion est impératif. Il n’est pas très pertinent d’expédier un échantillon dans un centre qui effectue le dosage, si ce n’est pour confirmer cette toxicité a posteriori, puisque les résultats reviennent plusieurs jours après l’envoi du spécimen.
Le début de l’activité pharmacologique est rapide et se manifeste pendant la perfusion, en quelques minutes, ou rapidement après celle-ci. Il existe peu d’information sur la durée de cet effet à l’exclusion des rapports anecdotiques relatés et de l’expérience au quotidien (de quelques minutes à plusieurs semaines de soulagement). Il n’est pas clair qu’une réponse favorable à la perfusion de lidocaïne puisse prédire un effet à long terme d’un relais avec un agent par voie orale à l’aide de son congénère la mexilétine (souvent mal tolérée), et cela bien que cette dernière possède également des vertus analgésiques. On connaît peu de choses sur une efficacité des perfusions répétées à la fin du soulagement. Les associations kétamine-lidocaïne ne sont pas relatées dans la documentation scientifique malgré l’intérêt de cette combinaison et le fait qu’en thérapeutique on retrouve un tel agencement des molécules par voie orale (p. ex. : kétamine par voie orale, lidocaïne en perfusion intermittente ou antiarythmique par voie orale à visée analgésique) et par voie topique (pommade lidocaïne et kétamine)11,21,24,26–30.
Les effets indésirables observés lors de notre collecte de données correspondent à ceux que l’on retrouve dans la documentation scientifique et à ce que l’on connaît de la molécule. L’unique situation de désaturation, même sans conséquence grave, est tout de même un événement sentinelle qui nous dicte la prudence et une extrême vigilance lors de traitements qui associent plusieurs molécules pour une population qui présente des facteurs de risque7,11,28,29.
Notre travail comporte certaines limites dans la mesure où il s’agit d’une collecte de données rétrospective et plusieurs informations sont ainsi incomplètes ou absentes. Les mesures peuvent être partiellement faussées parce qu’elles sont en partie subjectives (soulagement de la douleur, durée du soulagement, effets indésirables, interprétation du patient, du soignant). L’influence des changements apportés au régime thérapeutique (pharmacologiques et non pharmacologiques) sur la réponse globale n’a pu être décrite et peut très certainement influencer ces résultats. Finalement, la taille de l’échantillon est limitée et ceci a mis un frein à la possibilité de différencier la réponse en fonction du type d’algie.
Les perfusions de lidocaïne et de kétamine, administrées en milieu protégé, peuvent être des solutions intermédiaires ou de dernière ligne face à une douleur réfractaire aux traitements conventionnels ou lorsque les soins conventionnels sont contre-indiqués. Dans de nombreux cas, l’apaisement de la douleur est cliniquement significatif, mais de courte durée. Nous avons décrit notre expérience afin de valider nos habitudes et de les comparer à celles rapportées dans la documentation scientifique, d’observer notre procédure de façon rétrospective afin d’améliorer la qualité de nos interventions, de confirmer la réponse clinique chez nos malades, de vérifier la pertinence de nos gestes et d’accomplir le transfert de connaissances. Cette révision nous a permis de proposer des changements bénéfiques dans la standardisation de notre protocole ainsi que dans l’évaluation systématique de la douleur.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Logerot S, Baudrant-Boga M, Lehmann A, Schir E, Dumolard A, Alibeu JP et coll. Prise en charge ambulatoire des patients atteints de fibromyalgie par kétamine par voie sous-cutanée : que nous apprend la pratique ? Étude rétrospective observationnelle au CHU de Grenoble. Douleurs : Évaluation – Diagnostic – Traitement 2013;14:75–85.
2. Jouguelet-Lacoste J, La Colla L, Schilling D, Chelly JE. The use of intravenous infusion or single dose of low-dose ketamine for postoperative analgesia: a review of the current literature. Pain Med 2015;16:383–403.
3. Mion G, Villevieille T. Ketamine pharmacology: an update (pharmacodynamics and molecular aspects, recent findings). CNS Neurosci Ther 2013;19:370–80.
4. Wurtman RJ. Fibromyalgia and the complex regional pain syndrome: similarities in pathophysiology and treatment. Metabolism 2010;59(suppl.1):S37–S40.
5. Niesters M, Martini C, Dahan A. Ketamine for chronic pain: risks and benefits. Br J Clin Pharmacol 2014;77:357–67.

6. Chauvin M. La kétamine dans la douleur aiguë : de la pharmacologie à la clinique. Réanimation 2005;14:686–91.
7. Kosharskyy B, Almonte W, Shaparin N, Pappagallo M, Smith H. Intravenous infusions in chronic pain management. Pain Physician 2013; 16:231–49.
8. Centre hospitalier de l’Université de Montréal. La perfusion de kétamine. [en ligne] http://www.chumontreal.qc.ca/perfusion-de-ketamine (site visité le 25 mai 2017).
9. Zekry O, Gibson SB, Aggarwal A. Subanesthetic, subcutaneous ketamine infusion therapy in the treatment of chronic nonmalignant pain. J Pain Palliat Care Pharmacother 2016;30:91–8.
10. Guignard B. Kétamine, quelle place, quelles indications, quelles limites ? Évaluation et traitement de la douleur 2006, p. 629–638. [en ligne] http://jpmiss2.free.fr/Divers/SFAR_2006/dou06/html/d06_02/dou06_02.htm (site visité le 2 septembre 2016).
11. Shanthanna H, 2012. Intravenous therapies in the management of neuropathic pain: a review on the use of ketamine and lidocaine in chronic pain management. [en ligne] http://cdn.intechopen.com/pdfs/34029.pdf (site visité le 26 août 2016).
12. Patil S, Anitescu M. Efficacy of outpatient ketamine infusions in refractory chronic pain syndromes: a 5-year retrospective analysis. Pain Med 2012;13:263–9.
13. Domino EF. Taming the ketamine tiger. Anesthesiology 2010;113:678–84.
14. Noppers I, Niesters M, Aarts L, Smith T, Sarton E, Dahan A. Ketamine for the treatment of chronic non-cancer pain. Expert Opin Pharmacother 2010;11:2417–29.
15. Schwartzman RJ, Alexander GM, Grothusen JR. The use of ketamine in complex regional pain syndrome: possible mechanisms. Expert Rev Neurother 2011;11:719–34.
16. Dahan A, Olofsen E, Sigtermans M, Noppers I, Niesters M, Aarts L et coll. Population pharmacokinetic–pharmacodynamic modeling of ketamine-induced pain relief of chronic pain. Eur J Pain 2011; 15:258–67.
17. Rouiller F. Kétamine et soins palliatifs. InfoKara 2008; 23:91–5.
18. Cvrcek P. Side effects of ketamine in the long-term treatment of neuropathic pain. Pain Med 2008;9:253–7.
19. Noppers IM, Niesters M, Aarts LP, Bauer MC, Drewes AM, Dahan A et coll. Drug-induced liver injury following a repeated course of ketamine treatment for chronic pain in CRPS type 1 patients: a report of 3 cases. Pain 2011; 152:2173–8.
20. Gutkin E, Hussain SA, Kim SH. Ketamine-induced biliary dilatation. From Hong Kong to New York. J Addict Med 2012;6:89–91.
21. de Souza MF, Kraychete DC. The analgesic effect of intravenous lidocaine in the treatment of chronic pain: a literature review. Rev Bras Reumatol 2014;54:386–92.
22. Olivier M, Dolsan A, Brunel C, Durrieu MC, Quintard M. Utilisation de la lidocaïne pour les douleurs cancéreuses complexes. Douleurs : Évaluation – Diagnostic – Traitement 2015; 16:99–102.
23. Joris J. La lidocaïne par voie intraveineuse. MAPAR 2008; 465–70. [en ligne] www.mapar.org/article/pdf (site visité le 8 décembre 2016).
24. Rickard JP, Kish T. Systemic intravenous lidocaine for the treatment of complex regional pain syndrome: a case report and literature review. Am J Ther 2016;23:e1266–9.
25. Stavropoulou E, Argyra E, Zis P, Vadalouca A, Siafaka I. The effect of intravenous lidocaine on trigeminal neuralgia: a randomized double blind placebo controlled trial. ISRN Pain 2014; 2014:853826.

26. Ferrini R, Paice JA. How to initiate and monitor infusional lidocaine for severe and/or neuropathic pain. J Support Oncol 2004;2:90–4.
27. Peixoto RD, Hawley P. Intravenous lidocaine for cancer pain without electrocardiographic monitoring: a retrospective review. J Palliative Med 2015;18:373–7.
28. Przeklasa-Muszynskaa A, Kocot-Kepska M, Dobrogowski J, Wiatr M, Mika J. Intravenous lidocaine infusions in a multidirectional model of treatment of neuropathic pain patients. Pharmacol Rep 2016;68:1069–75.
29. Marmura MJ. Intravenous lidocaine and mexiletine in the management of trigeminal autonomic cephalalgias. Curr Pain Headache Rep 2010;14:145–50.
30. Mailis A, Taenzer P. Evidence-based guideline for neuropathic pain interventional treatments: spinal cord stimulation, intravenous infusions, epidural injections and nerve blocks. Pain Res Manag 2012;17:150–8.

PHARMACTUEL, Vol. 50, No. 4, 2017