
Catherine Pagé Béchard1,2,3, Pharm.D., M.Sc., Sophie Lachapelle1,4,5, Pharm.D., M.Sc., Véronique Bédard1,6,7, Pharm.D., M.Sc.
Reçu le 18 juillet 2017: Accepté après révision par les pairs le 26 février 2018
Titre : Sex and race differences in the association between statin use and the incidence of Alzheimer disease. JAMA Neurol 2017;74:225-321.
Auteurs : Zissimopoulos JM, Barthold D, Brinton RD, Joyce G
Commanditaires : L’étude a été financée par le National Institute on Aging du National Institutes of Health ainsi que par le fonds de recherche Zumberge de l’University of Southern California. Les sources de financement n’ont joué aucun rôle dans la conception et le déroulement de l’étude ou l’interprétation des résultats.
Cadre de l’étude : Les statines font partie des classes de médicaments les plus prescrites au Canada2. Les données probantes appuyant leur utilisation en prévention secondaire des maladies cardiovasculaires et leur profil d’innocuité favorable font des statines des agents grandement utilisés. Leur mécanisme d’action principal est la diminution des lipoprotéines de basse densité et de l’apolipoprotéine B par l’inhibition de l’enzyme 3-hydroxy-3-methylglutaryl coenzyme A réductase. D’autres effets des statines, tels que l’augmentation des lipoprotéines de haute densité et la diminution du stress oxydatif grâce à des propriétés pléiotropes, pourraient également expliquer l’efficacité de ces molécules3. Des spécialistes ont émis l’hypothèse qu’un lien existerait entre un niveau élevé de cholestérol total et la formation de plaques amyloïdes associées à la maladie d’Alzheimer4. Des études à répartition aléatoire et observationnelles ont tenté d’évaluer cette hypothèse; certaines ont démontré un effet préventif des statines sur la démence, alors que d’autres ont révélé un effet plutôt neutre ou négatif5–9. Une récente revue systématique Cochrane a exposé des données probantes de bonne qualité soutenant que la prise de statines à un âge avancé n’avait démontré aucune vertu préventive de la démence10. D’autre part, le fardeau financier est non négligeable; les coûts engendrés par la maladie d’Alzheimer et les troubles cognitifs connexes pourraient s’élever jusqu’à 153 milliards de dollars en 2038 au Canada11. Le but des auteurs de l’étude analysée ici était de comparer les taux de diagnostics d’Alzheimer selon une exposition élevée ou faible aux statines et possiblement de déterminer les caractéristiques des patients qui bénéficieraient du traitement.
Protocole de recherche : Il s’agit d’une étude observationnelle rétrospective qui s’est déroulée de 2006 à 2013. La collecte d’information a été effectuée à partir des réclamations administratives d’un échantillon de 20 % de bénéficiaires du programme Medicare aux États-Unis. Le but était de comparer le taux de diagnostics d’Alzheimer entre des patients intensément et faiblement exposés aux statines. La période d’exposition s’est étendue de 2006 à 2008 et les diagnostics ont été évalués de 2009 à 2013. L’étude a été approuvée par les comités de révision de l’University of Southern California et du National Bureau of Economic Research. Un modèle de risques proportionnels de Cox a été utilisé dans le but d’établir la relation entre l’utilisation de statines et les diagnostics d’Alzheimer. Des courbes de Kaplan-Meier ainsi que des modèles de résidus de Schoenfeld ont également été utilisés. Les analyses statistiques effectuées selon la méthode d’appariement Coarsened Exact Matching ont tenté de contrôler les variables potentiellement confondantes pouvant être présentes de façon inégale entre les groupes exposés faiblement et fortement aux statines uniquement pour l’analyse des objectifs secondaires. Les variables utilisées étaient l’âge, le sexe, l’ethnie, la région, les années depuis le diagnostic de dyslipidémie, le niveau d’éducation et l’état de santé. Les analyses ont été effectuées sur la cohorte entière et répétées en fonction des variables suivantes : sexe et ethnicité.
Patients : Les patients ont été sélectionnés à partir des services de statines (simvastatine, atorvastatine, fluvastatine, lovastatine, pitavastatine, pravastatine et rosuvastatine) entre 2006 et 2012. En janvier 2006, ils devaient avoir atteint au moins 65 ans, avoir reçu un diagnostic d’hyperlipidémie et bénéficier du programme Medicare depuis au moins deux ans au moment de l’inclusion. Aucune précision n’était apportée quant à la façon dont l’échantillon de 20 % des bénéficiaires du programme avait été choisi. Les non-utilisateurs de statines étaient exclus, de même que les patients ayant reçu un diagnostic de maladie d’Alzheimer avant 2009. Les patients devaient être des « utilisateurs de statines », dénomination désignant ceux qui avaient reçu au moins deux ordonnances de statines entre 2006 et 2012.
Interventions : L’intervention étudiée concernait l’exposition à une statine, laquelle était classée en deux catégories, soit une exposition élevée ou faible. Un participant se situait dans la catégorie élevée si le nombre de jours de service de statines, pendant deux des trois années suivantes, soit 2006, 2007 ou 2008, équivalait au moins au 50e percentile du nombre de jours de statines renouvelées. Le nombre de jours correspondant au 50e percentile n’était pas explicité dans l’étude. Les individus ayant fait une utilisation de statine inférieure au 50e percentile étaient classés dans la catégorie de faible utilisation. Les auteurs ont précisé que le niveau d’exposition, qu’il soit faible ou élevé, variait peu entre les périodes d’évaluation de l’objectif clinique principal, soit de 2006 à 2008 et de 2009 à 2013. L’exposition aux quatre statines les plus utilisées, c’est-à-dire la simvastatine, l’atorvastatine, la pravastatine et la rosuvastatine, a été évaluée de façon indépendante.
Points évalués : L’objectif principal de l’étude visait à mesurer la différence entre l’incidence de maladie d’Alzheimer selon l’importance de l’exposition à une statine (élevée ou faible). La variable permettant de mesurer l’objectif était un diagnostic de maladie d’Alzheimer à deux reprises entre 2009 et 2013. Cette donnée était déterminée par la présence du code 331.0 de la neuvième édition de l’International classification of diseases12. Les objectifs secondaires visaient à évaluer l’association entre le degré d’exposition aux statines et la maladie d’Alzheimer selon le sexe, l’ethnie et le type de statine utilisée.
Résultats : La sélection initiale de l’échantillon de 20 % des bénéficiaires de Medicare a permis d’identifier 2 666 059 participants. De ceux-ci, près de 46 % ont été exclus sur la base du critère de non-utilisation de statines. Un autre 44 % a été exclu en raison de la présence d’une démence de type Alzheimer. Au final, la population à l’étude correspondait à 399 979 hommes ou femmes de différentes ethnies utilisant une statine. Les seules caractéristiques disponibles des patients selon leur degré d’exposition aux statines sont présentées au tableau I. Les femmes sont représentées en plus grande proportion (64,2 %) et la moyenne d’âge des participants était de 75,9 ans, avec une différence entre les deux groupes de 0,6 an. La grande majorité des personnes était d’origine caucasienne (77,6 %), suivies des Hispaniques (8,2 %), des Noirs (8,1 %) et d’autres ethnies (6,2 %). Quant aux comorbidités présentées, on remarque que dans le groupe fortement exposé aux statines, la proportion de troubles cardiovasculaires était légèrement supérieure. La simvastatine était la molécule la plus utilisée (62 % des femmes et 61 % des hommes). Le nombre de jours d’exposition à une statine était en moyenne de 278 jours par année pour l’ensemble des patients. Il est important de noter que cette valeur était plus faible chez les Hispaniques (254 jours pour les deux sexes) et les Noirs (255 jours pour les femmes et 254 jours pour les hommes) que chez les Blancs (282 jours pour les femmes et 284 jours pour les hommes). Les auteurs ont présenté peu de caractéristiques des patients en fonction des deux groupes d’exposition évalués. Ainsi, il est difficile de déterminer le degré de similarité entre ces groupes, malgré le fait que les auteurs attestent cette similarité.
Tableau I Caractéristiques des patients à l’étude
Entre 2009 et 2013, l’incidence annuelle de démence de type Alzheimer rapportée dans la population à l’étude était de 1,72 % chez les femmes et 1,32 % chez les hommes. Ce taux d’incidence est plus faible chez les Caucasiens et les autres ethnies, alors qu’il était plus élevé dans la population noire et hispanique, tel que le démontre le tableau II.
Tableau II Principaux résultats de l’incidence de la maladie d’Alzheimer selon le sexe et l’ethniea
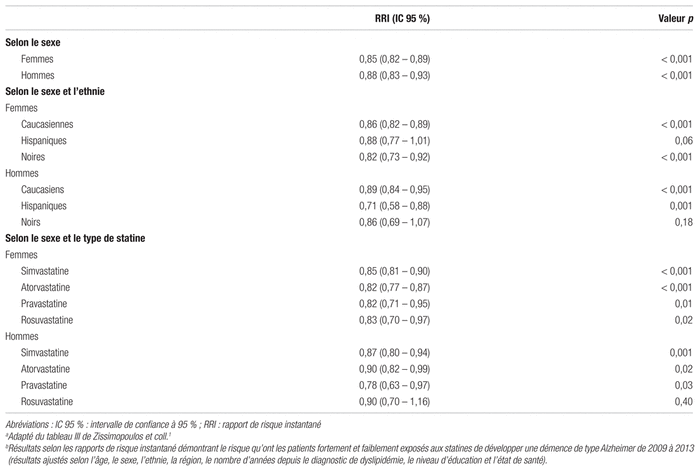
Le résultat de l’analyse non ajustée de l’objectif principal a montré qu’une forte exposition à une statine de 2006 à 2008 a engendré une réduction du risque de développer la maladie d’Alzheimer de 10 % dans les cinq années suivantes, comparativement aux personnes moins exposées aux statines. La différence ajustée de l’incidence de maladie d’Alzheimer parmi les patients fortement exposés aux statines par rapport à ceux faiblement exposés dans la cohorte entière n’est pas rapportée de façon précise. Les résultats ajustés rapportent que chez les femmes, une exposition forte à une statine est associée à une diminution de 15 % du risque d’avoir un diagnostic de maladie d’Alzheimer par rapport à une exposition faible (rapport de risque instantané [RRI] : 0,85; intervalle de confiance à 95 % [IC 95 %] : 0,82–0,89, p < 0,001). Une diminution de ce risque de l’ordre de 12 % a été constatée chez les hommes (RRI : 0,88; IC 95 % : 0,83–0,93, p < 0,001) et ce risque variait selon l’ethnie. Les principaux résultats des objectifs secondaires de l’étude sont présentés au tableau III.
L’étude réalisée par les épidémiologistes Zissimopoulos et collaborateurs a tenté de préciser l’association entre l’exposition élevée à une statine et la réduction du risque d’avoir un diagnostic d’Alzheimer. La relation biologique rationnelle entre le franchissement de la barrière hématoencéphalique par les statines selon leur lipophilie et leur effet respectif sur le cholestérol et donc sur les plaques amyloïdes s’avère être le pilier justifiant l’intérêt porté à ce sujet3. À notre connaissance, cette étude est la seule à ce jour à évaluer la diminution de l’incidence de la maladie d’Alzheimer selon l’exposition à différentes statines des personnes d’ethnie et de sexe différents.
Les résultats démontrent un effet statistiquement significatif d’une exposition élevée à la simvastatine, à l’atorvastatine et à la pravastatine sur la diminution de l’incidence de la maladie d’Alzheimer dans l’ensemble des patients étudiés et à la rosuvastatine chez les femmes. Toutes les ethnies ont pu bénéficier de l’exposition élevée à une statine sur l’incidence d’Alzheimer, sauf les hommes noirs et les femmes hispaniques. Ces résultats s’avèrent toutefois discutables compte tenu de plusieurs faiblesses méthodologiques.
Mentionnons d’abord les points forts de l’étude. La question de recherche était clairement libellée et pertinente vu la controverse entourant l’effet des statines pour la prévention de la maladie d’Alzheimer, basée sur les précédentes études observationnelles et à répartition aléatoire5–9. La taille de l’échantillon de la cohorte proche des 400 000 patients est une force importante de l’étude. L’objectif clinique principal a été mesuré à l’aide de la neuvième révision du système de codification de la Classification statistique internationale des maladies et des problèmes de santé connexes12. Cet outil semble approprié vu sa haute sensibilité et sa spécificité pour déterminer les diagnostics de démence12,13. Par ailleurs, toute préoccupation d’ordre éthique, tant sur le plan du financement que des conflits d’intérêts, peut être écartée.
Au sujet des points faibles, une attention particulière doit être portée à la méthode de sélection des patients. Les auteurs ont mentionné dans la discussion que l’hyperlipidémie justifiait la prise de statine par les patients. Toutefois, ce critère d’inclusion n’a pas été explicitement mentionné dans la méthodologie de l’étude. On constate donc un biais d’admission puisque, par rapport à la population source, la probabilité que ces patients soient atteints de la maladie d’Alzheimer est plus forte, compte tenu des données probantes qui disent que des niveaux élevés de cholestérol sont associés à un risque plus élevé de démence Alzheimer14. D’ailleurs, les résultats laissent présumer que les patients de la population source couraient un risque de base plus élevé de développer la maladie que la population en général. En effet, l’exclusion d’environ 40 % des patients de l’étude en raison d’un diagnostic préexistant de maladie d’Alzheimer diffère grandement de la prévalence de maladie d’Alzheimer qui s’avère être de 10 % dans la population américaine âgée d’au moins 65 ans15.
Ensuite, la définition du degré d’exposition soulève quelques interrogations. La définition de faible exposition pouvait inclure des patients ayant régulièrement pris une statine, c’est-à-dire qu’ils remplissaient les mêmes critères que les patients soumis à une exposition élevée, mais après 2008, de même que d’autres n’ayant pris qu’un minimum de statines, soit deux services au cours des années 2006 à 2012. Ainsi, si un patient développe la maladie d’Alzheimer après la même durée totale d’exposition à une statine, mais qu’il est classé dans un groupe différent simplement en raison du moment de l’exposition, ceci entraîne un biais de temps immortel. L’un des biais majeurs est celui de la performance en raison du croisement des groupes, puisque des patients ont pu être exposés à différentes statines durant la période de temps étudiée et ainsi être analysés dans plusieurs groupes différents. Ceci engendre un nombre beaucoup plus important d’expositions que le nombre de patients à l’étude, ce qui augmente la possibilité d’obtenir un résultat significatif dans l’analyse des données. Dans ce cas, les résultats significatifs concernant la simvastatine et l’atorvastatine peuvent faire penser à une efficacité supérieure des statines lipophiles comparativement aux statines hydrophiles. Toutefois, la différence importante entre le nombre de patients inclus dans les groupes (444 134 patients pour les molécules lipophiles et 142 974 patients pour les molécules hydrophiles) limite l’interprétation de l’effet. Il est fort probable que la taille de l’échantillon des utilisateurs de molécules hydrophiles n’était pas suffisante pour permettre de démontrer un résultat statistiquement significatif et de généraliser les résultats de l’étude. De plus, la dose de statine utilisée n’a pas fait l’objet de cette recherche. Il s’agit cependant d’une variable confondante pour laquelle le manque d’information pourrait introduire un biais d’information. Le nombre de visites chez le médecin est également une variable pouvant introduire un biais de constatation de l’exposition, compte tenu du diagnostic de la maladie d’Alzheimer qui doit être fait par un professionnel de la santé expérimenté. Les patients plus fidèles à leur traitement à la statine pourraient être moins malades et donc avoir moins besoin de consulter le médecin. Il est aussi possible qu’un ou plusieurs patients aient passé de l’assurance Medicare à une assurance privée, ce qui aurait causé une perte au suivi par l’impossibilité de retrouver le diagnostic de la maladie d’Alzheimer. Ce problème administratif potentiel n’a pas été pris en compte dans l’étude. En outre, un biais de rapport des résultats est reconnaissable, puisque les auteurs associent l’incidence supérieure de la maladie d’Alzheimer observée chez les Noirs et les Hispaniques à leur plus faible statut d’exposition aux statines. Le lecteur doit être vigilant, car la fréquence de la maladie d’Alzheimer chez les Noirs et les Hispaniques aux États-Unis est reconnue comme étant d’emblée plus élevée par rapport au reste de la population ayant atteint ou dépassé 65 ans15.
Du point de la relation biologique rationnelle, les plaques amyloïdes associées à la maladie d’Alzheimer se forment sur une période de temps prolongée. La mesure de l’exposition aux statines proche du développement de la maladie limite les conclusions qui pourraient être tirées de l’effet de cette classe de médicaments sur l’incidence de la maladie d’Alzheimer. Une exposition cumulative sur plusieurs années, donc une mesure plus tardive des résultats, aurait probablement été plus appropriée. Le recueil des taux de cholestérol sanguins aurait également permis d’appuyer l’hypothèse du mécanisme d’action des statines sur la formation des plaques amyloïdes.
Au sujet de l’analyse statistique, une critique peut être émise à l’égard de l’utilisation de la méthode d’appariement Coarsened Exact Matching. Comparativement au score de propension, ce test permet un ajustement des résultats plus facile et rapide, ce qui peut en affecter la validité16. De plus, pour améliorer la validité des résultats obtenus par les analyses statistiques effectuées, les auteurs ont inclus certaines variables potentiellement confondantes dans l’analyse. Toutefois, la collecte d’information au moyen d’une base de données administrative peut tout de même limiter l’accès à certaines des caractéristiques qui pourraient influencer l’effet du traitement sur l’incidence de la maladie d’Alzheimer. Ainsi, certains facteurs de risque reconnus par la Société Alzheimer du Canada n’ont pas été pris en compte dans les analyses. On cite notamment les antécédents familiaux ou génétiques de démence, la présence du gène ApoE4, les antécédents personnels de maladies neurologiques et de traumatisme crânien11. Le stade de la maladie au moment de son diagnostic et les autres traitements hypolipémiants n’ont pas été précisés. Ces informations auraient permis de mieux qualifier la population à l’étude et auraient été intéressantes pour évaluer la validité externe. D’autre part, il est important de noter que le changement de la statine que prend le patient est une variable confondante pouvant varier dans le temps, qui n’a pas été prise en compte dans les analyses statistiques. Un calcul de taille d’échantillon aurait aussi été souhaitable pour l’évaluation de l’atteinte de la puissance statistique, quoique l’obtention de résultats statistiquement significatifs avec la faible différence observée dans les incidences rapportées fait penser que l’échantillon était de taille suffisante.
Enfin, compte tenu de ces biais majeurs, on ne peut conclure qu’une statine en particulier ait un effet protecteur sur la maladie d’Alzheimer. L’impossibilité d’établir de comparaison entre les caractéristiques du groupe fortement exposé et celui faiblement exposé ne permet pas de conclure que les groupes étaient semblables et que la différence observée dans l’incidence de la maladie d’Alzheimer peut s’expliquer par une exposition plus importante aux statines. Cette étude n’apporte pas de données probantes suffisamment convaincantes pour justifier une modification des pratiques actuelles des soins pharmaceutiques en matière de prévention de la démence.
Les résultats obtenus confirment les données de la littérature sur le sujet, qui remontent au début des années 2000. À ce moment-là, une étude de cohorte a observé une réduction de la prévalence de la maladie d’Alzheimer de près de 70 % chez les patients utilisateurs d’une statine17. À la même période, une étude cas-témoins avait démontré une diminution de 71 % du risque relatif de recevoir un diagnostic de démence de type Alzheimer par les patients utilisateurs d’une statine18. Par la suite, trois revues systématiques portant principalement sur ces deux études ainsi que les études observationnelles subséquentes n’ont pu montrer qu’un faible avantage, voire un effet presque nul, sur la prévention à long terme19–21. Les auteurs ont rapporté que ces études étaient sujettes à plusieurs biais, dont celui d’indication, puisque les statines étaient prescrites pour une condition intimement liée au risque de développer une démence de type Alzheimer, par exemple à la suite d’un événement cardiovasculaire14. Ils notent également l’hétérogénéité non négligeable entre les études. En conséquence, la méta-analyse de Cochrane citée plus haut n’a choisi d’inclure que des études à répartition aléatoire et contrôlées par placebo qui étudiaient la prise de statine à long terme par une population exposée à un risque de démence10. En s’appuyant sur les données fournies par les deux plus grosses études, le groupe a conclu que les données probantes ne démontraient pas d’effet préventif de la prise de statines sur la détérioration de la fonction cognitive. De façon générale, les études à répartition aléatoire contrôlées exclues de cette méta-analyse ne montraient pas non plus d’effet protecteur des statines sur la démence5–9.
Donc, les résultats de l’étude observationnelle de Zissimopoulos et de ses collaborateurs abondent dans le même sens que les connaissances précédentes sur le sujet. Les études à répartition aléatoire n’ont pas démontré d’avantages des statines sur la prévention de la maladie d’Alzheimer. Les études observationnelles démontrant des avantages étaient sujettes à de nombreux biais, tout comme celle de Zissimopoulos et de ses collaborateurs.
L’étude a tenté de mettre en évidence la différence entre le statut d’exposition aux statines et leur effet respectif sur l’incidence de la maladie d’Alzheimer selon le sexe et l’ethnie des patients. En raison des limites soulevées, on ne peut pas conclure à un effet protecteur supérieur de l’exposition élevée à une statine par rapport à une exposition faible sur la prévention de la démence de type Alzheimer. Il faudrait d’abord qu’une étude observationnelle de grande envergure démontre de façon plus convaincante que des caractéristiques préventives existent pour qu’une évaluation des différences entre les types de statines puisse avoir une portée clinique pertinente. Il serait également intéressant que de futures études prospectives se penchent sur les effets protecteurs des statines en prévention primaire de la maladie d’Alzheimer.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique du programme de maîtrise en pharmacothérapie avancée de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables et collaborateurs ainsi que Mme Isabelle Racine, pharmacienne au Centre intégré de santé et de services sociaux de Laval, pour son aide dans la révision du manuscrit. Une autorisation écrite a été obtenue de ces personnes.
1. Zissimopoulos JM, Barthold D, Brinton RD, Joyce G. Sex and race differences in the association between statin use and the incidence of Alzheimer disease. JAMA Neurol 2017;74:225–32.
2. Statistique Canada. Consommation de médicaments sur ordonnance chez les Canadiens de 6 à 79 ans. [en ligne] http://www.statcan.gc.ca/pub/82-003-x/2014006/article/14032-fra.pdf (site visité le 19 mars 2017).
3. Barone E, Domenico FD, Butterfield DA. Statins more than cholesterol lowering agents in Alzheimer disease: their pleiotropic functions as potential therapeutic targets. Biochemical pharmacology. 2014;88:605–16.
4. Kivipelto M, Solomon A. Cholesterol as a risk factor for Alzheimer’s disease - epidemiological evidence. Acta Neurol Scand Suppl 2006;185:50–7.
5. Heart protection study collaborative group. MRC/BHF Heart protection study of cholesterol lowering with simvastatin in 20,536 high-risk individuals: A randomised placebo-controlled trial. Lancet 2002;360:7–22.
6. Sano M, Bell KL, Galasko D, Galvin JE, Thomas RG, van Dyck CH et coll. A randomized, double-blind, placebo-controlled trial of simvastatin to treat Alzheimer disease. Neurology 2011;77:556–63.
7. Feldman HH, Doody RS, Kivipelto M, Sparks DL, Waters DD, Jones RW et coll. Randomized controlled trial of atorvastatin in mild to moderate Alzheimer disease: LEADe. Neurology 2010; 74:956–64.
8. Sparks DL, Kryscio RJ, Sabbagh MN, Connor DJ, Sparks LM, Liebsack C. Reduced risk of incident ad with elective statin use in a clinical trial cohort. Curr Alzheimer Res 2008;5:416–21.
9. Simons M, Schwarzler F, Lutjohann D, von Bergmann K, Beyreuther K, Dichgans J et coll. Treatment with simvastatin in normocholesterolemic patients with Alzheimer’s disease: A 26-week randomized, placebo-controlled, double-blind trial. Ann Neurol 2002;52:346–50.
10. McGuinness B, Craig D, Bullock R, Passmore P. Statins for the prevention of dementia. The Cochrane database of systematic review 2016;Cd003160.
11. Société Alzheimer du Canada 2010. Raz-demarée : Impact de la maladie d’Alzheimer et des affections connexes au Canada. [en ligne] http://www.alzheimer.ca/~/media/Files/national/Advocacy/ASC_Rising_Tide_Exec_summary_f.pdf (site visité le 19 mars 2017).
12. World health organization. Classification of diseases (ICD). [en ligne] http://www.who.int/classifications/icd/en/ (site visité le 15 juin 2017).
13. Quan H, Li B, Saunders LD, Parsons GA, Nilsson CI, Alibhai A et coll. Assessing validity of ICD-9-CM and ICD-10 administrative data in recording clinical conditions in a unique dually coded database. Health Serv Res 2008;43:1424–41.
14. Patterson C, Feightner JW, Garcia A, Hsiung GY, MacKnight C, Sadovnick AD. Diagnosis and treatment of dementia: 1. Risk assessment and primary prevention of Alzheimer disease. CMAJ 2008;178:548–56.
15. Alzheimer’s association. 2017 Alzheimer’s disease facts and figures. Alzheimers Dement 2017;13:325–73.
16. Iacus S, King G, Porro G. Causal inference without balance checking: Coarsened exact matching. Political Analysis 2012;20:1–24.
17. Wolozin B, Kellman W, Ruosseau P, Celesia GG, Siegel G. Decreased prevalence of Alzheimer disease associated with 3-hydroxy-3-methyglutaryl coenzyme A reductase inhibitors. Arch Neurol 2000;57:1439–43.
18. Jick H, Zornberg GL, Jick SS, Seshadri S, Drachman DA. Statins and the risk of dementia. Lancet 2000;356:1627–31.
19. Song Y, Nie H, Xu Y, Zhang L, Wu Y. Association of statin use with risk of dementia: A metaanalysis of prospective cohort studies. Geriatr Gerontol Int 2013;13:817–24.
20. Wong WB, Lin VW, Boudreau D, Devine EB. Statins in the prevention of dementia and Alzheimer’s disease: A meta-analysis of observational studies and an assessment of confounding. Pharmacoepidemiol Drug Saf 2013;22:345–58.
21. Swiger KJ, Manalac RJ, Blumenthal RS, Blaha MJ, Martin SS. Statins and cognition: A systematic review and meta-analysis of short- and long-term cognitive effects. Mayo Clin Proc 2013;88:1213–21.
PHARMACTUEL, Vol. 51, No. 2, 2018