Vanessa King1,2, Pharm.D., M.Sc., Marianne Boulé1,3, Pharm.D., M.Sc., Frédéric Charpentier1,4, Pharm.D., M.Sc., Katia Handfield5,6, Pharm.D., M.Sc.
Reçu le 15 juillet 2017: Accepté après révision par les pairs le 2 mars 2018
Titre de l’article : Daratumumab, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016;375:1319-311.
Auteurs : Dimopoulos MA, Oriol A, Nahi H, San-Miguel J, Bahlis NJ, Usmani N et coll.
Commanditaires : L’étude est soutenue par Janssen Research and Development. Ce groupe est responsable d’établir le protocole de recherche de l’étude et de faire l’analyse statistique, plus spécifiquement en ce qui concerne la compilation et la gestion des données.
Cadre de l’étude : Le myélome multiple est un cancer caractérisé par la prolifération de plasmocytes malins dans la moelle osseuse2. Depuis le début des années 2010, la survie de ces patients s’est beaucoup améliorée avec l’introduction de nouveaux agents, soit la thalidomide, le lénalidomide et le bortézomib3. Toutefois, la survie médiane demeure nettement inférieure chez les patients présentant un risque élevé, stade III selon l’International staging system révisé (R-ISS), soit 43 mois comparativement à 83 mois ou plus chez les patients ayant un stade I ou II R-ISS4–6. Le daratumumab est un anticorps monoclonal agissant sur le récepteur CD38, une protéine exprimée fortement à la surface des plasmocytes7. Selon des études in vitro, il entraînerait la mort de ces cellules tumorales de plusieurs façons : en activant le complément, en engendrant une cytotoxicité à médiation cellulaire et une phagocytose des cellules exprimant le CD38 de même qu’en tant qu’immunomodulateur8.
Les études de phase II, SIRIUS et GEN501, ont démontré l’efficacité du daratumumab en monothérapie pour traiter le myélome multiple récidivant ou réfractaire des patients ayant déjà présenté un échec à au moins deux lignes de traitement9,10. Une cinquantaine d’études sont présentement en cours pour évaluer l’efficacité du daratumumab selon diverses combinaisons et lignes de traitement du myélome multiple11.
Dans le cadre de l’étude POLLUX, les chercheurs évaluent l’efficacité du daratumumab lorsqu’il est combiné au lénalidomide et à la dexaméthasone pour des patients ayant reçu antérieurement au moins une ligne de traitement. Les sujets du bras comparateur recevaient le doublet lénalidomide et dexaméthasone, une combinaison approuvée au Québec en deuxième intention pour les patients ne pouvant pas recevoir le bortézomib12,13.
Protocole de recherche : La publication est une analyse intermédiaire de l’étude ouverte, multicentrique et à répartition aléatoire de phase III menée auprès de patients atteints d’un myélome multiple récidivant, qui ont reçu antérieurement au moins une ligne de traitement. La répartition aléatoire dans les deux groupes parallèles a été faite selon un ratio 1:1 et stratifiée selon le nombre de lignes de traitement antérieures, le stade de la maladie et l’utilisation antérieure ou non de lénalidomide. L’étude a été approuvée par le comité d’éthique indépendant de chaque site avant son démarrage. Le recrutement s’est déroulé de juin 2014 à juillet 2015.
Patients : Les patients inclus dans l’étude devaient avoir reçu un diagnostic de myélome multiple, avoir vu progresser la maladie selon les critères de l’International Myeloma Working Group (IMWG) et avoir reçu au moins un traitement antérieur pour le myélome multiple auquel ils avaient initialement répondu. Les patients n’étaient pas admissibles s’ils avaient cessé de prendre le lénalidomide pour des effets secondaires dans le passé ou s’ils souffraient d’un myélome multiple réfractaire au lénalidomide, défini comme une progression dans les 60 jours après la prise de cet agent immunomodulateur ou l’absence d’une réponse minimale avec cet agent. Les patients présentant une neutropénie (neutrophiles inférieurs ou égaux à 1,0 × 109/L), une anémie (hémoglobine inférieure ou égale à 75 g/L) et une thrombopénie (plaquettes inférieures à 75 × 109/L) n’étaient également pas admissibles, de même que ceux présentant une atteinte hépatique (définie comme une valeur égale ou supérieure à 2,5 fois la limite supérieure de la normale pour l’aspartate transaminase, l’alanine transaminase ou la phosphatase alcaline ou à 1,5 fois la limite supérieure de la normale pour la bilirubine) et une insuffisance rénale (clairance de la créatinine inférieure à 30 mL/min).
Interventions : Le groupe témoin recevait le lénalidomide et la dexaméthasone alors que le groupe expérimental recevait en plus le daratumumab. Les patients recevaient le daratumumab à une dose de 16 mg/kg par voie intraveineuse, toutes les semaines pendant huit semaines (ce qui correspond aux cycles 1 et 2), puis toutes les deux semaines pendant 16 semaines (ce qui correspond aux cycles 3 à 6) et finalement toutes les quatre semaines. Les deux groupes de traitements recevaient le lénalidomide à une dose de 25 mg par voie orale du jour 1 à 21 de chaque cycle de chimiothérapie. La dose de lénalidomide était réduite à 10 mg si la clairance de la créatinine se situait entre 30 et 60 mL/min. Les patients du groupe expérimental recevaient 20 mg de dexaméthasone avant l’administration du daratumumab et 20 mg le lendemain en prévention des réactions liées à la perfusion, tandis que les patients du groupe témoin recevaient la dexaméthasone en une seule dose hebdomadaire de 40 mg. Les patients de plus de 75 ans ou ayant un indice de masse corporelle inférieur à 18,5 pouvaient recevoir une dose de dexaméthasone réduite de 20 mg à la discrétion de leur médecin traitant.
Points évalués : L’objectif primaire de cette étude visait à évaluer la survie sans progression (SSP). Les objectifs secondaires étaient d’évaluer l’intervalle de temps jusqu’à la progression, le taux de réponse globale, le taux de très bonne réponse partielle (TBRP) ou mieux (comprenant les TBRP, les réponses complètes [RC] et les réponses complètes strictes), le taux de réponse complète ou mieux (comprenant les RC et les réponses complètes strictes), le pourcentage de patients avec une maladie résiduelle minimale négative (MRM négative), l’intervalle de temps jusqu’à la réponse, la durée de la réponse, la survie globale et l’innocuité.
Résultats : Au total, 569 patients ont été répartis aléatoirement dans l’étude, soit 286 dans le groupe daratumumab en association avec le lénalidomide et la dexaméthasone et 283 dans le groupe lénalidomide et dexaméthasone. La durée médiane du suivi des patients était de 13,5 mois au moment de l’analyse intermédiaire. Le taux de SSP à 12 mois était de 83,2 % dans le groupe expérimental (intervalle de confiance à 95 % [IC 95 %] 78,3–87,2) comparativement à 60,1 % dans le groupe témoin (IC 95 %: 54,0–65,7). Le rapport des risques [RR] pour la SSP au moment de l’analyse intermédiaire était de 0,37 dans le groupe daratumumab par rapport au groupe témoin (IC 95 % : 0,27–0,52; p < 0,001). L’effet bénéfique du traitement semble persistant dans l’ensemble des sous-groupes prédéfinis.
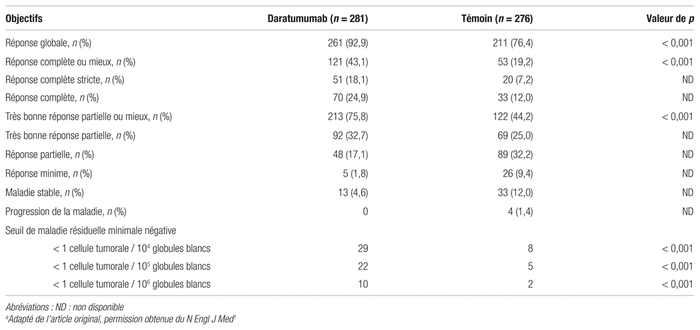
Le taux de réponse globale des patients ayant une réponse mesurable était significativement supérieur dans le groupe daratumumab comparativement au groupe témoin (92,9 % par rapport à 76,4 %; p < 0,001). Le taux de TBRP ou mieux était supérieur dans le groupe expérimental comparativement au groupe témoin (75,8 % par rapport à 44,2 %; p < 0,001). Le daratumumab a également démontré un avantage dans le taux de RC ou mieux (43,1 % par rapport à 19,2 %; p < 0,001). Bien que la mesure de la MRM soit encore peu utilisée en clinique, les auteurs ont rapporté un pourcentage de patients ayant une MRM négative (1 cellule tumorale par 104 globules blancs) plus élevé dans le groupe expérimental comparativement au groupe témoin (29 % par rapport à 8 %, p < 0,001). Les principaux résultats de l’étude sont résumés au tableau I.
Tableau I Résultats concernant les patients ayant eu une réponse évaluablea
En termes d’innocuité, les effets secondaires étaient similaires entre les groupes sauf pour les neutropénies, les diarrhées, les infections du système respiratoire et la toux, qui se sont produites à une plus grande fréquence d’au moins 10 % dans le groupe expérimental comparativement au groupe témoin. Il y avait plus de neutropénies de grade 3 ou 4 dans le groupe expérimental (51,9 %) que dans le groupe témoin (37 %). L’incidence de réactions liées à la perfusion (toux, dyspnée, vomissements) était de 47,7 % dans le groupe daratumumab, la majorité des réactions étant survenues lors de la première perfusion (92 %). La plupart des réactions étaient de grade 1 ou 2, toutefois, 15 patients (5,3 %) ont eu une réaction de grade 3.
Les avancées médicales dans le domaine du traitement du myélome multiple sont importantes depuis ces dernières années. L’étude POLLUX, une grande étude ouverte à répartition aléatoire et stratifiée, apporte des données très intéressantes quant à la place du daratumumab, un anticorps anti-CD38, dans le traitement du myélome multiple. L’absence de placebo était justifiée dans cette étude, puisque le daratumumab cause un risque élevé de réactions liées à la perfusion et perturbe les tests de compatibilité sanguine19. Toutefois, il existe un risque de biais d’information en l’absence d’un comité indépendant pour l’évaluation des réponses cliniques, d’autant plus que la compagnie pharmaceutique a participé à l’analyse des résultats. Il reste néanmoins que les résultats présentés ci-dessus en termes de SSP et de taux de réponse, dont les MRM négatives, sont tous en faveur de l’ajout du daratumumab au lénalidomide et à la dexaméthasone. Les valeurs de l’objectif primaire permettent même d’estimer le nombre nécessaire à traiter (NNT) de cinq patients sur 13,5 mois pour prévenir la progression de la maladie chez un de ces patients. Des mises à jour des données ont été présentées à l’American Society of Clinical Oncology (ASCO) 2017. La survie globale a été améliorée de manière statistiquement significative lors de l’ajout du daratumumab, avec un RR de 0,63 (IC 95 % : 0,42–0,95)20. La SSP était également supérieure dans le groupe daratumumab (24 mois comparativement à 17,5 mois, RR 0,41; IC 95 % : 0,31–0,53)21. La cytogénétique et les lactates déshydrogénases sont des facteurs pronostiques importants maintenant intégrés à l’ISS, appelé R-ISS depuis 20156. Les patients ayant les anomalies chromosomiques t(4;14), t(14;16) ou del17p sont considérés d’emblée comme présentant un risque élevé, soit un stade III R-ISS. La SSP des patients présentant un risque élevé était de 22,6 mois avec l’ajout du daratumumab comparativement à 18,2 mois dans le groupe lénalidomide et dexaméthasone (RR 0,53; IC 95 % : 0,25–1,13), tandis que les patients présentant un risque standard n’avaient pas encore atteint la SSP sous le daratumumab contre 18,5 mois sans daratumumab (RR 0,30; IC 95 % : 0,20–0,47). Cela suggère un bénéfice plus important chez les patients présentant un risque standard, toutefois ces résultats doivent être interprétés avec précaution puisqu’il y avait peu de patients présentant un risque élevé et qu’il s’agit d’une analyse post-hoc21.
En matière d’innocuité, 47,7 % des patients recevant le daratumumab ont eu des réactions liées à la perfusion, ce qui est comparable aux données existantes dans la littérature scientifique19,22. Ces effets secondaires et l’administration intraveineuse du produit peuvent avoir un impact important sur la qualité de vie des patients, surtout en début de traitement, un paramètre d’évaluation qui n’a pas été pris en compte dans cette étude. Il est à noter que 19 patients ont cessé le traitement en raison des effets indésirables dans le groupe expérimental comparativement à 23 patients dans le groupe témoin. L’arrêt du traitement en raison de la progression était plus fréquent dans le groupe témoin, soit 96 patients contre 40 patients dans le groupe daratumumab.
L’ajout du daratumumab dans l’arsenal thérapeutique soulève des questions quant au fardeau économique de la prise en charge des patients atteints de myélome multiple par les centres hospitaliers, étant donné l’administration intraveineuse du daratumumab. En effet, les coûts du daratumumab, mais également du lénalidomide et de la dexaméthasone, devront être pris en charge par les centres hospitaliers, alors qu’ils ne l’étaient pas dans le passé, car le doublet était géré en pharmacie communautaire. Une évaluation pharmacoéconomique devra être réalisée à cet effet ou une refonte des normes sur le remboursement de la chimiothérapie orale en concomitance avec la chimiothérapie intraveineuse23.
L’étude CASTOR, une étude de phase III, multicentrique, contrôlée et ouverte évaluant l’ajout du daratumumab au bortézomib et à la dexaméthasone pour le traitement du myélome récidivant ou réfractaire à au moins une ligne de traitement, a été publiée récemment22. La population de cette étude était comparable à celle de l’étude POLLUX. Toutefois, les patients ont reçu plus de lignes de traitements antérieures dans l’étude CASTOR (médiane de deux comparativement à une), ce qui peut expliquer les SSP inférieures dans cette étude comparativement à l’étude POLLUX. En effet, les résultats démontrent une survie sans progression supérieure lors de l’ajout du daratumumab au bortézomib et à la dexaméthasone (non atteinte comparativement à 7,2 mois, RR 0,39; IC 95 %: 0,28–0,53), toutefois les RR sont similaires entre les deux études22. Cependant, la comparaison des résultats est faite sous toute réserve étant donné qu’il s’agit de deux études différentes.
D’autres triplets ont aussi été étudiés pour la même indication, dont l’ajout de la carflizomib (étude ASPIRE), de l’ixazomib (étude TOURMALINE 1) ou de l’elotuzumab (étude ELOQUENT 2) à la combinaison de lénalidomide et de dexaméthasone24–26. Bien que les triplets n’aient pas été comparés directement et que les populations diffèrent légèrement, les RR de SSP sont respectivement de 0,70, 0,73 et 0,68 comparativement à 0,37 avec le daratumumab. Toutefois, le choix de traitement pour les patients ayant une maladie récidivante ou réfractaire doit être adapté en fonction des lignes antérieures, de l’âge, des comorbidités, de la cytogénétique des patients ainsi que du profil d’innocuité des thérapies.
D’ailleurs, les résultats ne s’appliquent pas aux patients dont la maladie a progressé sous le lénalidomide, ceux-ci ayant été exclus de l’étude POLLUX. Plusieurs autres agents sont disponibles ou à l’étude pour ces patients, dont les nouvelles générations d’immunomodulateurs (IMiDS), les inhibiteurs du protéasome et l’immunothérapie24–26.
L’analyse intermédiaire de l’étude POLLUX montre l’avantage d’ajouter le daratumumab au lénalidomide et à la dexaméthasone en termes de SSP, de taux de TBRP ou mieux et d’atteinte d’une MRM négative. Les résultats récents présentés à l’ASCO 2017 démontrent également l’avantage de l’adjonction du daratumumab sur la survie globale20. Si l’évaluation pharmacoéconomique s’avère positive, cette étude permettra l’ajout du daratumumab au lénalidomide ou au bortézomib en fonction de l’exposition antérieure et de la tolérance du patient, ce qui inscrit cet agent en continuité et flexibilité dans l’arsenal thérapeutique offert au Québec. De plus, les nombreuses études présentement en cours évaluant l’efficacité du daratumumab nous permettront de mieux situer la place de ce médicament dans le traitement du myélome multiple.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables. Une autorisation écrite a été obtenue de ces personnes.
1. Dimopoulos MA, Oriol A, Nahi H, San-Miguel J, Bahlis NJ, Usmani N et coll. Daratumumab, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016;375:1319–31.
2. Société canadienne du cancer. Myélome multiple. [en ligne] http://www.cancer.ca/fr-ca/cancer-information/cancer-type/multiple-myeloma/multiple-myeloma/?region=on (site visité le 24 mai 2017).
3. Kumar SK, Rajkumar SV, Dispenzieri A, Lacy MQ, Hayman SR, Buadi FK et coll. Improved survival in multiple myeloma and the impact of novel therapies. Blood 2008;111:2516–20.
4. Kastritis E, Zervas K, Symeonidis A, Terpos E, Delimbassi S, Anagnostopoulos N et coll. Improved survival of patients with multiple myeloma after the introduction of novel agents and the applicability of the international staging system (ISS): an analysis of the greek myeloma study group (GMSG). Leukemia 2009;23:1152–7.
5. Chan HSH, Chen CI, Reece DE. Current review on high-risk multiple myeloma. Curr Hematol Malig Rep 2017;12:96–108.
6. Palumbo A, Avet-Loiseau H, Oliva S, Lokhorst HM, Goldschmidt H, Rosinol L et coll. Revised international staging system for multiple myeloma: a report from international myeloma working group. J Clin Oncol 2015;33:2863–9.
7. de Weers M, Tai YT, van der Veer MS, Bakker JM, Vink T, Jacobs DC et coll. Daratumumab, a novel therapeutic human CD38 monoclonal antibody, induces killing of multiple myeloma and other hematological tumors. J Immunol 2011;186:1840–8.
8. Lokhorst HM, Plesner T, Laubach JP, Nahi H, Gimsing P, Hansson M et coll. Targeting CD38 with daratumumab monotherapy in multiple myeloma. N Engl J Med 2015;373:1207–19.
9. Usmani SZ, Weiss BM, Plesner T, Bahlis NJ, Belch A, Lonial S et coll. Clinical efficacy of daratumumab monotherapy in patients with heavily pretreated relapsed or refractory multiple myeloma. Blood 2016;128:37–44.
10. Lonial S, Weiss BM, Usmani SZ, Singhal S, Chari A, Bahlis NJ et coll. Daratumumab monotherapy in patients with treatment-refractory multiple myeloma (SIRIUS): an open-label, randomised, phase 2 trial. Lancet 2016;387:1551–60.
11. US national library of medecine. Daratumumab. Clinical Trials. [en ligne] https://clinicaltrials.gov/ct2/results?cond=&term=daratumumab&cntry=&state=&city=&dist= (site visité le 2 mars 2018).
12. Liste des médicaments mise à jour le 3 mai 2017. Régie de l’assurance maladie du Québec (RAMQ). Bibliothèque et archives nationales du Québec. [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/liste_med/liste_med_2017_06_01_fr.pdf (site visité le 8 mars 2017).
13. Groupe d’étude en oncologie du Québec. Myélome. [en ligne] http://www.geoq.info/fr/pro/protocole-chimio-370-site-anatomique-40 (site visité le 14 février 2017).
14. Munshi NC, Avet-Loiseau H, Rawstron AC, Owen RG, Child JA, Thakurta A et coll. Association of minimal residual disease with superior survival outcomes in patients with multiple myeloma: a meta-analysis. JAMA Oncol 2017;3:28–35.
15. Chaire myélome canada. Lignes de conduite sur le myélome multiple. Montréal, 2016. [en ligne] http://www.chaire-myelome-canada.org/professionnels-de-la-sante/lignes-de-conduite-sur-le-myelome-multiple/ (site visité le 24 mai 2017).
16. Anderson KC, Alsina M, Atanackovic D, Biermann JS, Chandler C, Costello C et coll. NCCN guidelines insights: multiple myeloma, version 3. J Natl Compr Canc Netw 2016;14:389–400.
17. Société canadienne du cancer. Symptômes du myélome multiple. [en ligne] http://www.cancer.ca/fr-ca/cancer-information/cancer-type/multiple-myeloma/signs-and-symptoms/?region=on (site visité le 20 février 2017).
18. Félix J, Aragao F, Almeida JM, Calada FJM, Ferreira D, Parreira ABS et coll. Time dependent endpoints as predictors of overall survival in multiple myeloma. BMC Cancer 2013;13:1–12.
19. Janssen inc. Monographie du daratumumab (Darzalex). Toronto, Ontario. Avril 2017.
20. Lonial S. Daratumumab combinations in multiple myeloma. Présentée au congrès annuel de l’ASCO; Chicago, IL, 2017.
21. Dangi-Garimella S. Daratumumab with standard regimen improves PFS in multiple myeloma, independant of cytogenetic risk. Présentée au congrès de l’American society of clinical oncology; Chicago, IL, 2017.
22. Palumbo A, Chanan-Khan A, Weisel K, Nooka AK, Masszi T, Beksac M et coll. Daratumumab, bortezomib, and dexamethasone for multiple myeloma. N Engl J Med 2016;375:754–66.
23. Circulaire 2000-028. Normes et pratiques de gestion, 2000. [en ligne] http://msssa4.msss.gouv.qc.ca/fr/document/d26ngest.nsf/3f4763bf7e3c23a78525660f00727c27/d6da7cdf54a465cf8525690a006f1db2/$FILE/2000-028.pdf (site visité le 20 juin 2017).
24. Stewart AK, Rajkumar V, Dimopoulos MA, Masszi T, Spicka I, Oriol A et coll. Carflizomib, lenalidomide, and dexamethasone for relapsed multiple myeloma. N Engl J Med 2015;372:142–52.
25. Moreau P, Masszi T, Grzasko N, Bahlis NJ, Hansson M, Pour L et coll. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. N Engl J Med 2016;374:1621–34.
26. Lonial S, Dimopoulos M, Palumbo A, White D, Grosicki S, Spicka I et coll. Elotuzumab therapy for relapsed or refractory multiple myeloma. N Engl J Med 2015;373:621–31.
PHARMACTUEL, Vol. 51, No. 2, 2018