
Vincent Barré1,2,3, Pharm.D., M.Sc., Camille Dufort-Rouleau1,2,4, Pharm.D., M.Sc., Benjamin Martin1,2,5, Pharm.D., M.Sc., Nicolas Goettel4, Pharm.D., M.Sc.
Reçu le 13 juillet 2017; Accepté après révision le 18 octobre 2017
Résumé
Objectif : Décrire un cas clinique d’acidose pyroglutamique qui serait causé par la prise concomitante de cloxacilline et d’acétaminophène et discuter des étiologies possibles de ce type d’acidose métabolique avec une élévation du trou anionique.
Résumé du cas : Une patiente de 83 ans, souffrant d’une infection, a développé une acidose métabolique avec une élévation du trou anionique et des lactates normaux lors du traitement à la cloxacilline d’un anévrisme mycotique à Staphylococcus aureus sensible à la méthicilline. La patiente recevait également de l’acétaminophène durant son hospitalisation. En retirant les agents causaux (cloxacilline et acétaminophène) et en instaurant un traitement de soutien et un protocole de N-Acétylcystéine, la patiente a récupéré rapidement sans subir de conséquence permanente.
Discussion : L’acidose pyroglutamique résulte de l’accumulation de 5-oxoproline secondaire à des anomalies du cycle gamma-glutamyl et à une déplétion en glutathion. Plusieurs rapports de cas décrivent différents facteurs de risque, dont certains médicaments (acétaminophène, cloxacilline, vigabatrin) et certaines comorbidités (atteinte rénale ou hépatique, sepsis, malnutrition). Selon les algorithmes de Naranjo et DIPS, il est probable que ce cas d’acidose pyroglutamique ait été causé par la combinaison de cloxacilline et d’acétaminophène. Bien qu’une valeur d’excrétion rénale de 5-oxoproline aurait permis de confirmer le diagnostic, la suspicion clinique demeure élevée après l’exclusion des autres causes potentielles.
Conclusion : L’acidose pyroglutamique est une cause rare d’acidose métabolique avec une élévation du trou anionique, et on devrait penser à une telle acidose une fois que le diagnostic différentiel a éliminé les étiologies communes d’acidose. Ce cas souligne bien le rôle du pharmacien dans la détection des effets indésirables médicamenteux rares.
Mots clés : Acétaminophène, acidose métabolique, acide pyroglutamique, adulte, cloxacilline, 5-oxoproline
Abstract
Objective : To describe a clinical case of pyroglutamic acidosis apparently caused by the concomitant use of cloxacillin and acetaminophen and to discuss the possible etiologies of this type of metabolic acidosis accompanied by an elevated anion gap.
Case Summary : An 83-year-old female patient with an infection developed metabolic acidosis with an elevated anion gap and normal lactates while being treated with cloxacillin for a methicillin-sensitive Staphylococcus aureus mycotic aneurysm. The patient also received acetaminophen during her hospital stay. Upon the withdrawal of the causal agents (cloxacillin and acetaminophen) and the initiation of supportive treatment and an N-acetylcysteine protocol, the patient experienced a rapid recovery with no permanent sequelae.
Discussion : Pyroglutamic acidosis results from a build-up of 5-oxoproline secondary to gamma-glutamyl cycle abnormalities and glutathione depletion. A number of case reports describe different risk factors, among which are certain drugs (acetaminophen, cloxacillin and vigabatrin) and certain comorbidities (hepatic or renal impairment, sepsis and malnutrition). Based on the Naranjo and Drug Interaction Probability Scale algorithms, this case of pyroglutamic acidosis was probably caused by the concomitant use of cloxacillin and acetaminophen. Although the diagnosis could have been confirmed from a urinary 5-oxoproline excretion value, clinical suspicion remained strong after ruling out the other possible causes.
Conclusion : Pyroglutamic acidosis is a rare cause of metabolic acidosis accompanied by an elevated anion gap and should be considered once the differential diagnosis has ruled out the common etiologies of acidosis. This case underscores the pharmacist’s role in detecting rare drug adverse effects.
Keywords : Acetaminophen, adult, cloxacillin, 5-oxoproline, metabolic acidosis, pyroglutamic acid
Ce cas décrit une patiente de 83 ans ayant développé une acidose métabolique secondaire à un traitement de cloxacilline et d’acétaminophène aux soins intensifs d’un hôpital universitaire québécois. L’acidose métabolique est une complication fréquente chez les patients hospitalisés, surtout chez ceux admis aux soins intensifs1,2. Le calcul du trou anionique plasmatique est une approche fréquente en pratique afin de différencier les cas d’acidose métabolique selon deux catégories : acidose métabolique avec trou anionique normal ou avec une élévation du trou anionique. Cette classification permet de faciliter la détermination des causes potentielles de l’acidose lors du diagnostic différentiel et ainsi de déterminer les approches thérapeutiques adaptées selon l’étiologie et la gravité de la présentation clinique3. Ce cas présente un intérêt particulier du fait que la cause qui semble avoir entraîné l’acidose métabolique est relativement peu fréquente et peu connue, soit une acidose métabolique avec une élévation du trou anionique secondaire à une accumulation de 5-oxoproline (acide pyroglutamique). La prise en charge de cette patiente souligne également l’importance du rôle du pharmacien dans la détection des effets indésirables, puisque le développement de l’acidose pyroglutamique semble secondaire à la prise de deux médicaments couramment utilisés en pratique, soit la cloxacilline et l’acétaminophène. À ce jour, il n’existe qu’une cinquantaine de cas semblables publiés dans la littérature médicale, dont une fraction seulement serait due à une interaction entre l’acétaminophène et la cloxacilline4–8.
Il s’agit d’une femme de 83 ans souffrant de multiples allergies et intolérances (carbamazépine, codéine, naproxène, norfloxacine, produits de contraste, sulfamidés). La patiente présente des antécédents médicaux d’hypertension artérielle traitée avec de l’irbesartan dosé à 150 mg par voie orale une fois par jour, d’hypothyroïdie traitée avec 0,088 mg de lévothyroxine par voie orale une fois par jour, d’ostéoporose traitée avec 500 mg de calcium par voie orale une fois par jour, 1000 unités de vitamine D par voie orale une fois par jour et 35 mg de risédronate par voie orale une fois par semaine ainsi que de maladie vasculaire athérosclérotique et d’adénocarcinome antégastrique ayant entraîné une gastrectomie partielle en 2014. Elle prend également 1200 mcg de cyanocobalamine par voie orale une fois par jour et de l’acétaminophène, en vente libre, à raison de 1 g par voie orale trois fois par jour à domicile. Elle ne prenait pas d’autres médicaments en vente libre ni de produits de santé naturels. Seule l’administration de lévothyroxine s’est poursuivie pendant toute la durée de l’hospitalisation alors que l’irbésartan, qui lui était administré à son arrivée, a rapidement été retiré au jour six dans le contexte d’une atteinte rénale aiguë. La patiente ne fume pas et ne consomme ni alcool et drogues. Elle ne montre aucun signe de dénutrition, son poids étant normal (60 kg ; 1,60 m; indice de masse corporelle [IMC] de 23 kg/m2), de même que son albumine sérique (34,3 [normal (N) = 35–52 g/L]). À l’admission, sa fonction hépatique (alanine aminotransférase [ALT] : 10 [N = 0–37 UI/L] et aspartate aminotransférase [AST] : 24 [N = 0–32 UI/L]) et rénale (créatinine : 65 umol/L et clairance selon Cockroft-Gault de 55 mL/min) sont normales. Les autres valeurs de laboratoires obtenues sont également normales (urée à 7,3 [N = 2,5–6,6 mmol/L], glucose à 5,4 [N = 3,3–5,5 mmol/L], lactates à 1,74 [N = 0,6–2,2 mmol/L], potassium à 3,8 [N = 3,5–5,1 mmol/L] et sodium à 140 [N = 135–145 mmol/L]).
La patiente s’est initialement présentée dans un centre hospitalier régional pour de la dysurie et de la nycturie accompagnées de douleur et de fièvre (38,9 °C), parce qu’elle n’avait pas répondu à un traitement de ciprofloxacine à 500 mg deux fois par jour pendant sept jours. La patiente reçoit un diagnostic de pyélonéphrite et d’urosepsis et elle entreprend un traitement à la pipéracilline associée au tazobactam à raison de 3 g par voie intraveineuse toutes les six heures. Les hémocultures effectuées avant le début du traitement antibiotique démontrent la présence de Staphylococcus aureus sensible à la méthicilline. Dans un contexte de bactériémie, une échocardiographie transthoracique s’avère nécessaire pour vérifier la présence ou non d’une endocardite. Cet examen a révélé qu’un anévrisme mycotique de l’aorte thoracique était à l’origine du sepsis. La patiente est alors transférée dans un centre hospitalier universitaire pour le traitement endovasculaire de son anévrisme.
Au premier jour de son hospitalisation, la cloxacilline à une dose de deux grammes toutes les quatre heures par voie intraveineuse remplace la pipéracilline et le tazobactam afin de réduire le spectre antibactérien dans un contexte de pathogène sensible. Dès son arrivée, la patiente, qui se plaint de douleurs, reçoit une ordonnance d’acétaminophène à une dose de 650 mg par voie orale administrée au besoin toutes les quatre heures (prise moyenne de deux grammes par jour). Quelques jours plus tard, une modification de l’ordonnance en prescrit la prise régulière toutes les six heures. De l’hydromorphone à 1 mg par voie sous-cutanée toutes les trois heures au besoin en cas de douleur (moyenne de trois doses par jour) se trouve également inscrite au profil médicamenteux dès le jour deux. Jusqu’au jour six de l’hospitalisation, la patiente présente une tension artérielle labile qui est contrôlée par l’ajout d’amlodipine au jour un. La dose de cette dernière a rapidement augmenté jusqu’à 10 mg par voie orale une fois par jour. Et au jour trois, la patiente reçoit 2,5 mg de bisoprolol par voie orale une fois par jour. Au jour sept, elle subit une intervention endovasculaire pour le traitement de son anévrisme de l’aorte. L’infectiologue recommande un traitement antibiotique prophylactique à vie. L’administration de la même dose de cloxacilline se poursuit, et au 8e jour, on procède à l’ajout de 600 mg de rifampin une fois par jour, soit 10 mg/kg/jour. Le même jour s’ajoute l’administration d’héparine dosée à 5000 unités et administrée par voie sous-cutanée deux fois par jour pour la prévention des thromboses. Au onzième jour de l’hospitalisation, on ajoute 40 mg de pantoprazole par voie orale une fois par jour pour traiter des symptômes gastro-intestinaux.
À partir du 14e jour d’hospitalisation, la patiente développe une acidose métabolique avec une alcalose respiratoire compensatoire confirmée par le gaz artériel (pH à 7,52; bicarbonates à 11,8 mmol/L; pO2 à 77,5 mmHg et pCO2 à 14,7 mmHg). La patiente présente également une élévation du trou anionique à 25,2, mais les lactates sont normaux à 1,75 mmol/L. À l’examen, les causes usuelles de l’acidose métabolique avec l’élévation du trou anionique sont éliminées (tableau I) et la cause la plus probable retenue par les néphrologues et les infectiologues est une acidose tubulaire pyroglutamique causée par la prise concomitante de cloxacilline et d’acétaminophène (une prise régulière à l’hôpital aux mêmes doses qu’à domicile). La cloxacilline est donc remplacée par de la céfazoline à la dose de deux grammes par voie intraveineuse toutes les huit heures. Au 14e jour d’hospitalisation, l’administration d’acétaminophène est également interrompue et reprise cinq jours plus tard. La patiente reçoit régulièrement plusieurs doses de bicarbonates du 14e au 17e jour de l’hospitalisation en plus du protocole local de perfusion de N-Acétylcystéine au jour 17 (tableau II), habituellement utilisé lors d’intoxication à l’acétaminophène. Toutes ces mesures permettent la résolution complète de l’acidose métabolique au 18e jour d’hospitalisation.
Tableau I Causes potentielles de l’acidose métabolique3,34
Tableau II Protocole d’administration de la N-Acétylcystéine
La patiente reçoit la céfazoline jusqu’au 21e jour d’hospitalisation. Cet antibiotique est remplacé par 3 g de pipéracilline associée au tazobactam par voie intraveineuse toutes les six heures en raison d’une suspicion de pneumonie nosocomiale. La patiente est ensuite transférée de nouveau à son centre hospitalier régional et il est prévu de remplacer son antibiotique par du céfadroxil par voie orale lors du congé afin de maintenir une prophylaxie antibiotique à vie. Le tableau III présente la chronologie des évènements.
Tableau III Chronologie des évènements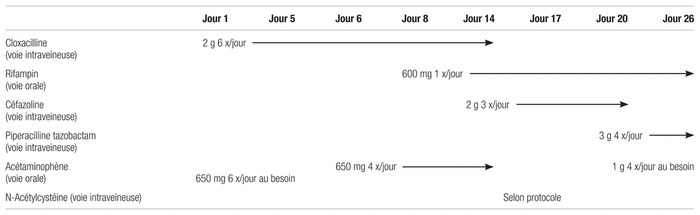
L’accumulation sérique d’acide pyroglutamique (ou 5-oxoproline), un acide organique endogène, est une cause rare d’acidose métabolique avec une élévation du trou anionique9. Toutefois, cette condition, dont le premier cas décrit chez l’adulte date de 1989, demeure probablement sous-diagnostiqué4,9,10. Le mécanisme exact de cette complication s’explique essentiellement par une déplétion en glutathion secondaire à des anomalies du cycle gamma-glutamyl (figure 1)3–14. Ce cycle joue un rôle primordial dans le métabolisme et la synthèse du glutathion, un tripeptide ubiquitaire composé d’acide glutamique, de cystéine et de glycine. Parmi les fonctions principales du glutathion, citons son puissant effet antioxydant et son rôle dans la détoxification de plusieurs xénobiotiques. De plus, il aurait des fonctions immunomodulatrices et serait un cofacteur dans le transport intracellulaire des acides aminés4,5,9–11,13.
|
|
||
Les deux enzymes principales agissant dans la pathophysiologie de l’acidose métabolique pyroglutamique sont la glutathion synthétase et la 5-oxoprolinase5,9,11. La première se charge de convertir la gamma-glutamylcystéine en glutathion (figure 1, étape 1) tandis que la deuxième catalyse la transformation de la 5-oxoproline en L-glutamate (figure 1, étape 4). Une réduction de l’activité de la glutathion synthétase induit une déficience en glutathion, qui, à son tour, entraîne une augmentation subséquente des niveaux de gamma-glutamylcystéine (figure 1, étape 2). Cette dernière est rapidement transformée en 5-oxoproline par une voie métabolique secondaire (figure 1, étape 3), puis la 5-oxoproline est ensuite transformée en L-glutamate (figure 1, étape 4). Cependant, la saturation rapide de la capacité de l’enzyme 5-oxoprolinase nuit au déroulement normal de cette dernière étape, ce qui mène à une accumulation de 5-oxoproline, causant une acidose métabolique4,5,9,11,13.
Quelques maladies génétiques liées à des défauts enzymatiques héréditaires peuvent être à l’origine du développement d’une acidose pyroglutamique, mais ces dernières sont très rares. Elles surviennent presque exclusivement en bas âge et sont associées à d’autres manifestations, telles des anomalies hématologiques et neurologiques4,9. À l’opposé, l’acidose pyroglutamique acquise est plus fréquente chez l’adulte. À ce jour, environ une cinquantaine de cas sont répertoriés dans la littérature scientifique, dont 11 proviennent de la série de cas publiés par Pitt et coll. en 19984,14. Parmi les facteurs de risque mentionnés dans les rapports de cas, notons la déplétion des réserves de glutathion secondaire à l’utilisation de l’acétaminophène, à la malnutrition, à la grossesse, au sepsis, à l’alcoolisme chronique et à l’insuffisance hépatique3–6,9,11,13–15. Les données probantes rapportent également que les femmes sont davantage sujettes à cette complication. Bien que la cause exacte de cette forte prévalence féminine ne soit pas complètement élucidée, des différences de l’activité enzymatique entre hommes et femmes demeurent l’hypothèse la plus probable9. Des différences dans les réserves de glutathion et dans le métabolisme de l’acétaminophène ont été également été observées chez la femme3. Nous avons noté dernièrement que l’insuffisance rénale peut réduire la clairance de 5-oxoproline, tandis que certains médicaments (flucloxacilline, ciprofloxacine, vigabatrin) ont été associés à une inhibition de l’activité de la 5-oxoprolinase et à une accumulation subséquente de 5-oxoproline4,5,9,11.
Comme l’excrétion urinaire de 5-oxoproline est importante, l’analyse urinaire quantitative de cet acide sert de test standard pour confirmer la présence d’une acidose pyroglutamique. Généralement, une concentration urinaire inférieure à 100 μmol de 5-oxoproline par mmol de créatinine est considérée comme normale3. Parmi les cas d’acidose pyroglutamique rapportés dans la littérature, les niveaux de 5-oxoproline urinaire varient entre 600 et plus de 20 000 μmol/mmol de créatinine13. Toutefois, ce bilan n’a pas été effectué pour le cas présenté ici, il n’existe donc aucune confirmation objective de cette réaction. Le test est disponible dans notre centre, mais il semble peu connu des cliniciens et donc peu utilisé. Cependant, plusieurs autres indices permettent de renforcer la suspicion clinique d’une acidose pyroglutamique chez cette patiente. D’abord, il s’agit d’une femme qui présentait initialement un état septique et qui était traitée chroniquement avec de l’acétaminophène à une dose thérapeutique. Une dose de 3 g par jour, telle que celle reçue à domicile, semble appropriée pour cette patiente âgée, étant donné l’absence d’autres facteurs de risque d’hépatotoxicité (alcoolisme chronique, dénutrition, faible poids). La dose reçue pendant son hospitalisation est également appropriée si l’on tient compte de ces mêmes facteurs. Comme nous l’avons mentionné plus haut, le sexe féminin semble prédisposer au développement de cette condition, tandis que l’ingestion chronique d’acétaminophène ainsi que l’épisode initial de sepsis ont probablement contribué à une déplétion des réserves de glutathion et à une augmentation subséquente du niveau de gamma-glutamylcystéine. Ceci mène ultimement à une augmentation de la production de 5-oxoproline. Parallèlement, la patiente a reçu un traitement à la cloxacilline durant les 14 jours précédant l’acidose métabolique. Par son effet inhibiteur sur l’activité de la 5-oxoprolinase, la cloxacilline aurait donc entraîné une diminution de l’élimination métabolique de la 5-oxoproline puis une accumulation sérique. En agissant ensemble, ces deux mécanismes (augmentation de la production et réduction de l’élimination) semblent avoir engendré une acidose métabolique avec une élévation du trou anionique.
Bien que la réaction indésirable subie par la patiente déjà soumise à d’autres facteurs de risque semble avoir été causée par l’exposition combinée à la cloxacilline et à l’acétaminophène, il est intéressant de se pencher sur les réels soupçons qui pèsent sur ces médicaments en utilisant l’algorithme de Naranjo de manière à vérifier chaque médicament séparément ainsi que le DIPS (Drug Interaction Probability Scale), qui a été conçu pour aider à déterminer l’origine d’une interaction médicamenteuse16,17. Tout d’abord, aucun cas d’acidose métabolique n’est décrit dans la monographie de la cloxacilline, mais plusieurs cas cliniques d’acidose pyroglutamique sont rapportés dans la littérature actuelle4–9,11,13,15,18. Parmi ces cas, certains accusent la combinaison cloxacilline-acétaminophène. Hunter et coll. rapportent le développement d’une acidose pyroglutamique chez trois patients recevant cette combinaison dans des contextes d’infections à Staphylococcus aureus. Dans les trois cas, le diagnostic a été confirmé par un résultat de 5-oxoproline urinaire élevé. Dans le premier cas, un homme de 67 ans, traité de façon chronique avec de l’acétaminophène à dose thérapeutique (1 g par voie orale quatre fois par jour), a développé une acidose deux semaines après l’introduction de la cloxacilline intraveineuse pour une infection des tissus mous. Le patient présentait également d’autres facteurs de risque, dont l’alcoolisme chronique, une insuffisance rénale aiguë et le sepsis. Dans le deuxième cas, une patiente de 53 ans a développé une acidose métabolique et une hypokaliémie environ un mois après l’introduction de la cloxacilline intraveineuse, de l’acétaminophène et du rifampin (contexte d’endocardite infectieuse et remplacement de la valve aortique). Enfin, une acidose métabolique et une hypokaliémie ont été dépistées chez une patiente dénutrie de 73 ans, 43 jours après l’introduction de la cloxacilline intraveineuse, l’acétaminophène (1 g par voie orale quatre fois par jour) et la rifampine pour le traitement d’un abcès. Dans les trois cas, l’acétaminophène a été retiré à la suite du diagnostic. La deuxième patiente est la seule à avoir abandonné la cloxacilline. Les deux premiers patients ont été traités avec un protocole de N-Acétylcystéine par voie orale (600 mg deux fois par jour). La résolution complète de l’acidose s’est produite sept jours après la prise en charge des trois patients4. Lanoy et Bouckaert décrivent le cas d’une acidose pyroglutamique chez une patiente de 82 ans. Dix jours après le début du traitement pour une infection à Staphylococcus aureus sensible à la méthicilline (2 g de cloxacilline par voie intraveineuse six fois par jour, 600 mg de rifampin par voie orale une fois par jour, 1 g d’acétaminophène par voie intraveineuse quatre fois par jour), la patiente a été admise aux soins intensifs avec une acidose métabolique (pH = 7,17) et un trou anionique à 22. L’investigation des causes usuelles d’une acidose métabolique avec une élévation du trou anionique s’est révélée négative, et un résultat élevé de 5-oxoproline urinaire (9789 mmol/ mmol de créatinine) a confirmé le diagnostic d’une acidose pyroglutamique. Une modification du traitement antibiotique ainsi qu’une perfusion de N-Acétylcystéine ont permis un rétablissement de l’acidose huit jours plus tard5. Amer et coll. discutent de deux cas d’acidose pyroglutamique secondaires à la prise concomitante de cloxacilline et d’acétaminophène par des patientes âgées de plus que 80 ans. Le délai d’apparition de l’acidose variait entre 26 et 38 jours et, dans les deux cas, le diagnostic a été confirmé par une mesure de 5-oxoproline urinaire.
L’abandon de la cloxacilline et de l’acétaminophène a permis de corriger l’acidose, ce qui a permis aux auteurs de calculer un score de sept avec l’algorithme de Naranjo (probable). Le sepsis et l’insuffisance rénale ont été les autres facteurs de risque présents chez ces patientes6. Les rapports de cas de Luyasu et coll. et de Peter et coll. décrivent des cas similaires à ceux déjà mentionnés7,8. Tel qu’on l’a vu dans l’un des cas, il est intéressant de noter que l’hémodialyse semble être une option thérapeutique efficace qui accélère l’élimination de la 5-oxoproline7. En ce qui concerne l’acétaminophène seul, certains cas d’acidose métabolique (non pyroglutamique) sont répertoriés en monothérapie, mais ils sont rares et surviennent généralement à des doses toxiques, soit des doses totales de 13 à 112,5 g par jour13,19,20. Toutefois, on rapporte des cas d’acidose pyroglutamique avec l’acétaminophène en monothérapie ou en association avec d’autres médicaments ou facteurs de risques4–6,9,11,13,15.
Le délai d’apparition de l’acidose pyroglutamique dans ce cas-ci, soit 14 jours après le début du traitement à la cloxacilline, correspond à celui des cas répertoriés. En effet, la littérature médicale rapporte que l’acidose se manifeste généralement après 10 à 28 jours de traitement4,5,11. De plus, cette complication iatrogénique a été contrôlée par l’arrêt des agents potentiellement en cause et un traitement de soutien optimal. Cependant, la cloxacilline n’a pas été réintroduite, vu l’importance de la réaction, contrairement à l’acétaminophène qui a été réintroduit au jour 20 sans réapparition d’évènement indésirable (tableau III). L’algorithme de Naranjo qui a servi à vérifier l’acétaminophène a produit le score de 0, ce qui indique qu’il est peu probable que ce médicament soit responsable à part entière de la réaction de la patiente. En ce qui concerne la cloxacilline seule, le score de Naranjo est de 4, soit une cause possible. En calculant le score de DIPS, on obtient un score de 5, ce qui permet de conclure que l’acidose pyroglutamique suspectée est probablement secondaire à la prise concomitante de cloxacilline et d’acétaminophène. Dans ces circonstances, les soupçons pesant sur l’acétaminophène ou la cloxacilline en monothérapie s’amenuisent. Ainsi, la combinaison médicamenteuse d’acétaminophène et de cloxacilline semble toujours être la cause primaire la plus probable de l’acidose pyroglutamique.
Les autres facteurs de risque d’acidose pyroglutamique ont également été étudiés. La grossesse a été exclue étant donné l’âge de la patiente, et l’alcoolisme chronique ne concorde pas avec les habitudes de vie rapportées par celle-ci. La patiente avait des enzymes hépatiques et une créatinine normales, ce qui permet d’écarter l’insuffisance hépatique ou rénale. Finalement, un état de malnutrition semble peu probable lorsqu’on considère le poids et la taille de la patiente ainsi que son albumine sérique normale. D’ailleurs, ces valeurs sont restées stables au cours de l’hospitalisation. En ce qui concerne les autres causes d’acidose métabolique avec une élévation du trou anionique (tableau I), la patiente avait des valeurs de laboratoire normales (urée, glucose et lactate) et n’était pas exposée à des agents causaux reconnus. Les médicaments au profil de la patiente lors de la réaction sont présentés précédemment dans la description du cas et aucune notion d’acidose métabolique n’est mentionnée dans les monographies de ces molécules18,21–28. Toutefois, quelques cas de néphrite tubulo-interstitielles ont été associés à la prise de rifampin, soit un diagnostic différentiel d’acidose métabolique qui a été exclu par les néphrologues, car les réactions répertoriées dans la littérature ont été observées après plus d’un mois de traitement29–31. Ensuite, la littérature actuelle portant sur le pantoprazole, l’hydromorphone et le bisoprolol ne décrit aucun cas d’acidose métabolique. Deux cas d’acidose métabolique distincts, secondaires à des intoxications volontaires, ont été répertoriés en présence de lévothyroxine (dose totale de 13,2 mg) et d’amlodipine (dose totale de 85 mg)32,33. De plus, aucun nouveau médicament n’avait été introduit ou retiré dans les cinq jours précédant le diagnostic d’acidose pyroglutamique.
En ce qui concerne le traitement, la résolution de l’acidose pyroglutamique passe d’abord et avant tout par la cessation des médicaments pouvant causer un tel désordre5,6,9. Dans ce cas, la cloxacilline a été remplacée par la céfazoline, un antibiotique non reconnu pour entraîner l’accumulation d’acide pyroglutamique. L’acétaminophène a été momentanément retiré pour permettre la résolution de l’acidose et repris par la suite sans crainte de récurrence, puisque la patiente en prenait déjà régulièrement à domicile. Dans un deuxième temps, un traitement de soutien, notamment l’administration de fluides, de bicarbonates et d’électrolytes, est recommandé afin d’assurer la résolution de l’acidose et la normalisation des paramètres cliniques5,6,9. Finalement, l’effet de l’ajout d’un protocole standard de N-Acétylcystéine comme traitement empirique, ayant possiblement la propriété de rétablir les concentrations normales de glutathion par la cystéine (un des acides aminés composant le glutathion), est peu étudié dans la littérature. Ce protocole standard semble associé à des bienfaits en favorisant l’augmentation des concentrations intracellulaires de glutathion, mais il pourrait théoriquement entraîner une augmentation de gamma-glutamylcystéine et une saturation de la glutathion synthétase, ce qui pourrait paradoxalement augmenter les niveaux de 5-oxoproline. Ceci dit, l’utilisation d’un protocole de N-Acétylcystéine dans un contexte d’acidose pyroglutamique demeure controversée, mais raisonnable étant donné son profil d’innocuité favorable3,9,13.
Le cas présenté ici décrit le développement d’une acidose pyroglutamique dans un contexte de sepsis chez une patiente traitée avec de la cloxacilline et de l’acétaminophène. L’acidose pyroglutamique est une acidose métabolique rare causée par l’accumulation de 5-oxoproline à la suite d’une déplétion en glutathion. Plusieurs facteurs augmentant le risque d’acidose pyroglutamique sont cités dans la littérature, notamment certains médicaments. Dans ce cas-ci, la chronologie des évènements et la résolution des symptômes lors du retrait des médicaments suspectés permettent d’attribuer de façon probable l’acidose à l’accumulation de 5-oxoproline causée par l’administration de cloxacilline en combinaison avec l’acétaminophène. L’abandon des médicaments en cause combiné à un traitement de soutien et à l’administration de N-Acétylcystéine ont permis une résolution complète et rapide de l’acidose métabolique. D’ailleurs, il s’agit de la prise en charge recommandée par la majorité des auteurs pour une telle condition3,9,13. La nécessité d’éviter la combinaison de ces deux agents n’est pas bien établie à l’heure actuelle. Ajoutons que le recours à un traitement substitutif peut être limité dans certains contextes cliniques. En effet, la cloxacilline demeure un agent de première ligne pour la couverture du staphyloccocus aureus sensible à la méthicilline, et l’acétaminophène est un analgésique largement utilisé en raison de son profil d’efficacité et de son innocuité. La prise en compte des facteurs de risque inhérents au patient devient donc primordiale lors du diagnostic différentiel d’une acidose métabolique. Le cas présenté démontre bien l’importance du rôle du pharmacien dans l’évaluation des effets secondaires potentiels des médicaments. En mettant à profit son expertise, le pharmacien permet d’assurer la prise en charge rapide d’effets indésirables médicamenteux, notamment dans les cas d’acidose pyroglutamique, pour lesquels on ne suspecte pas toujours de causes médicamenteuses.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs remercient les responsables et les collaborateurs pour les commentaires reçus lors de la rédaction de cet article. Une autorisation écrite a été obtenue de ces personnes.
1. Martin M, Murray J, Berne T, Demetriades D, Belzberg H. Diagnosis of acid-base derangements and mortality prediction in the trauma intensive care unit: The physiochemical approach. J Trauma 2005;58:238–43.
2. Gunnerson KJ. Clinical review: The meaning of acid-base abnormalities in the intensive care unit part I-epidemiology. Crit Care 2005;9:508–516.

3. Schurmans W, Lemahieu W, Frans E. High anion gap metabolic acidosis: use the proper acronym, discard the red herrings and thou shall find the culprit. Clin Kidney J 2014;7:320–2.
4. Hunter RW, Lawson C, Galitsiou E, Glifford F, Neary J. Pyroglutamic acidosis in association with therapeutic paracetamol use. Clin Med (Lond) 2016;16:524–9.
5. Lanoy C, Bouckaert Y. Metabolic acidosis and 5-oxoprolinuria induced by flucloxacillin and acetaminophen: a case report. J Med Case Rep 2016;10:184.

6. Amer H, Dockery F, Barrett N, George M, Witek K, Stanton J et coll. Refractory metabolic acidosis in patients with sepsis following hemiarthroplasty for femoral neck fracture: a causative role for paracetamol and flucloxacillin? BMJ Case Reports 2011;2011.
7. Luyasu S, Wamelink MM, Galanti L, Dive A. Pyroglutamic acid-induced metabolic acidosis: a case report. Acta Clin Belg 2014;69:221–3.
8. Peter JV, Rogers N, Murty S, Gerace R, Mackay R, Peake SL. An unusual cause of severe metabolic acidosis. Med J Aus 2006;185:223–5.
9. Fenves AZ, Kirkpatrick HM, Patel VV. Increased anion gap metabolic acidosis as a result of 5-oxoproline (pyroglutamic acid): A role for acetaminophen. Clin J Am Soc Nephrol 2006;1:441–7.
10. Creer MH, Lau BW, Jones JD, Chan KM. Pyroglutamic acidemia in an adult patient. Clin Chem 1989;35:684–6.
11. Kortmann W, van Agtmael MA, van Diessen J, Kanen BL, Jakobs C, Nanayakkara PW. 5-oxoproline as a cause of high anion gap metabolic acidosis: an uncommon cause with common risk factors. Neth J Med 2008;66:354–7.
12. Fily A, Vaillant C, Truffert P, Rouland V, Dobbelaere D, Kacet N. Déficit en glutathion synthétase (à propos d’un cas). Arch Pediatr 2004;11;1339–41.
13. Liss DB, Paden MS, Schwarz S, Mullins ME. What is the clinical significance of 5-oxoproline (pyroglutamic acid) in high anion gap metabolic acidosis following paracetamol (acetaminophen) exposure? Clin Toxicol (Phila) 2013;51:817–27.
14. Pitt JJ, Hauser S. Transient 5-oxoprolinuria and high anion gap metabolic acidosis: clinical and biochemical findings in eleven subjects. Clin Chem 1998;44:1497–503.
15. Verma R, Polsani KR, Wilt J, Loehrke ME. 5-oxoprolinuria as a cause of high anion gap metabolic acidosis. Br J Clin Pharmacol 2012;73:489–91.

16. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA et coll. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1980;30:239–45.
17. Horn JR, Hansten PD, Chan LN. Proposal for a new tool to evaluate drug interaction cases. Ann Pharmacother 2007;41;4:674–80.
18. SteriMax Inc. Monographie de produit : Cloxacilline pour Injection. [en ligne] http://sterimaxinc.com/wp-content/uploads/2015/09/cloxacillin-monograph-FR.pdf (site visité le 17 mars 2017).
19. Shah AD, Wood DM, Dargan PI. Understanding lactic acidosis in paracetamol (acetaminophen) poisoning. Br J Clin Pharmacol 2011;71:20–8.

20. Zein JG, Wallace DJ, Kinasewitz G, Toubia N, Kakoulas C. Early anion gap metabolic acidosis in acetaminophen overdose. Am J Emerg Med 2010;28:798–802.
21. Janssen-Ortho Inc. Monographie de produit : Tylenol. [en ligne] https://www.janssen.com/canada/sites/www_janssen_com_canada/files/product/pdf/tyl08062014cpm_pdc.pdf (site visité le 17 mars 2017).
22. Apotex Inc. Monographie de produit : Apo-Bisoprolol.[en ligne] https://pdf.hres.ca/dpd_pm/00037784.PDF (site visité le 17 mars 2017).
23. Sanofi Inc. Monographie de produit : Rifadin. [en ligne] http://products.sanofi.ca/en/rifadin.pdf (site visité le 17 mars 2017).
24. Sandoz Inc. Monographie de produit : Injection d’héparine sodique USP. [en ligne] http://www.sandoz.ca/cs/groups/public/@sge_ca/documents/document/n_prod_1301722.pdf (site visité le 17 mars 2017).
25. Pfizer Inc. Monographie de produit : Norvasc. [en ligne] http://www.pfizer.ca/sites/g/files/g10017036/f/201505/Norvasc_PM_177714_30_Jan_2015_FR.pdf (site visité le 17 mars 2017).
26. Takeda Canada Inc. Monographie de produit : Pantoloc. [en ligne] http://www.takedacanada.com/pantolocpm/~/media/countries/ca/files/productpdfs/pantolocpm_eng_2016dec12.pdf (site visité le 17 mars 2017).
27. Milan Inc. Monographie de produit : Synthroid. [en ligne] http://www.mylan.ca/-/media/mylanca/documents/english/productpdf/1.3.1-synthroidpm.pdf (site visité le 17 mars 2017).
28. Purdue Inc. Monographie de produit : Dilaudid. [en ligne] http://www.purdue.ca/files/2012-04-05/Dilaudid_Mod-Sev_ENG_Mktg_FINAL.pdf (site visité le 17 mars 2017).
29. Min HK, Kim EO, Lee SJ, Chang YK, Suh KS, Yang CW et coll. Rifampin-associated tubulointersititial nephritis and Fanconi syndrome presenting as hypokalemic paralysis. BMC Nephrol 2013;16;14:13.

30. Rosati S, Cherubini C, Iacomi F, Giannakakis K, Vincenzi L, Ippolito G et coll. Acute rifampicin-associated interstitial tubulopathy in a patient with pulmonary tuberculosis: a case report. J Med Case Rep 2013;7:106.

31. Covic A, Goldsmith DJ, Segall L, Stoicescu C, Lungu S, Volovat C et coll. Rifampicin-induced acute renal failure: a series of 60 patients. Nephrol Dial Transplant 1998;13:924–9.
32. Rothberger GD, Desai AK, Sharif S, Chawla SA, Shirazian S. The Case | Elevated lactate and osmolar gap after levothyroxine overdose. Kidney Int 2015;88:419–20.
33. Naha K, Suryanarayana J, Aziz RA, Shastry BA. Amlodipine poisoning revisited: Acidosis, acute kidney injury and acute respiratory distress syndrome. Indian J Crit Care Med 2014;18:467–9.

34. Kraut JA, Madias NE. Differential diagnosis of nongap metabolic acidosis: Value of a systematic approach. Clin J Am Soc Nephrol 2012;7:671–9.

PHARMACTUEL, Vol. 51, No. 1, 2018