|
|
||
|
Figure 1 Répartition des patients a |
||
Sonia Couturier1,2,3, Pharm.D., M.Sc., Andréanne Groleau1,4,5, Pharm.D., M.Sc., Catherine Lacroix1,4,6, Pharm.D., M.Sc., Audrey-Ann Pelletier St-Pierre1,4,7, Pharm.D., M.Sc.
1Candidate au programme de maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction de l’article, Centre intégré de santé et services sociaux du Bas-Saint-Laurent-Hôpital régional de Rimouski, Rimouski (Québec) Canada;
3Pharmacienne, Centre intégré de santé et services sociaux de la Gaspésie-Hôpital de Maria, Maria (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction de l’article, Institut universitaire de cardiologie et de pneumologie de Québec - Université Laval, Québec (Québec) Canada;
5Pharmacienne, Centre intégré universitaire de santé et services sociaux de la Mauricie-et-du-Centre-du-Québec - Hôpital Sainte-Croix, Drummondville (Québec) Canada;
6Pharmacienne, Centre intégré de santé et services sociaux de la Côte-Nord - Hôpital Le Royer, Baie-Comeau (Québec) Canada;
7Pharmacienne, Institut universitaire de cardiologie et de pneumologie de Québec – Université Laval, Québec (Québec) Canada
Reçu le 12 septembre 2017; Accepté après révision par les pairs le 7 novembre 2017
Titre Osimertinib or platinum-pemetrexed in EGFR T790M - positive lung cancer. N Engl J Med 2017;376:629-641.
Auteurs : Mok TS, Wu YL, Garassino MC, Kim HR, Ramalingam SS, Shepherd FA et coll. pour les investigateurs de l’étude AURA3.
Commanditaires : L’étude AURA 3 a été financée et soutenue (conception du protocole de l’étude, collecte de données, analyse, interprétation des données ainsi que rédaction de l’article) par la compagnie pharmaceutique AstraZeneca.
Cadre de l’étude : Le cancer du poumon représente le cancer le plus diagnostiqué (12,9 %) et le plus mortel (19,4 %) dans le monde2. Au Canada, le cancer du poumon non à petites cellules (CPNPC) représente 85 à 90 % des cancers du poumon3. Parmi les patients atteints de ce type de cancer, 10 à 12 % des Caucasiens présenteront une mutation génétique des récepteurs du facteur de croissance épidermique (EGFR)4. Cette proportion augmente jusqu’à 30 à 40 % dans la population asiatique4. La présence de cette mutation permet l’utilisation des inhibiteurs de la tyrosine kinase (ITK) de l’EGFR, une thérapie ciblée qui constitue la première ligne de traitement des CPNPC localement avancés ou métastatiques. Malgré un taux de réponse élevé avec l’utilisation des ITK de l’EGFR, la majorité des patients progresseront après 9 à 13 mois de traitement5. Lors d’une progression, plus de la moitié des patients présenteront une mutation acquise T790M qui confère une résistance aux ITK de l’EGFR de 1re et de 2e génération6. À l’heure actuelle, selon l’algorithme d’investigation, de traitement et de suivi du cancer du poumon élaboré par le groupe d’étude en oncologie du Québec (GEOQ), l’Institut national d’excellence en santé et en services sociaux (INESSS) et la direction québécoise de cancérologie, la thérapie composée d’une platine et de pemetrexed constitue la deuxième ligne de traitement lors d’une progression sous ITK de l’EGFR7.
L’osimertinib est un inhibiteur oral, sélectif et irréversible de la tyrosine kinase de l’EGFR de 3e génération. Il agit à la fois sur les mutations génétiques de l’EGFR et les mutations acquises T790M8. Dans les études de phase 1/2 (AURA) et de phase 2 (AURA 2), l’utilisation de l’osimertinib pour les patients atteints d’un CPNPC localement avancé ou métastatique avec mutation T790M a démontré respectivement un taux de réponse de 61 % et de 70 % ainsi qu’une durée moyenne de survie sans progression de 9,6 et 9,9 mois9,10. L’étude AURA 3 compare l’efficacité de l’osimertinib à celle de la chimiothérapie composée d’une platine et du pemetrexed, pour les patients atteints d’un CPNPC localement avancé ou métastatique, avec présence de la mutation T790M après l’utilisation d’un ITK de l’EGFR en première ligne.
Protocole de recherche : Il s’agit d’une étude clinique internationale à répartition aléatoire, comparative, de phase III, multicentrique et ouverte. Elle vise à démontrer la supériorité de l’osimertinib par rapport à la thérapie standard composée d’un doublet de chimiothérapies à base de platine et de pemetrexed pour les patients atteints d’un CPNPC localement avancé ou métastatique, présentant une mutation T790M confirmée après un traitement de première ligne à base d’un ITK de l’EGFR.
Patients : Entre août 2014 et septembre 2015, des patients ont été recrutés dans 126 centres, à travers plusieurs pays, dont le Canada. Les examens cytologiques ou histologiques des patients retenus révélaient la présence d’un CPNPC localement avancé ou métastatique ayant progressé après une thérapie de première ligne à base d’un ITK de l’EGFR avec l’identification de mutation T790M. Les patients ayant des métastases cérébrales stables et asymptomatiques étaient admissibles s’ils n’avaient pas reçu de corticostéroïdes depuis au moins quatre semaines avant la première dose du médicament à l’étude. Les principaux critères d’exclusion comprenaient une maladie rénale, soit une créatinine supérieure à 1,5 fois la limite supérieure à la normale et une clairance de la créatinine inférieure à 50 mL/min ainsi qu’une condition cardiaque associée à l’allongement du QTc (plus de 470 ms).
Interventions : Les patients ont d’abord été stratifiés selon leur origine asiatique ou non asiatique, puis ils ont été répartis selon un ratio 2:1 pour recevoir l’osimertinib à une dose de 80 mg par voie orale une fois par jour ou la chimiothérapie. Les patients du groupe chimiothérapie recevaient la posologie standard associée à ce stade de CPNPC selon les recommandations du GEOQ, soit le pemetrexed à raison de 500 mg/m2 intraveineux (IV) en combinaison avec le carboplatine par voie intraveineuse (dose calculée en utilisant la formule de Calvert avec une cible d’aire sous la courbe de 5) ou le cisplatine à 75 mg/m2 par voie intraveineuse toutes les trois semaines jusqu’à un maximum de six cycles11,12. Un traitement de maintien avec le pemetrexed était possible pour les patients dont la maladie n’avait pas progressé après quatre cycles de chimiothérapie.
Les traitements se poursuivaient jusqu’à la confirmation de la progression de la maladie, au développement d’effets indésirables incommodants ou au moment où le patient ou le spécialiste désirait cesser le traitement. Selon un amendement au protocole initial, il était permis aux patients recevant la chimiothérapie de la remplacer par l’osimertinib si la maladie progressait de façon évidente (cross-over). La tumeur était évaluée toutes les six semaines jusqu’à la confirmation de la progression. Le suivi de la survie était effectué à la même fréquence. L’innocuité des différents régimes utilisés était mesurée toutes les trois semaines.
Points évalués : L’objectif primaire visait à évaluer la durée de la survie sans progression (SSP) selon les critères RECIST version 1.1. L’analyse de cet objectif portait sur tous les patients présentant une progression, même ceux ayant changé de traitement en cours d’étude. Un groupe indépendant a également effectué à l’aveugle l’analyse de la SSP. Les principaux objectifs secondaires concernaient le taux de réponse objectivée, la durée de la réponse, la survie globale (SG), les symptômes rapportés par les patients de même que le profil de sécurité.
Des sous-groupes prédéfinis ont été formés pour l’analyse de deux objectifs, soit la durée de la SSP et le taux de réponse objectivée. En effet, les résultats étaient stratifiés selon que la mutation des patients était prouvée ou non au moyen d’une biopsie tissulaire ou d’un échantillon d’acide désoxyribonucléique (ADN) plasmatique et en fonction de la présence ou non de métastase cérébrale au diagnostic.
Résultats : Au total, 1036 dossiers ont été analysés, ce qui a mené à l’admission de 419 patients. À la suite de la répartition aléatoire, 219 patients ont formé le groupe osimertinib, tandis que 136 des 140 patients ont reçu le traitement de chimiothérapie (figure 1). Les caractéristiques démographiques et cliniques sont décrites dans le tableau I. Quant à l’origine ethnique des participants, environ 65 % des patients des deux groupes étaient asiatiques.
Figure 1 Répartition des patients a
a Adapté de la figure S.1 de l’appendice de Mok et coll.1
Tableau I Principales caractéristiques de base des participantsa

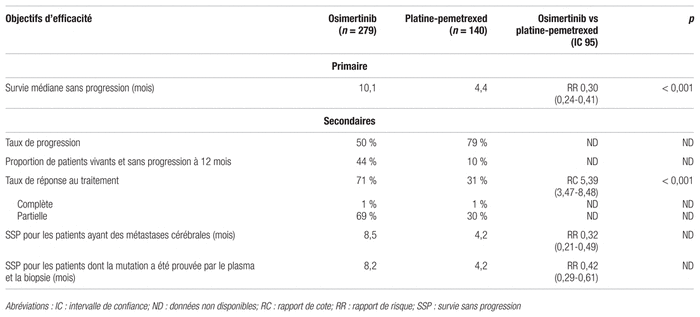
La durée moyenne du suivi a été de 8,3 mois. La durée moyenne du traitement du groupe osimertinib a été de 8,6 mois comparativement à 74 % des patients qui ont terminé au moins quatre cycles de chimiothérapie. La progression de la maladie a été constatée chez 50 % des patients du groupe osimertinib et chez 79 % des patients utilisant la chimiothérapie. À l’arrêt de l’étude, 166 patients (59 %) du groupe osimertinib et 16 patients (12 %) du groupe chimiothérapie recevaient toujours le traitement qui leur avait été prescrit initialement. La proportion de patients du groupe chimiothérapie ayant changé de traitement en faveur de l’osimertinib était de 59 %. Ainsi, la médiane de la SSP au sein du groupe osimertinib a été évaluée à 10,1 mois contre 4,4 mois (rapport de risques [RR] : 0,30; intervalle de confiance [IC 95 %] 0,23–0,41, p < 0,001). La SSP estimée à 12 mois était de 44 % dans le groupe osimertinib et de 10 % dans le groupe platine-pemetrexed. Dans le sous-groupe de patients ayant des métastases cérébrales, la survie sans progression a été évaluée à 8,5 mois dans le groupe osimertinib contre 4,2 mois dans le groupe chimiothérapie (RR : 0,32; IC 95 % : 0,21–0,49). Le taux de réponse observé dans le groupe osimertinib était de 71 % (IC 95 % : 65–76) contre 31 % (IC 95 % : 24–40) au sein du groupe comparateur (rapport de cote [RC] : 5,39 IC 95 % : 3,47–8,48, p < 0,001). La survie sans progression des patients dont la mutation T790M s’est confirmée tant sur le plan plasmatique (liquid biopsy) que tissulaire (biopsie standard), était respectivement de 8,2 mois et 4,2 mois pour les groupes osimertinib et chimiothérapie (RR : 0,42; IC 95 % : 0,29–0,61). Les résultats sont détaillés dans le tableau II.
Tableau II Principaux résultats d’efficacité
L’analyse de sécurité a démontré que 98 % des patients du groupe osimertinib et 99 % des patients recevant la chimiothérapie subissaient des effets indésirables. La proportion de patients recevant l’osimertinib et la chimiothérapie qui subissaient des effets indésirables limités au grade 1 était respectivement de 33 % et de 11 %. Vingt-trois pour cent (23 %) des patients du groupe osimertinib et 47 % de ceux du groupe chimiothérapie ont présenté des effets indésirables de grade égal ou supérieur à 3. Le taux d’abandon du traitement lié aux effets indésirables était de 7 % dans le groupe osimertinib et de 10 % dans le groupe platine-pemetrexed. Quatre patients du groupe osimertinib et un patient du groupe chimiothérapie ont subi un effet indésirable fatal. Les principaux effets indésirables rapportés au sein du groupe osimertinib étaient la diarrhée (41 %), les éruptions cutanées (34 %), la xérose (23 %) et les paronychies (22 %). Les effets indésirables les plus rapportés dans le groupe chimiothérapie étaient les nausées (49 %), une diminution de l’appétit (36 %), la constipation (35 %) et l’anémie (30 %). Il faut également noter que neuf patients du groupe osimertinib ont présenté une pneumopathie interstitielle comparativement à un seul patient du groupe chimiothérapie. De plus, sept patients du groupe osimertinib ont présenté une augmentation de l’intervalle QT, contre un seul patient du groupe chimiothérapie.
L’étude AURA 3 est la première étude de phase III à répartition aléatoire qui compare l’osimertinib à la chimiothérapie1. Elle fait suite aux études AURA et AURA 29,10. Dans l’étude AURA 3, l’osimertinib a permis un gain de SSP de 5,7 mois, comparativement au régime platine-pemetrexed, de même qu’une diminution significative du risque relatif de progression de 70 %. Le risque de progression a d’ailleurs diminué d’au moins 50 % avec l’osimertinib au sein de tous les sous-groupes à l’étude, y compris pour les patients atteints de métastases cérébrales. D’autre part, la probabilité d’obtenir une réponse avec l’osimertinib par rapport à la chimiothérapie a été plus élevée. Les résultats sont conformes à ceux obtenus dans les études AURA précédentes9,10.
Les patients recevant l’osimertinib ont présenté moins d’effets indésirables de grade égal ou supérieur à 2, comparativement à ceux du groupe chimiothérapie. Les principaux effets indésirables rencontrés avec l’osimertinib étaient la diarrhée, les éruptions cutanées, les paronychies ainsi que la xérose. Ces effets étaient également le plus souvent rapportés par les études AURA précédentes, ainsi que par la monographie du fabricant8,9,10. Bien que l’osimertinib ait été associé à un taux d’arrêt de traitement plus faible que la chimiothérapie en raison d’un effet indésirable, cette différence ne semble pas cliniquement significative (7 % contre 10 %).
Les résultats concernant la SSP et le taux de réponse objectivée n’ont pas montré de différence significative entre le sous-groupe de patients présentant une mutation T790M positive avérée par la biopsie ou le plasma et la population en intention de traiter. Les résultats de l’étude AURA 3 concordent avec ceux d’une sous-analyse de l’étude AURA, dans laquelle Oxnard et coll. ont comparé les taux de réponse des patients présentant une mutation T790M positive révélée par la biopsie et/ou le plasma à ceux obtenus par des patients dont les deux mêmes types de prélèvements révélaient une mutation négative13. Tout comme Oxnard et coll., les auteurs de l’étude AURA 3 concluent qu’il faudrait pratiquer une biopsie de la tumeur des patients dont la maladie a progressé sous un ITK de l’EGFR, mais dont la mutation T790M est négative à l’examen plasmatique13. La meilleure technique connue à l’heure actuelle pour détecter la mutation T790M demeure controversée14.
Par ailleurs, des résultats préliminaires de l’étude BLOOM démontrent que l’osimertinib semble mieux pénétrer le système nerveux central comparativement aux autres ITK de l’EGFR. Cette étude de phase 1 a évalué l’efficacité de l’osimertinib auprès de patients ayant développé des métastases cérébrales à la suite d’une thérapie à base d’un ITK de l’EGFR. Parmi les 23 patients qui ont été évalués par une imagerie cérébrale, dix ont présenté une diminution des lésions15. Les résultats de l’étude AURA 3 sont complémentaires à ceux obtenus dans l’étude BLOOM15. Toutefois, l’étude BLOOM avait augmenté la dose d’osimertinib à 160 mg par jour15.
Le groupe comparateur choisi par les investigateurs est une force de l’étude. En effet, la thérapie à base de platine et de pemetrexed constitue le traitement standard pour les patients atteints d’un CPNPC localement avancé ou métastatique ayant progressé sous un ITK de l’EGFR7. La SSP de 4,4 mois de même que le taux de réponse objectivée de 31 % observé avec cette chimiothérapie sont conformes aux résultats de l’étude IMPRESS (5,4 mois et 34 %). Cette dernière était un essai contrôlé à répartition aléatoire qui a évalué les avantages à poursuivre l’administration du gefitinib en plus d’une chimiothérapie à base de platine et de pemetrexed à des patients ayant progressé sous un ITK de l’EGFR en première ligne16. D’autre part, l’étude AURA 3 détient une bonne validité externe, puisqu’elle présente peu de critères d’inclusion et d’exclusion. Les critères utilisés sont similaires à ceux retrouvés au sein d’autres études évaluant l’effet des thérapies ciblées pour les CPNPC17,18. Toutefois, les patients avec une clairance de la créatinine inférieure à 50 mL/min en étaient exclus. Les auteurs ne justifient pas l’application de ce critère d’exclusion à l’ensemble des patients. Bien que le protocole de recherche ne soit pas à double insu, l’analyse de l’objectif primaire a été conduite à l’aveugle par des radiologistes de centres indépendants. De plus, la stratification de la population en différents sous-groupes a diminué le risque de biais de confusion. Les caractéristiques cliniques et démographiques des sujets sont bien détaillées et similaires dans les deux groupes. Par ailleurs, le nombre de patients inclus dans l’étude semble suffisant selon la puissance statistique attendue.
Les auteurs n’abordent pas les forces et les limites de l’étude dans la discussion de l’article, ce qui en constitue une faiblesse. D’autre part, le choix de la SSP plutôt que de la SG comme objectif principal d’efficacité est discutable, étant donné l’agressivité du CPNPC. Les auteurs justifient ce choix dans le protocole en mentionnant que le changement de traitement permis à la progression de la maladie diminue la validité de la SG. En effet, le risque de biais de confusion associé à la SG tend à augmenter, puisque 59 % des patients du groupe chimiothérapie ont reçu l’osimertinib au moment de la progression du cancer. Par ailleurs, la puissance statistique de l’étude a été réduite de 90 à 80 % à la suite de trois amendements au protocole, ce qui diminue la précision des résultats. D’autre part, les auteurs ne précisent pas dans quelle proportion les patients du groupe chimiothérapie ont reçu le carboplatine ou le cisplatine. Il aurait été pertinent de prendre en considération cette information pour l’interprétation des résultats puisque, malgré un meilleur profil de sécurité du carboplatine, les données d’efficacité de cette molécule sont plus faibles que celles du cisplatine pour le traitement du CPNPC19.
L’étude AURA 3 démontre les effets bénéfiques de l’ajout de l’osimertinib à la thérapie des patients atteints de CPNPC localement avancé ou métastatique ayant progressé sous un ITK de l’EGFR. La diminution du risque de progression de 70 % en présence de l’osimertinib se révèle cliniquement significative. D’autre part, l’efficacité observée chez les patients atteints de métastases cérébrales est intéressante, étant donné le mauvais pronostic attaché à ce type d’atteinte. De plus, l’osimertinib présente un profil de sécurité avantageux par rapport à la chimiothérapie, et la prise orale réduit les déplacements réguliers des patients à l’hôpital. Cette thérapie ciblée permet donc d’offrir aux patients une solution supplémentaire avant le passage à la chimiothérapie. La population à l’étude est représentative de celle des centres d’oncologie québécois. Malgré le fait que la majorité des patients étaient d’origine asiatique, les résultats reflètent bien la prédominance de la mutation EGFR au sein de cette ethnie. Toutefois, le coût de l’osimertinib représente environ 10 000 $ par mois et par patient, ce qui n’est pas négligeable. Actuellement, la compagnie AstraZeneca rembourse la totalité du montant au moyen d’un programme de compassion. Dans son avis de juin 2017, l’INESSS recommande au ministre de ne pas inscrire l’osimertinib aux listes de médicaments jusqu’à ce que des mesures d’atténuation du fardeau économique soient prises20.
De plus, certains auteurs s’intéressent à la place potentielle de l’osimertinib comme thérapie de première ligne. L’étude FLAURA a comparé l’efficacité de l’osimertinib à celle du gefitinib ou de l’erlotinib comme traitement de première intention du CPNPC localement avancé ou métastatique, en présence de la mutation EGFR avec délétion de l’exon 19 ou L858R et en l’absence de la mutation T790M21. La survie sans progression dans le groupe osimertinib était de 18,9 mois comparativement à 10,2 mois dans le groupe ITK de première génération malgré des taux de réponse comparables (80 % vs 76 %). Par ailleurs, 6 % des patients du groupe osimertinib ont présenté une progression de la maladie affectant le système nerveux central comparativement à 15 % des patients recevant un ITK de l’EGFR de première génération. En outre, l’étude de phase 2 AZENT évaluera l’efficacité de l’osimertinib en première ligne, pour les patients qui présentent les mutations EGFR et T790M lors du diagnostic22.
L’étude AURA 3 démontre que l’osimertinib constitue une option intéressante comme thérapie de deuxième ligne pour les patients atteints d’un CPNPC localement avancé ou métastatique ayant progressé sous un ITK de l’EGFR et porteur de la mutation T790M. L’osimertinib permet de prolonger la SSP par rapport à la chimiothérapie, tout en présentant un profil de sécurité favorable. Des mesures d’atténuation du fardeau économique associé au prix de l’osimertinib devront être prises afin que cette thérapie soit largement disponible aux patients qui en auront besoin. Ainsi, la place de l’osimertinib dans la prise en charge du cancer du poumon non à petites cellules avec mutation de l’EGFR devrait se préciser dans le futur.
Aucun financement avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours PHA-6074 Information sur les médicaments basée sur la preuve de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable. Une autorisation écrite a été obtenue de cette personne.
1. Mok TS, Wu YL, Ahn MJ, Garassino MC, Kim HR, Ramalingam SS et coll. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017;376:629–40.
2. Cancer Today - international agency for research on cancer. Cancer fact sheets: lung cancer cancer. Cancer Today IARC. [en ligne] https://gco.iarc.fr/today/fact-sheets-cancers?cancer=11&type=0&sex=0 (site visité le 21 août 2017).
3. Société canadienne du cancer. Tumeurs malignes du poumon. [en ligne] http://www.cancer.ca/fr-ca/cancer-information/cancer-type/lung/lung-cancer/non-small-cell-lung-cancer/?region=on (site visité le 19 juin 2017).
4. Ellison G, Zhu G, Moulis A, Dearden S, Speake G, McCormack R. EGFR mutation testing in lung cancer: a review of available methods and their use for analysis of tumour tissue and cytology samples. J Clin Pathol 2013;66:79–89.

5. Ettinger DS, Wood DE, Aisner DL, Akerley W, Bauman J, Chirieac LR et coll. Non-small cell lung cancer, Version 5.2017, NCCN Clinical practice guidelines in oncology. J Natl Compr Canc Netw 2017;15:504–35.
6. Yu HA, Arcila ME, Rekhtman N, Sima CS, Zakowski MF, Pao W et coll. Analysis of tumor specimens at the time of acquired resistance to EGFR-TKI therapy in 155 patients with EGFR-mutant lung cancers. Clin Cancer Res 2013;19:2240–7.

7. Institut national d’excellence en santé et en services sociaux (INESSS) et Groupe d’étude en oncologie du Québec (GEOQ). Algorithmes d’investigation, de traitement et de suivi Cancer du poumon. INESSS et GEOQ. [en ligne] http://www.geoq.info/pro/documents/algos/Algorithme_CancerduPoumon_juillet2014.pdf (site visité le 20 août 2017).
8. Astrazeneca Canada inc. Monographie de produit : Tagrisso. [en ligne] https://www.astrazeneca.ca/content/dam/az-ca/frenchassets/Ourmedicines/Tagrisso%20-%20Monographie.pdf (site visité le 19 juin 2017).
9. Janne PA, Yang JC, Kim DW, Planchard D, Ohe Y, Ramalingam SS et coll. AZD9291 in EGFR inhibitor-resistant non-small-cell lung cancer. N Engl J Med 2015;372:1689–99.
10. Goss G, Tsai CM, Shepherd FA, Bazhenova L, Lee JS, Chang GC et coll. Osimertinib for pretreated EGFR Thr790Met-positive advanced non-small-cell lung cancer (AURA2): a multicentre, open-label, single-arm, phase 2 study. Lancet Oncol 2016;17:1643–52.
11. Groupe d’étude en oncologie du Québec. Guide d’administration protocole cisplatine-pemetrexed. [en ligne] http://www.geoq.info/fr/pro/guide-administration-protocole-chimio-478-siteanatomique-66/doc-1768 (site visité le 20 août 2017).
12. Groupe d’étude en oncologie du Québec. Guide d’administration protocole carboplatine-pemetrexed. [en ligne] http://www.geoq.info/fr/pro/protocole-chimio-504-site-anatomique-66 (site visité le 20 août 2017).
13. Oxnard GR, Thress KS, Alden RS, Lawrance R, Paweletz CP, Cantarini M et coll. Association between plasma genotyping and outcomes of treatment with osimertinib (AZD9291) in advanced non-small-cell lung cancer. J Clin Oncol 2016;34:3375–82.

14. Juan O, Popat S. Treatment choice in epidermal growth factor receptor mutation-positive non-small cell lung carcinoma: latest evidence and clinical implications. Ther Adv Med Oncol 2017;9:201–16.

15. Yang JC, Cho BC, Kim DW, Kim SW, Lee JS, Su WC et coll. Osimertinib for patients (pts) with leptomeningeal metastases (LM) from EGFR-mutant non-small cell lung cancer (NSCLC): Updated results from the BLOOM study. J Clin Oncol 2017;35:2020.
16. Soria JC, Wu YL, Nakagawa K, Kim SW, Yang JJ, Ahn MJ et coll. Gefitinib plus chemotherapy versus placebo plus chemotherapy in EGFR-mutation-positive non-small-cell lung cancer after progression on first-line gefitinib (IMPRESS): a phase 3 randomised trial. Lancet Oncol 2015;16:990–8.
17. Wu YL, Zhou C, Hu CP, Feng J, Lu S, Huang Y et coll. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial. Lancet Oncol 2014;15:213–22.
18. Urata Y, Katakami N, Morita S, Kaji R, Yoshioka H, Seto T et coll. Randomized phase III study comparing gefitinib with erlotinib in patients with previously treated advanced lung adenocarcinoma: WJOG 5108L. J Clin Oncol 2016;34:3248–57.
19. Azzoli CG, Kris MG, Pfister DG. Cisplatin versus carboplatin for patients with metastatic non-small-cell lung cancer an old rivalry renewed. J Natl Cancer Inst 2007;99:828–9.
20. Institut national d’excellence en santé et en services sociaux (INESSS). TAGRISSO – Cancer du poumon non à petites cellules. Avis de refus d’inscription aux listes des médicaments. [en ligne] http://www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/Juin_2017/Tagrisso_2017_06.pdf (site visité le 20 juin 2017).
21. U.S. National Institutes of Health. AZD9291 Versus gefitinib or erlotinib in patients with locally advanced or metastatic non-small cell lung cancer (FLAURA). [en ligne] https://clinicaltrials.gov/ct2/show/NCT02296125 (site visité le 22 août 2017).
22. U.S. National Institutes of Health. Osimertinib (AZD9291) in First-line Locally Advanced or Metastatic NSCLC Patients With EGFR and EGFR T790M (AZENT). [en ligne] https://clinicaltrials.gov/ct2/show/NCT02841579 (site visité le 22 août 2017).
PHARMACTUEL, Vol. 51, No. 1, 2018