Figure 1 Répartition des patients
Abréviation : tx = traitement
Adapté de la Figure S1 de l’Appendix de Bellmunt et coll., permission obtenue du N Engl J Med 1
a Patients en cours de traitement au moment de l’analyse de données
Marianne Bouchard1,2,3, Pharm.D., M.Sc., Maude Bachand-Fournier1,2,3, Pharm.D., M.Sc., Reda Rais1,2,4, Pharm.D., M.Sc., Julie-Rose St-Pierre1,2,4, Pharm.D., M.Sc.
Reçu le 21 septembre 2017: Accepté après révision par les pairs le 27 février 2018
Titre : Pembrolizumab as second-line therapy for advanced urothelial carcinoma. N Engl J Med 2017;376:1015-261.
Auteurs : Bellmunt J, de Wit R, Vaughn DJ, Fradet Y, Lee JL, Fong L et coll. pour les chercheurs de KEYNOTE-045
Commanditaires : Cette étude a été financée par la compagnie Merck qui a participé à l’élaboration de l’étude, à l’analyse statistique, à l’interprétation des résultats, au financement des statisticiens d’un comité externe lors des analyses intérimaires, ainsi qu’à la rédaction et à la préparation de l’article.
Cadre de l’étude : En 2017, le cancer de la vessie se situait au quatrième rang des cancers les plus diagnostiqués chez les hommes au Canada et au 12e rang chez les femmes2. Il serait responsable de plus de 4 % de tous les cancers au Canada, tous sexes confondus2.
Différentes combinaisons de chimiothérapie à base de platine ont été étudiées pour le traitement de première ligne de la maladie métastatique, notamment MVAC (méthotrexate, vinblastine, doxorubicine et cisplatine), GC (gemcitabine et cisplatine), PCG (paclitaxel, cisplatine et gemcitabine) et carboplatine-gemcitabine3. Elles demeurent le traitement standard1. La survie globale moyenne d’un patient atteint de maladie métastatique recevant le protocole MVAC en première ligne est de 15 mois4. Quant aux patients ayant progressé après un traitement à base de platine, la survie globale ne serait que d’environ cinq mois en l’absence de traitement5. Parmi les options thérapeutiques actuelles, on trouve en monothérapie les taxanes, la gemcitabine, le pemetrexed et la vinflunine (disponible uniquement en Europe)3,5. Il est aussi possible d’administrer la combinaison de chimiothérapie que le patient n’a pas reçue en première ligne3,6. La faible quantité de données disponibles et d’options de traitement justifie donc le besoin de nouvelles avenues thérapeutiques1,7.
Le pembrolizumab est un anticorps monoclonal humanisé de type IgG4k8. L’étude de phase 1b KEYNOTE-012 et l’étude de phase 2 KEYNOTE-052 ont démontré son activité antitumorale pour le traitement du carcinome urothélial avancé9,10. En inhibant le récepteur programmed cell death-1 PD-1, le pembrolizumab bloque son interaction avec les ligands programmed death-ligand PD-L1 et PD-L2, ce qui annule l’inactivation des lymphocytes T et donc l’inhibition de la réponse immunitaire antitumorale8.
Protocole de recherche : KEYNOTE-045 est une étude à répartition aléatoire de phase III, ouverte et internationale. Elle compare le pembrolizumab à la chimiothérapie standard pour les patients souffrant de cancer urothélial avancé ayant récidivé ou progressé après une chimiothérapie à base de platine.
Patients : Pour être inclus, les patients devaient être âgés d’au moins 18 ans et avoir une confirmation histologique ou cytologique de carcinome urothélial. Les autres critères d’inclusion comprenaient la prédominance histologique de cellules transitionnelles, la progression après une chimiothérapie à base de platine pour une maladie avancée ou pour une récidive moins de 12 mois après un traitement adjuvant ou néoadjuvant, le traitement par deux lignes ou moins de traitement de chimiothérapie pour la maladie avancée, la présence d’au moins une lésion mesurable selon les critères de la ligne directrice Response Evaluation Criteria In Solid Tumor RECIST version 1.1, et un score de statut de performance Eastern Cooperative Oncology Group (ECOG) de 0, 1 ou 2. Les patients avec un statut de performance ECOG de 2 et ayant un ou plusieurs facteurs de mauvais pronostic pour un traitement de deuxième ligne étaient exclus de l’étude.
Interventions : Les patients ont été répartis aléatoirement selon un ratio 1:1 dans les bras pembrolizumab ou chimiothérapie. La chimiothérapie était au choix de l’investigateur, parmi les trois groupes suivants : docétaxel 75 mg/m2, paclitaxel 175 mg/m2, vinflunine 320 mg/m2. Chaque traitement était administré par perfusion intraveineuse toutes les trois semaines. Une stratification de la répartition aléatoire a été effectuée selon quatre critères : le statut de performance ECOG (0 et 1 vs 2), la présence ou non de métastases hépatiques, le niveau d’hémoglobine (< ou ≥ 100 g/L) et le temps écoulé depuis l’administration de la dernière dose de chimiothérapie (< ou ≥ trois mois). Le traitement se poursuivait jusqu’à progression de la maladie selon l’évaluation des critères RECIST, mais pouvait être prolongé selon l’évaluation radiographique de l’investigateur et si le statut clinique du patient était stable. La conception de l’étude ne prévoyait aucun croisement. L’expression du PD-L1 était évaluée durant la période de sélection des patients comme critère d’inclusion supplémentaire. Un comité indépendant procédait à l’évaluation de la réponse au traitement à des moments fixes par des imageries de la tumeur ainsi que par l’évaluation des critères RECIST.
Points évalués : Les deux objectifs primaires de cette étude concernant l’efficacité visaient la survie globale (SG) et la survie sans progression (SSP). Ils étaient évalués à la fois dans la population totale et dans le sous-groupe de population ayant un score d’expression du PD-L1 ≥ 10 %. Comme objectifs secondaires, on retrouvait le taux de réponse objective, définie comme le pourcentage de réponse partielle et complète, la durée de réponse objectivée, définie comme l’intervalle de temps entre la réponse objective et la progression ou le décès, et l’innocuité. Cette dernière était analysée chez tous les patients ayant reçu au minimum une dose d’un traitement étudié. Pour ce qui est des objectifs touchant l’efficacité, ils étaient analysés selon la population en intention de traitement, c’est-à-dire ayant été répartis aléatoirement dans un des groupes.
Résultats : Entre novembre 2014 et 2015, 748 patients de 120 sites différents dans 29 pays, dont le Canada, les États-Unis, des pays d’Amérique latine, d’Europe et d’Asie, ont été enrôlés. Parmi ces patients, 542 ont été répartis aléatoirement et 521 ont reçu au moins une dose de traitement. La répartition aléatoire a attribué 270 patients au groupe pembrolizumab et 272 au groupe chimiothérapie. Le traitement des patients appartenant à ce dernier groupe était laissé au choix de l’investigateur, si bien que 84 patients ont reçu le docétaxel, 84 patients ont reçu le paclitaxel et 87 patients ont reçu la vinflunine. Par ailleurs, les caractéristiques de base des patients étaient similaires entre les deux groupes, tels que l’illustre le tableau I. Le score positif d’expression du marqueur tumoral PD-L1 ≥ 10 % a été atteint par 74 patients (27 %) dans le groupe pembrolizumab et 90 patients (33 %) dans le groupe chimiothérapie. La durée médiane de suivi a été de 14,1 mois (9,9–22,1) avec une durée médiane de traitement de 3,5 mois dans le groupe pembrolizumab et 1,5 mois dans le groupe chimiothérapie. L’étude a été interrompue prématurément lors de la deuxième analyse intérimaire, 22 mois après le début de l’étude, quand le seuil de supériorité du pembrolizumab sur le plan de la SG dans les deux populations a été atteint. Une thérapie subséquente a été administrée à 68 patients du groupe pembrolizumab et à 91 du groupe chimiothérapie, dont respectivement deux et 35 traitements d’immunothérapie.
Tableau I Caractéristiques de base des patientsa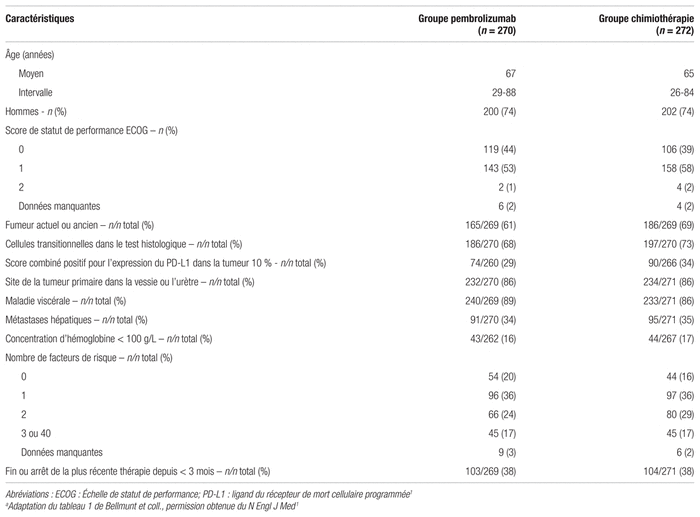
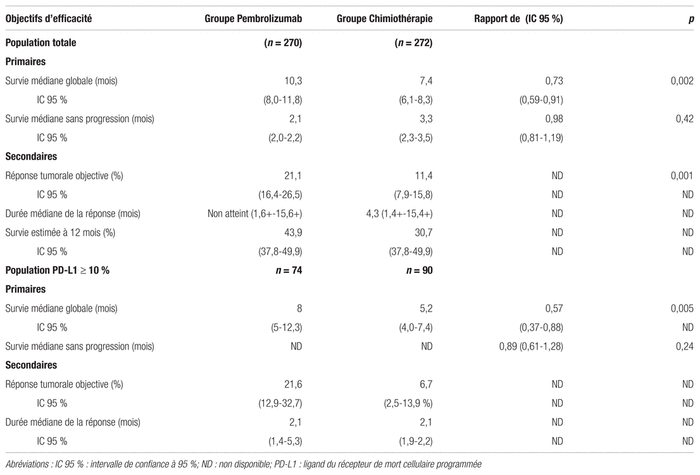
Efficacité : Dans la population totale, la SG s’est significativement allongée pour atteindre 10,3 mois dans le groupe pembrolizumab, comparativement à 7,4 mois dans le groupe chimiothérapie (rapport de risque [RR] : 0,73; intervalle de confiance à 95 % [IC 95 %] 0,59–0,91, p = 0,002). Les principaux résultats sont présentés au tableau II. Aucune différence statistiquement significative n’a été démontrée en ce qui a trait à la SSP dans les deux populations. Le groupe pembrolizumab s’est également démarqué quant au taux de réponse objective avec 21,1 % (IC 95 % : 16,4–26,5), comparativement à 11,4 % dans le groupe chimiothérapie (IC 95 %, 7,9–15,8) (p = 0,001). Des données semblables sont observées dans la population avec un score d’expression du PD-L1 ≥ 10 %.
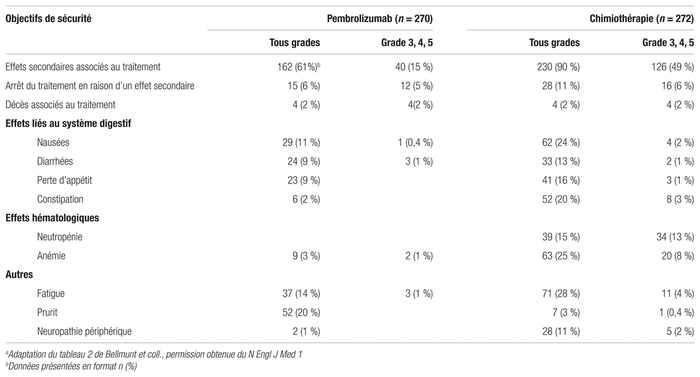
Innocuité : L’incidence globale d’effets secondaires liés au traitement était en faveur du groupe pembrolizumab avec 60,9 % comparativement à 90,2 % dans le groupe chimiothérapie. On observe cette même tendance pour les effets secondaires sévères (grade 3, 4, 5) avec respectivement 15 % et 49,4 %. Les principaux résultats d’innocuité sont présentés au tableau III. Dans le groupe pembrolizumab, 15 patients (5,6 %) ont dû cesser le traitement en raison d’effets secondaires comparativement à 28 patients (11 %) dans le groupe chimiothérapie. Tous grades confondus, les effets secondaires les plus fréquents qu’ont subis les patients ayant reçu le pembrolizumab étaient le prurit (19,5 %), la fatigue (13,9 %) et les nausées (10,9 %). Les patients ayant reçu la chimiothérapie présentaient plus fréquemment de l’alopécie (37,6 %), de la fatigue (27,8 %) et de l’anémie (24,7 %).
|
|
||
|
Figure 1 Répartition des patients |
||
KEYNOTE-45 a permis de démontrer des avantages en termes de SG et de tolérance au traitement en faveur du groupe pembrolizumab comparativement aux chimiothérapies standards dans le traitement de deuxième ligne du carcinome urothélial avancé. Les résultats relatifs aux objectifs primaires nécessitent toutefois d’être interprétés à la lumière de deux aspects intéressants. Premièrement, les intervalles de confiance de la SG s’entrecoupent légèrement (10,3 mois; IC 95 % 8 à 11,8 mois contre 7,4 mois IC 95 % 6,1 à 8,3 mois). Dans l’absolu, il s’agit d’une amélioration de la survie d’environ trois mois, ce qui est cliniquement significatif pour le traitement de deuxième ligne d’un cancer avancé. Deuxièmement, la SSP ne s’est pas améliorée avec l’usage du pembrolizumab. L’article mentionne que la SSP à 12 mois a été grandement influencée à la baisse par le faible taux de réponse objective dans les deux groupes (< 30 %). Cette mesure est de plus en plus critiquée dans la littérature en oncologie, puisqu’elle n’est pas adaptée à l’usage de l’immunothérapie1,11. Enfin, le score d’expression du PD-L1 n’a pas influencé les résultats des objectifs primaires.
Quant à la SG du groupe chimiothérapie (7,4 mois), elle est comparable à ce qu’on trouve dans la littérature scientifique3. De plus, l’étude a montré un net avantage en faveur du pembrolizumab pour la fréquence des effets indésirables liés au traitement (60,9 % contre 90,2 %) et pour les effets secondaires sévères (15 % contre 49,4 %). Les résultats sont toutefois présentés sans intervalle de confiance ou de seuil de significativité statistique. L’effet secondaire le plus fréquemment associé au pembrolizumab était le prurit (19,5 %). Cet effet indésirable peut être contrôlé avec des corticostéroïdes topiques ou des antihistaminiques12. Les problèmes rares d’origine immune (pneumonite, troubles thyroïdiens, néphrite, etc.) ont été décrits dans des proportions similaires aux autres études effectuées sur le pembrolizumab1,13.
L’étude présente plusieurs points forts. En plus d’être multicentrique, la population (n = 542) est très élevée comparativement aux autres études réalisées dans ce domaine3,14. Bien que l’étude ne soit pas menée à l’insu, ce qui est souvent le cas en oncologie, les auteurs se sont assuré de proposer une méthodologie robuste en termes de puissance, de seuil de significativité statistique et en proposant tout au moins que l’efficacité du traitement soit évaluée à l’insu par un comité de radiologistes indépendants. Les groupes à l’étude étaient bien équilibrés, sans différences significatives (tableau I). Plusieurs outils validés ont été utilisés dans le cadre de l’étude (par exemple les critères RECIST, NCITC, ECOG, etc.) et les résultats/impacts cliniques ont été mesurés selon des indicateurs qui se trouvent dans la plupart des études en oncologie (SG, SSP, taux de réponse objective, gradation des effets secondaires, etc.). Toutefois, les critères RECIST 1.1 utilisés ne sont pas spécifiques à l’immunothérapie11.
Les points faibles de l’étude comprennent le fait que l’étude n’a pas été menée à l’insu, tant pour les patients que pour l’équipe traitante. Toutefois, cette pratique est comparable à la plupart des études d’oncologie. Cette caractéristique de l’étude pourrait justifier le plus grand nombre d’abandons dans le groupe chimiothérapie, ce qui entraîne un biais d’information. Une autre des limites très importantes de l’étude est une faible validité externe, étant donné que la plupart des patients rencontrés en pratique sont plus âgés que ceux de KEYNOTE-45, avec des scores ECOG moins avantageux (2 ou plus)2. Il est mentionné dans l’étude que plusieurs patients ont reçu un traitement après la progression sous pembrolizumab, sans toutefois présenter les types de traitement reçus, ce qui est une source de biais d’information importante, puisque cela peut prolonger la survie des patients. De plus, il n’y a aucune information concernant les pertes au suivi, ce qui peut induire un biais de sélection potentiel. Il est également important de souligner l’importante contribution de Merck, le fabricant du KeytrudaMD, dans le cadre de cette étude.
L’interprétation des résultats est toutefois limitée par l’absence de certains traitements couramment utilisés en pratique au Québec, comme le protocole MVAC15. Par ailleurs, la vinflunine n’est pas disponible au Canada, ce qui en fait un comparateur sans intérêt pour la pratique d’ici. Enfin, les auteurs ne mettent pas en relation l’efficacité du traitement et son prix, qui est élevé, soit environ 12 000 $ par mois de traitement16.
Cette étude est donc la première comparant un anticorps monoclonal avec la chimiothérapie chez une population atteinte d’un carcinome urothélial avancé. D’autres anticorps monoclonaux sont aussi étudiés en carcinome urothélial avancé, mais aucune étude ne les a comparés directement entre eux. Présentement, l’atézolizumab est le seul ayant obtenu l’approbation de Santé Canada, qui soit accessible par un programme de compassion19. Le durvalumab, l’avelumab, le nivolumab et le pembrolizumab sont pour leur part approuvés par la Food and Drug administration (FDA) aux États-Unis pour le traitement de deuxième ligne du carcinome urothélial avancé20. Seul le pembrolizumab a fait l’objet d’une étude de phase III. L’utilisation de l’atézolizumab, du nivolumab, du durvalumab a été appuyée par des études de phase II et l’avelumab, par une étude de phase 1b21–24. Les résultats des différentes molécules sont comparables, bien que le pembrolizumab semble offrir une SG plus longue1. En effet, l’atézolizumab a donné des résultats de SG de 7,9 mois, le nivolumab 8,7 mois et les résultats pour le durvalumab ne sont pas publiés à ce jour21,22. Les profils de tolérance sont comparables entre les molécules25–26. Au moment de la rédaction, le pembrolizumab n’est pas remboursé au Québec, et les recommandations de l’Institut national d’excellence en santé et en services sociaux (INESSS) à cet effet sont toujours en attente. Aucun programme de compassion n’est en place pour cet agent.
L’étude KEYNOTE-45 a permis de positionner le pembrolizumab favorablement par rapport à la chimiothérapie pour le carcinome urothélial avancé réfractaire aux platines1. Le pembrolizumab a démontré une amélioration de la SG de trois mois comparativement à la chimiothérapie. Les résultats pour la SSP n’ont pas été significatifs. Le profil d’innocuité du pembrolizumab est avantageux, l’agent produit nettement moins de toxicités que la chimiothérapie. Il faudra déterminer la place que prendra le pembrolizumab en relation avec les autres anticorps monoclonaux, compte tenu de l’arrivée de l’atezolizumab sur le marché canadien19.
À la suite de la rédaction de cet article, l’INESSS a émis son positionnement sur le pembrolizumab en carcinome urothélial avancé27. Un avis de refus d’ajout comme médicament d’exception à la Liste des médicaments - Établissements a été publié en mars 2018. Bien que le profil d’effets secondaires de l’immunothérapie soit avantageux en comparaison à la chimiothérapie et que la valeur thérapeutique du pembrolizumab ait été reconnue par l’INESSS, le rapport coût efficacité a été jugé défavorable. Les coûts estimés s’élèvent à 58,7 M$ sur 3 ans.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours PHA-6074 Information sur les médicaments basée sur la preuve de la Faculté de pharmacie de l’Université Laval. Les auteurs en remercient la responsable. Une autorisation écrite a été obtenue de cette personne.
1. Bellmunt J, de Wit R, Vaughn DJ, Fradet Y, Lee JL, Fong L et coll. Prembrolizumab as second-Line therapy for advanced urothelial carcinoma. N Engl J Med 2017;376:1015–26.
2. Comité consultatif de la Société canadienne du cancer. Statistiques canadiennes sur le cancer 2017. 2017. [en ligne] http://www.cancer.ca/~/media/cancer.ca/CW/cancer%20information/cancer%20101/Canadian%20cancer%20statistics/Canadian-Cancer-Statistics-2017-FR.pdf?la=fr-CA (site visité le 20 juin 2017).
3. Yafi FA, North S, Kassouf W. First- and second-line therapy for metastatic urothelial carcinoma of the bladder. Curr oncol 2011;18:e25–34.
4. Von der Maase H, Sengelov L, Roberts JT, Ricci S, Dogliotti L, Oliver T et coll. Long-term survival results of a randomized trial comparing gemcitabine plus cisplatin, with methotrexate, vinblastine, doxorubicin, plus cisplatin in patients with bladder cancer. J Clin Oncol 2005;23:4602–8.
5. Bellmunt J, Theodore C, Demkov T, Komyakov B, Sengelov L, Daugaard G et coll. Phase III trial of vinflunine plus best supportive care compared with best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J Clin Oncol 2009;27:4454–61.
6. Han KS, Joung JY, Kim TS, Jeong IG, Seo HK, Chung J et coll. Methotrexate, vinblastine, doxorubicin and cisplatin combination regimen as salvage chemotherapy for patients with advanced or metastatic transitional cell carcinoma after failure of gemcitabine and cisplatin chemotherapy. Br J Cancer 2008;98:86–90.
7. Rouanne M, Loriot Y, Lebret T, Soria JC. Novel therapeutic targets in advanced urothelial carcinoma. Crit Rev Oncol Hematol 2016;98:106–15.
8. Merck Canada Inc. Monographie de produit : pembrolizumab (Keytruda) [en ligne] http://www.merck.ca/assets/fr/pdf/products/KEYTRUDA-PM_F.pdf (site visité le 20 juin 2017).
9. Plimack ER, Bellmunt J, Gupta S, Berger R, Chow LQ, Juco J et coll. Safety and activity of pembrolizumab in patients with locally advanced or metastatic urothelial cancer (KEYNOTE-012): a non-randomised, open-label, phase 1b study. Lancet Oncol 2017;18:212–20.
10. Balar A, Bellmunt J, O’Donnell P.H, Castellano D, Grivas P, Vuky J et coll. Pembrolizumab (pembro) as first-line therapy for advanced/unresectable or metastatic urothelial cancer: Preliminary results from the phase 2 KEYNOTE-052 study. Ann Oncol 2017;35(suppl. 6):284.
11. Emens LA, Butterfield LH, Hodi FS Jr, Marincola FM, Kaufman HL. Cancer immunotherapy trials: leading a paradigm shift in drug development. J Immunother Cancer 2016;19;4:42
12. Groupe d’étude en oncologie du Québec. ONCIBLE Guide de ressources : effets indésirables fréquents des thérapies ciblées. 2015. [en ligne] www.capho.org/sites/default/files/pagefiles/2015%20OnCible.pdf (site visité le 25 juin 2017).
13. Robert C, Schachter J, Long GV, Arance A, Grob JJ, Mortier L. Pembrolizumab versus ipilimumab in advanced melanoma. N Engl J Med 2015;372:2521–32.
14. Gupta S, Gill D, Poole A, Agarwal N. Systemic immunotherapy for urothelial cancer: current trends and future directions. Cancers (Basel) 2017;9:15.
15. Castonguay V, Dumas O. Protocoles de traitement. Service d’hémato-oncologie de l’HDQHDL. 8e éd. Québec: Les presses de l’Université Laval; 2016.
16. Institut national d’excellence en santé et en services sociaux. KEYTRUDAMC – Mélanome avancé ou métastatique. 2016. [en ligne] www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/Août_2016/Keytruda_2016_08.pdf (site visité le 26 juin 2017).
17. Lee JH, Kang SG, Kim ST, Kang SH, Choi IK, Park YJ et coll. Modified MVAC as a second-line treatment for patients with metastatic urothelial carcinoma after failure of gemcitabine and cisplatin treatment. Cancer Res Treat 2014;46:172–7.
18. Von der Maase H, Hansen SW, Roberts JT, Dogliotti L, Oliver T, Moore MJ et coll. Gemcitabine and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000;18:3068–77.
19. Santé Canada. Avis d’admissibilité à un avis de conformité avec conditions portant sur Tecentriq. 2017. [en ligne] http://www.hc-sc.gc.ca/dhp-mps/prodpharma/notices-avis/conditions/tecentriq-qn-aa-196843-fra.php (site visité le 26 juin 2017).
20. U.S. Food & Drug Administration. Hematology/oncology (cancer) approvals & safety notifications. 2017 [en ligne] https://www.fda.gov/drugs/informationondrugs/approveddrugs/ucm279174.htm (site visité le 26 juin 2017).
21. Rosenberg JE, Hoffman-Censits J, Powles T, van der Heijden MS, Balar AV, Necchi A et coll. Atezolizumab in patients with locally advanced and metastatic urothelial carcinoma who have progressed following treatment with platinum-based chemotherapy: a single-arm, multicentre, phase 2 trial. Lancet 2016;387:1909–20.
22. Sharma P, Retz M, Siefker-Radtke A, Baron A, Necchi A, Bedke J et coll. Nivolumab in metastatic urothelial carcinoma after platinum therapy (CheckMate 275): a multicentre, single-arm, phase 2 trial. Lancet Oncol 2017;18:312–22.
23. Massard C, Gordon MS, Sharma S, Rafii S, Wainberg ZA, Luke J et coll. Safety and efficacy of durvalumab (MEDI4736), an anti-programmed cell death ligand-1 immune checkpoint inhibitor, in patients with advanced urothelial bladder cancer. J Clin Oncol 2016;34:3119–25.
24. Apolo AB, Infante JR, Balmanoukian A, Patel MR, Wang D, Kelly K, et coll. Avelumab, an anti-programmed death-ligand 1 antibody, in patients with refractory metastatic urothelial carcinoma: results from a multicenter, phase Ib study. J Clin Oncol 2017;35:2117–24.
25. Bellmunt J, Powles T, Vogelzang NJ. A review on the evolution of PD-1/PD-L1 immunotherapy for bladder cancer: The future is now. Cancer Treat Rev 2017;54:58–67.
26. Farina MS, Lundgren KT, Bellmunt J. Immunotherapy in urothelial cancer: recent results and future perspectives. Drugs 2017;77:1077–89.
27. Institut national d’excellence en santé et en services sociaux. KEYTRUDA – Cancer urothélial, Avis de refus d’ajout d’une indication reconnue à la Liste Établissements – Médicament d’exception. 2018. [en ligne] https://www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/Avril_2018/Keytruda_2018_03.pdf (site visité le 28 mai 2018).
PHARMACTUEL, Vol. 51, No. 2, 2018