
Mélanie Gilbert1, B.Pharm., M.Sc., Martin Turgeon1, B.Pharm., M.Sc., Éric Deland2,3, MD, M.Sc., Marie-France Beauchesne1,4,5,6, B.Pharm., M.Sc., Pharm.D.
Reçu le 27 novembre 2017: Accepté après révision par les pairs le 7 mai 2018
Résumé
Objectifs : Cette étude visait à évaluer la conformité de la gestion des anticoagulants oraux directs en période périopératoire par rapport aux recommandations émises au CIUSSS de l’Estrie - CHUS.
Méthode : Il s’agit d’une étude rétrospective comportant une collecte des données dans les dossiers des patients ayant subi une chirurgie non urgente entre 2011 et 2015 au CIUSSS de l’Estrie - CHUS. Les délais de cessation et de reprise de l’anticoagulation ont été comparés aux délais recommandés dans le Guide sur les nouveaux anticoagulants oraux du CIUSSS de l’Estrie - CHUS afin de déterminer les taux de conformité de la pratique.
Résultats : Les données provenant de 90 patients sous anticoagulants oraux directs à dose thérapeutique ont été prises en compte. Les résultats ont démontré un taux de conformité global de 84,4 % en période préopératoire et de 69,3 % en période postopératoire.
Conclusion : L’évaluation de la conformité de la cessation préopératoire des anticoagulants oraux directs dépasse la valeur prédite de 70 %. Le taux de conformité global en période postopératoire est légèrement inférieur à la valeur prédite de 70 %. Ces résultats nous ont permis d’objectiver la pratique actuelle et pourront être comparés aux données d’essais cliniques à venir, afin d’encadrer et d’uniformiser l’utilisation des anticoagulants oraux directs en période périopératoire.
Mots clés : Anticoagulants oraux directs, chirurgie, embolies, saignements
Abstract
Objectives : The aim of this study was to assess the compliance of the perioperative management of direct oral anticoagulants with the guidelines published at the CIUSSS de l’Estrie-CHUS.
Method : A retrospective study was conducted using data collected from patients’charts who had undergone an elective surgery between 2011 and 2015 at the CIUSSS de l’Estrie-CHUS. The timing of cessation and resumption of anticoagulation was compared with the time points recommended in the “Guide sur les nouveaux anticoagulants oraux” of the CIUSSS de l’Estrie-CHUS to determine the rate of compliance of this practice.
Results : The data from 90 patients on therapeutic-dose direct oral anticoagulants were included. The results showed an overall preoperative compliance rate of 84.4 % and a postoperative compliance rate of 69.3 %.
Conclusion : The assessment of compliance of preoperative cessation of direct oral anticoagulants exceeded the predicted value of 70 %, while the overall postoperative rate of compliance was slightly less than the predicted value of 70 %. These results enabled us to document the current practice and will be compared with data from future clinical trials in order to provide guidance on and standardize the perioperative use of direct oral anticoagulants.
Keywords : Bleeding, direct oral anticoagulants, embolism, surgery
De nombreux patients nécessitent une anticoagulation à long terme. Lorsqu’ils subissent une intervention chirurgicale, l’anticoagulation doit souvent être interrompue. La nécessité d’interrompre la prise de l’anticoagulant avant une chirurgie élective et le moment de la reprise en période postopératoire dépendent du risque d’évènement thromboembolique ainsi que des risques de saignement associés à la chirurgie. La prévalence d’évènements thromboemboliques varie entre 0,3 et 4,6 % dans les 30 jours qui suivent l’intervention selon les sources consultées1, 2. La prévalence de saignements en période périopératoire varie entre 1,3 % et 3,2 % selon des études réalisées auprès de sujets recevant de la warfarine1,3. Jusqu’en 2011, le seul anticoagulant oral utilisé à dose thérapeutique au CIUSSS de l’Estrie - CHUS était la warfarine, pour lequel le ratio normalisé international (RNI) permet d’évaluer l’intensité de l’anticoagulation. En octobre 2011, le dabigatran, premier représentant des nouveaux anticoagulants oraux (NACO), a été rendu disponible au CIUSSS de l’Estrie - CHUS. Le rivaroxaban et l’apixaban ont par la suite été ajoutés au formulaire thérapeutique. Leur appellation a évolué au fil du temps, puisque les termes « anticoagulants oraux directs » (AOD) sont désormais utilisés pour représenter cette classe de molécules.
Contrairement à la warfarine, les AOD représentent un défi bien particulier en situation périopératoire. En effet, leurs durées d’action sont plus courtes que celle de la warfarine4–6. On doit également tenir compte de la demi-vie de chacun des agents pour connaître le moment opportun d’interruption avant l’intervention chirurgicale, puisque la durée de la demi-vie varie selon la fonction rénale des sujets7. De plus, il existe des paramètres de laboratoire nous permettant d’évaluer de façon sensible ou précise l’effet anticoagulant résiduel de tous les AOD avant une intervention chirurgicale, mais ils ne sont pas disponibles dans la majorité des milieux7. Finalement, outre le dabigatran, il n’y a pas encore d’antidote disponible commercialement au Canada pour renverser l’effet des AOD en situations urgentes8.
En 2014, le CIUSSS de l’Estrie - CHUS, installations Hôtel-Dieu et Hôpital Fleurimont a élaboré le Guide sur l’utilisation des nouveaux anticoagulants oraux. Ce guide mentionnait des recommandations concernant l’interruption et la reprise des AOD en période périopératoire de chirurgies électives. Ces recommandations étaient basées sur les données figurant aux monographies des produits et sur l’opinion d’experts4–7. Elles tiennent compte du risque de saignement associé à la chirurgie et de la fonction rénale du patient. En revanche, elles ne tiennent pas compte de la présence d’interaction médicamenteuse. Plusieurs mises à jour du Guide ont été effectuées depuis sa version initiale, mais les recommandations portant sur la gestion des AOD en période périopératoire sont demeurées constantes.
Au moment de l’élaboration du Guide, il existait peu d’études portant sur l’usage des AOD en période périopératoire. Une sous-analyse de l’étude RE-LY concluait à une incidence de saignements similaires entre les groupes dabigatran et warfarine durant l’interruption périopératoire de leur administration9. Toutefois, aucune étude d’observation en situation réelle de pratique, déterminant le degré d’application des recommandations sur l’usage des AOD en période périopératoire n’avait été répertoriée dans la documentation scientifique. L’objectif principal de ce projet était de déterminer la proportion de prescriptions d’AOD qui étaient conformes à l’ensemble des recommandations émises par le CIUSSS de l’Estrie - CHUS sur l’usage des AOD en période périopératoire pour des sujets adultes ayant subi une intervention chirurgicale élective au CIUSSS de l’Estrie - CHUS. L’hypothèse de recherche supposait que la proportion de prescriptions conformes à l’ensemble des recommandations émises serait de 70 %, tant en période préopératoire que postopératoire.
Le protocole de recherche retenu est descriptif et transversal, et il implique une collecte rétrospective de données à partir des dossiers médicaux des sujets admissibles. Ces derniers étaient des patients adultes ayant subi une intervention chirurgicale élective (planifiée et non urgente) au CIUSSS de l’Estrie - CHUS, installations Hôtel-Dieu et Hôpital- Fleurimont, entre le 1er octobre 2011 et le 10 janvier 2015 et ayant reçu au moins une dose thérapeutique d’AOD dans les 90 jours précédant la chirurgie et jusqu’à 30 jours après celle-ci. Le mois d’octobre 2011 a été choisi pour entreprendre la collecte de données, puisqu’il s’agit du mois où le dabigatran s’est ajouté au formulaire thérapeutique. La date du 10 janvier 2015 a marqué la fin de la collecte des données, puisqu’il s’agit du moment où la disponibilité des données pour la réalisation du projet prenait fin au technocentre. L’absence de description de la prise et de l’interruption planifiée d’un AOD dans les notes médicales (patient hospitalisé) ou lors de la visite à la clinique préparatoire à la chirurgie (patient externe), le fait de subir une chirurgie urgente et l’incapacité de juger de la conformité, due à l’absence de mesure de la créatinine (Cr) sérique dans les trois mois précédant la chirurgie, constituaient les principaux critères d’exclusion. Il est à noter que les patients référés à la clinique préparatoire à la chirurgie sont généralement évalués par un interniste ou un anesthésiologiste lorsqu’une interruption de l’anticoagulation est requise.
Les données démographiques (âge, sexe), la Cr sérique, les antécédents médicaux, l’indication de l’anticoagulothérapie, l’AOD prescrit, l’utilisation d’un pont avec une héparine à dose thérapeutique (pont à l’héparine) lors de la cessation de la prise de l’AOD en période périopératoire de même que la présence d’interactions médicamenteuses ont tout d’abord été collectées à partir des dossiers médicaux. Les interactions médicamenteuses prises en considération pour l’ensemble des AOD étaient associées aux agents suivants : kétoconazole, itraconazole, posaconazole, ritonavir, tipranavir, nelfinavir, saquinavir, atazanavir, darunavir, fosamprenavir, indinavir, quinidine, amiodarone, clarithromycine, érythromycine, vérapamil, diltiazem, dronédarone, rifampicine, carbamazépine, phénytoïne et millepertuis4–6. Pour le dabigatran, nous avons également pris en compte les antiacides à base d’aluminium, de bicarbonate de soude, de calcium ou de magnésium, le ténofovir, le tacrolimus et la cyclosporine4. Les autres interactions médicamenteuses liées au rivaroxaban et à l’apixaban étaient associées aux agents suivants : voriconazole, amprénavir, cobicistat, lopinavir, fluconazole, phénobarbital et primidone5,6. Certaines interactions médicamenteuses ont été évaluées malgré l’absence de contre-indication dans les monographies officielles, afin d’en tenir compte dans l’analyse des épisodes de saignements, particulièrement pour la population âgée ou lors d’interactions multiples. La prise d’antiplaquettaires et d’anti-inflammatoires non stéroïdiens (AINS) a été prise en considération. L’estimation de la clairance de la créatinine (ClCr) était basée sur la formule Cockroft-Gault (CG), à l’aide du poids réel du patient ou du poids de dosage si l’indice de masse corporelle (IMC) était égal ou supérieur à 30.
Quant à l’estimation du risque embolique des patients (faible, modéré, élevé), elle reposait sur les critères du protocole d’interruption d’anticoagulation pour intervention effractive du CIUSSS de l’Estrie - CHUS, installations Hôtel-Dieu et Hôpital Fleurimont. Ce protocole est adapté des lignes directrices en anticoagulothérapie de l’American College of Chest Physicians (disponibles sur demande)10.
Le risque de saignement associé à la chirurgie a été classé en deux catégories : risque mineur ou majeur et son estimation repose sur les informations trouvées dans les lignes directrices canadiennes du traitement de la fibrillation auriculaire (FA) de 201411. Le lecteur est invité à consulter le tableau 1 de la référence 11 qui décrit le risque de saignement selon le type de procédure11. Les cas pour lesquels le risque de saignement ne pouvait être déterminé par le pharmacien ont été soumis à un médecin expert qui collaborait à la recherche. Ce dernier a également contacté des chirurgiens afin de déterminer avec plus de précisions le risque de saignement. Une chirurgie majeure a été définie comme une procédure de plus d’une heure.
Tableau I Caractéristiques des patients
À l’aide du Guide sur les nouveaux anticoagulants oraux du CIUSSS de l’Estrie - CHUS, nous avons élaboré des indicateurs de conformité pour déterminer l’arrêt et la reprise de l’AOD en période périopératoire, selon la molécule, la ClCr du patient et le risque de saignement associé à la procédure chirurgicale (figure 1). Le comité d’anticoagulothérapie du CHUS et le comité de pharmacologie avaient révisé et approuvé le Guide avant sa diffusion aux médecins et aux pharmaciens des installations Hôpital Fleurimont et Hôtel-Dieu. Par ailleurs, le comité d’anticoagulothérapie du CHUS avait également approuvé les indicateurs de conformité.
|
|
||
|
Figure 1 Guide sur les nouveaux anticoagulants oraux du CHUS, version avril 2017 |
||
Les moments de l’arrêt de la prise de l’AOD en période préopératoire et de sa reprise en période postopératoire ont fait l’objet d’une recherche dans les notes numérisées de la clinique préparatoire à la chirurgie, de l’anesthésiologiste du bloc opératoire et du profil d’administration des médicaments. Ils ont été documentés en heures par rapport au moment de la chirurgie, pour déterminer la conformité. La conformité de la cessation de prise des AOD en période préopératoire et de leur reprise en période postopératoire a été classée en trois catégories, soit : conforme : respecte le délai minimal recommandé d’arrêt ou de reprise de l’AOD; non conforme : la prise de l’AOD a été interrompue tardivement avant l’opération ou reprise précocement après l’opération et conforme-long : arrêt précoce ou reprise tardive de l’AOD. Une période sans AOD considérée comme étant « conforme-long » signifie qu’elle est plus longue que nécessaire. La conformité globale a été estimée à partir de la somme de la conformité des patients classés dans « conforme » et « conforme-long ». Les cessations préopératoires de prise d’AOD et les reprises postopératoires dont la durée était supérieure à celles généralement recommandées (conforme-long) ont tout de même été incluses dans le calcul de conformité globale, puisque les recommandations émises portent sur les délais minimaux jugés sécuritaires pour éviter les saignements en période per-et postopératoire.
La survenue d’un événement thromboembolique ou d’un décès toutes causes confondues durant la période périopératoire (sept jours avant et jusqu’à 30 jours après la chirurgie) a été colligée. Les éléments indésirables relatifs à cet objectif combiné (accident vasculaire cérébral [AVC] ischémique, embolie systémique, infarctus du myocarde [IM], embolie pulmonaire [EP], mort toutes causes confondues) sont similaires à ceux décrits dans l’étude RELY12. La survenue de saignements en période postopératoire a également été colligée. Les saignements ont été classés en saignement mineur ou majeur selon la classification proposée par Schulman et coll.13.
Les données ont été collectées par des stagiaires en pharmacie et en pharmacologie, sous la supervision de la pharmacienne chercheure principale. Les données ont ensuite été saisies dans un formulaire développé pour ce projet et consignées dans un fichier Excel.
La réalisation du calcul de la taille de l’échantillon se base sur l’estimation de la proportion de prescriptions conformes de 70 %, avec un intervalle de confiance à 95 % (IC 95 %) et une précision de 5 %. Selon ce calcul, le nombre de patients à inclure était de 245. En modifiant la précision de l’effet à 10 %, nous obtenions une taille d’échantillon estimée à 75 patients. Des statistiques descriptives (moyenne, écart type) ont été estimées à l’aide du logiciel Excel.
La conduite de ce projet a été approuvée par le comité d’éthique et de la recherche du Centre de recherche du CHUS. De plus, une demande d’autorisation de collecte des données à partir des dossiers médicaux des patients a été obtenue du directeur des services professionnels du CHUS.
Des 181 dossiers révisés, nous avons pu évaluer l’utilisation périopératoire des AOD pour 90 patients. Une majorité des patients ont été exclus, parce qu’ils ne prenaient pas d’AOD en période préopératoire (n = 63). L’absence de détails portant sur l’arrêt préopératoire de la prise de l’AOD (n = 19), les chirurgies urgentes (n = 5) et l’absence de mesure de la Cr sérique permettant d’évaluer la conformité (n = 4) étaient d’autres motifs d’exclusion.
L’âge moyen des patients était de 70,2 ans (20–93 ans; médiane : 71,3 ans). La ClCr moyenne était de 77,1 mL/min, alors que le débit de filtration glomérulaire ajusté selon la surface corporelle des patients en période préopératoire était de 83,1 mL/min. Les hommes composaient 57,7 % de la cohorte (tableau I).
Les indications thérapeutiques les plus fréquentes des anticoagulants étaient la FA (88,9 %) et l’EP (5,6 %). Le score CHADS2 moyen des patients atteints de FA était de 2,6, ce qui représente un risque embolique intermédiaire. Les patients évalués recevaient du dabigatran (48,9 %), du rivaroxaban (45,6 %), et de l’apixaban (5,5 %). Trente-cinq patients ont subi une intervention comportant un risque mineur de saignement (38,9 %), alors que le reste de la cohorte (61,1 %) a subi une intervention chirurgicale dont le risque de saignement était majeur. Il s’agissait de chirurgie majeure dans 83,9 % des cas et la durée moyenne de l’intervention était de 184 minutes. Le 76,6 % des interventions chirurgicales a eu lieu pendant les années 2014–2015. Les procédures cardiaques (30 %) et orthopédiques (28,9 %) étaient les chirurgies les plus fréquentes (tableau I).
L’arrêt préopératoire de la prise d’AOD a été évalué pour l’ensemble des patients (n = 90). Le délai moyen de cessation préopératoire est de 2,75 jours, dans un spectre entre zéro et 12 jours (médiane : 2 jours). Le tableau II illustre les délais d’arrêt préopératoire selon la molécule, la ClCr et le risque de saignement dû à la chirurgie.
Tableau II Évaluation de la conformité et délais de cessation préopératoire de la prise d’AOD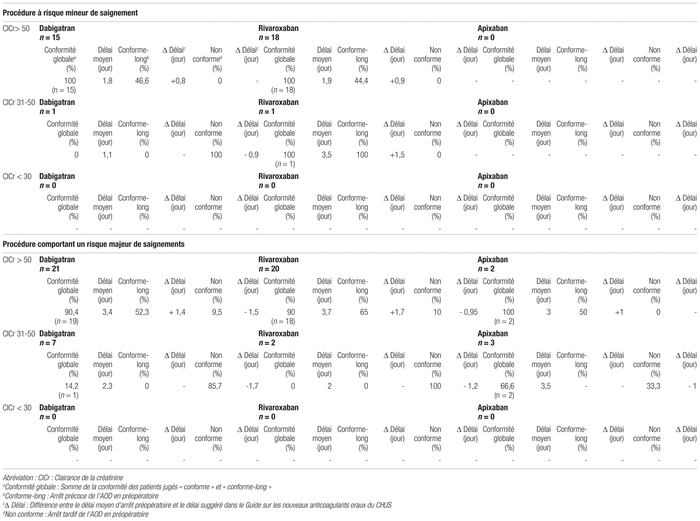
La conformité globale de l’arrêt préopératoire selon la molécule, la ClCr du patient et le risque de saignement lié à l’intervention chirurgicale est de 84,4 % (n = 76). Des arrêts préopératoires « conforme-long » sont survenus dans 41 des 76 dossiers jugés conformes (53,9 %). Plus précisément, l’interruption a été jugée en moyenne trop longue d’une journée pour ces patients. Si on retire ces patients du calcul, le taux de conformité chute à 38,8 %. Enfin, pour 16 patients, l’arrêt préopératoire a été jugé non conforme. La majorité de ces patients ont subi leur chirurgie en 2014 (50 %).
Des 41 patients dont l’arrêt a été jugé « conforme-long », 16 (39 %) présentaient un risque embolique faible, 22 un risque embolique intermédiaire (53,6 %) et trois un risque embolique élevé (7,4 %). De ces 41 patients, 25 (61 %) ont subi une chirurgie comportant un risque majeur de saignements et 16 patients (39 %), une chirurgie comportant un risque mineur de saignement.
Dix-neuf patients ont reçu un pont à l’héparine en période préopératoire. Une perfusion d’héparine par voie intraveineuse (IV) a été utilisée chez 15 patients et quatre patients ont reçu une injection d’héparine de bas poids moléculaire (HBPM). La durée d’utilisation du pont à l’héparine n’a pas été colligée. Parmi ces 19 patients, la cessation de la prise d’AOD était conforme pour quatre patients, non conforme pour deux patients et « conforme-long » pour 13 patients. Le risque embolique de ces derniers était faible dans 30,8 % des cas (n = 4), intermédiaire dans 46,1 % des cas (n = 6) et élevé dans 23,1 % des cas (n = 3). La ClCr moyenne de ces 13 patients était de 83,3 mL/ min (29,82 – 169,56 mL/min). Un seul d’entre eux avait une ClCr inférieure à 30 mL/min et était considéré comme présentant un risque embolique élevé. L’héparine IV a été utilisée comme pont thérapeutique pour ce patient.
La reprise postopératoire a été évaluée auprès de 75 patients de la cohorte (83,3 %). La reprise postopératoire n’a pu être déterminée en raison de l’absence de données au dossier médical (n = 7), du remplacement par la warfarine (n = 3) et de la cessation définitive de l’AOD après l’opération (n = 5).
La conformité globale de la reprise postopératoire a été calculée à 69,3 % (n = 52). La conformité de 27 des 52 patients (51,9 %) a été jugée « conforme-long ». Parmi ces 27 patients, 20 avaient subi une chirurgie comportant un risque majeur de saignement. Des 27 patients jugés « conformes-longs », 37 % présentaient un risque embolique faible (n = 10), 55,5 % un risque embolique intermédiaire (n = 15) et 7,5 % un risque embolique élevé (n = 2). Le délai moyen de reprise postopératoire était de 3,93 jours, avec un spectre situé entre zéro et 15 jours. Parmi les patients dont la reprise de l’AOD en période postopératoire a été jugée non conforme (n = 23), le délai moyen de reprise était de 0,88 jour. La majorité des patients jugés non conformes ont subi leur chirurgie en 2013–2014 (65,2 %). Le tableau III résume l’évaluation de la conformité et des délais de reprise postopératoire de l’AOD selon le risque de saignements associé à la chirurgie.
Tableau III Évaluation de la conformité et délais de reprise postopératoire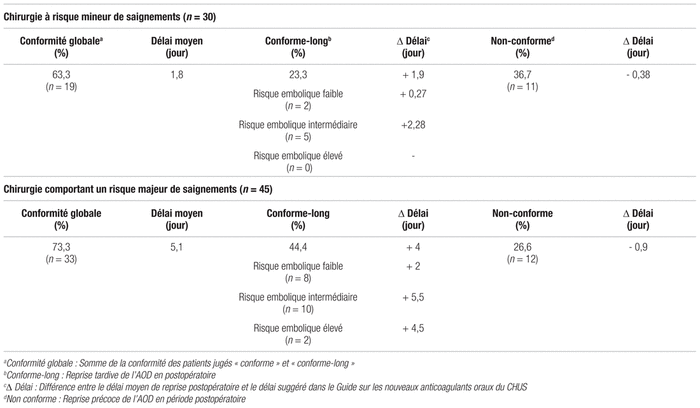
Quatre patients sur l’ensemble de la cohorte (4,4 %) ont présenté un évènement indésirable par rapport à l’objectif combiné (AVC, embolie systémique, infarctus du myocarde ou décès toutes causes confondues) en période postopératoire, soit : AVC cardioembolique, décès à la suite d’une aspiration pulmonaire, décès à la suite d’une arthrite septique et IM. Bien qu’elles ne soient pas incluses dans l’objectif combiné, nous avons également observé deux thromboses veineuses superficielles et une thrombose fémorale suite à une angioplastie fémorale.
La dose d’AOD en période préopératoire a été jugée adéquate selon la ClCr et l’âge pour l’ensemble de ces patients. Parmi ceux-ci, deux présentaient un risque embolique faible, trois un risque embolique intermédiaire et deux un risque embolique élevé. L’arrêt préopératoire a été jugé conforme pour trois de ces sept patients, « conforme-long » d’en moyenne 3,8 jours (0,5 – 10 jours) pour trois autres patients et non conforme pour un patient.
Seulement trois évènements indésirables décrits semblent être directement liés à l’arrêt de l’anticoagulation (AVC cardioembolique et thromboses veineuses superficielles). Le taux de complications emboliques pour l’ensemble de notre cohorte varie donc entre 1,1 % (objectif combiné) et 3,3 % (ajout des thromboses veineuses superficielles). L’arrêt préopératoire a été jugé « conforme-long » pour ces trois patients. Ils étaient tous anticoagulés pour de la FA, avec un score CHADS2 de 4 (risque embolique intermédiaire). Aucun de ces patients n’a reçu de pont à l’héparine en période préopératoire. La durée totale de l’arrêt de l’anticoagulation pour ces trois patients a été respectivement de 12 jours, deux jours et 1,5 jour. Si on exclut le patient ayant cessé la prise d’AOD pendant 12 jours en prévision d’un drainage d’hématome sous-dural, l’arrêt préopératoire est en moyenne supérieur de 0,75 jour comparativement aux recommandations du Guide. Nous avons également déterminé que ces patients ont eu une reprise postopératoire de l’AOD jugée « conforme-long ». De ces trois patients, un a subi une chirurgie comportant un risque majeur de saignement (drainage hématome sous-dural). Quant aux deux autres patients, ils ont subi une chirurgie comportant un risque mineur de saignement. Le délai de reprise postopératoire pour ces deux patients était en moyenne supérieur de 0,65 jour comparativement aux recommandations.
En situation postopératoire, cinq patients (5,5 %) ont présenté un saignement considéré comme mineur, tels que : hématurie macroscopique, hématome au bras, hématome de la plaie chirurgicale, hématome à la cuisse et rectorragie. La majorité de ces saignements sont survenus dans les sept premiers jours postopératoires (n = 4). Trois patients ont subi une chute d’hémoglobine de 6, 16 et 19 g/L en période postopératoire. La dose d’AOD a été jugée adéquate selon la ClCr et l’âge pour l’ensemble des patients ayant présenté un saignement postopératoire. La présence d’une interaction médicamenteuse (diltiazem) a été relevée chez un patient sous dabigatran, qui avait une fonction rénale estimée à 50 mL/ min. La présence de médicaments affectant l’hémostase (aspirine, ticagrélor) a été notée au profil pharmacologique de trois patients.
Deux des épisodes de saignements sont survenus chez des patients ayant un critère de non-conformité. Le premier évènement indésirable est survenu dans les sept premiers jours postopératoires chez un patient dont l’arrêt préopératoire a été jugé non conforme. Ce patient présentait un risque embolique élevé sous dabigatran et avait une fonction rénale estimée entre 30 et 50 mL/min. L’arrêt préopératoire aurait dû être de quatre jours, alors que la prise de dabigatran a été interrompue 2,33 jours avant la chirurgie. Ce patient n’a pas reçu de pont à l’héparine. L’autre cas de saignements est survenu dans les sept premiers jours postopératoires chez un patient présentant un risque embolique intermédiaire, dont la reprise postopératoire a été jugée non conforme. L’AOD aurait dû être repris au moins 48 heures après la chirurgie, alors que la reprise postopératoire a été effectuée après 0,63 jour. Ce même patient a également été couvert par un pont à l’héparine en période postopératoire (héparine IV). Outre ce cas, deux autres patients ayant présenté un saignement en période postopératoire avaient reçu un pont à l’héparine (héparine IV) en période préopératoire.
L’évaluation de la conformité de la cessation préopératoire de la prise des AOD démontre un taux de conformité globale de 84,4 %. Cette évaluation dépasse la valeur prédite de 70 %. Le taux de conformité globale atteint 69,4 % en période postopératoire, ce qui est légèrement inférieur à la valeur prédite de 70 %.
Nos résultats sont similaires à ceux rapportés par une étude canadienne de 2015 évaluant l’usage du dabigatran en période périopératoire. Les délais d’arrêt préopératoire établis étaient les mêmes que ceux proposés par le Guide du CIUSSS de l’Estrie - CHUS. Le taux de conformité décrit dans cette étude est de 89 % en période préopératoire et de 77 % en période postopératoire14.
Le délai moyen de fin de la prise d’AOD préopératoire de 2,75 jours est similaire à celui noté dans l’étude de Healy et coll., qui démontre une période d’arrêt préopératoire moyenne de 49 heures pour les patients sous dabigatran devant subir une chirurgie qui nécessite l’arrêt de l’anticoagulation9. On remarque toutefois que la durée de cessation préopératoire de 45,5 % des patients inclus dans le calcul de conformité globale était plus longue que nécessaire et variait en moyenne entre 0,7 et 1,7 jour supplémentaire. Ces données démontrent une tendance à cesser hâtivement la prise d’AOD, particulièrement lorsque le patient doit subir une intervention comportant un risque élevé de saignement. L’absence d’une valeur de laboratoire facilement accessible indiquant le degré d’anticoagulation lié aux AOD peut expliquer cette tendance à la prudence, afin de ne pas procéder à la chirurgie sous une anticoagulothérapie résiduelle. De plus, le recours à une anesthésie neuraxiale lors de la chirurgie n’a pas été pris en compte lors de la collecte de données. Un grand nombre de chirurgies effectuées sous ce type d’anesthésie aurait pu expliquer un délai de cessation de la prise d’AOD plus long. En effet, les recommandations de l’American Society of Regional Anesthesia and Pain Medicine sont généralement plus strictes que celles préconisées dans les monographies des produits et les différents guides de pratique, dont celui du CIUSSS de l’Estrie - CHUS15.
Parallèlement, on note une tendance d’arrêt non conforme plus marquée pour les patients dont la ClCr se situe entre 31 et 50 mL/min et devant subir une chirurgie qui comporte un risque élevé de saignement. Cette tendance peut s’expliquer par le fait que les cliniciens avaient moins d’expérience de l’usage des AOD entre 2011 et 2015. Comparativement à la warfarine, la fonction rénale du patient était un élément « nouveau » à prendre en considération en période préopératoire. Enfin, il est possible que certains cliniciens aient plutôt utilisé le débit de filtration glomérulaire accessible dans le dossier clinique informatisé pour évaluer la fonction rénale des patients, alors que l’outil de gestion des AOD est conçu en fonction d’une ClCr calculée selon CG. Toutefois, l’estimation de la fonction rénale de notre cohorte n’a pas démontré de valeur cliniquement différente selon la méthode choisie. Enfin, aucune tendance portant sur la gestion périopératoire des AOD en fonction de l’âge, de l’IMC ou du risque thromboembolique des patients n’a été observée. En période préopératoire, une attention particulière devrait donc être portée aux patients ayant une ClCr inférieure à 50 mL/min, afin de respecter les délais minimaux suggérés.
Dix-neuf patients ont reçu un pont à l’héparine en période préopératoire (21,1 %). Parmi eux, la cessation de la prise d’AOD était « conforme-long » pour 13 patients. Une tendance à cesser hâtivement la prise d’AOD et à instaurer un pont thérapeutique est observable. Dans l’étude de Healy de 2012, les investigateurs ont noté l’utilisation d’un pont à l’héparine en période périopératoire pour 15,3 % des patients sous dabigatran à 110 mg, deux fois par jour, et 17 % des patients sous dabigatran à 150 mg, deux fois par jour9. Une autre étude plus récente de 2015 ne rapporte aucun cas d’utilisation d’un pont à l’héparine en période préopératoire pour les patients sous dabigatran14. L’étude de Beyer-Westendorf de 2014, évaluant l’usage du dabigatran, du rivaroxaban et de l’apixaban en période périopératoire, démontre une augmentation du risque de saignement, sans diminution de la survenue d’événements cardiovasculaires indésirables, avec l’usage d’un pont à l’héparine lors de l’interruption des AOD16. Ces données cliniques n’ont pu être appliquées à la majorité des patients de notre cohorte, dont la chirurgie et la gestion périopératoire de l’AOD ont eu lieu avant 2014. Les lignes directrices récentes de 2017 affirment ainsi que les patients pour qui la gestion préopératoire de l’AOD est adéquate n’ont pas besoin de pont à l’héparine17. Dans la présente cohorte, seulement trois patients pour qui l’arrêt de l’AOD a été jugé « conforme-long » présentaient un risque embolique élevé, ce qui porte à 15,8 % seulement l’utilisation adéquate d’un pont à l’héparine. Les lignes directrices mentionnent également qu’en période postopératoire, les ponts à l’héparine devraient être réservés à des cas particuliers, notamment lorsque la voie orale n’est pas disponible pour la reprise de l’AOD ou si une autre procédure chirurgicale est envisagée17. Il est donc possible que l’absence de lignes directrices portant sur les indications limitées des ponts à l’héparine dans la gestion périopératoire des AOD au protocole d’interruption d’anticoagulation pour les interventions effractives ait pu entrainer une surutilisation injustifiée des ponts à l’héparine, particulièrement dans les premières années de commercialisation de ces molécules.
Un événement thromboembolique de l’objectif combiné a été noté chez un patient (1,1 %). Il semble que la combinaison de la cessation hâtive et d’une reprise tardive de l’AOD en période postopératoire soit un facteur de risque de thromboembolies, même pour les patients présentant un risque embolique intermédiaire. Une étude prospective de 2014 rapporte que les sujets sous AOD ayant subi une intervention chirurgicale avaient un taux d’évènements thromboemboliques de 1 %, ce qui est similaire à celui observé dans notre cohorte16. De plus, une étude multicentrique canadienne évaluant l’utilisation du dabigatran en période périopératoire appuie la sécurité d’un protocole similaire aux recommandations du Guide du CIUSSS de l’Estrie - CHUS14.
En période postopératoire, 5,5 % des patients ont été victimes d’un saignement mineur dans les sept premiers jours postopératoires. Aucun saignement majeur n’a été enregistré. Une étude de 2014 évaluant l’usage périopératoire du dabigatran rapporte que 1,8 % des patients ont subi un saignement majeur et que 5,2 % de ces patients ont présenté un saignement mineur dans les 30 jours postopératoire14. Il est à noter que nos données sur les saignements ne permettaient pas de distinguer un saignement relatif à la chirurgie elle-même d’un saignement attribuable à la gestion périopératoire de l’AOD. Enfin, les données recueillies auprès de notre cohorte semblent démontrer que la présence d’interactions médicamenteuses ou d’autres médicaments affectant l’hémostase peut favoriser la survenue de saignements.
Le protocole de recherche rétrospectif, de même que le faible nombre de patients évalués constituent les principaux points faibles de cette étude. De plus, la reprise des AOD en période postopératoire n’a pu être évaluée que chez 75 patients. Enfin, la faible proportion de patients sous apixaban diminue la validité externe de cette étude. L’élimination rénale de l’apixaban ne représente que 27 % de son élimination totale, ce qui en fait un des AOD les moins touchés par les variations de la fonction rénale6. Un nombre plus élevé de patients sous apixaban aurait pu favoriser une proportion supérieure de prescriptions conformes en période préopératoire et refléter l’utilisation actuelle de cette molécule. Enfin, bien que les AOD soient contre-indiqués pour les patients ayant une dysfonction rénale, pour une ClCr variant entre 15 et 30 mL/min selon la molécule, cette étude ne permet pas de tirer de conclusions quant à la gestion périopératoire de cette classe médicamenteuse pour cette population, en raison de la faible proportion de cette catégorie de patients dans notre cohorte4–6.
La gestion périopératoire des AOD semble adéquate dans notre cohorte de patients issus d’un centre hospitalier universitaire, bien qu’une tendance à une cessation hâtive de la prise d’AOD en période préopératoire soit présente chez les patients présentant une dysfonction rénale. Un autre objectif de ce projet visait à formuler des recommandations sur l’usage sécuritaire des AOD en période périopératoire pour les indicateurs qui avaient obtenu un taux de conformité inférieur à 80 %. Une mise à jour de la section relative à la gestion périopératoire du Guide sur les AOD a donc été effectuée au CIUSSS de l’Estrie - CHUS, afin de clarifier la conduite à tenir. En période préopératoire, la conduite est désormais exprimée en nombre de doses à omettre plutôt qu’en jours d’arrêt de la prise d’AOD. Un ajout au Guide portant sur les indications limitées des ponts à l’héparine dans la gestion périopératoire des AOD est en évaluation. Une présentation des résultats de cette étude a en outre été faite aux médecins spécialistes en médecine interne, principalement responsables de l’évaluation des patients à la clinique préparatoire à la chirurgie. Finalement, l’étude PAUSE (Perioperative Anticoagulant Use for Surgery Evaluation Study) nous procurera des données cliniques robustes nous permettant d’uniformiser la gestion des AOD en période périopératoire pour les patients souffrant de FA et de corriger les lacunes observées.
Les auteurs ont reçu du financement pour effectuer cette étude. Ce projet a fait l’objet d’une bourse du Fonds Brigitte-Perreault de la fondation du Centre hospitalier universitaire de Sherbrooke, dédié à la qualité et à la sécurité des soins.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation des conflits d’intérêts potentiels. L’auteure, Mélanie Gilbert, a reçu une rémunération de la part des compagnies pharmaceutiques Bayer, Pfizer, Bristol-Myers-Squibb et Boehringer-Ingelheim pour l’élaboration du Guide sur les anticoagulants oraux directs et une rémunération des compagnies pharmaceutiques Bristol-Myers-Squibb et Pfizer à titre de conférencière. L’auteure, Marie-France Beauchesne, a reçu des subventions de recherche pour des projets entrepris par l’investigateur de l’alliance Bristol-Myers-Squibb-Pfizer, Boehringer-Ingelheim et Bayer.
Les autres auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Les auteurs aimeraient remercier les personnes suivantes pour leur précieuse contribution à la réalisation de cette étude. Lydia Turkié, Benoit Giraud, Katy Lavoie, Geneviève Jolin, Sophie Lanthier, Amélie Houde, Viviane Marquis et Gabrielle Gagnon. Une autorisation écrite a été obtenue de ces personnes.
1. Jaffer AK, Brotman DJ, Bash LD, Mahmood SK, Lott B, White R. Variations in perioperative warfarin management: outcomes and practice patterns at nine hospitals. Am J Med 2010;123:141–50.
2. Steinberg BA, Peterson ED, Kim S, Thomas L, Gersh BJ, Fonarow GC et coll. Use and outcomes associated with bridging during anticoagulation interruptions in patients with atrial fibrillation. Circulation 2015;131:488–94.

3. Attaya H, Wysokinski WE, Bower T, Litin S, Daniels PR, Slusser J et coll. Three-month cumulative incidence of thromboembolism and bleeding after periprocedural anticoagulation management of arterial vascular bypass patients. J Thromb Thrombolysis 2013;35:100–6.
4. Micromedex Healthcare series. Monographie du dabigatran. Thomson Micromedex, 1974–2018. [en ligne] http://www.thomsonhc.com (site visité le 10 octobre 2017).
5. Micromedex Healthcare series. Monographie du rivaroxaban. Thomson Micromedex, 1974–2018. [en ligne] http://www.thomsonhc.com (site visité le 10 octobre 2017).
6. Micromedex Healthcare series. Monographie de l’apixaban. Thomson Micromedex, 1974–2018. [en ligne] http://www.thomsonhc.com (site visité le 10 octobre 2017).
7. Nutescu EA. New approaches to reversing oral anticoagulant therapy. Am J Health Syst Pharm 2013;70(suppl 1):S1–2.
8. Pollack CV, Reilly PA, Eikelboom J, Glund S, Verhamme P, Bernstein RA et coll. Idarucizumab for dabigatran reversal. N Engl J Med 2015;373:511–20.
9. Healy J, Eikelboom J, Douketis J, Wallentin L, Oldgren J, Yang S et coll. Periprodural bleeding and thromboembolic events with dabigatran compared with warfarin; Results from the randomized evaluation of long-term anticoagulation therapy (RE-LY) randomized trial. Circulation 2012;126:343–8.
10. Douketis JD, Spyropoulos AC, Spencer FA, Mayr M, Jaffer AK, Eckman MH et coll. Perioperative management of antithrombotic therapy. Chest 2012;141(2 suppl):e326S–e350S.

11. Verma A, Cairns JA, Mitchell B, Macle L, Stiell IG, Gladstone D et coll. 2014 Focused update of the CCS AF guidelines. Can J Cardiol 2014;30:1114–30.
12. Connolly SJ, Ezekowitz MD, Yusuf S, Eikelboom J, Oldgren J, Parekh A et coll. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139–51.
13. Schulman S, Angera U, Bergqvist D, Eriksson B, Lassen MR, Fisher W et coll. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in surgical patients. J Thromb Haemost 2010;8:202–4.
14. Schulman S, Carrier M, Lee A. Perioperative management of dabigatran: A prospective cohort study. Circulation 2015;132:167–73.
15. Horlocker T, Vandermeuelen E, Kopp S, Gogarten W, Leffert L, Benzon H. Regional anesthesia in the patient receiving antithrombotic or thrombolytic therapy. Reg Anesth Pain Med 2018;43:263–309.
16. Beyer-Westendorf J, Gelbricht V, Forster K, Ebertz F, Kohler C, Werth S et coll. Peri-interventional management of novel oral anticoagulants in daily care: results from the prospective Dresden NOAC registry. Eur Heart J 2014;35:1888–96.
17. Doherty J, Gluckman T, Hucker W, Januzzi J, Ortel T, Saxonhouse S et coll. 2017 ACC expert consensus decision pathway for periprocedural management of anticoagulation in patients with nonvalvular atrial fibrillation. J Am Coll Cardiol 2017;69:871–98.
PHARMACTUEL, Vol. 51, No. 3, 2018