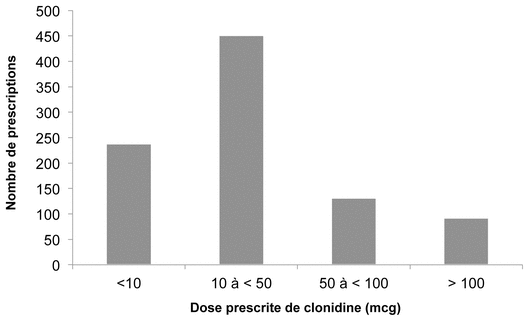
Figure 1 Nombre de prescriptions du 1er novembre 2016 au 20 novembre 2017 selon les doses de clonidine prescrites
Claudiane Dubuc1,2, Marylou Fournier Tondreau3, Pharm.D., M.Sc., Jean-Marc Forest4, B.Pharm., DPH, M.Sc.
Reçu le 4 février 2018: Accepté après révision le 8 juillet 2018
Résumé
Objectif : L’objectif de ce projet pilote est d’optimiser la préparation magistrale orale de la clonidine sur le plan de sa stabilité, de ses propriétés organoleptiques et de sa facilité de reconditionnement en seringues orales au Centre hospitalier universitaire Sainte-Justine afin de réduire les erreurs de calcul de doses et de services.
Description de la problématique : Il n’existe aucune forme orale liquide commercialisée de clonidine. Le Centre hospitalier universitaire Sainte-Justine, utilise depuis des années une formulation magistrale concentrée à 0,1 mg/mL pour la patientèle pédiatrique. Cette concentration occasionne parfois des erreurs de calcul et potentiellement de dosage pouvant affecter de façon considérable le patient. De plus, sa stabilité est limitée à 28 jours et le véhicule utilisé, le sirop simple, occasionne des problèmes de mise en seringues orales et d’homogénéité.
Résolution de la problématique : Une revue de la littérature a été effectuée pour repérer les différentes formulations magistrales publiées et leur stabilité. Les formulations concentrées à 0,01 mg/mL, 0,02 mg/mL et 0,05 mg/mL ont été retenues pour réaliser un sondage auprès des pharmaciens de l’établissement. Les formulations favorisées par le sondage, soit celles concentrées à 0,01 mg/mL et 0,02 mg/mL, ont été préparées dans Ora-BlendMD et Oral MixMD pour tester la mise en seringues orales et exécuter un examen sommaire de leurs propriétés organoleptiques.
Conclusion : La préparation magistrale orale de clonidine retenue est celle concentrée à 20 mcg/mL dans Oral MixMD ou Ora-BlendMD. La nomenclature a été modifiée pour exprimer la concentration de la préparation en microgrammes par millilitre, c’est-à-dire 20 mcg/mL.
Mots clés : Clonidine, concentration, dose, magistrale, pédiatrie
Abstract
Objective : The objective of this pilot project is to optimize the oral compounding of clonidine in terms of its stability, its organoleptic properties and the ease of aliquoting it into oral syringes at the Centre hospitalier universitaire Sainte-Justine in order to reduce dose miscalculations and serving errors.
Problem description : There is no commercially available liquid oral form of clonidine. At the Centre hospitalier universitaire Sainte-Justine, a compounded formulation with a concentration of 0.1 mg/mL has been used for years. With this concentration, miscalculations and, potentially, dosage errors, sometimes occur which can substantially affect the patient. In addition, its stability is limited to 28 days, and the vehicle used, simple syrup, causes homogeneity problems and problems aliquoting the formulation into oral syringes.
Problem resolution : We conducted a literature review to identify the different published compounded formulations and their stability. Those with a concentration of 0.01 mg/mL, 0.02 mg/mL and 0.05 mg/mL were selected for the purpose of surveying the hospital’s pharmacists. The formulations preferred in the survey, those with a concentration of 0.01 mg/mL and 0.02 mg/mL, were prepared in Ora-Blend® and Oral Mix® to test oral syringe aliquoting and to conduct a summary examination of their organoleptic properties.
Conclusion : The compounded oral preparation of clonidine chosen was that with a concentration of 20 mcg/mL in Oral Mix® or Ora-Blend®. The nomenclature was changed to express the concentration of the preparation in micrograms per millilitre, i.e., 20 mcg/mL
Keywords : Clonidine, compounding, concentration, dose, pediatrics
La clonidine est un agoniste du récepteur α2-adrénergique central entraînant une diminution du tonus du système nerveux sympathique et causant une diminution des résistances vasculaires périphériques, de la fréquence cardiaque et de la tension artérielle1. En pédiatrie, elle est utilisée dans le traitement de l’hypertension artérielle, en sédation et comme coanalgésique2,3. Elle peut également être prescrite pour atténuer les symptômes de sevrage après l’administration prolongée d’opioïdes3,4. D’autre part, les prescripteurs ont de plus en plus recours à la clonidine pour traiter des conditions psychiatriques, telles que le trouble du déficit de l’attention accompagné d’hyperactivité, le syndrome de Gilles de la Tourette ou le trouble oppositionnel avec provocation chez l’enfant1,5,6. En néonatologie, la clonidine est une option de traitement des symptômes de sevrage aux opioïdes chez les nouveau-nés1,7. Par ailleurs, un test de stimulation à la clonidine existe dans le but d’évaluer la déficience en hormone de croissance en pédiatrie8.
La clonidine est offerte commercialement au Canada en trois teneurs de comprimés (0,025 mg; 0,1 mg; 0,2 mg)9. Les doses thérapeutiques recommandées dans la population pédiatrique, soit 0,002–0,025 mg/kg/jour, sont généralement beaucoup plus faibles que les comprimés disponibles, par exemple de l’ordre du dixième ou du vingtième d’un comprimé de 0,1 mg1,4. Il importe donc que les pharmaciens des milieux hospitaliers et communautaires préparent des formulations magistrales orales afin d’offrir les bons dosages à la population pédiatrique. Lors du calcul du volume à administrer, des erreurs de dosage peuvent se produire, par exemple, lors de la conversion en millilitres d’une dose en milligrammes ou en microgrammes5.
En pédiatrie, la clonidine est souvent prescrite en microgrammes, alors que pour l’adulte, la posologie est généralement exprimée en milligrammes, ce qui est source d’erreurs potentielles10,11. La fenêtre thérapeutique de la clonidine pour l’enfant est plus étroite que pour l’adulte et une erreur de dosage peut entraîner de lourdes conséquences10,11. En effet, chez l’enfant, l’ingestion de plus de 0,01 mg/kg peut entraîner une surdose importante causant des symptômes, tels qu’une bradycardie, une hypotension, une tachypnée, une hypotonie, une diminution de l’état de conscience et une dépression respiratoire5,10–12. Plusieurs cas d’intoxication à la clonidine en pédiatrie ont été rapportés dans la littérature médicale, certains ayant nécessité une hospitalisation et d’autres, une admission aux soins intensifs5,10,13–14.
Le Centre hospitalier universitaire (CHU) Sainte-Justine utilise une préparation magistrale sous forme orale liquide, concentrée à 0,1 mg/mL dans le sirop simple, qui est stable pendant 28 jours lorsqu’elle est réfrigérée1. Elle est préparée et mise en réserve dans des bouteilles ambrées en plastique puis servie dans des seringues orales transparentes après le prélèvement du volume unidose requis. Les doses ayant été les plus fréquemment prescrites durant la période du 1er novembre 2016 au 20 novembre 2017 se situaient principalement entre 10 mcg et 50 mcg (figure 1).
|
|
||
|
Figure 1 Nombre de prescriptions du 1er novembre 2016 au 20 novembre 2017 selon les doses de clonidine prescrites |
||
Le risque d’erreur de dosage en raison d’une erreur de positionnement de la décimale lors de la conversion en millilitres est donc d’autant plus grand avec une formulation concentrée à 0,1 mg/mL. S’ajoute à ce risque le fait que les médecins du CHU Sainte-Justine prescrivent généralement la clonidine en microgrammes plutôt qu’en milligrammes. Il s’avère alors plus que pertinent d’envisager un changement des habitudes sur le plan de la concentration de la formulation magistrale de clonidine dans le but de diminuer le risque d’erreur de dosage.
Par la même occasion, il semble approprié de chercher à optimiser la durée de la stabilité de la préparation étant donné qu’un délai de péremption de 28 jours peut compliquer la gestion du produit, particulièrement pour les pharmacies externes qui servent habituellement la médication pour un mois. Finalement, le véhicule, soit le sirop simple, utilisé dans la préparation, occasionne parfois des difficultés lors de sa mise en seringues orales, car le liquide est très visqueux et l’homogénéité de la préparation semble difficile à obtenir. Une longue et vigoureuse agitation est nécessaire avant le prélèvement en seringues orales d’un produit homogène.
Dans le but de déterminer la nouvelle concentration de clonidine en préparation magistrale qui réduirait le risque d’erreur de dosage, les auteurs ont procédé à une revue exhaustive de la littérature scientifique afin de repérer les différentes formulations existantes et leur stabilité. La consultation des ressources PubMed et Embase a permis de déterminer les articles pertinents sur le sujet. Différents mots clés en anglais et mis en association ont été utilisés, tels que clonidine, suspensions, solutions, drug compounding, pediatric, stability, etc. La recherche portait sur les articles publiés entre 1992 et décembre 2017. Cette revue a permis d’observer que la formulation la plus anciennement étudiée est celle qu’utilise le CHU Sainte-Justine, soit la préparation concentrée à 0,1 mg/mL dans le sirop simple et stable 28 jours lorsqu’elle est réfrigérée1. Les autres préparations magistrales de clonidine répertoriées se trouvent sommairement au tableau I2–4,7,15–18.
Tableau I Articles tirés de la littérature scientifique sur les préparations magistrales de clonidine : concentration, véhicule principal et stabilité1–4,7,15–18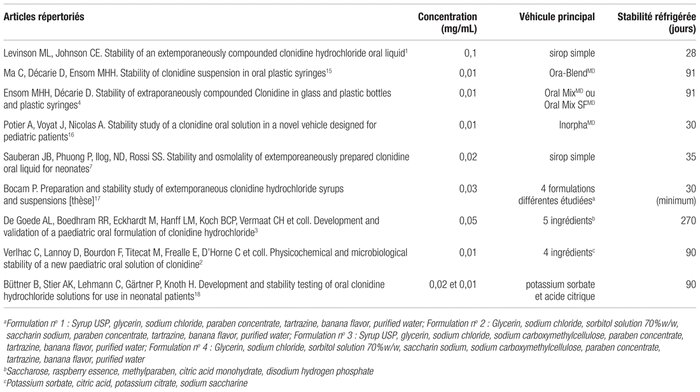
Les formulations publiées, concentrées à 0,01 mg/mL, 0,02 mg/mL et 0,05 mg/mL, ont été retenues afin d’être incluses dans le sondage en ligne destiné aux pharmaciens du CHU Sainte-Justine, sondage qui a d’ailleurs été organisé à leur demande. Il a été transmis à 34 pharmaciens et 20 l’ont rempli. Cette enquête réalisée au moyen de Survey MonkeyMD a permis de recueillir leur avis sur la concentration qui serait la plus appropriée, pour notamment réduire le risque d’erreur de dosage et optimiser la durée de stabilité. Les répondants ont été informés que les résultats feraient l’objet d’une publication. En fait, les auteurs avaient l’intention de faire profiter les pharmaciens communautaires de cette démarche. Le tableau II présente la compilation des résultats du sondage. Enfin, il a été possible de tester les préparations magistrales préférées des personnes qui ont répondu au sondage, notamment celles concentrées à 0,01 mg/mL et 0,02 mg/mL. Les formulations concentrées à 0,01 mg/mL dans Ora-BlendMD et Oral MixMD ont été préparées selon la description présentée dans la littérature scientifique4,15. La formulation concentrée à 0,02 mg/mL a été testée dans Ora-BlendMD puis Oral MixMD plutôt que dans le sirop simple6.
Tableau II Abrégé du sondage d’opinion des pharmaciens (n = 20) sur la préparation magistrale idéale de clonidine
Une étude de stabilité portant sur chacune des deux dernières préparations sera nécessaire afin d’officialiser leur stabilité et elle fera l’objet de travaux subséquents. Parmi les personnes préparant couramment des formulations magistrales, quelques assistantes techniques ont été consultées par la suite afin d’obtenir leur avis sur la facilité et la rapidité de la mise en seringues orales des quatre différentes préparations magistrales testées. Nous avons procédé à une analyse sommaire des propriétés organoleptiques des quatre formulations afin de les comparer au sirop simple. Landry et coll. ont aussi analysé le glycopyrrolate de cette manière19. Ils ont observé l’apparence des préparations, leur homogénéité et leur couleur. À cela s’ajoutait un test de goût, de texture en bouche et d’odeur. La réalisation de ces différentes étapes et l’obtention d’un consensus verbal lors d’une présentation aux pharmaciens du CHU Sainte-Justine ont abouti à la conclusion que la concentration la plus appropriée serait celle de 0,02 mg/mL dans Oral MixMD ou Ora-BlendMD. Par ailleurs, la nomenclature a été modifiée pour exprimer la concentration de la préparation en microgrammes par millilitre (c’est-à-dire 20 mcg/mL).
Au cours des dernières années, différentes voix se sont élevées, autant de la part du département de pharmacie que des équipes médicales, pour s’exprimer sur le choix de la formulation magistrale de clonidine au CHU Sainte-Justine. Une analyse complète de la situation a permis à toutes les personnes concernées d’exprimer leur opinion sur le sujet pour parvenir à des conclusions éclairées. Le sondage et les discussions subséquentes dans le cadre du club de lecture ont permis de recueillir l’opinion de l’équipe des pharmaciens sur les différentes formulations retenues, soit celles concentrées à 0,01 mg/mL, à 0,02 mg/mL et à 0,05 mg/mL. La préparation à 0,01 mg/mL pourrait, selon certains, entrainer encore des erreurs de positionnement de la décimale ainsi qu’une confusion avec la concentration actuelle de 0,1 mg/mL. Elle demanderait également le service de volumes plus élevés, étant donné sa plus faible concentration, mais aurait l’avantage d’être plus précise pour la mesure des volumes des petites doses.
Pour la concentration à 0,05 mg/mL, les volumes à servir en néonatologie seraient trop petits et donc difficiles à mesurer, puisque les doses requises sont généralement très faibles. Selon la majorité des 20 personnes sondées, cette concentration semblait être la moins bonne option des trois. Du côté de la formulation magistrale concentrée à 0,02 mg/mL, elle semble présenter le moins d’inconvénients et permettrait de mesurer plus précisément les volumes pour les petites doses. D’autre part, les durées de stabilité inférieures à 30 jours sont peu favorables aux traitements à l’externe, vu que la majorité des pharmacies communautaires servent des doses mensuelles de médication. Une autre remarque a également été faite concernant le véhicule, puisque la formulation actuelle de clonidine avec le sirop simple semble occasionner des problèmes lors de son prélèvement en seringues orales, car le liquide est très visqueux. Par conséquent, un changement de véhicule de la préparation magistrale serait aussi bénéfique pour les assistants techniques en pharmacie et assurerait une meilleure homogénéité du produit. Finalement, un autre point pertinent a été soulevé concernant les unités utilisées pour exprimer la concentration de la formulation magistrale de clonidine.
Comme les médecins du CHU Sainte-Justine prescrivent généralement les doses de clonidine en microgrammes pour la population pédiatrique, il serait approprié désormais de désigner la concentration en termes de microgrammes par millilitre (mcg/mL) et de modifier l’entrée des doses dans le système d’exploitation de la pharmacie (GesphaRxMD) pour qu’elle soit en microgrammes. Les pharmaciens ayant participé à cette réflexion trouvaient qu’il était pertinent de publier ce projet afin d’en aviser la communauté, car une modification de la concentration de la préparation magistrale de clonidine pourrait occasionner des erreurs de dosage.
À la suite de la réalisation des quatre préparations magistrales expérimentales de clonidine (1re : 0,02 mg/mL dans Ora-BlendMD; 2e : 0,01 mg/mL dans Ora-BlendMD; 3e : 0,01 mg/ mL dans Oral MixMD; 4e : 0,02 mg/mL dans Oral MixMD), trois assistantes techniques du secteur fabrication ont réalisé des tests de mise en seringues orales. Les deux premières ont conclu qu’il y avait très peu de différence entre les quatre préparations alors que la dernière préférait les formulations préparées dans Oral MixMD, car il y avait moins de bulles dans la seringue comparativement aux formules dans Ora-BlendMD. Selon ces trois mêmes personnes, les quatre formulations étaient plus faciles et plus rapides à prélever que la préparation actuelle dans le sirop simple. Leur texture était plus liquide et moins visqueuse qu’avec le sirop simple, ce qui facilitait le prélèvement en seringues orales.
Dans un dernier temps, les investigateurs ont procédé à un examen sommaire des propriétés organoleptiques et les ont comparées à la formulation actuelle dans le sirop simple. L’apparence des quatre préparations était homogène même après une agitation de faible intensité. La couleur des formulations dans Ora-BlendMD était légèrement rosée alors que dans Oral MixMD, elle était plutôt blanche, presque transparente. Les préparations avaient toutes une odeur et un goût sucré, ce qui devrait être agréable pour les enfants. La préparation actuelle dans le sirop simple était plus blanche, plus opaque et sa texture en bouche semblait plus granuleuse que celle des quatre autres préparations qui étaient plus liquides et probablement plus agréables du point de vue gustatif.
Ces différentes étapes nous ont amenés à une proposition finale de la préparation magistrale de clonidine. À la lumière des commentaires obtenus par le sondage, il semble plus judicieux de retenir la concentration de 0,02 mg/mL, qui permet de mesurer des volumes plus précis pour les petites doses sans toutefois nécessiter de trop grands volumes pour certains patients requérant des doses plus élevées et ne pouvant pas prendre la médication en comprimés. De plus, il semble important de modifier les unités exprimant la concentration de la préparation en remplaçant les mg/mL par les mcg/mL, c’est-à-dire 20 mcg/mL. Quant au choix du véhicule de la préparation, le remplacement du sirop simple par Oral MixMD ou Ora-BlendMD s’est imposé. Des études de stabilité seront cependant nécessaires étant donné que la littérature scientifique n’a pas publié d’études portant sur la préparation de clonidine concentrée à 0,02 mg/mL dans ces véhicules.
La préparation magistrale orale de clonidine concentrée à 20 mcg/mL (soit 0,02 mg/mL) dans un véhicule commercial Oral MixMD ou Ora-BlendMD a été retenue bien qu’il soit important de réaliser des études de stabilité. D’ici l’obtention des résultats de stabilité, la formulation magistrale concentrée à 0,02 mg/mL dans du sirop simple, stable 35 jours au réfrigérateur restera en vigueur7.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
L’auteur remercie monsieur Denis Giroux pour l’aide dans la recherche bibliographique. Une autorisation écrite de cette personne a été obtenue.
1. Levinson ML, Johnson CE. Stability of an extemporaneously compounded clonidine hydrochloride oral liquid. Am J Hosp Pharm 1992;49:122–5.
2. Verlhac C, Lannoy D, Bourdon F, Titecat M, Frealle E, D’Horne C et coll. Physicochemical and microbiological stability of a new paediatric oral solution of clonidine. Eur J Hosp Pharm 2017;24(suppl. 1):A209.
3. De Goede AL, Boedhram RR, Eckhardt M, Hanff LM, Koch BCP, Vermaat CH et coll. Development and validation of a paediatric oral formulation of clonidine hydrochloride. Int J Pharm 2012;433:119–20.
4. Ensom MHH, Décarie D. Stability of extraporaneously compounded clonidine in glass and plastic bottles and plastic syringes. Can J Hosp Pharm 2014;67:308–10.

5. Suchard JR, Graeme KA. Pediatric clonidine poisoning as a result of pharmacy compounding error. Pediatr Emerg Care 2002;18:295–6.
6. Wiley JF. Clonidine poisoning: is there any effective therapy? Clin Ped Emerg Med 2000;1:207–12.
7. Sauberan JB, Phuong P, Ilog, ND, Rossi SS. Stability and osmolality of extemporeaneously prepared clonidine oral liquid for neonates. Ann Pharmacother 2016;50:243–4.
8. Parfitt K, Sweetman SC, Blake PS, Parsons AV, Brayfield A, Cadart CRM et coll. Martindale – The complete drug reference. 32e éd. London (UK): Pharmaceutical Press;1999:843.
9. Gouvernement du Canada. [en ligne]. Ottawa (ON) : Le gouvernement; 2018. Base de données sur les produits pharmaceutiques. [en ligne] https://produits-sante.canada.ca/dpd-bdpp/index-fra.jsp (site visité le 11 juin 2018).
10. ISMP Canada. Oral clonidine suspension: 1000-fold compounding errors cause harm to children. ISMP Canada Safety Bulletin 2011;11:1–3.
11. Romano MJ, Dinh A. A l000-fold overdose of clonidine caused by a compounding error in a 5-year-old child with attention-deficit/hyperactivity disorder. Pediatrics 2001;108:471–2.
12. Michael JB, Sztajnkrycer MD. Deadly pediatric poisons: nine common agents that kill at low doses. Emerg Med Clin N Am 2004;22:1019–50.
13. Kappagoda C, Hanson RM, Hutchins P. Clonidine overdose in childhood: implications of increased prescribing. J Paediatr Child Health 1998;34:508–12.
14. Erickson S, Duncan A. Clonidine poisoning - an emerging problem: epidemiology, clinical features, management and preventative strategies. J Paediatr Child Health 1998;34:280–2.
15. Ma C, Décarie D, Ensom MHH. Stability of clonidine suspension in oral plastic syringes. Am J Health Syst Pharm 2014;71:657–61.
16. Potier A, Voyat J, Nicolas A. Stability study of a clonidine oral solution in a novel vehicle designed for pediatric patients. Pharm Dev Technol 2017;1–10.
17. Bocam P. Preparation and stability study of extemporaneous clonidine hydrochloride syrups and suspensions [thèse]. Thaïlande: Prince of Songkla University - Pharmacy in Pharmaceutical Sciences; 2010;1–188.
18. Büttner B, Stier AK, Lehmann C, Gärtner P, Knoth H. Development and stability testing of oral clonidine hydrochloride solutions for use in neonatal patients. Eur J Hosp Pharm 2017;24(suppl. 1):A175.
19. Landry C, Forest JM, Hildgen P. Glycopyrrolate orale liquid dosage form. Int J Pharm Compd 2005;9:396–8.
PHARMACTUEL, Vol. 51, No. 3, 2018