Thérapie anti-inflammatoire au canakinumab pour la maladie coronarienne : étude CANTOS
Evelyn Meyan Chin1,2,3, B.Sc., Pharm.D., Étienne Gendron1,4,5, Pharm.D., Qian Li1,6,7, Pharm.D., Marie Lordkipanidzé8,9, B.Pharm., Ph.D.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux du Centre-Ouest-de-l'Île-de-Montréal, Hôpital général juif, Montréal (Québec) Canada;
3Pharmacienne, Centre intégré de santé et de services sociaux du Centre-Ouest-de-l'Île-de-Montréal, Hôpital général juif, Montréal (Québec) Canada;
4Résident en pharmacie au moment de la rédaction, Centre intégré de santé et de services sociaux de Laval, Hôpital de la Cité-de-la-Santé, Laval (Québec) Canada;
5Pharmacien, Centre intégré de santé et de services sociaux de Laval, Hôpital de la Cité-de-la-Santé, Laval (Québec) Canada;
6Résidente en pharmacie au moment de la rédaction, Centre universitaire de santé McGill, Montréal (Québec) Canada;
7Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
8Professeure adjointe, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
9Chercheure, Centre de recherche, Institut de Cardiologie de Montréal, Montréal (Québec) Canada
Reçu le 9 juin 2018: Accepté après révision par les pairs le 29 octobre 2018
Titre de l’article : Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med 2017;377:1119-311.
Auteurs : Ridker PM, Everett BM, Thuren T, MacFayden JG, Chang WH, Ballantyne C et coll. pour les investigateurs de
l’étude CANTOS.
Commanditaires : Novartis a commandité cette étude et y a contribué. Il était responsable de l’élaboration du protocole et de la collecte de données. Norvatis a également fourni le médicament expérimental et le placebo apparenté.
Cadre de l’étude : Les dernières décennies ont été marquantes pour l’amélioration de la prise en charge médicamenteuse et interventionnelle des maladies coronariennes. Ce progrès a permis de réduire significativement la morbidité et la mortalité associées à la maladie cardiovasculaire2–6. Néanmoins, les cardiopathies ischémiques demeurent la première cause de mortalité dans le monde7. Au Canada, selon des données de 2012–2013, le nombre de patients âgés de 20 ans et plus et vivant avec une cardiopathie ischémique s’élève à 2,4 millions8.
La maladie coronarienne est un continuum de lésions vasculaires impliquant les lipides sanguins, l’inflammation, la dysfonction endothéliale et la prolifération anormale des cellules de la paroi vasculaire, culminant en un événement thrombotique majeur qui peut mener à une occlusion partielle ou totale de l’artère coupable9,10. Bien que l’inflammation fasse partie tant du spectre précoce qu’avancé de la pathophysiologie de la maladie athérosclérotique coronarienne, les modalités thérapeutiques qui s’attaquent à l’inflammation vasculaire sans effet sur les lipides sont peu étudiées. Plusieurs études épidémiologiques ont démontré une association entre le niveau de protéine C réactive (CRP) et la prévalence des maladies athérosclérotiques9,10. De plus, dans l’étude CARE de Ridker et coll., les résultats démontrent une interaction entre le profil lipidique et inflammatoire des sujets athérosclérotiques11. Plusieurs thérapies anti-inflammatoires pour la maladie coronarienne font actuellement l’objet d’études12–15.
Le canakinumab est un anticorps monoclonal humain d’isotype IgG1/k ciblant l’interleukine-1β (IL-1β). Il prévient l’activation de la production de médiateurs inflammatoires, dont la synthèse de l’interleukine-6 (IL-6) impliquée dans la production de la CRP. Au Canada et en France, ce médicament est actuellement approuvé pour le traitement de certaines maladies rhumatismales rares, telles que la fièvre méditerranéenne familiale16,17. L’inhibition de l’IL-1β par le canakinumab réduit l’IL-6 et la CRP sans affecter le profil lipidique18. L’étude CANTOS de Ridker et coll. est la première étude d’envergure voulant confirmer cette hypothèse.
Protocole de recherche : Il s’agit d’une étude de phase III, multicentrique, à répartition aléatoire, à double insu, contrôlée par placebo, regroupant des sujets ayant subi un infarctus du myocarde (IM) récent. Les sujets admissibles ayant consenti à y participer étaient répartis aléatoirement selon le ratio suivant : 1,5 (placebo):1 (50 mg):1 (150 mg):1 (300 mg). Une stratification a été faite en fonction du temps écoulé entre l’épisode d’IM le plus récent et la répartition aléatoire et selon le moment d’inclusion de l’étude, soit avant ou après l’ajout d’un groupe expérimental supplémentaire de canakinumab 50 mg à la demande des agences réglementaires. Les auteurs ont effectué une analyse en intention de traiter pour évaluer l’objectif primaire et les objectifs secondaires. La taille d’échantillon nécessaire pour obtenir une puissance égale ou supérieure à 90 % était de 17 200 patients sur une période de cinq ans pour l’objectif primaire. Il existe un seuil de signification ajusté pour chaque groupe expérimental qui permet la prise en compte de la multiplicité des tests. Pour les doses de 50 mg, 150 mg et 300 mg, les seuils sont respectivement de 0,02115, 0,02115 et 0,01058. L’étude n’était pas conçue pour détecter des différences sur le plan des objectifs de sécurité. En décembre 2013, à la demande du commanditaire, le nombre de sujets recrutés a été réduit à 10 000 et la période de suivi prolongée d’un an pour une question d’ordre économique. Le protocole avait été approuvé par l’ensemble des comités d’éthique de chaque institution.
Patients : Afin d’être admissibles, les sujets devaient être âgés d’au moins 18 ans, avoir un taux sérique de CRP égal ou supérieur à 2 mg/L et avoir un historique d’IM documenté, datant d’au moins 30 jours avant la répartition aléatoire. Les critères d’exclusion étaient les suivants : toute infection active, chronique ou récurrente, un antécédent de cancer autre que le carcinome cutané basocellulaire, un état d’immunosuppression, une infection à tuberculose active ou latente, la présence du virus de l’immunodéficience humaine et toute prise de médicament anti-inflammatoire systémique.
Interventions : Les sujets étaient répartis aléatoirement dans l’un des quatre groupes de l’étude. La composition des trois groupes expérimentaux était la suivante : canakinumab à 50 mg, 150 mg et 300 mg. Les sujets du groupe témoin recevaient le placebo. Toutes les doses de canakinumab ainsi que le placebo étaient administrés par injection sous-cutanée tous les trois mois. Le groupe à 300 mg a reçu les deux premières doses toutes les deux semaines, puis les autres tous les trois mois. L’ensemble des participants recevait les soins standards qui font suite à un IM.
Points évalués : L’objectif primaire d’efficacité était la survenue d’un objectif composite, soit un IM non fatal, un accident vasculaire cérébral (AVC) non fatal et un décès cardiovasculaire. Les deux objectifs secondaires d’efficacité étaient les suivants : objectif composite primaire en plus de la survenue d’hospitalisation pour une angine instable menant à une revascularisation d’urgence, ainsi que l’apparition de diabète de type II (DM2) chez les patients prédiabétiques au moment de la répartition aléatoire. Les résultats portant sur le DM2 ne sont pas rapportés dans l’article. On retrouve deux autres objectifs secondaires prédéterminés : le décès toutes causes confondues et l’objectif composite défini par un IM non fatal, un AVC non fatal et le décès toutes causes confondues. Une évaluation de la sécurité à long terme du canakinumab comparativement au placebo a été effectuée. Afin de confirmer le concept entourant la composante inflammatoire, les auteurs ont mesuré à diverses reprises et pendant 48 mois le niveau de CRP et le bilan lipidique de tous les groupes.
Résultats : Le recrutement s’est déroulé entre avril 2011 et mars 2014 dans 39 pays. Parmi les 17 482 sujets recrutés, 10 061 ont été inclus dans l’étude. On compte 7377 sujets exclus, notamment en raison d’une CRP inférieure à 2 mg/L (46 %) et de la présence de tuberculose (25 %). Après la répartition aléatoire, 3344 sujets ont été attribués au groupe placebo, 2170 au groupe de 50 mg, 2284 au groupe de 150 mg et 2263 au groupe de 300 mg. Les groupes étaient comparables, âgés en moyenne de 61 ans et majoritairement des hommes. Comme l’indique le tableau I, les comorbidités et la prise des médicaments concomitants étaient réparties de manière équivalente entre les quatre groupes. La médiane du suivi des patients à l’étude est de 3,7 ans. Une réduction statistiquement significative de la CRP (p < 0,001) a été rapportée après 48 mois dans l’ensemble des groupes expérimentaux comparativement au placebo. Une réduction dose-dépendante médiane de 26 %, 37 % et 41 % a été observée dans les groupes de 50 mg, 150 mg et 300 mg comparativement au placebo. De plus, le canakinumab n’a pas diminué le LDL sérique de manière significative comparativement au niveau de base. Les résultats clés sont présentés dans le tableau II.
Tableau I Caractéristiques des patients au début de l’étudea,b
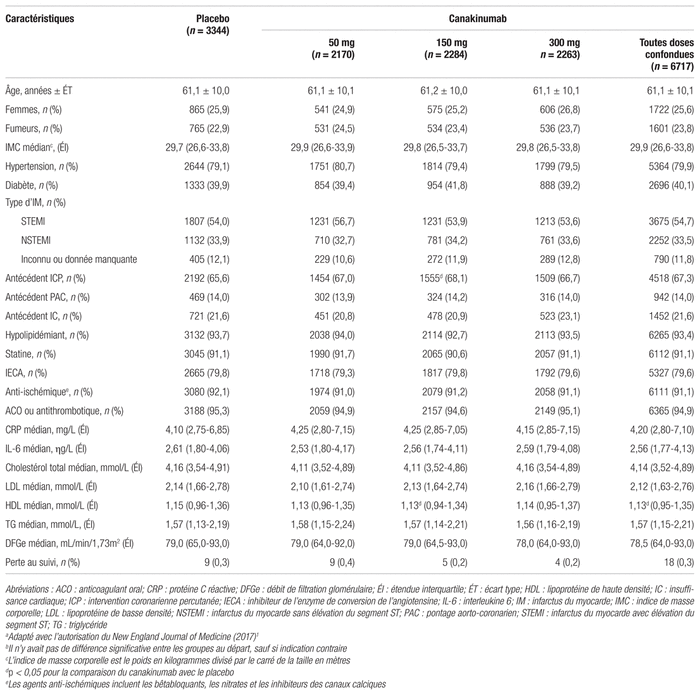
Tableau II Principaux résultats d’efficacitéa,b
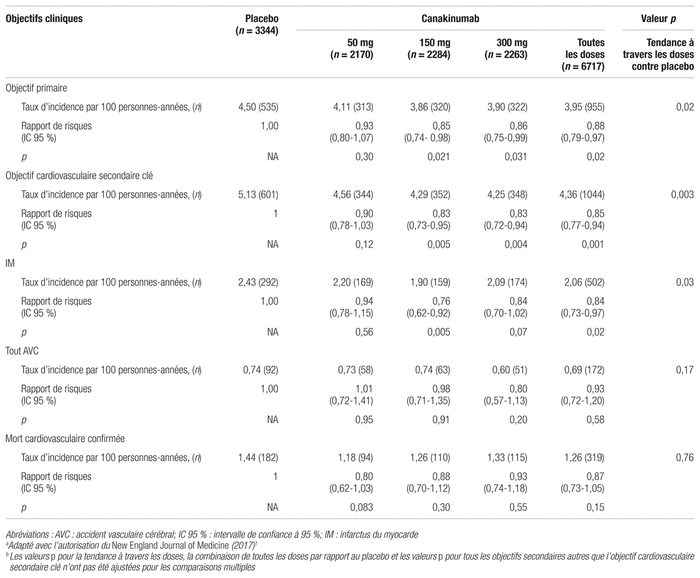
L’incidence de l’objectif composite primaire était de 4,50 évènements par groupe de 100 personnes en l’espace d’une année (soit, 4,50 par 100 personnes-années) dans le groupe placebo, comparativement à 4,11, 3,86 et 3,90 évènements par 100 personnes-années pour le groupe placebo à 50 mg, 150 mg et 300 mg, respectivement. La dose de 50 mg n’a démontré aucun effet significatif comparativement au placebo dans l’évaluation de l’objectif primaire (rapport de risques [RR] : 0,93; intervalle de confiance à 95 % [IC 95 %] : 0,80–1,07, p = 0,30). En revanche, le résultat obtenu pour la dose de 150 mg était statistiquement significatif en faveur du canakinumab, avec une diminution du RR de 15 % par rapport au placebo (RR : 0,85; IC 95 % : 0,74–0,98, p < 0,021). Bien que le RR du groupe à 300 mg soit semblable à celui de 150 mg (RR : 0,86; IC 95 % : 0,75–0,99, p < 0,031), il n’a pas atteint le seuil de signification prédéterminé. Quant au premier objectif secondaire, la dose de 150 mg a également démontré un effet statistiquement significatif en faveur du canakinumab, avec une diminution de 17 % du RR (RR : 0,83; IC 95 % : 0,73–0,95, p < 0,005).
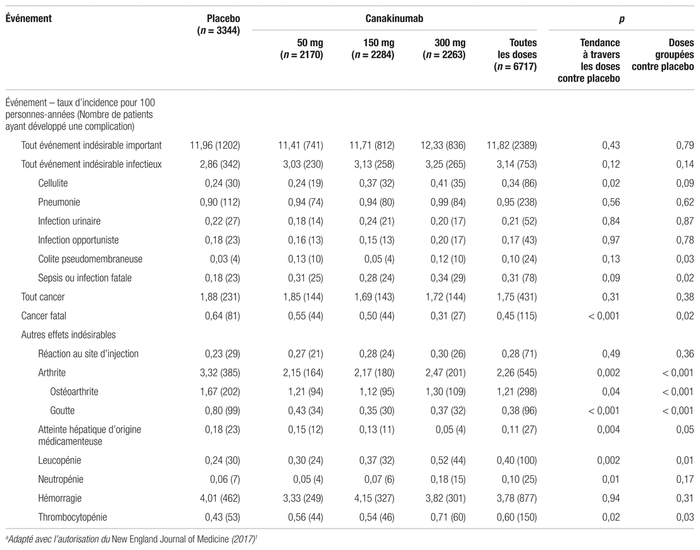
Les effets indésirables importants du canakinumab sont rapportés dans le tableau III. Toutes les doses étaient associées à une augmentation statistiquement significative des infections fatales comparativement au placebo. La neutropénie et la thrombocytopénie ont aussi été plus souvent rapportées dans les groupes expérimentaux. En revanche, le canakinumab est également associé à une diminution significative de la mortalité liée au cancer comparativement au placebo (incidence de 0,45 patients-années dans l’ensemble des groupes expérimentaux comparativement à une incidence de 0,64 patients-années dans le groupe placebo, p = 0,02).
Tableau III Événements indésirables importantsa
Grille d’analyse

Discussion
Les résultats de cette étude permettent de démontrer un lien potentiellement causal entre l’inflammation et l’athérosclérose. Il s’agit de la première étude d’envergure démontrant une réduction de la récurrence de la maladie cardiovasculaire, indépendamment d’une réduction du bilan lipidique. Ces résultats enrichissent donc notre arsenal thérapeutique contre la maladie athérosclérotique et ouvrent la voie à de futures pistes de recherche permettant de cibler d’autres composantes de la cascade inflammatoire. Deux études comparant respectivement le méthotrexate à faible dose et la colchicine au placebo pour la prévention secondaire d’événement cardiovasculaire sont déjà en cours19,23. Le canakinumab permet pour la première fois de cibler les patients associés à un risque cardiovasculaire résiduel malgré une thérapie optimale. À ce jour, les lignes directrices nord-américaines et européennes ne mentionnent pas les résultats de cette étude.
L’étude a plusieurs forces méthodologiques. Les critères d’exclusion étaient appropriés, puisqu’ils ciblaient les patients pouvant bénéficier le plus d’une thérapie anti-inflammatoire, c’est-à-dire ceux avec un fardeau inflammatoire élevé ainsi qu’un faible risque infectieux. D’ailleurs, une CRP inférieure à 2 mg/L et un risque de tuberculose substantiel ont représenté plus de 70 % des raisons d’exclusion durant la phase de recrutement. Les groupes étaient comparables quant aux facteurs de risque cardiovasculaires les plus fréquents (hypertension, diabète, dyslipidémie et statut tabagique), ce qui limite le biais de confusion. De plus, l’étude a été menée à l’aveugle tant pour les patients et les investigateurs que pour le personnel responsable de la collecte et du traitement des données. L’objectif clinique composite était également semblable aux autres études pivots en médecine cardiovasculaire. Le regroupement de plusieurs objectifs était justifié afin d’augmenter la possibilité de détecter une différence statistiquement significative. De plus, l’adhésion était objectivée en raison de l’administration du médicament par une infirmière. Les résultats prometteurs obtenus dans le sous-groupe de patients cancéreux représentent une avenue de recherche attrayante en oncologie. Ils concordent avec des données expérimentales illustrant le lien entre l’IL-1β et le développement de certains cancers20.
Malgré l’innovation thérapeutique qu’elle apporte, l’étude CANTOS comporte plusieurs faiblesses qui limitent son applicabilité clinique. Bien qu’il soit statistiquement significatif, l’effet clinique reste modeste, c’est-à-dire une diminution du risque absolu de 0,64 %, qui se traduit par un nombre nécessaire de patients à traiter de 156. Mais le poids de ce résultat est largement attribué à l’incidence d’IM non fatal. De plus, l’augmentation d’infection fatale ou de sepsis et de leucopénie soulève des inquiétudes par rapport à l’innocuité du canakinumab, surtout si on prend en compte le fait que les patients exposés à un risque d’infection étaient exclus de l’étude. Par ailleurs, bien que la proportion des interruptions du traitement entre les groupes ait été similaire, les causes de ces interruptions (18,1 % dans le groupe placebo comparativement à 18,7 % dans les groupes expérimentaux) ne sont pas précisées, ce qui introduit la possibilité de données manquantes (incidence d’infections différente entre les groupes) pouvant créer un biais dans l’interprétation des résultats. Les interruptions de traitement étaient présumées comme étant non informatives et une analyse de sensibilité était prévue à cet égard, mais les résultats ne sont pas rapportés par les auteurs. Il est cependant rassurant de noter que la fréquence des retraits est similaire aux études évaluant les inhibiteurs de la proprotéine convertase subtilisine/kexine de type 9 (PCSK9), qui se situent entre 12 et 28 %4,5. Finalement, une analyse de sous-groupe selon le niveau de risque cardiovasculaire à l’aide d’un outil de prédiction, tel le score GRACE, aurait été profitable pour l’estimation de la mortalité à six mois des patients hospitalisés souffrant d’un syndrome coronarien aigu21. Par ailleurs, la méthode d’appariement des coefficients de propension aurait également pu être employée pour l’ajustement statistique du niveau de risque cardiovasculaire, ce qui aurait permis de prendre en compte le risque cardiovasculaire individuel de chaque participant.
Il faut aussi noter que la participation de Novartis à la rédaction du protocole et à la collecte de données peut avoir influencé le rapport des résultats. Les résultats de plusieurs objectifs secondaires n’avaient pas été rapportés, dont l’incidence de DM2 dans le sous-groupe de patients prédiabétiques. De plus, parmi les résultats rapportés, certains n’ont pas été ajustés en fonction de la multiplicité des tests, sans mention de justification.
L’enjeu pharmacoéconomique lié au canakinumab est un obstacle de taille pour l’applicabilité clinique de cette molécule. En effet, comme son prix annuel est de 200 000 dollars américains, il n’a été approuvé au Canada en juin 2017 que pour le traitement de cinq syndromes auto-inflammatoires de fièvre périodique16,22. Il est impossible d’évaluer à ce stade l’impact économique du médicament, car le prix actuel reflète son utilisation pour traiter des maladies orphelines qui affectent des patients d’exception. De plus, il est difficile de justifier l’adoption d’une molécule dont l’effet est modeste, mais dont le prix est élevé lorsqu’il existe des thérapies anti-inflammatoires prometteuses et peu coûteuses en cours d’évaluation, tels le méthotrexate et la colchicine19,23. Pour le moment, aucun inhibiteur de la PCSK9 n’a été approuvé par la Régie de l’assurance maladie du Québec comme traitement de l’hypercholestérolémie dans la maladie cardiovasculaire athérosclérotique. Le prix annuel de l’évolocumab est d’environ 6 000 dollars canadiens, ce qui est bien en deçà du prix actuel du canakinumab24.
Étant donné son effet clinique modeste, les inquiétudes par rapport à son innocuité et son coût important, le canakinumab devra être restreint aux patients qui en bénéficieraient le plus, soit ceux ayant un antécédent d’événement cardiovasculaire accompagné d’un risque résiduel élevé de récidive, d’une CRP élevée et d’un faible risque d’infection.
Conclusion
Les patients ayant un antécédent d’IM et une CRP supérieure à 2 mg/L pourraient bénéficier du canakinumab à 150 mg administré par voie sous-cutanée tous les trois mois afin de réduire le risque de récurrence d’évènements cardiovasculaires. Toutefois, les bienfaits cliniquement modestes et un profil de sécurité préoccupant limitent l’utilisation de cette molécule. L’étude CANTOS apporte tout de même de nouvelles connaissances sur le rôle de l’inflammation dans la pathogenèse de la maladie coronarienne athérosclérotique.
Financement
Aucun financement en rapport avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Remerciements
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal; les auteurs remercient les responsables et collaborateurs. Une autorisation écrite a été obtenue de ces personnes.
Références
1. Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C et coll. Antiinflammatory therapy with canakinumab for atherosclerotic disease. N Engl J Med 2017;377:1119–31.

2. Capewell S, Morrison CE, McMurray J. Contribution of modern cardiovascular treatment and risk factor changes to the decline in coronary heart disease mortality in Scotland between 1975 and 1994. Heart 1999;81:380–6.


3. Capewell S, Beaglehole R, Seddon M, McMurray J. Explanation for the decline in coronary heart disease mortality rates in Auckland, New Zealand, between 1982 and 1993. Circulation 2000; 102:1511–6.

4. Robinson JG, Farnier M, Krempf M, Bergeron J, Luc G, Averna M et coll. Efficacy and safety of alirocumab in reducing lipids and cardiovascular events. N Engl J Med 2015;372:1489–99.

5. Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA et coll. Evolocumab and clinical outcomes in patients with cardiovascular disease. N Engl J Med 2017; 376:1713–22.

6. Lloyd-Jones DM, Morris PB, Ballantyne CM, Birtcher KK, Daly DD Jr, DePalma SM et coll. 2017 Focused update of the 2016 ACC expert consensus decision pathway on the role of non-statin therapies for LDL-cholesterol lowering in the management of atherosclerotic cardiovascular disease risk: a report of the american college of cardiology task force on expert consensus decision pathways. J Am Coll Cardiol 2017;70:1785–822.

7. Organisation mondiale de la Santé. Les 10 principales causes de mortalité (24 mai 2018). [en ligne] http://www.who.int/mediacentre/factsheets/fs310/fr/ (site visité le 24 mai 2018).
8. Gouvernement du Canada. Les maladies du coeur au Canada : faits saillants du système canadien de surveillance des maladies chroniques (1er août 2017). [en ligne] https://www.canada.ca/fr/sante-publique/services/publications/maladies-et-affections/maladies-coeur-canada-fiche-technique.html (site visité le 1er février 2018).
9. Ridker PM, Cushman M, Stampfer MJ, Tracy RP, Hennekens CH. Inflammation, aspirin, and the risk of cardiovascular disease in apparently healthy men. N Engl J Med 1997;336:973–9.

10. Ridker PM, Hennekens CH, Buring JE, Rifai N. C-reactive protein and other markers of inflammation in the prediction of cardiovascular disease in women. N Engl J Med 2000;342:836–43.

11. Ridker PM, Rifai N, Pfeffer MA, Sacks FM, Moye LA, Goldman S et coll. Inflammation, pravastatin, and the risk of coronary events after myocardial infarction in patients with average cholesterol levels. Cholesterol and Recurrent Events (CARE) Investigators. Circulation 1998;98:839–44.

12. Ridker PM, Lüscher TF. Anti-inflammatory therapies for cardiovascular disease. Eur Heart J 2014;35:1782–91.


13. Westlake SL, Colebatch AN, Baird J, Kiely P, Quinn M, Choy E et coll. The effect of methotrexate on cardiovascular disease in patients with rheumatoid arthritis: a systematic literature review. Rheumatology 2010;49:295–307.

14. Micha R, Imamura F, Wyler von Ballmoos, M. Systematic review and meta-analysis of methotrexate use and risk of cardiovascular disease. Am J Cardiol 2011;108:1362–70.


15. Verma S, Eikelboom JW, Nidorf SM, Al-Omran M, Gupta N, Teoh H et coll. Colchicine in cardiac disease: a systematic review and meta-analysis of randomized controlled trials. BMC Cardiovasc Disord 2015;15:96.


16. Norvartis pharmaceutiques Canada Inc. Monographie de produit : Ilaris (5 janvier 2017). [en ligne] https://www.novartis.ca/sites/www.novartis.ca/files/ilaris_scrip_e.pdf (site visité le 1er février 2018).
17. Haute autorité de santé. Commission de la transparence. [en ligne] https://www.has-sante.fr//portail/upload/docs/evamed/CT16220_ILARIS_PIC_EI_Avis3_CT16220.pdf (site visité le 1er février 2018).
18. Ridker PM, Howard CP, Walter V, Everett B, Libby P, Hensen J et coll. Effects of interleukin-1β inhibition with canakinumab on hemoglobin A1c, lipids, C-reactive protein, interleukin-6, and fibrinogen: a phase IIb randomized, placebo-controlled trial. Circulation 2012;126:2793–48.

19. Clinicaltrials.gov. Cardiovascular inflammation reduction trial (9 mai 2012). [en ligne] https://clinicaltrials.gov/ct2/show/NCT01594333 (site visité le 1er février 2018).
20. Dinarello CA. Why not treat human cancer with interleukin-1 blockade? Cancer Metastasis Rev 2010;29:317–29.


21. Fox KA, Dabbous OH, Goldberg RJ, Pieper KS, Eagle KA, Van de Werf F et coll. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ 2006;333:1091–4.


22. Harrington RA. Targeting inflammation in coronary artery disease. N Engl J Med 2017;377:1197–8.

23. Clinicaltrials.gov. Colchicine cardiovascular outcomes trial (16 septembre 2015). [en ligne] https://clinicaltrials.gov/ct2/show/NCT02551094 (site visité le 1er février 2018).
24. Régie de l’assurance maladie du Québec. Liste des médicaments (3 avril 2018). [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/liste_med/liste_med_2018_04_03_fr.pdf (site visité le 1er février 2018).
Pour toute correspondance : Étienne Gendron, Centre intégré de santé et de services sociaux de Laval, Hôpital de la Cité-de-la-Santé, 1755, boul. René-Laennec, Laval, Québec H7M 3L9, Canada; Téléphone : 450 668-1010, p. 23224; Télécopieur : 450 975-5354; Courriel : etienne.gendron.cissslav@ssss.gouv.qc.ca
(Return to Top)
PHARMACTUEL, Vol. 52, No. 1, 2019