Étude TRUST: Traitement à la lévothyroxine pour des patients âgés atteints d’hypothyroïdie subclinique
Jennifer Fontaine1,2, Pharm.D., Philippe Arbour1,3, Pharm.D., Laurence Messier1,3, Pharm.D., Virginie Verreault1,3, Pharm.D., Louise Mallet4,5,6, B.Sc. Pharm., Pharm.D., FESCP, FOPQ
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction de l’article, Hôpital général juif, Montréal (Québec) Canada;
3Résident en pharmacie au moment de la rédaction de l’article, Centre hospitalier de l’Université de Montréal, Montréal (Québec) Canada;
4Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
5Rédactrice adjointe, Pharmactuel, Montréal (Québec) Canada;
6Professeure titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
Reçu le 20 mai 2018: Accepté après révision par les pairs le 15 août 2018
Résumé
Cadre de l’étude : L’hypothyroïdie subclinique est définie par une valeur de la thyréostimuline (TSH) supérieure à 4,6 mUI/L sans augmentation de la thyroxine libre (T4L)2. Les termes hypothyroïdie infraclinique ou fruste sont aussi utilisés pour décrire l’hypothyroïdie subclinique. La prévalence est de 4 à 8 % dans la population générale, mais elle augmente jusqu’à 15 à 18 % chez les femmes de plus de 60 ans3,4. Certaines études avancent l’hypothèse que l’hypothyroïdie subclinique serait associée à une augmentation de la mortalité cardiovasculaire et pourrait être un facteur de risque d’insuffisance cardiaque5,6.
Les lignes directrices de l’American Association of Clinical Endocrinologists recommandent de traiter l’hypothyroïdie subclinique si la TSH est supérieure ou égale à 10 mUI/L, car le risque cardiovasculaire est plus élevé chez ces patients7. Quand la TSH est inférieure à 10 mUI/L, on recommande d’individualiser le traitement en fonction du risque cardiovasculaire du patient, de ses comorbidités ou de ses symptômes.
Le traitement de l’hypothyroïdie subclinique demeure un sujet controversé, c’est pourquoi cette étude tente d’évaluer la pertinence clinique de traiter les patients d’âge égal ou supérieur à 65 ans qui en souffrent.
Protocole de recherche : Il s’agit d’une étude à répartition aléatoire contrôlée et multicentrique, réalisée en double aveugle avec deux groupes traités parallèlement: le groupe recevant de la lévothyroxine et le groupe placebo. Le recrutement s’est fait en Écosse, aux Pays-Bas, en Irlande et en Suisse. Les analyses statistiques ont été réalisées en intention de traiter modifiée (ITTm), elles ne portent que sur les patients dont le résultat primaire était disponible, sans prise en compte de leur arrêt prématuré ou non du traitement.
Patients : Étaient inclus dans l’étude les patients d’au moins 65 ans avec une hypothyroïdie subclinique persistante, définie par une TSH de 4,60 à 19,99 mUI/L, mesurée à deux occasions consécutives, dans un intervalle de trois mois à trois ans, en plus d’être associée à un niveau de T4L dans les valeurs de référence du laboratoire. Ont été exclus de l’étude les patients ayant un antécédent de chirurgie thyroïdienne, une prise d’iode radioactif dans les 12 mois précédents, une démence, une hospitalisation pour une maladie majeure, une chirurgie élective ou un syndrome coronarien aigu dans les quatre semaines précédentes ainsi que ceux présentant une maladie terminale. Les patients prenant de la lévothyroxine, un antithyroïdien, de l’amiodarone ou du lithium en étaient également exclus.
Interventions : Les patients ont été répartis aléatoirement dans les deux groupes par blocs permutés aléatoires dans un ratio 1:1. Lors de la répartition aléatoire, une stratification a eu lieu selon le pays, le sexe et la dose de départ. Pour le groupe lévothyroxine, la dose de départ était de 50 μg une fois par jour ou de 25 μg si le patient avait un poids inférieur à 50 kg ou une maladie coronarienne définie par un antécédent d’infarctus du myocarde ou par une angine stable. Un suivi était effectué six à huit semaines après l’instauration du traitement à la lévothyroxine ou au placebo. L’ajustement de la dose de lévothyroxine était effectué par ordinateur, sans intervention d’un médecin, pour obtenir une TSH entre 0,4 et 4,59 mUI/L. La dose totale maximale était de 150 μg par jour. Les patients du groupe placebo ont obtenu une simulation d’ajustement de dose afin de maintenir l’aveugle.
Points évalués : Les principaux critères d’évaluation de l’efficacité du traitement étaient la qualité de vie, les symptômes d’hypothyroïdie et la fatigue ainsi que leur évolution après 12 mois. Deux sections du score Thyroid-Specific Quality of Life Patient-Reported Outcome Measure (ThyPRO) ont été utilisées: l’Hypothyroid Symptoms Score et le Tiredness Score. Un score plus élevé indiquait une présence accrue de symptômes. Les objectifs secondaires évalués étaient les suivants: les évènements cardiovasculaires fatals ou non fatals, la mort toutes causes confondues, la qualité de vie évaluée par le score EuroQoL Group 5-Dimension Self-Report Questionnaire (EQ-5D) Descriptive Score, le score ThyPRO-39 (une version abrégée du score ThyPRO), la force de préhension, la fonction cognitive, les pressions systoliques et diastoliques, le poids, l’indice de masse corporelle, le tour de taille, les activités de la vie quotidienne et domestiques.
L’évaluation de l’innocuité a été effectuée à l’aide de l’Hyperthyroid Symptom Score. Les patients ont bénéficié d’investigations visant à détecter les effets indésirables sérieux pouvant être liés à une dose trop élevée de lévothyroxine, comme la fibrillation auriculaire, l’insuffisance cardiaque, une fracture osseuse ou un nouveau diagnostic d’ostéoporose.
Résultats : Parmi les 2647 patients admissibles à l’étude, 1910 ont été exclus avant la répartition aléatoire, avec comme cause principale une valeur de TSH normalisée, qui concernait 1645 patients. Des 2647 patients évalués pour leur admissibilité, 737 ont été répartis aléatoirement; 369 ont été inclus dans le groupe placebo et 368 dans le groupe lévothyroxine. L’âge moyen était de 74,4 ans et 53,6 % étaient des femmes. La TSH moyenne était de 6,4 ± 2,01 mUI/L au début de l’étude et 4,6 % (n = 34) des patients inclus avaient une TSH supérieure ou égale à 10 mUI/L. Les caractéristiques des patients sont présentées au tableau I. Il n’y avait au départ aucune différence statistiquement significative entre les deux groupes.
Après 12 mois, 337 (91,3 %) patients étaient encore dans le groupe placebo et 332 (90,2 %) dans le groupe lévothyroxine. La dose médiane de lévothyroxine était de 50 μg et la durée moyenne de suivi était de 17,3 mois pour le groupe placebo et de 18 mois pour le groupe lévothyroxine.
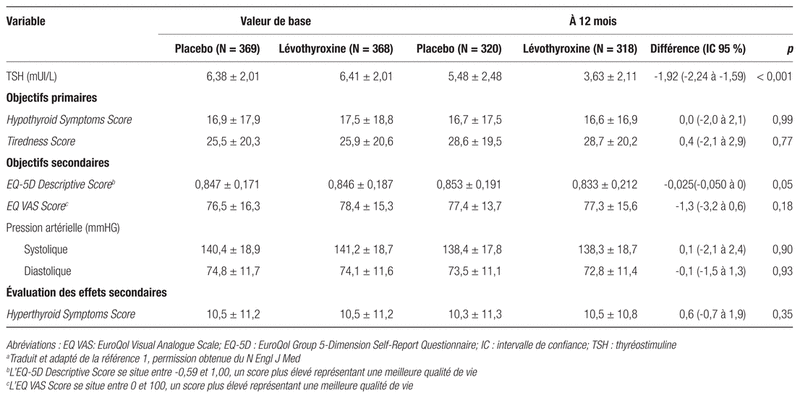
Pour ce qui est de l’objectif primaire à 12 mois, la TSH moyenne avait diminué à 5,48 mUI/L dans le groupe placebo et à 3,63 mUI/L dans le groupe sous lévothyroxine (tableau II). On note donc une différence significative de la valeur de TSH, soit 1,92 mUI/L, dans le groupe traité comparativement au groupe placebo lors du suivi à 12 mois (différence de moyennes: −1,92; intervalle de confiance à 95 % [IC 95 %] −2,24 à −1,59, p < 0,001).
Toutefois, pour ce qui est des symptômes, l’Hypothyroid Symptom Score (différence de moyennes: 0,0; IC 95 %: −2,0 à 2,1, p = 0,99) ainsi que le score de fatigue Tiredness Score (différence de moyennes: 0,4; IC 95 %: −2,1 à 2,9, p = 0,77) n’ont pas démontré de différence statistiquement significative entre les deux groupes. Quant aux objectifs secondaires figurant au tableau II ainsi qu’à ceux sur l’innocuité de la lévothyroxine, aucune différence statistiquement significative n’a été observée. Dans le groupe placebo, 103 patients ont rapporté au moins un effet indésirable sérieux comparativement à 78 dans le groupe lévothyroxine.
Tableau I Caractéristiques de base des patients à l’entrée dans l’étudea
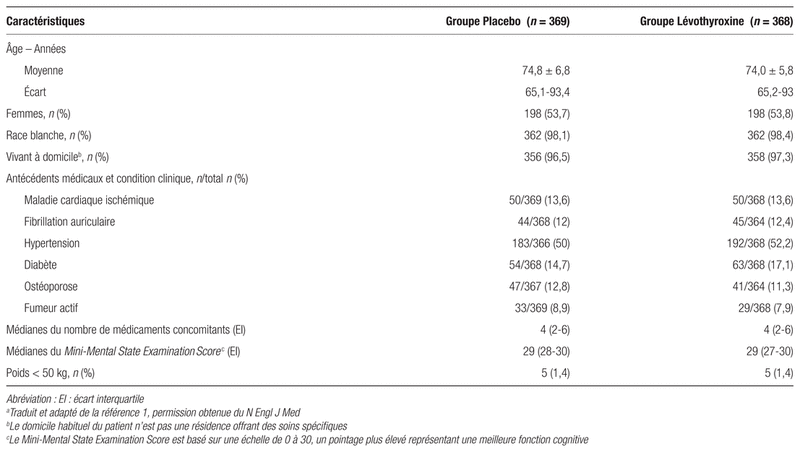
Tableau II Résultats des objectifs primaires et secondaires à 12 mois et de l’évaluation des effets indésirablesa
Un suivi prolongé a été réalisé auprès de 187 patients du groupe placebo (24,2 mois) et de 194 patients du groupe lévothyroxine (24,5 mois). Le seul objectif démontrant une différence statistiquement significative était celui de l’EQ-5D Descriptive Index, qui a démontré une amélioration en faveur du groupe lévothyroxine (différence de moyennes: 0,040; IC 95 %: 0,005 à 0,075, p = 0,03).
Grille d’évaluation critique

Discussion
L’étude TRUST démontre l’absence d’avantages du traitement à la lévothyroxine pour traiter les symptômes associés à l’hypothyroïdie subclinique touchant des patients âgés de 65 ans et plus.
L’objectif primaire visait le changement de résultat sur deux sections du ThyPRO, un score de mesure rapporté par les patients, qui possède une forte validité clinique et une bonne fiabilité démontrée par la reproductibilité test-retest12,13. Le score ThyPRO est approprié, puisqu’il a été validé pour l’évaluation de la qualité de vie dans les cas de désordres thyroïdiens et il est sensible aux modifications des symptômes. Toutefois, les patients étaient peu symptomatiques à leur entrée dans l’étude, il est donc difficile de mesurer l’amélioration de la qualité de vie et des symptômes d’hypothyroïdie. L’évaluation de ce paramètre comme objectif primaire est donc peu pertinente sur le plan clinique.
L’hypothyroïdie subclinique pourrait être associée, surtout chez les sujets ayant une TSH supérieure à 10 mUI/L, à un risque accru d’accidents cardiovasculaires, soit un infarctus du myocarde, une hospitalisation pour une angine ou une revascularisation coronarienne10. Étant donné le manque de puissance statistique des effets du traitement sur les atteintes cardiovasculaires, évaluation qui avait été initialement prévue dans les objectifs primaires, l’analyse de ces atteintes a été déplacée dans les objectifs secondaires. Ce changement affaiblit la puissance clinique potentielle de l’étude.
De plus, l’hypothyroïdie subclinique a été associée à de la dyslipidémie9. Une diminution des niveaux de lipoprotéines de basse densité (LDL) lors du traitement de l’hypothyroïdie subclinique à la lévothyroxine a été rapportée dans la littérature même chez des patients ayant une TSH inférieure à 10 mUI/L14–16. Le bilan lipidique n’a cependant pas été mesuré dans l’étude TRUST. Ces données auraient été pertinentes pour l’évaluation des effets cardiovasculaires liés au traitement.
Quand elle est élevée, la TSH peut se normaliser spontanément chez beaucoup de patients17. Ainsi, les sujets inclus dans l’étude devaient avoir deux valeurs de TSH supérieures à 4,6 mUI/L dans un intervalle de trois mois. En effet, 1645 des 2647 patients évalués pour leur admissibilité ont vu leur TSH se normaliser avant le début de l’étude. Il est donc intéressant de constater que la valeur de la TSH peut prendre de six à 60 mois pour se normaliser spontanément. Les participants à l’étude auraient donc pu avoir une normalisation spontanée ultérieurement.
La mesure des anticorps anti-thyroperoxydase (anti-TPO) n’a pas été faite. Selon les lignes directrices de l’American Association of Clinical Endocrinologists, la décision de traiter l’hypothyroïdie subclinique n’est pas influencée par la valeur d’anti-TPO7. Il est donc normal que les investigateurs ne l’aient pas mesurée.
L’analyse des résultats a été conduite en ITTm. Cette perspective d’analyse ne tient pas compte des patients pour lesquels le résultat de l’objectif primaire n’est pas disponible à 12 mois. L’exclusion de l’analyse d’une proportion significative de patients peut avoir influencé la répartition aléatoire. De plus, il a été démontré que les analyses en ITTm sont souvent associées à de l’imprécision et à une difficulté d’interprétation des résultats18,19. Dans le cadre de cette étude, cette méthode d’analyse ne semble pas avoir eu d’effet majeur sur les conclusions. Des analyses de sensibilité n’ont toutefois pas été effectuées et les informations sur les patients perdus au suivi ne sont pas connues. Il faut donc rester prudent lors de l’interprétation des résultats.
L’étude ne démontre aucun avantage du traitement de l’hypothyroïdie subclinique à la lévothyroxine. D’ailleurs, la plupart des patients avaient très peu de symptômes à leur entrée dans l’étude. Ne devrions-nous traiter que les patients présentant des symptômes? La lévothyroxine est-elle bénéfique pour les patients présentant une TSH très élevée? Comme le nombre de patients ayant une TSH supérieure à 10 mUI/L à l’entrée dans l’étude était faible, soit 4,6 % des sujets, il est impossible de répondre à cette question. La lévothyroxine peut-elle apporter des avantages cardiovasculaires même aux patients asymptomatiques? Ce sont toutes des questions que l’étude laisse en suspens. Il est toutefois rassurant de constater que le traitement à la lévothyroxine était associé à une incidence d’évènements indésirables similaire au placebo.
Conclusion
L’étude TRUST permet d’affirmer que le traitement à la lévothyroxine de l’hypothyroïdie subclinique des personnes âgées de plus de 65 ans n’offre aucun avantage sur le plan des symptômes. L’Hypothyroid Symptoms Score et le Tiredness Score n’ont pu déterminer aucun avantage clinique de ce traitement. Les effets du traitement sur le plan cardiovasculaire restent toutefois inconnus. Les pratiques actuelles consistant à ne traiter que les patients ayant une TSH supérieure à 10 mUI/L ne devraient donc pas changer à la lumière de ces résultats7.
Commanditaires
Cette étude a été financée par une bourse de l’Union européenne FP7, de la Swiss National Science Foundation, de la Swiss Heart Foundation et du Velux Stiftung. Merck a fourni les médicaments, sans aucune autre participation.
Remerciements
Cet article a été rédigé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs tiennent à remercier les responsables du cours. Une autorisation écrite de ceux-ci a été obtenue.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
Références
1. Stott DJ, Rodondi N, Kearney PM, Ford I, Westendorp RGJ, Mooijaart SP et coll. Thyroid hormone therapy for older adults with subclinical hypothyroidism. N Engl J Med 2017;376:2534–44.

2. Jones DD, May KE, Geraci SA. Subclinical Thyroid Disease. Am J Med 2010;123:502–4.

3. Villar HC, Saconato H, Valente O, Atallah AN. Thyroid hormone replacement for subclinical hypothyroidism. Cochrane Database Syst Rev 2007:CD003419:2.
4. Hollowell JG, Staehling NW, Flanders WD, Hannon WH, Gunter EW, Spencer CA et coll. Serum TSH, T(4) and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES III). J Clin Endocrinol Metab 2002;87:489–99.

5. Razvi S, Ingoe L, Keeka G, Oates C, McMillan C, Weaver JU. The beneficial effect of L-thyroxine on cardiovascular risk factors, endothelial function, and quality of life in subclinical hypothyroidism: randomized, crossover trial. J Clin Endocrinol Metab 2007;92:1715–23.

6. Gencer B, Collet TH, Virgini V, Bauer DC, Gussekloo J, Cappola AR et coll. Subclinical thyroid dysfunction and the risk of heart failure events: an individual participant data analysis from 6 perspective cohorts. Circulation 2012;12:1040–6.

7. Garber JR, Cobin RH, Gharib H, Hennessey JV, Klein I, Mechanick JI et coll. Clinical practice guidelines for hypothyroidism in adults: cosponsored by the American Association of Clinical Endocrinologists and the American Thyroid Association. Endocr Pract 2012;18:988–1028.

8. Malinowski JR, Denny JC, Bielinski SJ, Basford MA, Bradford Y, Peissig PL et coll. Genetic variants associated with serum thyroid stimulating hormone (TSH) levels in European Americans and African Americans from the eMERGE network. PLoS ONE. 2014;9:e111301.


9. Mikhail GS, Alshammari SM, Alenezi MY, Mansour M, Khalil NA. Increased atherogenic low-density lipoprotein cholesterol in untreated subclinical hypothyroidism. Endocr Pract 2008;14:570–5.

10. Rodondi N, den Elzen WP, Bauer DC, Cappola AR, Razvi S, Walsh JP et coll. Subclinical hypothyroidism and the risk of coronary heart disease and mortality. JAMA 2010;304:1365–74.


11. Javed Z, Sathyapalan T. Levothyroxine treatment of mild subclinical hypothyroidism: a review of potential risks and benefits. Ther Adv Endocrinol Metab 2016;7:12–23.


12. Watt T, Hegedus L, Groenvold M, Bjorner JB, Rasmussen AK, Bonnema SJ et coll. Validity and reliability of the novel thyroid-specific quality of life questionnaire, ThyPRO. Eur J Endocrinol 2010;162:161–7.

13. Watt T, Cramon P, Hegedus L, Bjorner JB, Bonnema SJ, Rasmussen AK et coll. The thyroid-related quality of life measure ThyPRO has good responsiveness and ability to detect relevant treatment effects. J Clin Endocrinol Metab 2014;99:3708–17.

14. Caraccio N, Ferrannini E, Monzani F. Lipoprotein profile in subclinical hypothyroidism: response to levothyroxine replacement, a randomized placebo-controlled study. J Clin Endocrinol Metab 2002;87:1533–8.

15. Monzani F, Caraccio N, Kozakowa M, Dardano A, Vittone F, Virdis A, et coll. Effect of levothyroxine replacement on lipid profile and intima-media thickness in subclinical hypothyroidism: a double-blind, placebo-controlled study. J Clin Endocrinol Metab 2004;89:2099–106.

16. Danese MD, Ladenson PW, Meinert CL, Powe NR. Effect of thyroxine therapy on serum lipoproteins in patients with mild thyroid failure: A quantitative review of the literature. J Clin Endocrinol Metab 2000;85:2993–3001.
17. Díez J, Iglesias P, Burman KD. Spontaneous normalization of thyrotropin concentrations in patients with subclinical hypothyroidism. J Clin Endocrinol Metab 2005;90:4124–7.

18. Gupta SK. Intention-to-treat concept: A review. Perspect Clin Res 2011;2:109–12.


19. Sainani KL. Making sense of intention-to-treat. PM R 2010;2:209–13.

Pour toute correspondance: Jennifer Fontaine, Hôpital général juif, 3755, chemin de la Côte-Sainte-Catherine, Montréal (Québec) H3T 1E2, CANADA; Téléphone: 514 340-8222; Télécopieur: 514 340-8201; Courriel: jennifer.fontaine@umontreal.ca
(Return to Top)
PHARMACTUEL, Vol. 51, No. 4, 2018