
Florence Marcotte1,2,3, Pharm.D., M.Sc., Karianne Beaulieu1,2,4, Pharm.D., M.Sc., Alexandra Hinse1,2,5, Pharm.D., M.Sc., Dominique Baillargeon1,2,6, Pharm.D.
Reçu le 9 août 2018: Accepté après révision par les pairs le 31 octobre 2018
Résumé
Objectif : Décrire un cas de rhabdomyolyse chez un patient obèse morbide recevant de la daptomycine depuis 15 jours et faire une revue de la littérature sur l’ajustement des doses de daptomycine dans les cas d’obésité.
Résumé du cas : Il s’agit d’un adulte obèse dont l’indice de masse corporelle est de 53 kg/m2, dont la clairance de la créatinine est de 81 mL/min avec un poids ajusté de 92 kg. Le patient reçoit de la daptomycine intraveineuse à une dose de 6 mg/kg/jour ajustée selon son poids réel depuis 15 jours après avoir reçu pendant 11 jours de la vancomycine pour le traitement d’une infection de sa prothèse du genou à Staphylococcus epidermidis et Peptostreptococcus sp. Le patient présente une augmentation de la créatine phosphokinase à plus de 13 000 unités internationales par litre lors du suivi médical. Le retour à une valeur normale est observé quelques jours après l’hydratation adéquate et la perfusion de bicarbonate.
Discussion : L’effet indésirable subi par le patient est probablement lié à l’administration de la daptomycine. Certains facteurs de risque, dont l’obésité, une fonction rénale diminuée, le lien temporel entre l’administration de la daptomycine et l’augmentation de la créatine phosphokinase, l’exclusion des autres causes possibles ainsi que les cas rapportés dans la littérature appuient cette association. Ce cas vient soutenir le fait que l’administration de daptomycine en fonction du poids réel des patients obèses cause probablement une surexposition du patient au médicament et augmente ainsi le risque de présenter des effets indésirables, dont la rhabdomyolyse.
Conclusion : Le suivi clinique et la prise en charge des patients obèses devraient faire l’objet de suivis plus rapprochés, peu importe leur fonction rénale, étant donné la pharmacocinétique des médicaments peu prévisible pour cette population.
Mots clés : Créatine phosphokinase, daptomcine, obésité, poids réel, rhabdomyolyse
Abstract
Objective : To describe a case of rhabdomyolysis in a morbidly obese patient to whom daptomycin was administered for 15 days and to conduct a literature review of daptomycin dose adjustments in cases of obesity.
Case summary : The patient was an obese adult male with a body mass index of 53 kg/m2 and a creatinine clearance of 81 mL/min, based on an adjusted weight of 92 kg. The patient received daptomycin intravenously at an actual body weight-adjusted dose of 6 mg/kg/day for 14 days after receiving vancomycin for 11 days for the treatment of an infection of his knee prosthesis due to Staphylococcus epidermidis and Peptostreptococcus sp. The patient’s creatine phosphokinase level increased to more than 13,000 IU/L during the medical follow-up. It returned to normal a few days after adequate hydration and IV bicarbonate.
Discussion : The adverse effect experienced by the patient was probably linked to the administration of daptomycin. This association is supported by certain risk factors, such as obesity and diminished renal function, temporal connection between the administration of daptomycin and increase in his creatine phosphokinase level, other possible causes were ruled out, and cases reported in the literature support. This case supports the fact that actual body weight-based dosing of daptomycin in obese patients probably causes overexposure to the drug, thus increasing the risk of adverse effects, such as rhabdomyolysis.
Conclusion : Clinical follow-up and management of obese patients warrants closer monitoring, regardless of their renal function, given the pharmacokinetics of drugs, which are unpredictable in this population.
Keywords : Actual body weight, creatine phosphokinase, daptomycin, obesity, rhabdomyolysis
La daptomycine est un antibiotique de la famille des lipopeptides, commercialisée depuis 2007 au Canada1,2. Elle est utilisée en clinique pour le traitement des infections compliquées de la peau et des tissus mous et pour traiter les bactériémies causées par des bactéries à Gram positif, notamment le Streptococcus, le Staphylococcus aureus et l’Enterococcus faecalis3. L’élimination de la daptomycine se fait à 78 % par le système rénal4,5.
Parmi les effets indésirables de la daptomycine, on rapporte une augmentation de la créatine phosphokinase (CPK) associée ou non à des myopathies pouvant mener à une insuffisance rénale1. Selon la monographie, les doses suggérées de daptomycine, basées sur le poids réel du patient, peuvent varier entre 4 et 6 mg/kg/jour1. Des doses allant jusqu’à 12 mg/kg/jour sont désormais utilisées, principalement dans un contexte d’endocardite, d’ostéomyélite et d’infections compliquées4,5. La dose idéale à administrer à un patient obèse n’est pas clairement définie dans la littérature médicale d’autant plus que la monographie ne propose pas d’ajustement de la posologie pour ces patients1,6,7. Dans un contexte d’insuffisance rénale, on propose une diminution de la fréquence d’administration aux 48 heures à partir d’une clairance de la créatinine inférieure à 30 mL/min1.
Nous rapportons ici le cas d’un patient obèse morbide avec un indice de masse corporelle (IMC) de 53 kg/m2, ayant présenté une augmentation asymptomatique de la CPK à plus de 13 000 unités internationales par litre (UI/L) 15 jours après le début de l’administration de la daptomycine à une dose de 6 mg/kg/jour, qui avait été calculée selon le poids réel pour le traitement d’une infection de prothèse de genou à Peptostreptococcus sp. et Staphylococcus epidermidis.
Il s’agit d’un homme de 63 ans, mesurant 163 cm et pesant 140 kg, ayant comme antécédents une obésité morbide (IMC de 53 kg/m2), de l’hypertension, une bradycardie sinusale intrinsèque, un syndrome d’apnée du sommeil non appareillée et une gonarthrose bilatérale sévère. Le patient n’a pas d’allergie médicamenteuse. Sa créatinine de base est de 108 μmol/L, sa clairance de la créatinine avec un poids ajusté de 92 kg est de 81 mL/min et sa valeur initiale de la CPK est de 47 UI/L. Il est admis à l’hôpital pour une installation de prothèse totale du genou gauche. La médication usuelle du patient est présentée au tableau I.
Tableau I Médication du patient lors de sa première admission
À la suite de l’opération, le patient quitte l’hôpital après trois jours. Le seul changement à sa médication régulière est l’ajout d’une thromboprophylaxie orale, le rivaroxaban à 10 mg une fois par jour pendant 14 jours.
Quinze jours après son opération, l’orthopédiste note un écoulement séreux abondant d’allure lymphatique qui progresse depuis 48 heures. Bien que le patient soit asymptomatique, on prévoit pour le lendemain des cultures, un débridement et un lavage. Le patient est hospitalisé le soir même.
Le 20e jour, on entreprend une antibiothérapie empirique à la vancomycine à une dose de 2 g par voie intraveineuse, chaque 12 heures. À ce stade, l’état de la plaie du patient nécessite un second débridement et le 22e jour, le médecin pose un diagnostic d’arthrite septique. Le 23e jour, on procède à l’ajout de 450 mg de rifampine deux fois par jour, puisque l’articulation infectée contient du matériel prothétique. Le tableau II présente les pathogènes identifiés lors des cultures de plaie ainsi que leur sensibilité aux antibiotiques.
Tableau II Résultats des cultures de plaie prélevées lors des deux débridements
Le tableau III présente les doses de vancomycine et les dosages sériques. Une diminution de dose à 1 g toutes les 12 heures (environ 7 mg/kg/dose) a permis d’obtenir un creux plus près de l’intervalle thérapeutique visé, soit entre 15 et 20 mg/L8. Pourtant, la dose initiale de 2 g chaque 12 heures semblait être plus adaptée dans le contexte d’un patient obèse, dont la clairance de la créatinine est normale, bien que celle-ci se soit avérée suprathérapeutique8.
Tableau III Doses et dosages sériques de vancomycine
Au congé, le 30e jour, le patient reçoit une prescription de daptomycine par voie intraveineuse en remplacement de la vancomycine dans le but de simplifier le suivi de la thérapie en externe. La prise de rifampine se poursuit, à laquelle s’ajoute la daptomycine à une dose de 850 mg une fois par jour, ce qui représente environ 6 mg/kg/jour sur la base du poids réel. Les valeurs de la CPK et de créatinine sont présentées dans le tableau IV. Au moment de l’ajout de la daptomycine, ces paramètres étaient normaux.
Tableau IV Valeurs de laboratoires et informations pertinentes sur la rhabdomyolyse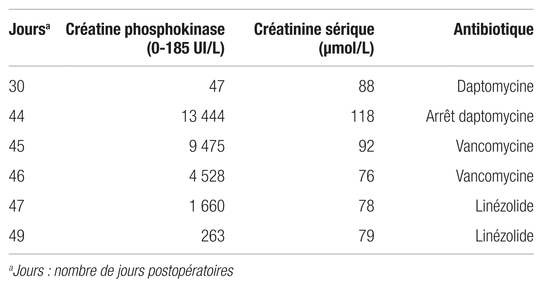
Lors du suivi de la thérapie, quinze jours après l’ajout de la daptomycine, soit au jour 44, le prélèvement sanguin révèle une augmentation de la CPK à 13 444 UI/L, soit 73 fois supérieure à la valeur limite normale de 185 UI/L ainsi qu’une créatinine sérique à 118 μmol/L. Une analyse d’urine révèle une urine d’aspect jaune foncé et légèrement trouble, sans autre particularité. Le bilan électrolytique semble également normal. Le patient ne se plaint pas de myalgie, n’a pas de fièvre ni de frissons. Il rapporte cependant avoir eu des diarrhées durant trois jours à raison de trois à quatre selles par jour la semaine précédente. Le patient reçoit un diagnostic de rhabdomyolyse et il est hospitalisé à nouveau. On lui retire la daptomycine et on entreprend une hydratation avec du normal salin, du dextrose et du bicarbonate de sodium afin de prévenir les complications associées à la rhabdomyolyse. Les médicaments à potentiel néphrotoxique sont retirés. Six jours après l’arrêt de la daptomycine, la créatinine sérique et la CPK se normalisent.
Au jour 45, le patient reprend de la vancomycine à une dose de charge de 1,75 g suivie d’une dose de maintien de 1,25 g chaque 12 heures. Il poursuit la prise de 450 mg de rifampine deux fois par jour. Finalement, au jour 51, il reçoit son congé de l’hôpital, et la vancomycine est remplacée par le linézolide à une dose ajustée de 600 mg par voie orale trois fois par jour, étant donné l’obésité et la gravité de l’infection du patient, pour un traitement d’une durée de 19 jours9. Au total, le patient aura reçu un traitement antibiotique de 45 jours, ce qui représente une durée de traitement adéquate pour une infection de matériel prothétique10,11. Lors du dernier examen de suivi au jour 127, la douleur au genou avait diminué, la plaie avait une belle apparence et il n’y avait plus d’écoulement.
Une autorisation écrite a été obtenue du directeur des services professionnels du Centre intégré de santé et de services sociaux de l’Estrie-Centre hospitalier universitaire de Sherbrooke pour la publication de ce cas.
La rhabdomyolyse peut se manifester cliniquement par des myalgies, bien que le diagnostic ne requière pas nécessairement cette manifestation clinique12. La hausse de la CPK de plus de cinq fois la limite supérieure est la valeur de laboratoire la plus sensible pour détecter un dommage musculaire et poser le diagnostic12. L’urine qui peut prendre une coloration de thé provoquée par la hausse de myoglobine dans les urines est aussi un aspect clinique distinctif de cette condition12. Outre les causes médicamenteuses, la rhabdomyolyse peut se produire à la suite de convulsions, d’un syndrome neuroleptique malin, d’une activité musculaire intense, d’une infection, d’un traumatisme, d’un abus d’alcool ou de drogues, d’une exposition à des températures extrêmes, d’une immobilité prolongée, de troubles électrolytiques ou peut être idiopathique12. Selon la gravité de l’atteinte, la survenue de l’un des désordres électrolytiques (potassium, calcium, urée et phosphore), d’une hypovolémie, d’une acidose, d’un syndrome du compartiment, d’une dysfonction du compartiment ou encore d’une dégradation de la fonction rénale est possible12. L’insuffisance rénale aiguë (IRA), secondaire à la rhabdomyolyse, s’explique par trois mécanismes intimement liés. D’abord, la destruction musculaire provoque un appel de fluides circulants vers le troisième espace, ce qui diminue le volume intravasculaire et précipite l’hypovolémie. Ce phénomène stimule l’axe rénine-angiotensine-aldostérone et une vasoconstriction rénale s’ensuit, ce qui entraîne la formation de cylindres intratubulaires et finalement une toxicité directe de la myoglobine sur les cellules tubulaires rénales13. L’IRA secondaire à la myoglobinurie est une complication potentiellement mortelle14.
L’incidence de l’augmentation de la CPK rapportée dans la monographie de la daptomycine est de 2,8 % avec une dose de 4 mg/kg et de 6,7 % avec une dose de 6 mg/kg1. Les facteurs de risque de rhabdomyolyse sous daptomycine sont plutôt méconnus, toutefois la littérature indique que des doses élevées, principalement des creux plasmatiques importants, une insuffisance rénale ainsi que l’administration concomitante d’un inhibiteur de l’HMG-CoA réductase sont des facteurs pouvant favoriser l’augmentation de la CPK6,15,16. La récente étude cas-témoin rétrospective de Dare et coll. démontre une association entre les rhabdomyolyses secondaires à la daptomycine et l’utilisation des statines avec un rapport de cote (RC) de 4,67 (p = 0,03)16. De plus, il démontre une forte corrélation entre l’obésité et l’incidence de rhabdomyolyse sous daptomycine (RC 3,28, p = 0,03) alors que l’âge élevé semblait être un facteur protecteur de rhabdomyolyse (RC 0,97, p = 0,05)16,17. Dans l’étude, les doses moyennes, calculées selon le poids réel, étaient similaires entre les deux groupes (6,3 mg/kg et 6,1 mg/kg)16.
Le suivi recommandé consiste à évaluer la CPK avant d’entreprendre l’administration de l’antibiotique, puis chaque semaine durant le traitement de daptomycine ou plus souvent lorsque des symptômes musculaires sont présents1,3. Le mécanisme d’action exact de la toxicité du médicament sur les myocytes des muscles squelettiques est encore méconnu3. Le mécanisme décrit dans la littérature est une perturbation de la membrane des myocytes engendrée par la daptomycine, ce qui amène une fuite de la CPK dans le compartiment plasmatique16,18.
Malgré le fait que la monographie propose une dose maximale de daptomycine de 6 mg/kg/jour, les infections graves nécessitent des doses supérieures19. Nous savons que la daptomycine possède une activité bactéricide rapide et que la cinétique de cet antibiotique est linéaire jusqu’à 12 mg/kg/jour chez un patient de poids normal19.
Un groupe italien a publié une étude rétrospective observationnelle de cohorte incluant 102 patients qui ont tous reçu des doses élevées de daptomycine dans le contexte d’une endocardite infectieuse. Ces patients avaient un poids moyen de 61,8 kg (51,1 – 92 kg) et plus de 53 d’entre eux (51,9 %) avaient une clairance de la créatinine inférieure à 50 mL/min. L’objectif des investigateurs visait à déterminer la fréquence des effets indésirables sous l’effet de doses élevées, soit des doses supérieures à 6 mg/kg/jour. La dose moyenne administrée aux patients était de 8,3 mg/kg (6,1 à 11,4). La toxicité musculaire était définie par une élévation de la CPK20. Elle a été observée chez 15 patients avec une médiane de 15 jours avant l’apparition des symptômes. Dans la majorité des cas, la toxicité musculaire était légère et réversible, malgré la poursuite du traitement20. Les auteurs d’une série de cas comptant 61 patients ont rapporté des doses moyennes de daptomycine de 8 mg/kg/jour (7 à 11) selon le poids réel, pour un traitement d’une durée médiane de 25 jours (14 à 82)21. Tous les patients souffraient d’obésité, 74 % étaient obèses de grade I (IMC entre 30–34,9 kg/m2) et 26 % présentaient une obésité de grade III (IMC > 40 kg/m2)21. Seuls trois patients ont présenté des symptômes musculosquelettiques avec des concentrations de la CPK supérieures à 1000 U/L. On remarque une tendance vers une augmentation de la CPK qui est dose-dépendante.
D’autres rapports de cas ont été publiés dans la littérature médicale au sujet de l’augmentation du taux de CPK lors d’un traitement à la daptomycine. L’un d’eux présente une série de huit patients qui ont reçu de la daptomycine à une dose moyenne de 7,75 mg/kg/jour selon leur poids réel, sur une durée médiane de 42 jours18. La durée médiane entre le début du traitement et l’augmentation du taux de CPK était de 20,5 jours et l’intervalle se situait entre huit et 28 jours. L’augmentation de CPK était moindre que dans le cas présenté plus haut. L’approche clinique a consisté à suspendre l’administration de l’antibiotique pendant 24 heures et à poursuivre le traitement sans modification de dose18.
Étant donné l’augmentation constante du nombre de patients obèses ainsi qu’une morbidité et une mortalité plus importantes lorsque cette population est atteinte d’infection comparativement à la population générale, il est essentiel de se questionner sur les doses idéales d’antibiotiques à administrer à ces patients17. Il est connu que plusieurs changements métaboliques chez les patients obèses affectent la pharmacocinétique et la pharmacodynamie des antibiotiques. Ces changements touchent l’augmentation du taux de filtration glomérulaire, l’augmentation du flot sanguin urinaire, l’augmentation de la masse corporelle ainsi qu’une altération du métabolisme. Ils peuvent donc causer une sous-exposition ou encore une surexposition aux antibiotiques17. Bien que la monographie suggère de calculer la dose de daptomycine selon le poids réel des patients obèses, soit une dose de 4 mg/kg, un doute persiste dans la littérature quant au poids optimal dictant le calcul des doses. Il a été démontré que parmi des sujets exposés à une dose de daptomycine de 4 mg/kg de poids réel, les patients souffrant d’obésité modérée (IMC moyen 33,2 kg/m2 [28–38]) et sévère (IMC moyen 46,2 kg/m2 [40–58]) présentaient des paramètres pharmacocinétiques différents des cas témoins. Les investigateurs ont constaté entre autres une augmentation statistique de la concentration maximale (Cmax), de l’aire sous la courbe (ASC) et du volume de distribution (Vd) et une diminution de la clairance rénale17,22. L’ASC et la Cmax des patients obèses étaient respectivement supérieures d’environ 30 % et 25 % à celles des sujets témoins. Dans une autre étude comparant sept femmes obèses (IMC moyen 46,2 +/− 5,5 kg/m2) à des sujets sains, on observe une augmentation d’environ 60 % de la Cmax et de l’ASC chez les obèses alors que l’augmentation du Vd et de la Cl ne serait pas proportionnelle à l’augmentation de l’exposition à la daptomycine23. Bien qu’une différence soit notée dans l’ampleur de la variation des paramètres pharmacocinétiques, on retient de ces deux études une augmentation de l’exposition à la daptomycine chez les patients obèses. Ceux-ci seraient donc surexposés à la daptomycine et risqueraient davantage de subir des effets indésirables lorsque la dose est calculée en fonction de leur poids réel. Malgré ces particularités pharmacocinétiques, l’exposition à la daptomycine restait tout de même dans l’écart sécuritaire et tolérable6,23. Par ailleurs, on a démontré que l’efficacité clinique n’était pas statistiquement inférieure lorsque le calcul de la dose était basé sur le poids idéal plutôt que sur le poids réel des patients obèses7.
L’expérience clinique dans la population obèse démontre aussi une association entre le degré d’obésité et l’augmentation de la CPK. L’étude de Bookstaver et collaborateurs présente des données intéressantes17. Ils avancent que les patients avec un IMC de stade I présentaient un taux d’augmentation des CPK supérieur à 1000 UI/L de 3,6 %, alors que pour des IMC de stade II et III, les augmentations observées étaient de 10,3 % et de 10,5 % (p = 0,554)17. Bien que ces résultats ne soient pas statistiquement significatifs, on peut observer une tendance.
Une étude observationnelle a démontré que le calcul de la dose basé sur un poids ajusté pour des patients ayant un poids réel supérieur à 130 % de leur poids idéal permettait d’atteindre les mêmes résultats cliniques, microbiologiques et de toxicité qu’une dose calculée selon le poids réel24. Ces données portent à croire que la dose de daptomycine calculée selon un poids ajusté permettrait de limiter les toxicités et de diminuer les risques d’interruption précoce du traitement tout en conservant une efficacité similaire, tel que le démontre une récente revue de l’utilisation des antibiotiques pour les patients obèses ayant un IMC égal ou supérieur 35 kg/mètres carrés6.
L’estimation de la fonction rénale des patients obèses est imprécise25. Il a été démontré dans cette population que la formule de Cockcroft-Gault habituellement utilisée avec le poids ajusté, validée pour l’usage des aminoglycosides pour les patients avec un IMC entre 30 et 40 kg/m2, surestime la fonction rénale alors que l’utilisation du poids maigre la sous-estimait25. Ceci implique que les médicaments ajustés selon la fonction rénale calculée par rapport au poids réel seraient donnés à des doses supérieures à celles nécessaires pour le patient, ce qui surexpose le patient obèse au médicament. Néanmoins, parmi les formules disponibles, la formule de Cockcroft-Gault ou CKD-EPI ajustée pour la surface corporelle du patient sont deux outils d’estimation de la fonction rénale qui peuvent être utilisés avec un poids ajusté pour les patients obèses25. Une étude menée au Centre hospitalier universitaire de Sherbrooke (CHUS), indique qu’en présence ou non d’obésité, ces deux méthodes évaluent la fonction rénale de manière similaire26.
La monographie de la daptomycine indique qu’il n’est pas nécessaire d’ajuster la daptomycine en cas d’insuffisance rénale légère à modérée1. Par contre, lorsque la clairance de la créatinine est inférieure à 30 mL/min, l’antibiotique doit être administré aux 48 heures plutôt qu’une fois par jour. Une surveillance étroite de l’innocuité du traitement, dont le suivi de la fonction rénale plus fréquent qu’une fois par semaine, est nécessaire lorsque la clairance de la créatinine est inférieure à 80 mL/min1.
L’augmentation de la CPK dans le cas du patient obèse présenté dans cet article apparaît 15 jours après la première administration de la daptomycine et le retour à une valeur normale est noté quelques jours après l’arrêt de l’antibiotique et la prise en charge adéquate de la rhabdomyolyse. Le traitement de la rhabdomyolyse non traumatique nécessite principalement l’administration de liquide afin d’obtenir un débit rénal approprié d’environ 200 à 300 mL/h. L’alternance entre l’administration d’un salin isotonique et d’un soluté de dextrose ainsi que d’une perfusion de bicarbonate de sodium permet de limiter l’accumulation de fluides27. On remarque donc un lien temporel entre les deux événements. Lors du diagnostic de rhadomyolyse, jusqu’à 50 % des patients ne présentent pas de douleurs musculaires ou de faiblesse, mais seulement des symptômes non spécifiques27. Le patient présentait des caractéristiques qui compliquaient la prédiction de la pharmacocinétique de l’antibiothérapie, dont la fonction rénale difficile à évaluer avec précision et l’obésité.
Concernant la vancomycine, selon ses paramètres pharmacocinétiques, qui incluent l’âge, le sexe et la créatinine sérique utilisés pour le calcul de la clairance rénale, le patient aurait besoin d’une dose de 2 g par période de 24 heures. Toutefois, lorsque nous calculons la dose nécessaire selon le poids réel avec une dose de 30 mg/kg/jour nous obtenons 4,2 g par période de 24 heures8. En supposant que nous limitons chaque dose à 2 g, la dose initiale semblait appropriée selon les calculs, mais elle était trop élevée selon la pharmacocinétique propre au patient.
Quant à la daptomycine, comme la dose a été calculée selon le poids réel du patient, il est possible qu’une dose suprathérapeutique soit en cause. En effet, lorsqu’elle est calculée par rapport au poids ajusté, la dose reçue par le patient est d’environ 9 mg/kg/jour. Le poids de référence pour le calcul de la dose de daptomycine est donc un sujet qui reste controversé dans la littérature médicale. La daptomycine étant principalement éliminée par le système rénal, l’IRA du patient peut aussi avoir contribué significativement à une accumulation de l’antibiotique. De plus, la médication prise par le patient quelques jours avant la mesure élevée de la CPK comportait un inhibiteur de l’enzyme de conversion de l’angiotensine, un diurétique et probablement un antiinflammatoire non stéroïdien, dont la prise était « au besoin » à la maison et dont l’utilisation réelle est inconnue. Finalement, le patient présentait des diarrhées qui auraient pu contribuer à l’IRA. Cette triade représente un risque bien connu pouvant précipiter l’apparition d’insuffisance rénale aiguë28. Les dosages sériques de vancomycine nous indiquent aussi que le patient a probablement une fonction rénale moins performante que les estimations mathématiques nous laissent croire. En effet, de faibles doses, soit environ 7 mg/kg/dose, ont été administrées à un patient de 140 kg pour atteindre une concentration sérique thérapeutique visée qui se situait entre 15 et 20 mg/L8.
Une recherche a été effectuée sur PubMedMD afin d’examiner si les autres médicaments pris par le patient étaient associés à une augmentation du risque de rhabdomyolyse. Un rapport de cas sur l’utilisation de l’hydrochlorothiazide, menant à une hypokaliémie sévère, mentionne l’apparition d’une rhabdomyolyse chez trois sujets, mais l’étiologie de la rhabdomyolyse est en fait une cascade secondaire au désordre électrolytique29. Concernant le diclofénac-misoprostol, aucun rapport de cas ne mentionne de rhabdomyolyse avec la formulation combinée. Par contre, trois rapports de cas hétérogènes rapportent une rhabdomyolyse aiguë à la suite de la prise de diclofénac seul, mais ils n’ont aucune ressemblance avec le cas présenté dans cet article30–32. En somme, si la cause de la rhabdomyolyse est d’étiologie médicamenteuse, la daptomycine en est très probablement responsable. De plus, aucune interaction médicamenteuse reconnue présente dans ce cas n’aurait pu causer une rhabdomyolyse.
Les causes électrolytiques de la rhabdomyolyse sont peu probables dans le cas de ce patient, car la phosphatémie, la natrémie et la kaliémie étaient toutes normales. Quant à l’activité musculaire intense ou au trauma, ce sont des causes très improbables pour ce patient, car aucune information concordant avec ces hypothèses n’a été retrouvée à la lecture de l’histoire médicale dans le dossier du patient. Ainsi, selon l’algorithme de Naranjo, l’imputabilité de la daptomycine dans la survenue de la rhabdomyolyse est « probable », avec un résultat de cinq33.
Ce cas illustre l’histoire d’un patient obèse morbide ayant présenté une augmentation importante de la CPK sous daptomycine après 15 jours de traitement. Il est possible que l’insuffisance rénale aiguë ainsi que l’exposition du patient à une dose potentiellement trop élevée de daptomycine soient responsables de la rhabdomyolyse.
Malgré la volonté de simplifier le suivi en externe en remplaçant la vancomycine par la daptomycine, un suivi plus précoce aurait sans doute permis de détecter une anomalie dans la valeur de la CPK. Dans le cas présenté ici, étant donné la valeur très élevée de la CPK, l’équipe traitante a décidé de retirer la daptomycine. De plus, une hydratation et une perfusion de bicarbonate ont permis d’éliminer la CPK pour éviter une détérioration de la fonction rénale du patient. Ce cas souligne l’importance d’un suivi plus étroit des niveaux de CPK des sujets traités avec la daptomycine et présentant des facteurs de risque de toxicité, dont l’obésité et l’insuffisance rénale. Selon nous, le poids ajusté devrait être pris en considération pour le calcul de la dose dans le cas de patients ayant un IMC supérieur à 35 kg/mètres carrés6. Toutefois, la littérature est pauvre sur le sujet. Ce cas permet de rappeler la nécessité d’une surveillance hebdomadaire, et une étude propose même une surveillance bihebdomadaire15. Il faudrait envisager un suivi plus fréquent de la thérapie des patients qui risquent de subir une toxicité, comme le patient obèse présenté dans cet article.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs en remercient les responsables du cours ainsi que Audrey-Anne Longpré et Mélanie Gilbert pour la proposition du cas et pour leurs commentaires lors du processus de rédaction. Une autorisation écrite a été obtenue de ces personnes.
1. Cubist Pharmaceuticals LLC. Monographie de produit: Cubicin. [en ligne] https://pdf.hres.ca/dpd_pm/00040324.PDF (site visité le 26 janvier 2018).
2. Programme de gestion thérapeutique des médicaments. Daptomycine (CubicinMD). [en ligne] http://pgtm.org/documentation/FSW/Daptomycine_EC_20080612.pdf (site visité le 31 octobre 2018).
3. Carpenter CF, Chambers HF. Daptomycin: another novel agent for treating infections due to drug-resistant gram-positive pathogens. Clin Infect Dis 2004;38:994–1000.
4. Pham P, Avdic E. Daptomycin. [en ligne] https://www.hopkinsguides.com/hopkins/view/Johns_Hopkins_ABX_Guide/540155/all/Daptomycin (site visité le 22 janvier 2018).
5. Micromedex Healthcare series. Monographie de la daptomycine. Thomson Micromedex, 1974–2018. [en ligne] http://www.micromedexsolutions.com (site visité le 23 octobre 2018).
6. Meng L, Mui E, Holubar MK, Deresinski SC. Comprehensive guidance for antibiotic dosing in obese adults. Pharmacotherapy 2017;37:1415–31.
7. Ng JK, Schulz LT, Rose WE, Fox BC, Andes DR, Buhr KA et coll. Daptomycin dosing based on ideal body weight versus actual body weight: comparison of clinical outcomes. Antimicrob Agents Chemother 2014;58:88–93.

8. Rybak MJ, Lomaestro BM, Rotschafer JC, Moellering RC, Craig WA, Billeter M et coll. Vancomycin therapeutic guidelines: a summary of consensus recommendations from the infectious diseases Society of America, the American Society of Health-System Pharmacists, and the Society of Infectious Diseases Pharmacists. Clin Infect Dis 2009;49:325–7.
9. Dzintars K, Pham PA. Linezolid. [en ligne] https://www.hopkinsguides.com/hopkins/view/Johns_Hopkins_ABX_Guide/540316/all/Linezolid%20-%20Linezolid (site visité le 22 avril 2018).
10. Keller S, Auwaerter PG. Prosthetic joint infections. [en ligne] https://www.hopkinsguides.com/hopkins/view/Johns_Hopkins_ABX_Guide/540256/all/Prosthetic%20joint%20infection (site visité le 22 avril 2018).
11. Osmon DR, Berbari EF, Berendt AR, Lew D, Zimmerli W, Steckelberg JM et coll. Diagnosis and management of prosthetic joint infection: clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis 2013;56:e1–e25.
12. Khan FY. Rhabdomyolysis: a review of the literature. Neth J Med 2009;67:272–83.
13. Petejova N, Martinek A. Acute kidney injury due to rhabdomyolysis and renal replacement therapy: a critical review. Crit Care 2014;18:224.

14. Giannoglou GD, Chatzizisis YS, Misirli G. The syndrome of rhabdomyolysis: pathophysiology and diagnosis. Eur J Intern Med 2007;18:90–100.
15. Dare RK, Tewell C, Harris B, Wright PW, Van Driest SL, Farber-Eger E et coll. Effect of statin coadministration on the risk of daptomycin-associated myopathy. Clin Infect Dis 2018; 67:1356–63.

16. Ferrandez O, Urbina O, Luque S, Espona M, Berenguer N, Grau S. Normalization of creatine kinase values in a case of rhabdomyolysis during daptomycin treatment. Indian J Pharmacol 2013;45:193–4.

17. Bookstaver PB, Bland CM, Qureshi ZP, Faulkner-Fennell CM, Sheldon MA, Caulder CR et coll. Safety and effectiveness of daptomycin across a hospitalized obese population: results of a multicenter investigation in the southeastern United States. Pharmacotherapy 2013;33:1322–30.
18. Burdette SD, Oleson F, McDaneld PM, Benziger D, Patel HN. Dosing strategy to allow continued therapy with daptomycin after asymptomatic increases in creatine kinase levels. Am J Health Syst Pharm 2014;71:1101–7.
19. Seaton RA, Menichetti F, Dalekos G, Beiras-Fernandez A, Nacinovich F, Pathan R et coll. Evaluation of effectiveness and safety of high-dose daptomycin: results from patients included in the european cubicinMD outcomes registry and experience. Adv Ther 2015;32:1192–205.

20. Durante-Mangoni E, Andini R, Parrella A, Mattucci I, Cavezza G, Senese A et coll. Safety of treatment with high-dose daptomycin in 102 patients with infective endocarditis. Int J Antimicrob Agents 2016;48:61–8.
21. Figueroa DA, Mangini E, Amodio-Groton M, Vardianos B, Melchert A, Fana C et coll. Safety of high-dose intravenous daptomycin treatment: three-year cumulative experience in a clinical program. Clin Infect Dis 2009;49:177–80.
22. Dvorchik BH, Damphousse D. The pharmacokinetics of daptomycin in moderately obese, morbidly obese, and matched nonobese subjects. J Clin Pharmacol 2005;45:48–56.
23. Pai MP, Norenberg JP, Anderson T, Goade DW, Rodvold KA, Telepak RA et coll. Influence of morbid obesity on the single-dose pharmacokinetics of daptomycin. Antimicrob Agents Chemother 2007;51:2741–7.

24. Shemanski S, Bennett N, Boyd S, Woods M, Ploetz J, Kennedy K. Evaluation of clinical effectiveness utilizing adjusted body weight for daptomycin dosing. Crit Care Med 2016;44:251.
25. Legris ME, Desforges K. Ajustement posologique: pour un choix éclairé de la formule d’estimation de la fonction rénale. Pharmactuel 2017;50:34–44.
26. Clément V. Est-ce que l’équation du Chronic Kidney Disease Epidemiology Collaboration (CKD-EPI) ajustée selon la surface corporelle du patient donne des résultats similaires à ceux obtenus avec la formule de Cockcroft-Gault pour l’estimation de la fonction rénale ? Pharmactuel 2016;49:158–63.
27. Cervellin G, Comelli I, Benatti M, Sanchis-Gomar F, Bassi A, Lippi G. Non-traumatic rhabdomyolysis: Background, laboratory features, and acute clinical management. Clin Biochem 2017;50:656–62.
28. Kidney Disease: Improving Global Outcome (KDIGO). Clinical practice guideline for acute kidney injury (AKI). [en ligne] http://kdigo.org/clinical_practice_guidelines/pdf/KDIGO%20AKI%20Guideline.pdf (site visité le 28 janvier 2018).
29. Girola SS, Mazzone A, Moroni M, Porta C, Nastasi G, Notario A. [Hypokalemic rhabdomyolysis and thiazide diuretics. 3 clinical cases]. Ann Ital Med Int 1995;10:134–7.
30. Knobloch K, Rossner D, Gössling T, Lichtenberg A, Richter M, Krettek C. [Rhabdomyolysis after administration of diclofenac]. Unfallchirurg 2005;108:415–7.
31. Delrio FG, Park Y, Herzlich B, Grob D. Case report: diclofenac-induced rhabdomyolysis. Am J Med Sci 1996;312:95–7.
32. Manigandan G, Seshadri MS. Diclofenac-induced rhabdomyolysis - a great masquerader. J Assoc Physicians India 2016;64:90–1.
33. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA et coll. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30:239–45.
PHARMACTUEL, Vol. 52, No. 1, 2019