Sabrina Almassy1, Pharm.D., M.Sc.
Reçu le 9 août 2018: Accepté après révision par les pairs le 12 décembre 2018
Résumé
Objectif : Présenter un cas de neutropénie probablement associé à la prise de lévodopa-carbidopa pour le traitement de la maladie de Parkinson.
Résumé du cas : Le cas rapporté dans cet article est celui d’une femme de 90 ans admise à l’hôpital pour des chutes et des hallucinations. La maladie de Parkinson, pour laquelle elle ne reçoit aucun médicament, est peut-être à l’origine des chutes, c’est pourquoi la patiente entame un traitement à la lévodopa-carbidopa. Par la suite, elle développera une neutropénie modérée secondaire, qui pourrait avoir été causée par ce médicament.
Discussion : On trouve dans la littérature scientifique des descriptions de cas de neutropénie en relation avec plusieurs classes de médicaments. Le résultat obtenu à l’aide de l’algorithme de Naranjo nous indique qu’il est probable que la lévodopa-carbidopa ait causé cette neutropénie, mais la présence d’un autre problème hématologique ne peut être exclue, étant donné que le bilan hématologique est incomplet. Lors de neutropénie légère à modérée qui n’est pas causée par des agents de chimiothérapie, le retrait de l’agent suspecté est souvent le seul geste requis pour assister à une normalisation du décompte des neutrophiles. Il est généralement associé à des mesures de prévention des infections pour les patients à risque.
Conclusion : On rapporte peu de cas de neutropénie en relation avec la lévodopa seule ou combinée. Le personnel médical doit néanmoins garder présent à l’esprit cet effet indésirable quand une neutropénie se déclare chez un patient traité avec ce médicament.
Mots clés : Carbidopa, lévodopa, maladie de Parkinson, neutropénie
Abstract
Objective : To present a case of neutropenia likely related to the use of levodopa-carbidopa to treat Parkinson’s disease.
Case summary : The case reported in this article involved a 90-year-old woman hospitalized for falls and hallucinations. The falls may have been due to Parkinson’s disease, for which she was not receiving any medication. She was started on levodopa-carbidopa. Subsequently, she developed moderate secondary neutropenia, which may have been caused by this drug.
Discussion : Cases of neutropenia associated with several classes of drugs are described in the scientific literature. The result given by the Naranjo algorithm indicated that levodopa-carbidopa was the probable cause of her neutropenia, but the presence of another hematological problem cannot be ruled out, given that her hematological workup was incomplete. During mild to moderate neutropenia not caused by chemotherapeutic agents, withdrawal of the suspected agent is often the only action required to bring about a normalization of the neutrophil count. Generally, in at-risk patients, infection prevention measures are taken as well.
Conclusion : There are few reported cases of neutropenia associated with levodopa alone or in combination. Medical personnel should nonetheless keep this adverse effect in mind when a patient treated with this drug develops neutropenia.
Keywords : Carbidopa, levodopa, neutropenia, Parkinson’s disease
La lévodopa, précurseur de la dopamine, est utilisée depuis plus de 50 ans pour le traitement de la maladie de Parkinson1. Combinée à un inhibiteur de la dopa décarboxylase périphérique (carbidopa ou bensérazide), la lévodopa reste à ce jour le médicament le plus efficace et donc, la pierre angulaire du traitement de cette pathologie2,3. La maladie de Parkinson étant causée par la dégénérescence des neurones dopaminergiques de la voie nigro-striée, la lévodopa restaure les niveaux de dopamine au striatum, ce qui permet l’amélioration des symptômes de la maladie, principalement les symptômes moteurs, tels que la bradykinésie et la rigidité. L’inhibiteur de la dopa décarboxylase contribue, d’une part, à diminuer les effets indésirables périphériques de la lévodopa (nausées, vomissements, hypotension) en empêchant sa conversion en dopamine en périphérie et, d’autre part, à prolonger sa demi-vie et à augmenter son activité au cerveau2.
Généralement, les principaux effets secondaires de la lévodopa sont les nausées et vomissements, l’hypotension orthostatique, ainsi que diverses complications motrices, en particulier les fluctuations motrices et les dyskinésies liées au pic de dose3. Des effets indésirables psychiatriques, tels que les idéations paranoïdes et la psychose, sont également possibles4. La monographie de la lévodopa-carbidopa mentionne également que des effets sur la fonction hématologique peuvent survenir, mais les descriptions de tels effets sont très rares dans la littérature médicale4.
Cet article présente un cas de neutropénie qui semble être survenu après la prise de lévodopa-carbidopa. Aucun cas semblable n’avait encore été répertorié par Santé Canada5.
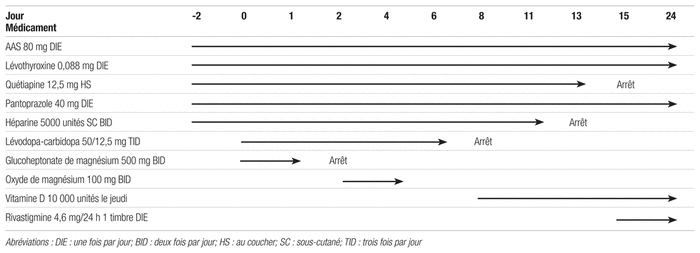
Il s’agit d’une patiente caucasienne de 90 ans (45 kg, 156 cm) admise en médecine familiale pour un quatrième épisode de chutes et d’hallucinations requérant une hospitalisation dans la dernière année. Aucune allergie n’apparaît à son dossier. Ses antécédents médicaux comprennent, entre autres, une maladie de Parkinson diagnostiquée en 2015, des hallucinations visuelles chroniques, probablement secondaires à un syndrome de Charles-Bonnet, de l’hypotension orthostatique, de l’hypertension, un trouble anxieux généralisé, de la constipation chronique ainsi qu’une hypothyroïdie. Le tableau I présente le bilan comparatif de la médication à l’admission à l’hôpital ainsi qu’au départ de la patiente. Certains médicaments ne présentant aucun intérêt pour cette étude ont été volontairement omis pour alléger le tableau (par exemple, les laxatifs prescrits au besoin).
Tableau I Bilan comparatif des médicaments à l’admission et au départ
Au début de l’hospitalisation, l’équipe de gériatrie est demandée en consultation et conclut que la patiente présente une instabilité posturale due à la maladie de Parkinson qui a progressé. Le gériatre pose aussi les diagnostics suivants : syndrome de chutes secondaires à l’hypotension orthostatique et à la maladie de Parkinson, déconditionnement et troubles neurocognitifs majeurs et mixtes d’étiologie à préciser. La dame est également en perte d’autonomie et a une hypomagnésémie à corriger.
Elle commence donc à prendre la lévodopa-carbidopa à raison de 50 mg/12,5 mg trois fois par jour (jour 0) pour tenter de remédier aux symptômes moteurs liés à sa maladie de Parkinson et de diminuer ainsi le risque de chutes. En examinant l’histoire médicamenteuse, on retient que la patiente avait déjà reçu ce traitement trois ans auparavant durant un mois environ, mais il est impossible de savoir pourquoi il avait été interrompu. Des suppléments de magnésium sont également prescrits pour une courte durée. Deux jours après le début du traitement, on remarque déjà une bonne réponse de la patiente à la lévodopa, mais l’hypotension orthostatique sévère limite l’augmentation de la dose. On remarque également, lors d’un contrôle de laboratoire, que les leucocytes de la dame sont passés de 7 à 2,8 × 109 cellules/L, et que la valeur des neutrophiles absolus a chuté de 5,8 à 1 × 109 cellules/L. Mis à part une valeur d’hémoglobine légèrement abaissée qui était déjà connue, le reste de la formule sanguine ne présente aucune particularité. Durant les jours suivants, les neutrophiles restent bas, mais relativement stables, comme le démontre le tableau II.
Tableau II Tests de laboratoires durant l’hospitalisation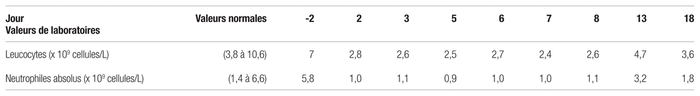
La prise de lévodopa-carbidopa est interrompue au jour six étant donné la persistance de la neutropénie. Entretemps, la patiente est transférée dans une unité de courte durée gériatrique (UCDG) pour subir diverses évaluations. Au jour 14, les neutrophiles sont revenus dans les valeurs normales. Vu la nature de la réaction, on décide alors de supprimer la lévodopa-carbidopa et de ne pas la tenter de nouveau. Durant le séjour à l’UCDG, l’ajout de sachets de sel dans le plateau-repas permet de mieux contrôler l’hypotension orthostatique. Ensuite, l’équipe de gérontopsychiatrie détermine qu’il n’y a pas d’indication pour que cette dame reçoive un psychotrope, on retire donc la quétiapine. L’équilibre de la patiente s’améliore. On lui prescrit par ailleurs de la rivastigmine en timbre pour diminuer les hallucinations et ralentir la progression des troubles cognitifs. Au congé, la dame présente encore une bradykinésie importante limitant ses activités de la vie quotidienne, mais on maintient la décision de ne pas réintroduire d’agent antiparkinsonien à ce stade, car il est peu probable que la patiente le tolèrerait étant donné son problème d’hypotension orthostatique et d’hallucinations. De plus, la patiente bénéficie d’aide dans la résidence où elle demeure. Son médecin de famille devra néanmoins réévaluer cette décision selon la progression de la maladie.
Une autorisation écrite a été obtenue du directeur des Services professionnels du Centre intégré de santé et de services sociaux de l’Estrie-Centre hospitalier universitaire de Sherbrooke pour la publication de ce cas.
La neutropénie induite par un médicament est une réaction potentiellement mortelle6. Elle se définit par un décompte absolu de neutrophiles inférieur à 1,5 × 109 cellules/L. On parle de neutropénie légère lorsque le décompte se situe entre 1 et 1,5 × 109 cellules/L, de neutropénie modérée quand il se situe entre 0,5 et 1,0 × 109 cellules/L et de neutropénie sévère, aussi nommée agranulocytose, lorsque le décompte est en dessous de 0,5 × 109 cellules/L6. Elle est causée le plus souvent par des agents de chimiothérapie7. Elle est également associée à d’autres classes de médicaments, mais elle est alors plus rare, soit une fréquence estimée à 2,4 à 15,4 cas sur un million de personnes8. La neutropénie causée par les autres médicaments pourrait être médiée par une réaction immune ou par une toxicité directe à la moelle7. Le premier mécanisme serait plus plausible, car des anticorps dirigés contre les neutrophiles circulants ont été mis en évidence dans plusieurs études6. Ce type de réaction surviendrait rapidement, de quelques heures à deux jours après l’exposition au médicament, surtout si le patient avait déjà pris le médicament auparavant, comme dans le cas présenté dans cet article9. La réaction immune peut survenir selon plusieurs mécanismes différents, qui ne seront pas tous énumérés ici. Certains médicaments agissent comme des haptènes et peuvent donc s’attacher à des protéines pour former des anticorps et se lier aux neutrophiles, ce qui cause leur destruction. Il peut aussi y avoir une formation de complexes immuns, qui causera la lyse des neutrophiles9,10. Finalement, un cas a également été rapporté avec la prise de propylthiouracil, où la neutropénie était causée par un mécanisme médié par le système du complément11. On trouve des cas de neutropénie en présence de presque toutes les classes de médicaments, mais particulièrement des anti-inflammatoires, des antimicrobiens, des antipsychotiques, des anticonvulsivants, des antithyroïdiens, des antihistaminiques et des médicaments cardiovasculaires9. Les molécules le plus souvent impliquées sont les suivantes : méthimazole, clozapine, sulfasalazine, carbimazole, amoxicilline, triméthoprime-sulfaméthoxazole, ticlopidine et valganciclovir6,8. La neutropénie se résorbe habituellement entre neuf et 24 jours après le retrait de l’agent en cause, mais on assiste aussi parfois à des résolutions en deux à sept jours seulement6,12.
La monographie du SinemetMD (lévodopa-carbidopa) mentionne qu’une diminution des globules blancs peut survenir sous l’effet de la lévodopa seule ou en combinaison4. On parle également, dans les effets indésirables peu fréquents étant survenus dans les études cliniques ou après la commercialisation du médicament, d’agranulocytose, mais pas de neutropénie légère à modérée4. On ne spécifie toutefois pas l’incidence de ces effets secondaires. Sinon, on retrouve dans l’article de Bhatt et coll., qui fait une révision de la neutropénie induite par les médicaments, le tableau des différentes molécules pouvant causer une neutropénie et la lévodopa y figure9. La base de données en ligne des effets indésirables de Canada Vigilance répertorie un seul cas d’agranulocytose en présence de la lévodopa-bensérazide chez un patient de 90 ans, mais on n’y trouve aucun cas de neutropénie légère à modérée5.
Une recherche plus approfondie de la littérature nous a permis de trouver un seul article sur un cas similaire au nôtre. Cordano et coll. rapportent une neutropénie modérée survenue chez un patient de 82 ans après la prise de lévodopa-carbidopa et de lévodopa-bensérazide pour des tremblements au repos13. Dans ce cas, la neutropénie avait été découverte lors d’un prélèvement sanguin de routine, cinq mois après le début de la prise de lévodopa-carbidopa à raison de deux comprimés de 100 mg/25 mg une fois par jour. Le début de l’effet indésirable n’est donc pas connu, et l’article mentionne que le patient a toujours été asymptomatique. À l’arrêt du médicament, le décompte absolu de neutrophiles était à 0,71 × 109 cellules/L. Il est revenu à la normale après deux mois et demi. La lévodopa a ensuite été réadministrée, cette fois en combinaison avec la bensérazide, alors que le décompte absolu des neutrophiles était à 1,79 × 109 cellules/L. Un mois plus tard, le patient était de nouveau neutropénique (neutrophiles absolus à 0,98 × 109 cellules/L). Il a tout de même poursuivi la prise du médicament, mais deux mois plus tard, la formule sanguine complète démontrait toujours une neutropénie. La lévodopa-bensérazide a finalement été retirée et les neutrophiles étaient à nouveau normaux lors d’un contrôle fait quatre mois plus tard.
Le résultat obtenu avec l’algorithme de Naranjo est de 5, ce qui signifie que la neutropénie secondaire à la lévodopa-carbidopa est une réaction probable16. Ce résultat provient du fait qu’il existe un autre rapport de cas sur la neutropénie causée par la lévodopa dont la réaction est survenue après l’administration du médicament et que dès le retrait de celui-ci, une amélioration est apparue. Aussi, les données objectives ont confirmé l’effet indésirable. Nous ne pouvons pas exclure qu’une autre cause aurait pu être responsable de la neutropénie, car les analyses étaient peu nombreuses. Parmi les causes de neutropénie les plus fréquentes figurent le sepsis secondaire à une infection bactérienne grave ou à un virus, les maladies causant une insuffisance médullaire et l’hypersplénisme. Dans de plus rares cas, la neutropénie peut aussi être causée par des déficits nutritionnels12. Dans notre cas, l’équipe a écarté la cause infectieuse, étant donné que la patiente n’avait aucun symptôme d’infection virale ou bactérienne. De plus, en vue d’expliquer cette neutropénie persistante, au jour 8, l’équipe a effectué une analyse par électrophorèse des protéines, qui n’a révélé aucune anomalie (sauf une très légère diminution de l’albumine). Ces résultats laissent présager une absence d’état inflammatoire et, par le fait même, une faible probabilité que la patiente ait eu une condition pouvant l’avoir menée à un hypersplénisme17,18. L’analyse du frottis sanguin, omise ici pour une raison inconnue, fait partie des examens de base qui devraient être faits lors d’une neutropénie inexpliquée19. L’absence d’une telle analyse, ainsi que d’une biopsie de la moelle osseuse, ne nous permet donc pas d’exclure la présence d’une maladie hématologique chez cette patiente souffrant également d’une légère anémie20. De plus, des analyses nutritionnelles manquent au dossier (vitamine B12, folate). Le dosage de vitamine B12 était cependant normal six mois auparavant.
Il aurait été intéressant de pouvoir comparer le cas de l’article de Cordano et coll. avec le nôtre en ce qui a trait aux variations des neutrophiles en fonction de la prise ou non de lévodopa, car rappelons que, dans notre cas comme dans celui de Cordano et coll., la patiente en était à une deuxième exposition à la lévodopa. Malheureusement, les intervalles entre chaque analyse sanguine mentionnés dans l’article de ces chercheurs sont assez élevés, ce qui nous empêche de nous faire une idée claire du délai d’apparition et de résolution de la neutropénie. Dans le cas Cordano et coll., lors de la deuxième exposition à la lévodopa, on note que les neutrophiles du patient étaient bas (0,98 × 109 cellules/L) lors du contrôle qui s’est fait un mois plus tard, mais il n’est pas possible de savoir si l’effet indésirable est survenu aussi rapidement que dans notre cas, soit après deux jours d’exposition au médicament. La neutropénie de notre patiente pourrait avoir été causée par la lévodopa-carbidopa, puisqu’aucun autre médicament n’a été introduit dans les jours précédant la baisse des neutrophiles et que le retrait de la dopathérapie a mené à une normalisation des neutrophiles. Cette dernière s’est faite plus rapidement que dans le cas rapporté par Cordano et coll., mais selon certaines données de la littérature, il semble possible qu’une neutropénie causée par un médicament se résorbe une semaine après la cessation de l’agent causal12. Notons que la patiente a reçu des suppléments de magnésium en même temps que la lévodopa-carbidopa. Toutefois, nous ne croyons pas que la neutropénie puisse avoir un lien avec la réplétion en magnésium, car rien dans la littérature ne mentionne que ce type de supplément pourrait entraîner une neutropénie ou un autre désordre des leucocytes14,15. Quant à la quétiapine et au pantoprazole, ils avaient été introduits dans les six mois précédant l’hospitalisation, mais il est peu probable que ces médicaments aient été en cause, puisque la neutropénie s’est corrigée sans que ceux-ci aient été retirés.
Nous avons mené une recherche dans les anciens résultats de laboratoires de la patiente. Dans le passé, aucun prélèvement sanguin n’avait été fait durant la courte période où la patiente avait pris de la lévodopa-carbidopa. Nous avons toutefois pu remarquer que ses neutrophiles tendent à se maintenir proches de la limite inférieure. Tesfa et coll. rapportent d’ailleurs que les neutropénies surviendraient souvent lorsqu’on commence l’administration d’un médicament chez un patient ayant un nombre de neutrophiles qui se situe dans les limites inférieures à la normale. Ils amènent donc l’idée que la neutropénie peut se manifester après l’ajout du nouveau médicament, mais qu’elle peut être causée par une infection virale, un autre médicament ou par une simple fluctuation du décompte des neutrophiles et qu’il est souvent difficile d’en déterminer la cause réelle10. Il est important de garder cette observation présente à l’esprit lors de l’analyse de notre cas, mais le lien entre la neutropénie et la lévodopa-carbidopa nous semble tout de même probable, vu la chronologie des évènements et étant donné que même si les neutrophiles de la patiente étaient souvent bas, aucun de ses anciens résultats ne démontrait une neutropénie franche. De plus, le fait que le décompte de neutrophiles ait diminué après une réexposition à la lévodopa-carbidopa nous fait penser à une réaction immune.
Lorsqu’un diagnostic de neutropénie est posé et qu’on suspecte que celle-ci est due à l’administration d’un médicament, il faut commencer par retirer l’agent causal9. C’est d’ailleurs ce qui semble avoir permis à notre patiente de retrouver une valeur de neutrophiles normale. Il peut arriver que le patient doive recevoir des antimicrobiens s’il y a septicémie ou s’il risque une infection grave, comme on procède habituellement dans les cas de neutropénie fébrile6. Quant à l’utilisation des facteurs de croissance de la lignée granulocytaire, tels que filgrastim et pegfilgrastim, elle fait l’objet de plusieurs rapports de cas et de plusieurs études à répartition aléatoire ou non pour le traitement de l’agranulocytose causée par des médicaments, mais peu de rapports de cas évoquent la neutropénie faible à modérée6,10. Il n’existe donc pour l’instant aucune littérature qui appuie leur utilisation dans des cas comme le nôtre, où le décompte des neutrophiles est supérieur à 0,5 × 109 cellules/L. Son utilisation dans les cas d’agranulocytose qui n’est pas causée par des médicaments de chimiothérapie est hors indication6,21,22.
Nous avons présenté un cas de neutropénie qui pourrait avoir été causée par la prise de lévodopa-carbidopa. La réaction est survenue assez rapidement, c’est-à-dire deux jours après la première prise du médicament, mais la patiente avait déjà été exposée à celui-ci trois ans auparavant. Après quelques jours, la lévodopa-carbidopa a été retirée, et nous avons assisté à une normalisation du décompte de neutrophiles huit jours plus tard. La littérature scientifique présente un cas semblable, mais il est difficile de le comparer au nôtre13. Il est parfois compliqué de trouver l’étiologie d’une neutropénie10. Dans notre cas, la chronologie des évènements et le résultat de l’algorithme de Naranjo nous font penser qu’il est probable que cette neutropénie ait été causée par la lévodopa-carbidopa, mais le bilan hématologique incomplet nous empêche d’exclure d’autres causes hématologiques. Dans les cas de neutropénies non-sévères où on soupçonne un médicament, on recommande le retrait de l’agent causal combiné à une surveillance de la formule sanguine et à des mesures de prévention des infections jusqu’à ce que le décompte de neutrophiles revienne à la normale6,9. Les cas de neutropénie en présence de la lévodopa demeurent très rares, puisque la littérature ne répertorie qu’un très faible nombre de cas. Il ne semble donc pas nécessaire d’augmenter la fréquence des suivis de la fonction hématologique, mais il est toujours possible de soupçonner la lévodopa-carbidopa quand une neutropénie survient chez un patient qui reçoit cet agent.
Aucun financement en relation avec le présent article n’a été déclaré par l’auteur.
L’auteur a rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. L’auteur n’a déclaré aucun conflit d’intérêts actuel ou potentiel en relation avec le présent article.
1. LeWitt PA, Fahn S. Levodopa therapy for Parkinson disease : a look backward and forward. Neurology 2016;86(suppl. 1):S3–12.
2. Salat D, Tolosa E. Levodopa in the treatment of Parkinson’s disease: current status and new developments. J Parkinsons Dis 2013;3:255–69.
3. Chen JJ, Dashtipour K. Parkinson Disease. Dans : DiPiro JT, Talbert RL, Yee GC, Matzke GR, Wells BG, Posey LM, rédacteurs. Pharmaco-therapy: a pathophysiologic approach, 10e. New York, NY: McGraw-Hill Education;2017. [en ligne] https://accesspharmacy.mhmedical.com/content.aspx?bookid=1861§ionid=134127873 (site visité le 7 mai 2018).
4. Merck Canada Inc. Monographie de produit : Sinemet. [en ligne] https://www.merck.ca/static/pdf/SINEMET-PM_F.pdf (site visité le 7 mai 2018).
5. Santé Canada. Recherche dans la base de données en ligne des effets indésirables de Canada Vigilance : lévodopa. Canada Vigilance. [en ligne] http://webprod3.hc-sc.gc.ca/arquery-recher-cheei/index-fra.jsp (site visité le 7 mai 2018).
6. Pick AM, Nystrom KK. Nonchemotherapy drug-induced neutropenia and agranulocytosis: could medications be the culprit? J Pharm Pract 2014;27:447–52.
7. Moore DC. Drug-induced neutropenia: a focus on rituximab-induced late-onset neutropenia. P T 2016;41:765–8.

8. Curtis BR. Non-chemotherapy drug-induced neutropenia: key points to manage the challenges. Hematology Am Soc Hematol Educ Program 2017;2017:187–93.

9. Bhatt V, Saleem A. Review: drug-induced neutropenia-pathophysiology, clinical features, and management. Ann Clin Lab Sci 2004;34:131–7.
10. Tesfa D, Keisu M, Palmblad J. Idiosyncratic drug-induced agranulocytosis: possible mechanisms and management. Am J Hematol 2009;84:428–34.
11. Akamizu T, Ozaki S, Hiratani H, Uesugi H, Sobajima J, Hataya Y et coll. Drug-induced neutropenia associated with anti-neutrophil cytoplasmic antibodies (ANCA): possible involvement of complement in granulocyte cytotoxicity. Clin Exp Immunol 2002;127:92–8.

12. Andrès E, Maloisel F. Idiosyncratic drug-induced agranulocytosis or acute neutropenia. Curr Opin Hematol 2008;15:15–21.
13. Cordano C, Pardini M, Cellerino M, Schenone A, Marino F, Cosentino M. Levodopa-induced neutropenia. Parkinsonism Relat Disord 2015;21:423–5.
14. Micromedex Healthcare series. Monographie de l’oxyde de magnésium. Thomson microme-dex, 1974–2018. [en ligne] http://www.microme-dexsolutions.com (site visité le 4 juin 2018).
15. Natural medicine comprehensive database 2018. Monographie du Magnesium. [en ligne] http://naturaldatabase.therapeuticresearch.com/home.aspx?cs=&s=ND (site visité le 4 juin 2018).
16. Naranjo CA, Busto U, Sellers EM, Sandor P, Ruiz I, Roberts EA et coll. A method for estimating the probability of adverse drug reactions. Clin Pharmacol Ther 1981;30:239–45.
17. Bakerman S. ABC’s of interpretive laboratory date. 4e édition. Scottsdale : Interpretive laboratory data, inc.; c2002.Protein electrophoresis, serum; p.452–53.
18. Jacob HS. Splénomégalie. Dans : Le manuel Merck.Kenilworth, NJ; Merck Sharp & Dohme Corp;2018. [en ligne] http://www.merckmanuals.com/fr-ca/professional/hématologie-etoncologie/troubles-spléniques/splénomégalie#v973061_fr (site visité le 18 novembre 2018).
19. Gibson C, Berliner N. How we evaluate and treat neutropenia in adults. Blood 2014;124:1251–8.
20. Valent P. Low blood counts: immune mediated, idiopathic, or myelodysplasia. Hematology Am Soc Hematol Educ Program 2012;2012:485–91.
21. Amgen Canada Inc. Monographie de produit : Neupogen. [en ligne] https://www.amgen.ca/products/~/media/a9ddd99af4b44bbd890222e34be4f7aa.ashx (site visité le 29 mai 2018).
22. Amgen Canada Inc. Monographie de produit : Neulasta. [en ligne] https://www.amgen.ca/products/~/media/8fda69c1d32b42d5a0347263c22ab22f.ashx (site visité le 29 mai 2018).
PHARMACTUEL, Vol. 52, No. 2, 2019