Romosozumab ou alendronate pour la prévention des fractures chez les femmes atteintes d’ostéoporose : étude ARCH
Marie-Lou Deschamps1,2,3*, Pharm.D., M.Sc., Chloé Trudeau1,4,5*, Pharm.D., M.Sc., Philippe Labrosse1,6,7, Pharm.D., M.Sc., Patrick Nguyen8,9, B.Pharm., M.Sc.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction de l’article, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction de l’article, Centre universitaire de santé McGill, Montréal (Québec) Canada;
3Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction de l’article, Centre hospitalier universitaire de l’Université de Montréal, Montréal (Québec) Canada;
5Pharmacienne, Centre hospitalier universitaire de l’Université de Montréal, Montréal (Québec) Canada;
6Résident en pharmacie au moment de la rédaction de l’article, Hôpital Charles-Le Moyne, Centre intégré de santé et des services sociaux de la Montérégie-Centre, Longueuil (Québec) Canada;
7Pharmacien, Hôpital Charles-Le Moyne, Centre intégré de santé et des services sociaux de la Montérégie-Centre, Longueuil (Québec) Canada;
8Pharmacien, Centre hospitalier universitaire de l’Université de Montréal, Montréal (Québec) Canada;
9Chercheur, Centre de recherche affilié à l’Université de Montréal, Montréal (Québec) Canada
Reçu le 9 août 2018: Accepté après révision par les pairs le 21 mars 2019
Titre de l’article : Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017;365:1417-271.
Auteurs : Gage BF, Bass AR, Lin H, Woller C, Stevens SM, Al-Hammadi N et coll. pour les investigateurs de l’étude GIFT.
Commanditaires : L’étude a été commanditée par Amgen, Astellas Pharma et UCB Pharma, trois compagnies actives dans le développement et la mise en marché du romosozumab. Les trois compagnies ont participé à différentes étapes de l’étude, dont la rédaction de l’article.
Cadre de l’étude : Notre compréhension des mécanismes de la régulation osseuse a beaucoup évolué au cours des dernières années. Elle a progressé, entre autres, grâce à la découverte de nouveaux marqueurs biologiques, tels que la sclérostine, pouvant mener à une dégradation osseuse excessive. En inhibant la sclérostine, le romosozumab, qui est un anticorps monoclonal, favorise la formation osseuse et diminue la résorption osseuse, en empêchant la différenciation ostéoclastique2. Dans l’étude FRAME, le romosozumab s’est montré supérieur au placebo pour réduire les fractures vertébrales après 12 mois de traitement, mais pas pour réduire les fractures non vertébrales3. Actuellement, les bisphosphonates sont la première ligne de traitement pour les femmes postménopausées souffrant d’ostéoporose4. Il est donc tout indiqué de comparer cette nouvelle molécule à celles de la première ligne de traitement actuelle afin de connaitre sa place dans le traitement de l’ostéoporose.
Protocole de recherche : Il s’agit d’une étude de phase III, multicentrique, internationale, à répartition aléatoire et à double insu. Les patientes ont été recrutées dans 125 centres. Lors de la répartition aléatoire, elles ont été stratifiées selon leur âge (moins de 75 ans et 75 ans et plus). Le protocole de recherche a été approuvé par les comités d’éthique de tous les centres.
Patients : Les femmes incluses dans l’étude étaient toutes postménopausées, âgées de 55 à 90 ans et ont été recrutées dans un contexte ambulatoire. Elles devaient correspondre à l’un des deux critères suivants au moment du recrutement. Le premier se définissait par un score T inférieur ou égal à −2,5 de la hanche ou du col fémoral ET au moins une fracture vertébrale modérée ou sévère OU plus d’une fracture vertébrale légère. Le second consistait en un score T inférieur ou égal à −2 de la hanche ou du col fémoral ET plus d’une fracture vertébrale modérée ou sévère OU une fracture du fémur proximal survenue trois à 24 mois avant la répartition aléatoire. Ont été exclues les femmes qui n’étaient pas en mesure de prendre les comprimés d’alendronate ou qui présentaient une contre-indication à ce bisphosphonate, par exemple un débit de filtration glomérulaire inférieur à 35 mL/min ajusté à la surface corporelle. Les femmes qui avaient un antécédent de maladie osseuse métabolique, un niveau de vitamine D active de moins de 50 nmol/mL, une hypo ou hypercalcémie active, une hypo ou hyperthyroïdie non contrôlée, une hypo ou une hyperparathyroïdie non contrôlée, un antécédent de transplantation de cellules souches ou d’organes solides, une suspicion de myélome multiple ou autre syndrome myéloprolifératif ou une utilisation récente de médicaments pouvant affecter le métabolisme osseux (bisphosphonate par voie intraveineuse dans les cinq dernières années, bisphosphonate par voie orale dans les trois dernières années et tériparatide dans la dernière année) ont aussi été exclues.
Interventions : Le groupe romosozumab recevait une injection sous-cutanée de 210 mg de romosozumab chaque mois tandis que le groupe alendronate recevait un comprimé d’alendronate de 70 mg par voie orale toutes les semaines, fourni par la compagnie Merck. Les 12 premiers mois de l’étude se sont déroulés à l’aveugle. Par la suite, toutes les femmes recevaient chaque semaine un comprimé d’alendronate de 70 mg jusqu’à la fin de l’étude. Les participantes recevaient également un supplément quotidien de calcium (500 à 1000 mg) et de vitamine D (600 à 800 unités).
Points évalués : Cette étude a été conçue pour démontrer la supériorité du romosozumab sur l’alendronate. Les objectifs primaires portaient sur l’évaluation de l’incidence de nouvelles fractures vertébrales à 24 mois ainsi que de l’incidence cumulative des fractures cliniques (non vertébrales et vertébrales symptomatiques). Cette analyse primaire était prévue lorsqu’une fracture clinique avait été confirmée chez au moins 330 patientes et que toutes les participantes avaient subi l’évaluation à 24 mois. Les objectifs secondaires visaient à mesurer la densité minérale osseuse (DMO) de la colonne lombaire, de la hanche et du col fémoral ainsi que l’incidence des fractures de la hanche à 12 et 24 mois dans les deux groupes. L’incidence ainsi que la sévérité des effets secondaires rapportés par le site d’investigation ont aussi été évaluées au cours de l’étude. Les effets indésirables cardiovasculaires sévères et les cas d’ostéonécrose de la mâchoire et de fractures atypiques étaient évalués par un comité indépendant. Un effet secondaire sérieux était défini dans le protocole comme un effet présentant au moins une des caractéristiques suivantes : fatal, mettant la vie en danger, nécessitant une hospitalisation ou une prolongation de l’hospitalisation, résultant en une incapacité ou un handicap persistant ou significatif, une anomalie congénitale ou tout autre effet médical d’importance. Les analyses évaluant l’efficacité ont été réalisées en intention de traiter ou en intention de traiter modifiée pour les analyses d’innocuité. La prise d’une radiographie du thorax et de la colonne lombaire ainsi que la mesure de la DMO de la colonne lombaire et du fémur proximal (selon une absorptiométrie à rayons X à double énergie) avaient eu lieu au moment de la répartition aléatoire et se sont répétées tous les 12 mois par la suite. Un sous-groupe de patientes a subi en outre la mesure des concentrations sériques des marqueurs du remodelage osseux, du télopeptide C-terminal du collagène de type 1 (β-CTX) et du propeptide N-terminal du procollagène de type 1 (P1NP). Les investigateurs ont également mesuré les anticorps antiromosozumab d’un autre sous-groupe de patientes au jour un et jusqu’au 24e mois, et les échantillons qui se sont révélés positifs ont subi des tests d’évaluation des anticorps neutralisants.
Résultats : Au total, 4093 patientes ont été incluses dans l’étude. Parmi celles-ci, 3150 ont participé à l’étude jusqu’à la fin, et ont été incluses dans l’analyse primaire. Les caractéristiques démographiques et médicales de la population à l’étude se trouvent dans le tableau I.
Tableau I Caractéristiques démographiques et médicales des patientes de l’étudea
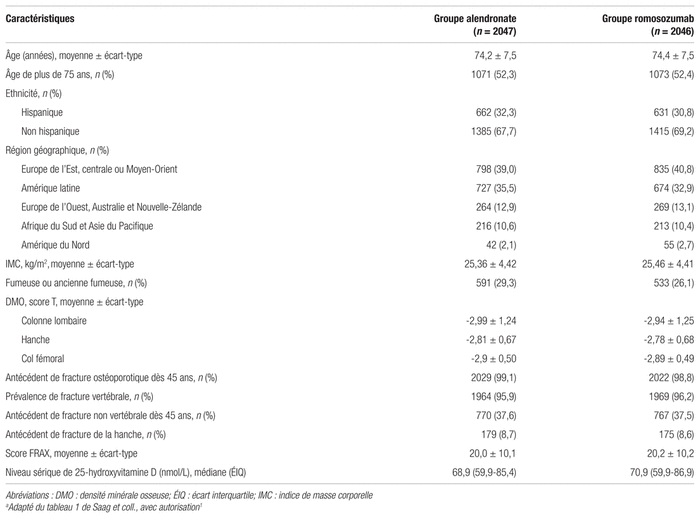
Les principaux résultats sont présentés dans le tableau II. À 24 mois, 127 femmes (6,2 %) ont développé une nouvelle fracture vertébrale dans le groupe romosozumab comparativement à 243 femmes (11,9 %) dans le groupe alendronate, ce qui équivaut à une réduction du risque de 48 % (Rapport de risque instantané [RRI] : 0,52; intervalle de confiance à 95 % [IC 95 %] 0,40–0,66, p < 0,001). Concernant les fractures non vertébrales, le romosozumab permet de réduire le risque de 19 % comparativement à l’alendronate seul (RRI : 0,81; IC 95 % : 0,66–0,99, p = 0,04). Les investigateurs ont aussi pu observer une réduction du risque de fractures de la hanche de 38 % (RRI : 0,62; IC 95 % : 0,42–0,92, p = 0,02) et une réduction du risque de fractures cliniques de 27 % (RRI : 0,73; IC 95 % : 0,61–0,88, p < 0,001).
Tableau II Résultats principauxa
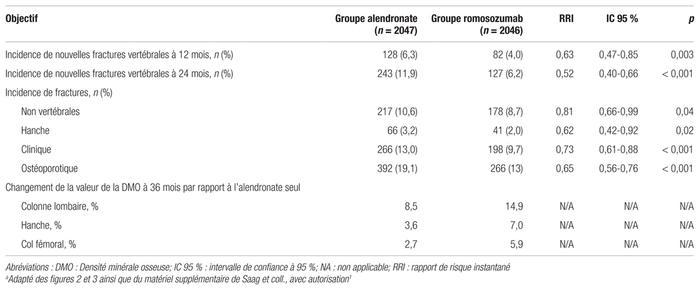
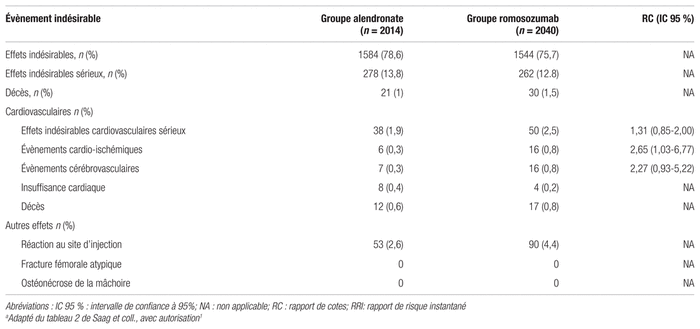
L’incidence des effets indésirables était similaire dans les deux groupes après 12 mois de traitement, comme on peut le voir dans le tableau III. Par contre, 2,5 % des participantes ont eu des troubles cardiovasculaires sérieux dans le groupe romosozumab comparativement à 1,9 % des patientes du groupe alendronate (Rapport de cotes [RC] : 1,31; IC 95 % : 0,85–2,00). 16 patientes (0,8 %) du groupe romosozumab ont subi un accident cardio-ischémique comparativement à six (0,3 %) dans le groupe alendronate (RC : 2,65; IC 95 % : 1,03–6,77). De plus, 16 patientes (0,8 %) du groupe romosozumab ont eu un accident cérébrovasculaire, tandis que ce nombre était de sept (0,3 %) dans le groupe alendronate (RC : 2,27; IC 95 % : 0,93–5,22). En ce qui concerne les fractures fémorales atypiques et l’ostéonécrose de la mâchoire, les résultats étaient comparables entre les deux groupes et aucun cas n’est survenu dans la première année de traitement.
Tableau III Innocuité des traitements lors de la période à l’aveugle (à 12 mois)a
Grille d’évaluation critique

Discussion
Les bisphosphonates sont utilisés actuellement en première ligne pour le traitement de l’ostéoporose ainsi que pour la prévention de fractures des patients ostéopéniques exposés à un risque élevé de fractures4. En effet, l’efficacité de ces agents est bien documentée et les essais cliniques produisent des résultats positifs constants sur la solidification des structures osseuses existantes5. De plus, les coûts associés aux bisphosphonates qui s’administrent par la bouche sont relativement faibles. À ce jour, le seul autre agent permettant une augmentation rapide la DMO est le tériparatide. L’étude VERO, qui comparait l’utilisation de tériparatide au risédronate, effectuée auprès de femmes postménopausées ayant un score T inférieur ou égal à −1,5 avec des fractures vertébrales, a montré respectivement une réduction du risque relatif de fractures vertébrales et cliniques à 24 mois de 56 % et de 52 % en faveur du tériparatide comparativement au risédronate6. Cependant, aucune donnée d’innocuité n’est disponible pour un usage de plus de 24 mois5. En effet, la durée d’utilisation du tériparatide est limitée, entre autres en raison de l’augmentation du risque de cancer osseux observée chez les rongeurs lors d’une exposition prolongée à cet agent5. L’étude FRAME, qui évaluait l’utilisation du romosozumab pendant 12 mois, suivie du dénosumab pour des femmes postménopausées ayant un score T de la hanche ou du col fémoral situé entre −2,5 et −3,5, a montré que le romosozumab réduisait de 73 % l’incidence de nouvelles fractures vertébrales comparativement au placebo après 12 mois et de 75 % après 24 mois. La diminution du risque de fractures non vertébrales à 12 et 24 mois n’a par contre pas pu être démontrée dans cette étude3. Dans un autre ordre d’idée, l’étude ARCH a révélé que le traitement à base de romosozumab suivi de l’alendronate était plus efficace à 24 mois pour réduire le risque de nouvelles fractures vertébrales comparativement à l’alendronate seul, le nombre nécessaire à traiter étant de 18 personnes. Mais les résultats portant sur les fractures non vertébrales étaient moins frappants, puisque 53 personnes devaient être traitées préventivement au romosozumab contre de telles fractures.
On a observé un nombre supérieur de troubles cardiovasculaires sérieux dans le groupe ayant reçu le romosozumab. En effet, on note environ deux fois plus d’accidents cardio-ischémiques et cérébrovasculaires avec l’utilisation du romosozumab comparativement à l’alendronate, même si les facteurs de risques cardiovasculaires des deux groupes étaient comparables au départ. Il est possible que cet accroissement du risque soit dû à l’inhibition de la sclérostine par l’agent expérimental, ce qui pourrait hypothétiquement provoquer une calcification des artères7. Cette constatation est d’autant plus inquiétante que l’étude FRAME n’en fait pas mention. Il est vrai que les patientes de cette étude étaient plus jeunes et présentaient moins de comorbidités3. Qui plus est, la fréquence de cet effet secondaire étant très rare, une erreur de type 1 est possible, puisque l’étude ARCH n’avait pas la puissance nécessaire pour déterminer la non-infériorité du romosozumab par rapport à l’alendronate à l’échelle de l’innocuité. Notons encore que le comité consultatif de la Food and Drug Administration s’est récemment prononcé en faveur du romosozumab. Il attend néanmoins des données supplémentaires sur l’innocuité de cette molécule8.
L’étude présente une méthodologie rigoureuse. En effet, les suivis ont été effectués de façon identique entre les deux groupes, ce qui réduit le risque de biais d’information. Si l’analyse principale en intention de traiter a permis de préserver les avantages de la répartition aléatoire, les analyses per protocole ont permis de décrire l’efficacité du romosozumab dans des conditions d’utilisation optimales. La prise de doses adéquates de calcium et de vitamine D par toutes les participantes permet de réduire le risque de biais attribuable aux variables confondantes. Finalement, l’utilisation d’un comparateur actif, dont l’efficacité est reconnue, permet de mieux situer la place du romosozumab dans la thérapie actuelle.
Par ailleurs, la validité externe est assez limitée. Les critères d’inclusion et d’exclusion étant très stricts, les résultats ne sont applicables qu’à une population restreinte, soit les femmes postménopausées ayant une ostéoporose sévère et n’étant pas traitées. L’étude présente aussi quelques limites. En effet, même si la prise de bisphosphonates oraux dans les trois dernières années était un critère d’exclusion, les investigateurs auraient pu stratifier les patientes selon leur utilisation antérieure de ces agents, un effet résiduel étant possible, puisque la demi-vie de l’alendronate lors d’une prise chronique est très longue9. De plus, cette étude n’a duré que deux ans, ce qui est assez court. Bien que l’utilisation d’alendronate comme comparateur permette de voir la différence entre un nouveau médicament et le traitement de première intention, il aurait été intéressant de comparer le romosozumab à un agent agissant sur la formation osseuse. Les comparaisons par rapport aux changements de densité minérale osseuse auraient été plus intéressantes que les résultats obtenus avec les bisphosphonates, des agents qui freinent la résorption osseuse plutôt que de stimuler la formation des os. Cette différence entre les mécanismes d’action des deux molécules étudiées peut aussi potentiellement expliquer la différence observée entre les groupes à 12 mois, puisqu’un début d’action plus rapide a généralement lieu avec les agents stimulant la formation osseuse10. Il est aussi important de noter qu’aucune donnée sur l’adhésion entre les groupes n’a été présentée. Les auteurs avaient prévu initialement cinq pour cent de pertes au suivi par année. Cependant, dès la première année, 23 % des patientes ont abandonné l’étude et environ 10 % des patientes ont été perdues au suivi, ce qui a obligé les auteurs à réaliser une analyse post-hoc qui incluait toutes les patientes réparties aléatoirement. Plusieurs facteurs, tels que la consommation de caféine ou d’alcool ainsi que l’activité physique, peuvent avoir un impact sur la santé osseuse et ils n’ont pas été pris en considération, ce qui augmente le risque de biais de confusion. Finalement, le présent article a été financé par la compagnie Amgen, qui commercialise le romosozumab et qui a participé à la rédaction du manuscrit final.
La place potentielle du romosozumab reste mal définie. Le romosozumab semble très efficace pour une population présentant un risque très élevé de fractures (score T inférieur ou égal à −3,0), en diminuant de moitié le risque de fractures vertébrales. Hypothétiquement, il pourrait être utilisé au même titre que le tériparatide, qui est indiqué pour les femmes souffrant d’ostéoporose fracturaire sévère (score T inférieur ou égal à −3,0) et ayant présenté une réponse inadéquate aux bisphosphonates11. Par contre, puisque les femmes ayant entrepris peu auparavant un traitement au bisphosphonate étaient exclues de la présente étude, des données supplémentaires sont nécessaires avant qu’on puisse se prononcer sur l’effet de la présence d’un bisphosphonate sur l’efficacité du romosozumab, d’autant plus qu’il existe des données montrant que l’usage préalable de bisphosphonate pourrait nuire à l’efficacité du tériparatide12. Dans un autre ordre d’idée, la comparaison à l’alendronate, qui est utilisé en première ligne au Québec, rend les résultats applicables à notre pratique4. Par contre, il est nécessaire d’investiguer de façon plus soutenue l’incidence des effets cardiovasculaires graves et leur lien avec l’utilisation du romosozumab. De plus, le romosozumab est un médicament injectable, ce qui pourrait ne pas convenir à toutes les patientes et avoir un impact délétère sur l’adhésion à la thérapie. La question du coût est aussi importante à soulever. Les coûts de ce nouvel agent n’étant pas connus pour l’instant, une étude pharmacoéconomique sera nécessaire afin de déterminer l’efficience du romosozumab dans le contexte des soins de santé québécois.
Conclusion
L’étude actuelle a permis de mettre en lumière une diminution significative de près de 50 % du risque de nouvelles fractures vertébrales ainsi qu’une augmentation significative et rapide de la DMO. Cette vaste étude présente des résultats très intéressants applicables aux femmes qui sont atteintes d’une ostéoporose très sévère non traitée. L’incidence d’évènements cardiovasculaires graves était plus élevée dans le groupe qui recevait du romosozumab. Il est nécessaire d’obtenir davantage de données sur l’innocuité de ce médicament avant d’en préconiser un usage à plus large échelle. Disons pour l’instant que le romosozumab est un agent qui pourrait peut-être s’ajouter un jour à l’arsenal thérapeutique contre l’ostéoporose pour les femmes ayant un score T inférieur ou égal à −3,0 et n’ayant aucun facteur de risque cardiovasculaire.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec cet article.
Remerciements
Cet article a été réalisé dans le cadre du cours Communication scientifique de la Faculté de pharmacie de l’Université de Montréal. Les auteurs tiennent à remercier les responsables. Une autorisation écrite a été obtenue de ces personnes.
Références
1. Saag KG, Petersen J, Brandi ML, Karaplis AC, Lorentzon M, Thomas T et coll. Romosozumab or alendronate for fracture prevention in women with osteoporosis. N Engl J Med 2017;377:1417–27.

2. Ferrari SL. Osteoporosis: Romosozumab to rebuild the foundations of bone strength. Nat Rev Rheumatol 2018;14:128.

3. Cosman F, Crittenden DB, Adachi JD, Binkley N, Czerwinski E, Ferrari S et coll. Romosozumab treatment in postmenopausal women with osteoporosis. N Engl J Med 2016;375:1532–43.

4. Papaioannou A, Morin S, Cheung AM, Atkinson S, Brown JP, Feldman S et coll. 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary. Can Med Assoc J 2010;182:1864–73.

5. Eli Lilly Canada inc. Monographie de produit: Forteo. [en ligne] https://www.lilly.ca/fr/pdf/product-monograph/4.0_forteo-pm_9feb10_clean-fr.pdf (site visité le 29 mai 2018).
6. Kendler DL, Marin F, Zerbini CA, Russo LA, Greenspan SL, Zikan V et coll. Effects of teriparatide and risedronate on new fractures in postmenopausal women with severe osteoporosis (VERO): a multicentre, double-blind, doubledummy, randomised controlled trial. Lancet 2017;291:230–40.
7. Claes KJ, Viaene L, Heye S, Meijers B, d’Haese P, Evenepoel P. Sclerostin: another vascular calcification inhibitor? J Clin Endocrinol Metab 2013;98:3221–8.

8. Monaco K. FDA advisors back romosozumab for osteoporosis. [en ligne] https://www.medpagetoday.com/endocrinology/osteoporosis/77479 (site visité le 5 mars 2019).
9. Merck Canada inc. Monographie de produit: Fosamax. [en ligne] https://www.merck.ca/static/pdf/FOSAMAX-PM_E.pdf (site visité le 29 mai 2018).
10. Arlot M, Meunier PJ, Boivin G, Haddock L, Tamayo J, Correa-Rotter R. Differential Effects of teriparatide and alendronate on bone remodeling in postmenopausal women assessed by histomorphometric parameters. J Bone Miner Res 2005;20:1244–53.

11. Régie d’assurance maladie du Québec. Liste des médicaments. Québec, 2019. [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/liste_med/2019/liste_med_2019_02_01_fr.pdf (site visité le 12 février 2019).
12. Ettinger B, San Martin J, Crans G, Pavo I. Differential effects of teriparatide on BMD after treatment with raloxifene or alendronate. J Bone Miner Res 2004;19:745–51.

Pour toute correspondance : Marie-Lou Deschamps, Centre universitaire de santé McGill, 1001, boulevard Décarie, Montréal (Québec) H4A 3J1, CANADA; Téléphone : 514 934-1934; Télécopieur : 514 843-1719; Courriel : marie-lou.deschamps@umontreal.ca
*Marie-Lou Deschamps et Chloé Trudeau ont contribué de façon équivalente à la rédaction de cet article (
Return to Text
)
(Return to Top)
PHARMACTUEL, Vol. 52, No. 3, 2019