Édoxaban, une nouvelle option pour le traitement des thromboembolies veineuses des patients cancéreux ?
Maude Couture1,2,3, Pharm.D., M.Sc., Mélanie Fauteux-Brault1,2,4, Pharm.D., M.Sc., Guillaume Kuate Fotso1,2,5, Pharm.D., Anne-Sophie Martin1,2,3, Pharm.D., M.Sc.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résident en pharmacie au moment de la rédaction, Centre hospitalier universitaire de Québec – Université Laval, site Hôpital Saint-François d’Assise, Québec (Québec) Canada;
3Pharmacienne, Centre hospitalier universitaire de Québec – Université Laval, Hôpital Saint-François d’Assise, Québec (Québec) Canada;
4Pharmacienne, Centre intégré universitaire de santé et de services sociaux du Nord-de-l’Île-de-Montréal, Hôpital Jean-Talon, Montréal (Québec) Canada;
5Pharmacien, Conseil cri de la santé et des services sociaux de la Baie-James, Baie-James (Québec) Canada
Reçu le 17 septembre 2018: Accepté après révision par les pairs le 7 février 2019
Titre de l’article : Edoxaban for the treatment of cancer-associated venous thromboembolism. N Engl J Med 2018;378:615-241.
Auteurs : Raskob GE, Es NV, Verhamme P, Carrier M, Di Nisio M, Garcia D et coll. pour les investigateurs Hokusai VTE Cancer.
Commanditaires : Cette étude a été financée par la compagnie Daiichi Sankyo (Tokyo, Japon) qui a participé à la conception du protocole, à la collecte des données et à l’analyse statistique en collaboration avec le comité de rédaction.
Cadre de l’étude : Le cancer est un facteur augmentant le risque d’épisodes thromboemboliques2–4. En effet, environ 8 % des patients atteints de cancer développeront au moins une fois un événement thromboembolique au cours de l’évolution de leur maladie3.
Les héparines de faible poids moléculaire (HFPM) constituent actuellement le traitement de choix pour les patients présentant une thromboembolie veineuse (TEV) associée à un cancer2,5–9. En effet, des études réalisées auprès de cette population ont démontré qu’une HFPM administrée pendant six mois s’était révélée supérieure à un antagoniste de la vitamine K (AVK) pour réduire le risque de récurrences de TEV, sans augmentation importante du risque de saignement10. L’injection sous-cutanée constitue toutefois le principal obstacle à son usage11.
Les anticoagulants oraux directs (AOD) prennent une place importante dans le traitement des TEV pour la population générale6,7,12. Toutefois, le manque de données précisant leur usage pour les patients cancéreux atteints d’une TEV limite leur utilisation. La littérature scientifique disponible provient d’analyses de sous-groupes dans des essais cliniques comparant un AOD à un AVK pour le traitement des TEV13–16. Le fait que la présente étude compare pour la première fois un AOD, l’édoxaban, au traitement standard, la daltéparine, pour des patients cancéreux atteints de TEV est un gage de sa pertinence.
Protocole de recherche : Il s’agit d’une étude ouverte internationale multicentrique, prospective, à répartition aléatoire et de non-infériorité visant à comparer l’efficacité et la sécurité de l’édoxaban par rapport à la daltéparine pour des patients cancéreux atteints d’une TEV.
Patients : Les patients ont été recrutés entre juillet 2015 et décembre 2016 dans 114 centres de 13 pays. Les critères d’inclusion des patients étaient les suivants : un âge minimal de 18 ans, une thrombose veineuse profonde (TVP) proximale symptomatique ou découverte fortuitement, une embolie pulmonaire (EP) aiguë confirmée par imagerie diagnostique, une EP découverte fortuitement dans une artère pulmonaire segmentaire ou de plus gros calibre, un cancer actif ou diagnostiqué dans les deux ans précédant la répartition aléatoire (autre qu’un carcinome basocellulaire ou carcinome spinocellulaire), une intention de traitement avec une HFPM pendant au moins six mois et l’aptitude à donner un consentement écrit.
Les principaux critères d’exclusion étaient les suivants : un autre traitement pour l’épisode courant de TEV, la prise d’un anticoagulant thérapeutique pour une autre indication, un saignement actif, un antécédent de thrombocytopénie associée à l’héparine ou une autre contre-indication au traitement à une HFPM ou à l’édoxaban, une clairance de la créatinine (ClCr) inférieure à 30 mL/min, une anomalie de la fonction hépatique, une grossesse, l’allaitement ou un traitement chronique avec un anti-inflammatoire non stéroïdien ou certains inhibiteurs puissants de la glycoprotéine P (P-gp).
Interventions : Les patients inclus étaient répartis aléatoirement pour recevoir l’édoxaban ou la daltéparine selon un ratio de 1:1. Ainsi, un groupe de patients a reçu 60 mg d’édoxaban par voie orale une fois par jour (ou la dose ajustée à la baisse) après au moins cinq jours de traitement à une HFPM choisie par le médecin traitant. Les patients ayant une ClCr de 30 à 50 mL/min, un poids inférieur ou égal à 60 kg ou un traitement concomitant avec un inhibiteur puissant de la P-gp recevaient une plus faible dose d’édoxaban (30 mg par voie orale une fois par jour). L’autre groupe de patients a reçu 200 unités/kg de daltéparine en injection sous-cutanée une fois par jour (dose quotidienne maximale de 18 000 unités) pendant 30 jours, puis 150 unités/kg une fois par jour. Le nombre de plaquettes absolues était monitoré durant l’étude et s’il était inférieur à 100 000/microlitre, la dose de daltéparine était temporairement réduite.
Dans les deux groupes, la durée prévue du traitement était d’au moins six mois, avec la possibilité d’une poursuite jusqu’à 12 mois selon le médecin traitant.
Un suivi était effectué durant 12 mois ou jusqu’à la fin de l’étude, mais il devait être assuré pendant un minimum de neuf mois. Une visite du patient en clinique ou une évaluation téléphonique avait lieu aux mois 1, 3, 6, 9 et 12 après la répartition aléatoire. Lorsque les patients rapportaient des symptômes correspondant à certains évènements indésirables, les investigateurs les prenaient en note : une suspicion de TEV ou de saignement, des évènements indésirables majeurs sans association avec le cancer ou ses traitements, une élévation des niveaux des aminotransférases et de la bilirubine.
Points évalués : L’objectif primaire composé de l’étude de non-infériorité visait l’évaluation de la récurrence d’une TEV ou d’un saignement majeur. La récurrence de TEV était définie par la présence d’au moins une des conditions suivantes : un nouveau diagnostic de TVP ou d’EP symptomatiques, la découverte fortuite de TVP ou d’EP au moyen d’imageries réalisées dans un autre contexte, une EP fatale, le décès de cause inexpliquée pour lequel l’EP ne pouvait être exclue.
La présence d’un saignement majeur était définie par un saignement manifeste et la présence d’au moins l’un des critères suivants : une diminution de l’hémoglobine égale ou supérieure à 2 g/dL, une transfusion d’au moins deux unités de sang, un saignement survenant dans un site critique ou entraînant le décès. Ces critères ont été déterminés par l’International Society on Thrombosis and Haemostasis (ISTH)17.
Quant aux objectifs secondaires, ils comprenaient principalement la récurrence de TEV, la présence d’un saignement majeur, d’un saignement non majeur cliniquement significatif, les décès toutes causes confondues et la survie sans évènements.
L’analyse primaire comprenait tous les évènements de l’objectif primaire apparus dès la répartition aléatoire et jusqu’à 12 mois ou jusqu’à la fin de l’étude. Les auteurs ont procédé à deux analyses de sensibilité pour répondre à l’objectif primaire. La première consistait à évaluer les évènements de l’objectif primaire survenant dans les six premiers mois après la répartition aléatoire. La seconde évaluait les évènements de l’objectif primaire survenant durant le traitement ou dans les trois jours après son arrêt dans la population per protocole.
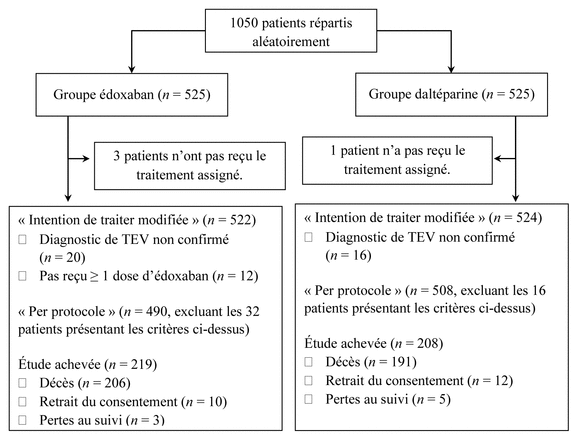
Résultats : Au total, 525 patients composaient chacun des deux groupes. La figure 1 présente la répartition des 1050 patients de l’étude, tandis que le tableau I décrit leurs principales caractéristiques. Celles-ci étaient similaires dans les deux groupes au moment de la répartition aléatoire.
| |
|
|
|
Figure 1 Répartition des patients dans l’étudea
Abréviations : n : nombre de patients; TEV : thromboembolie veineuse
aAdaptation autorisée de la figure 1 de l’étude de Raskob et coll.1
aAdaptation autorisée du tableau 2 de l’étude de Raskob et coll.1
|
Tableau I Caractéristiques de base des participants à l’étude comparant l’édoxaban à la daltéparinea
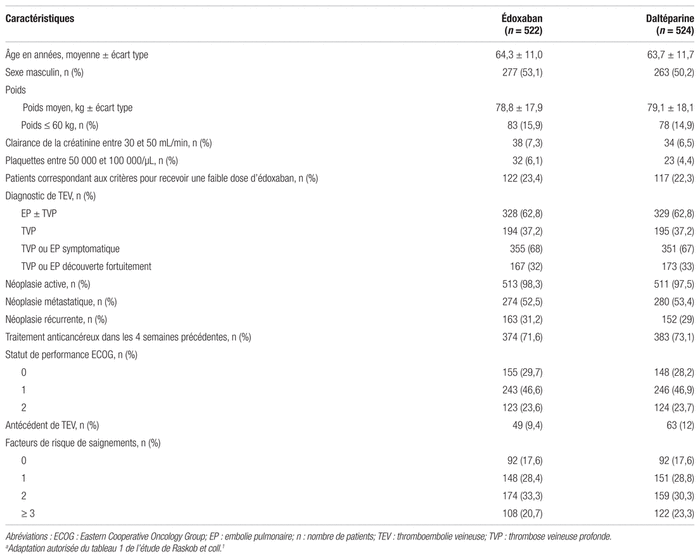
La durée médiane de traitement était inférieure dans le groupe daltéparine comparativement au groupe édoxaban, soit respectivement 184 jours et 211 jours, un résultat statistiquement significatif (p = 0,01). Une proportion de 14,9 % des patients, par rapport à seulement 4 % dans le groupe édoxaban, ont cessé définitivement la prise de daltéparine en raison du mode d’administration peu pratique. Toutefois, l’observance au traitement était similaire dans les deux groupes selon les critères de l’étude. En effet, 85,6 % des patients du groupe édoxaban et 88,7 % des patients du groupe daltéparine ont reçu au moins 80 % du traitement prescrit avant l’arrêt définitif.
Le tableau II présente les principaux résultats de l’étude. Il est possible de constater la non-infériorité de l’édoxaban par rapport à la daltéparine en ce qui concerne l’objectif primaire. En effet, les composantes de l’objectif primaire, soit la récurrence de TEV ou la présence d’un saignement majeur, ont été observées chez 12,8 % des patients du groupe édoxaban et 13,5 % des patients du groupe daltéparine (risque relatif [RR] : 0,97; intervalle de confiance à 95 % [IC 95 %] 0,70–1,36; p = 0,006 pour la non-infériorité).
Tableau II Caractéristiques de base des participants à l’étude comparant l’édoxaban à la daltéparinea
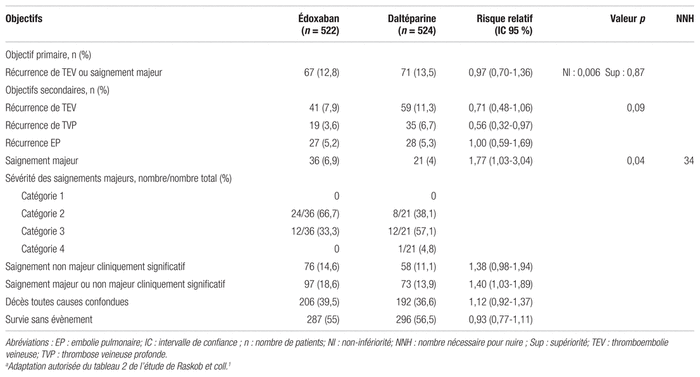
En ce qui concerne les objectifs secondaires, la récurrence de TEV était inférieure dans le groupe édoxaban (7,9 %) par rapport au groupe daltéparine (11,3 %), mais de façon non statistiquement significative (p = 0,09). Pour ce qui est des saignements majeurs, ils étaient significativement supérieurs dans le groupe édoxaban comparativement au groupe daltéparine, soit respectivement chez 6,9 % et 4 % des patients (p = 0,04; nombre nécessaire pour nuire sur une période de 12 mois [NNH] = 34). Parmi les 397 décès, six dans chaque groupe étaient liés à la récurrence de TEV ou à la présence d’un saignement majeur.
Des analyses de sous-groupes ont été réalisées pour l’objectif primaire, ainsi que pour les objectifs secondaires évaluant la récurrence de TEV et la présence de saignements majeurs. L’unique analyse de sous-groupe statistiquement significative a démontré que les patients souffrant de cancer gastro-intestinal présentaient un risque accru de saignements majeurs lorsqu’ils étaient traités à l’édoxaban contrairement à la daltéparine (respectivement 13,2 % et 2,4 %; p = 0,02; NNH = 9 patients sur une période de 12 mois). De plus, les deux analyses de sensibilité relatives à l’objectif primaire ont démontré des résultats semblables à ceux de l’analyse primaire.
Les principaux effets indésirables étaient similaires dans les groupes édoxaban et daltéparine. Ils comprenaient la progression d’une tumeur maligne (respectivement 13 % et 12,8 %), la progression d’une tumeur (respectivement 4,4 % et 4 %) et la pneumonie (respectivement 3,1 % et 2,7 %).
Grille d’évaluation critique


Discussion
Dans cette étude comparant l’édoxaban à la daltéparine pour les patients atteints de cancer qui présentent une TEV, les auteurs concluent que l’édoxaban n’est pas inférieur à la daltéparine dans le cadre de l’objectif primaire. L’objectif secondaire leur permet de spécifier que l’édoxaban serait associé à un risque significativement accru de saignement majeur comparativement à la daltéparine. Il faut cependant garder à l’esprit le fait que la combinaison de l’objectif d’efficacité et d’innocuité peut faciliter l’atteinte de la non-infériorité de l’édoxaban en limitant l’impact de l’augmentation du risque de saignement majeur sur les bénéfices cliniques nets. Ceci est une limite de l’étude.
L’étude comporte quelques autres limites, dont les quatre premières sont mentionnées par les auteurs. Premièrement, il s’agissait d’une étude ouverte. Les auteurs expliquent qu’il aurait été inapproprié d’utiliser des injections de placebo à long terme dans le groupe édoxaban, ce qui est justifiable. Pour pallier cette limite, c’est un comité dont les membres n’étaient pas informés de l’assignation des traitements qui était chargé de l’analyse des résultats. Ceci contribue à améliorer la validité interne de l’étude. Deuxièmement, la taille de l’échantillon était trop faible pour que des recommandations soient émises selon le type de cancer et de chimiothérapie. Troisièmement, la durée moyenne de traitement à la daltéparine était plus courte que le traitement à l’édoxaban, ce qui peut avoir eu un impact sur l’efficacité relative des traitements en défaveur de la daltéparine. Cependant, la raison principale ayant poussé les patients à cesser la daltéparine est l’inconvénient qu’occasionnent les injections sous-cutanées, ce qui est représentatif de la réalité. Quatrièmement, le nombre d’évènements associés à l’objectif primaire était inférieur au taux attendu. En effet, pour que l’étude atteigne une puissance de 80 %, les investigateurs comptaient observer 191 évènements associés à l’objectif primaire. Or, seulement 138 évènements se sont produits. Ce fait peut donc mener à une puissance plus faible que celle attendue, ce qui entraîne une diminution de la précision des résultats de l’étude. Finalement, une limite dont les auteurs n’ont pas discuté est le fait que la compagnie commercialisant l’édoxaban finançait l’étude et participait à la conception du protocole, à la collecte et à l’analyse des données. Toutefois, la collaboration de cette compagnie avec un comité indépendant réduit le risque de biais de financement. Par ailleurs, on pourrait penser à première vue que le taux de mortalité élevé constitue une limite de l’étude. Toutefois, ce taux de mortalité n’est pas surprenant dans une population atteinte de cancer, et il est plus bas comparativement à celui dans l’étude CLOT, qui met en parallèle la daltéparine et un AVK pour la prévention des récurrences de TEV chez les patients cancéreux10. Il est à noter que les patients de l’étude CLOT avaient possiblement une maladie plus avancée étant donné que 65 % d’entre eux étaient atteints d’une maladie métastatique, comparativement à 50 % dans la présente étude. De plus, l’avancement des thérapies anticancéreuses depuis le moment où a été réalisée l’étude CLOT (2003) a possiblement contribué à diminuer la mortalité.
Cette étude possède également certaines forces. D’abord, elle est la première à évaluer l’efficacité et la sécurité d’un AOD pour la prévention de TEV des patients cancéreux. Ensuite, l’analyse en intention de traiter modifiée et celle per protocole ont produit des résultats de non-infériorité comparables pour l’objectif primaire. Par ailleurs, le fait que le protocole ait été respecté constitue une force pour ce qui est de la validité interne de l’étude. D’autre part, la répartition aléatoire et la stratification constituent des forces, car elles limitent les biais de sélection et de confusion. Un autre point fort de l’étude porte sur le fait qu’un comité indépendant confirmait la validité des diagnostics de TEV et un médecin indépendant confirmait les diagnostics de cancers des patients inclus dans l’étude. Finalement, le fait que l’observance était considérée adéquate et comparable entre les deux groupes constitue également une force de l’étude. L’objectif primaire n’a donc pas été influencé par ce critère.
Le taux de 8,8 % de récurrence de TEV à six mois dans le groupe daltéparine est similaire à ce qui est retrouvé dans la littérature scientifique pour les patients atteints de cancer3,10. Quant au taux de 3,2 % de saignements majeurs à six mois dans le groupe daltéparine, il est comparable à ce que rapporte la littérature (4 %)10. En ce qui concerne le taux de saignements majeurs dans le groupe édoxaban, il semble supérieur au risque de base trouvé dans la population générale. En effet, le taux de saignements majeurs associé à l’édoxaban dans l’étude comparant cette molécule à la warfarine pour le traitement des TEV dans la population générale était de 1,4 %, comparativement à 6,9 % dans l’étude actuelle20. On pourrait potentiellement attribuer cette différence au taux supérieur de saignements chez les patients présentant un cancer gastro-intestinal, ce que démontre une analyse de sous-groupe de la présente étude. Finalement, l’étude SELECT-D publiée récemment évalue la place du rivaroxaban pour les patients cancéreux atteints de TEV21. La population étudiée (n = 406) était plus faible que celle de la présente étude et la méthodologie était différente, il est donc difficile de procéder à une comparaison directe des résultats. Toutefois, si on évalue les valeurs obtenues à six mois dans les deux études, les récurrences de TEV étaient de 4 % sous rivaroxaban et de 6,5 % sous édoxaban, tandis que les saignements majeurs étaient comparables, soit respectivement 6 % et 5,6 %. Par ailleurs, tout comme la présente étude, l’étude SELECT-D rapportait davantage de saignements majeurs sous l’AOD parmi les patients ayant un cancer oesophagien ou gastro-intestinal.
Certains éléments de l’étude facilitent ou limitent l’applicabilité des résultats aux patients québécois. Ils sont abordés plus en détail dans la grille d’évaluation critique ci-haut. Selon les données de la littérature actuelle, l’édoxaban et le rivaroxaban sont dorénavant des options de remplacement raisonnables de la daltéparine pour les patients cancéreux atteints de TEV, qui refusent les injections ou qui acceptent un risque de saignement plus élevé22,23. Certains critères restreignent cependant leur utilisation : les patients ayant un cancer gastro-intestinal, ceux exposés à un risque de saignement élevé (dont ceux qui ont un antécédent de saignement gastro-intestinal), les interactions médicamenteuses avec les AOD, des poids extrêmes, une insuffisance rénale ou hépatique sévère. Actuellement, il n’y a pas de données qui appuient l’utilisation de l’apixaban et du dabigatran pour les patients cancéreux atteints de TEV. Des études en cours sur l’apixaban, comme CARAVAGGIO et ADAM VTE, pourraient toutefois venir appuyer l’utilisation d’un autre AOD pour cette population. De plus, l’étude PRIORITY, actuellement en cours, permettra de mieux évaluer le risque de saignement majeur lié au rivaroxaban et à la daltéparine chez les patients atteints d’un cancer hépatobiliaire, pancréatique et gastrointestinal haut. En ce qui a trait au coût associé au traitement, l’édoxaban est avantageux, puisque son coût brut quotidien est évalué à environ 2,84 $ comparativement aux 30,26 $ de la daltéparine pour un patient de poids moyen29,24. De plus, ce montant exclut les services infirmiers de maintien à domicile des patients incapables de s’autoadministrer la daltéparine. Il faut également tenir compte de la qualité de vie associée à la prise orale d’édoxaban par rapport à l’injection de daltéparine lors du choix de traitement individualisé. Puisque la présente étude n’en tenait pas compte, il serait intéressant d’avoir plus de données à ce sujet. Cela permettrait de mieux positionner l’édoxaban dans l’arsenal thérapeutique à offrir aux patients cancéreux atteints de TEV.
En ce qui concerne la durée de traitement avec un AOD pour les patients cancéreux atteints d’une TEV, la présente étude se voulait novatrice en évaluant une durée de traitement allant jusqu’à 12 mois. Cependant, les auteurs n’ont pas présenté de résultats spécifiques aux patients dont le traitement s’est prolongé entre six et 12 mois. Ainsi, cette étude n’entraînera pas de changement des pratiques actuelles. Une durée de traitement d’au moins trois à six mois est actuellement recommandée pour cette population9,20. À l’heure actuelle, en l’absence de données cliniques convaincantes, la prolongation du traitement au-delà de six mois de certains patients plus à risque est uniquement basée sur un consensus d’experts9.
En somme, les résultats de l’étude ouvrent la porte à l’utilisation de l’édoxaban pour les patients cancéreux atteints de TEV. Cependant, le risque de saignement plus élevé limite son utilisation. Par conséquent, l’édoxaban ne peut actuellement être considéré comme une option de remplacement définitive de la daltéparine pour tous les patients.
Conclusion
En démontrant la non-infériorité d’un traitement à l’édoxaban jusqu’à 12 mois par rapport à la daltéparine, cette étude positionne l’édoxaban comme une option de remplacement possible de la daltéparine pour les patients cancéreux atteints de TEV. Toutefois, les saignements majeurs significativement élevés dans le groupe édoxaban obligent le clinicien à bien examiner le ratio risques/bénéfices pour chaque patient à qui ce traitement est proposé dans ce contexte. D’autres études seront donc nécessaires pour préciser la place de l’édoxaban et des autres AOD dans le traitement des TEV pour les patients cancéreux. Si les études à venir utilisent une méthodologie similaire et corroborent les résultats de la présente étude, il serait probablement indiqué de commencer le traitement par une HFPM pendant cinq jours, puis d’entreprendre l’administration d’édoxaban. Des études sur l’apixaban (CARAVAGGIO et ADAM VTE) et le rivaroxaban (COSIMO) sont actuellement en cours. COSIMO évaluera entre autres la satisfaction des patients par rapport au traitement reçu. Des résultats prometteurs sont attendus de ces études et de celles à venir. En effet, ils pourraient occasionner un virage des pratiques vers l’anticoagulation orale, ce qui serait tout à l’avantage des patients.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Remerciements
Cet article a été rédigé dans le cadre du cours Communication scientifique en pharmacie II de l’Université Laval. Les auteurs en remercient la responsable, Julie Méthot. Une autorisation écrite a été obtenue de cette personne.
Références
1. Raskob GE, van Es N, Verhamme P, Carrier M, Di Nisio M, Garcia D et coll. Edoxaban for the treatment of cancer-associated venous thromboembolism. N Engl J Med 2018;378:615–24.

2. Farge D, Debourdeau P, Beckers M, Baglin C, Bauersachs RM, Brenner B et coll. International clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. J Thromb Haemost 2013;11:56–70.

3. Khorana AA, Connolly GC. Assessing risk of venous thromboembolism in the patient with cancer. J Clin Oncol 2009;27:4839–47.


4. Heit JA, Mohr DN, Silverstein MD, Petterson TM, O’Fallon M, Melton III J. Predictors of recurrence after deep vein thrombosis and pulmonary embolism: a population-based cohort study. Arch Intern Med 2000;160:761–68.

5. Smrke A, Gross PL. Cancer-associated venous thromboembolism: a practical review beyond low-molecular-weight heparins. Front Med (Lausanne) 2017;4:142.

6. Kearon C, Akl EA, Ornelas J, Blaivas A, Jimenez D, Bounameaux H et coll. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest 2016;149:315–52.

7. Kearon C, Akl EA, Comerota AJ, Prandoni P, Bounameaux H, Goldhaber SZ et coll. Antithrombotic therapy for VTE disease: antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2012;141:e419S-e96S.


8. Hakoum MB, Kahale LA, Tsolakian IG, Matar CF, Yosuico VE, Terrenato I et coll. Anticoagulation for the initial treatment of venous thromboembolism in people with cancer. Cochrane Database Syst Rev 2018;1:CD006649.

9. Lyman GH, Khorana AA, Kuderer NM, Lee AY, Arcelus JI, Balaban EP et coll. Venous thromboembolism prophylaxis and treatment in patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol 2013;31:2189–204.

10. Lee AY, Levine MN, Baker RI, Bowden C, Kakkar AK, Prins M et coll. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N Engl J Med 2003;349:146–53.

11. Khorana AA, Yannicelli D, McCrae KR, Milentijevic D, Crivera C, Nelson WW et coll. Evaluation of US prescription patterns: are treatment guidelines for cancer-associated venous thromboembolism being followed? Thromb Res 2016;145:51–3.

12. Taillon I, Béliveau P, Bournival J, Brouillette F, Bureau I, Champagne J et coll. Guide d’utilisation - Les anticoagulants oraux directs (AOD). [en ligne] http://iucpq.qc.ca/sites/default/files/guide_aod_anticoagulants_oraux_directs_ou_naco_juin2017.pdf (site visité le 14 avril 2018).
13. Schulman S, Goldhaber SZ, Kearon C, Kakkar AK, Schellong S, Eriksson H et coll. Treatment with dabigatran or warfarin in patients with venous thromboembolism and cancer. Thromb Haemost 2015;114:150–7.

14. Raskob GE, van Es N, Segers A, Angchaisuksiri P, Oh D, Boda Z et coll. Edoxaban for venous thromboembolism in patients with cancer: results from a non-inferiority subgroup analysis of the Hokusai-VTE randomised, double-blind, doubledummy trial. Lancet Haematol 2016;3:379–87.

15. Prins MH, A.W. L, Brighton TA, Lyons RM, Rehm J, Trajanovic M. Oral rivaroxaban versus enoxaparin with vitamin K antagonist for the treatment of symptomatic venous thromboembolism in patients with cancer (EINSTEIN-DVT and EINSTEIN-PE): a pooled subgroup analysis of two randomised controlled trials. Lancet Haematol 2014;1:37–46.

16. Agnelli G, Buller HR, Cohen A, Gallus AS, Lee TC, Pak R et coll. Oral apixaban for the treatment of venous thromboembolism in cancer patients: results from the AMPLIFY trial. J Thromb Haemost 2015;13:2187–91.

17. Schulman S, Kearon C. Definition of major bleeding in clinical investigations of antihemostatic medicinal products in nonsurgical patients. J Thromb Haemost 2005: 692–4.

18. Régie de l’assurance maladie du Québec. Codes des médicaments d’exception. [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/professionnels/medicaments/codes-medicaments-exception/codes_medicaments_exception.pdf (site visité le 2 juin 2019).
19. Giroux I, Châteauvert N, Taillon I, Méthot J. Guide de l’usage optimal des héparines de faible poids moléculaire pour les patients obèses et les patients insuffisants rénaux. [en ligne] https://www.apesquebec.org/sites/default/files/publications/publications-conjointes/20170802-guide-heparines.pdf (site visité le 6 juin 2018).
20. Buller HR, Decousus H, Grosso MA, Mercuri M, Middeldorp S et coll. Edoxaban versus warfarin for the treatment of symptomatic venous thromboembolism. N Engl J Med 2013;369:1406–15.

21. Young AM, Marshall A, Thirlwall J, Chapman O, Lokare A, Hill C et coll. Comparison of an oral factor Xa inhibitor with low molecular weight heparin in patients with cancer with venous thromboembolism: results of a randomized trial (SELECT-D). J Clin Oncol 2018:1–12.
22. Thrombosis Canada. Cancer and thrombosis. [en ligne] http://thrombosiscanada.ca/wp-content/uploads/2018/07/Cancer-and-Thrombosis-2018June18.pdf (site visité le 8 juillet 2018).
23. Al-Amkari H, Connors JM. The role of direct anticoagulants in treatment of cancer-associated thrombosis. Cancers 2018;10:1–11.
24. Institut national d’excellence en santé et en services sociaux (INESSS). Lixiana – avis d’inscription aux listes des médicaments. [en ligne] http://www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/Octobre_2017/Lixiana_TEV_2017_06_.pdf (site visité le 20 juillet 2018).
Pour toute correspondance : Maude Couture, 10, rue de l’Espinay, Québec (Québec) G1L 3L5, CANADA; Téléphone : 418 525-4444; Courriel : maude.couture5@hotmail.com
(Return to Top)
PHARMACTUEL, Vol. 52, No. 3, 2019