Étude FLAURA : comparaison de l’osimertinib aux inhibiteurs des tyrosines kinases de l’EGFR de première génération dans le traitement de première ligne du cancer du poumon non à petites cellules avec mutation de l’EGFR de stade localement avancé ou métastatique
Alicia Maheux1,2,3, Pharm.D., M.Sc., Julie Poulin1,2,3, Pharm.D., M.Sc., Marie-Soleil Roy1,2,3, Pharm.D., M.Sc., Francis St-Père1,2,4, Pharm.D., M.Sc.
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université Laval, Québec (Québec) Canada;
2Résident en pharmacie au moment de la rédaction, Institut universitaire de cardiologie et de pneumologie de Québec - Université Laval, Québec (Québec) Canada;
3Pharmacienne, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Québec (Québec) Canada;
4Pharmacien, Centre intégré de santé et de services sociaux de Lanaudière, Terrebonne (Québec) Canada
Reçu le 24 septembre 2018: Accepté après révision par les pairs le 8 janvier 2019
Titre de l’article : Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018;378:113-251.
Auteurs : Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH et coll. pour les investigateurs FLAURA.
Commanditaires : L’étude FLAURA a été financée et soutenue par la compagnie AstraZeneca (réalisation du protocole, collecte, analyse, interprétation des données et rédaction de l’article).
Cadre de l’étude : Au Canada, le cancer du poumon est le type de cancer le plus fréquemment diagnostiqué et le plus mortel2. Le cancer du poumon non à petites cellules (CPNPC) représente 80 à 85 % des cancers du poumon2. La majorité des CPNPC localement avancés ou métastatiques ne sont pas admissibles aux traitements curatifs, et la survie à cinq ans est très limitée (1 à 7 %)3. À ce stade, le traitement est à visée palliative. L’analyse histologique ainsi que les mutations oncogéniques influencent le choix du traitement de première intention. Parmi les diagnostics de CPNPC, 10 à 15 % des Caucasiens et 30 à 50 % des Asiatiques présentent une mutation activatrice ou sensibilisatrice du gène du récepteur du facteur de croissance épidermique (EGFR)4–6. Au Québec, les thérapies ciblées de première ligne offertes aux patients présentant cette mutation sont le géfitinib et l’afatinib, deux inhibiteurs de la tyrosine kinase (ITK) de l’EGFR. L’erlotinib est également disponible, mais au Québec, il n’est pas remboursé en première ligne de traitement. La majorité des patients sous ITK de l’EGFR connaîtront une progression après neuf à 13 mois6,7. Plus de la moitié d’entre eux acquerront la mutation T790M leur conférant une résistance aux ITK de l’EGFR de première et de deuxième génération8.
L’osimertinib (TagrissoMD), un ITK de l’EGFR de troisième génération, sélectif et irréversible, est approuvé par Santé Canada pour le traitement du CPNPC localement avancé ou métastatique des patients porteurs de la mutation T790M, dont la maladie a progressé pendant ou après un traitement avec un ITK de l’EGFR (avant la publication de cette étude)9,10. Cette approbation s’appuie sur l’étude AURA3, une étude de phase III ayant démontré une survie sans progression (SSP) médiane plus élevée dans le groupe osimertinib comparativement à la chimiothérapie (10,1 c. 4,4 mois) pour des patients atteints d’un CPNPC localement avancé ou métastatique, présentant une mutation T790M après un traitement de première ligne avec un ITK de l’EGFR de première ou de deuxième génération11. Les résultats de l’étude AURA1, une étude de phase I, suggèrent l’efficacité de l’osimertinib également pour les patients présentant une mutation de l’EGFR et n’ayant jamais été traités (SSP médiane de 20,5 mois dans une cohorte de 60 patients)12.
Protocole de recherche : Il s’agit d’une étude clinique internationale, multicentrique, de phase III, comparative, à répartition aléatoire et à double insu. L’objectif de cette étude est d’évaluer l’efficacité et l’innocuité de l’osimertinib comparativement aux ITK de l’EGFR standards (erlotinib ou géfitinib) pour le traitement de première intention du CPNPC localement avancé ou métastatique avec mutation de l’EGFR.
Patients : Le recrutement des patients s’est déroulé entre décembre 2014 et mars 2016, dans 132 sites de 29 pays, dont le Canada. Les patients devaient présenter un statut de performance WHO de zéro ou un. Ils ne devaient pas avoir reçu de traitement du CPNPC localement avancé ou métastatique et devaient être admissibles à recevoir le géfitinib ou l’erlotinib. La présence d’une mutation de l’EGFR (Exdel19 ou L858R), seule ou en concomitance avec d’autres mutations de l’EGFR, devait avoir été confirmée. Les patients ayant des métastases au système nerveux central (SNC) étaient inclus dans l’étude si leur état était stable et que toute thérapie, y compris les corticostéroïdes, avait pris fin au moins deux semaines avant de recevoir le médicament à l’étude. Les principaux critères d’exclusion comprenaient la prise concomitante d’un inhibiteur ou d’un inducteur puissant du CYP3A4, un intervalle QTcF (selon la formule de Fredericia) supérieur à 470 ms, un antécédent de maladie pulmonaire interstitielle, une augmentation des enzymes hépatiques (aspartate aminotransférase [AST] et alanine aminotransférase [ALT]) de plus de 2,5 fois la limite supérieure normale (LSN) en l’absence de métastases hépatiques ou de plus de cinq fois la LSN en présence de métastases hépatiques ainsi qu’une créatinine supérieure à 1,5 fois la LSN accompagnée d’une clairance de la créatinine inférieure à 50 mL/min.
Interventions : Les patients ont été attribués aléatoirement au groupe osimertinib (80 mg par voie orale une fois par jour) ou au groupe ITK de l’EGFR standard (erlotinib 150 mg par voie orale une fois par jour ou géfitinib 250 mg par voie orale une fois par jour) selon un ratio 1:1. Ils ont été stratifiés selon le type de mutation de l’EGFR exprimée (Ex19del ou L858R) et selon leur ethnie (asiatique ou non asiatique).
Les patients ont reçu leur traitement jusqu’à la progression de la maladie, à l’apparition d’effets indésirables inacceptables ou au retrait du consentement. Lors d’une progression de la maladie, le traitement pouvait se poursuivre si les investigateurs jugeaient qu’il était encore possible que le patient en retire un avantage clinique. À la suite d’un amendement apporté au protocole le 13 avril 2015, les patients dont la maladie avait progressé sous traitement standard ont pu recevoir l’osimertinib après la confirmation de l’expression de la mutation T790M (« cross-over »).
Les patients étaient évalués à leur entrée dans l’étude, toutes les six semaines pendant 18 mois, puis toutes les 12 semaines jusqu’à la progression de la maladie. Les patients ayant des métastases cérébrales connues ou suspectées devaient subir une imagerie cérébrale de base avant de commencer l’étude. Par la suite, seuls les patients ayant un diagnostic de métastases cérébrales ont eu des suivis d’imagerie cérébrale. Les effets indésirables liés au traitement étaient évalués selon le National Cancer Institute Common Terminology Criteria for adverse events, version 4.0.
Points évalués : La SSP évaluée selon les critères RECIST version 1.1 constituait l’objectif primaire de cette étude. Cet objectif se définit comme l’intervalle de temps qui sépare la répartition aléatoire de la progression de la maladie ou du décès. L’analyse principale de la SSP était effectuée par les investigateurs. Un groupe central indépendant a également effectué une analyse de sensibilité à l’aveugle pour cet objectif.
Les objectifs secondaires comportaient la survie globale (SG), le taux de réponse au traitement, la durée de la réponse, le taux de contrôle de la maladie (taux de réponse complète, partielle ou de stabilité durant au moins six semaines avant la progression de la maladie), l’ampleur de la réponse (réduction de la taille de la lésion cible) ainsi que l’innocuité.
Plusieurs sous-groupes ont été prédéfinis pour l’analyse de la SSP13. Les critères portaient sur le sexe, l’âge lors de la procédure de sélection (moins de 65 ans; 65 ans et plus), l’ethnie (asiatique/non asiatique), antécédent de tabagisme, présence de métastases cérébrales lors de la sélection, statut de performance WHO lors de la sélection, statut T790M avant le début du traitement, présence de mutation de l’EGFR (Ex19del/L858R), mutation EGFR diagnostiquée par l’ADN tumoral circulant confirmée par un test ADN et mutation EGFR confirmée par un test effectué dans un centre certifié13.
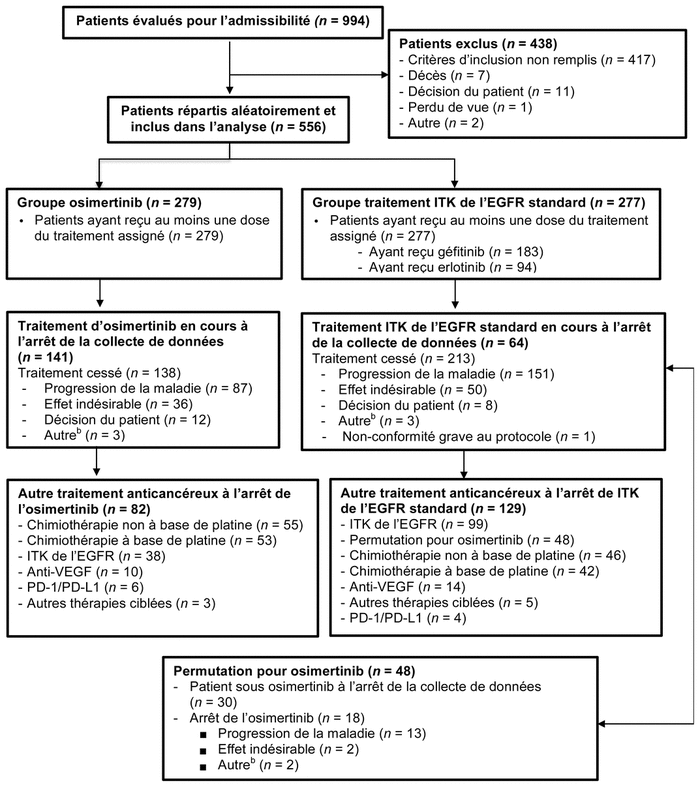
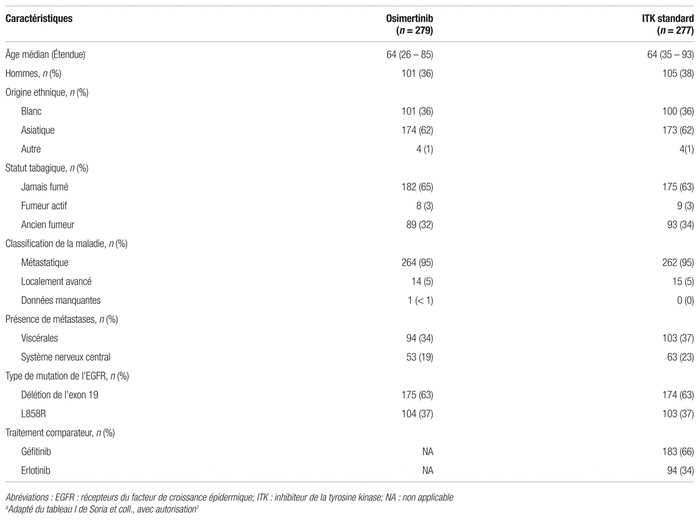
Résultats : Au total, 994 dossiers ont été analysés et 556 patients ont été inclus et répartis aléatoirement dans l’étude. La répartition aléatoire a scindé les participants en deux groupes : 279 patients formaient le groupe osimertinib, tandis que 277 formaient le groupe traitement standard (figure 1). Les caractéristiques démographiques et cliniques des patients sont présentées dans le tableau I. Dans le groupe traitement standard, 183 patients ont reçu le géfitinib, alors que 94 ont reçu l’erlotinib. Tous les patients répartis aléatoirement ont reçu au moins une dose du traitement assigné.
| |
|
|
|
Figure 1 Répartition des patientsa
Abréviations : EGFR : récepteurs du facteur de croissance épidermique; ITK : inhibiteur de la tyrosine kinase; PD-1: récepteur “programmed cell death - 1”; PD-L1 : ligand du récepteur PD-1 ; VEGF : facteur de croissance de l’endothélium vasculaire
aAdapté de la figure S1 de l’appendice de Soria et coll., avec autorisation1
bLa catégorie « autre » : raison non spécifiquement notée, par exemple le décès
|
Tableau I Principales caractéristiques de base des participantsa
À l’arrêt de la collecte de données, la durée moyenne d’exposition au traitement était de 16,2 mois (0,1 à 27,4) dans le groupe osimertinib et 11,5 mois (0 à 26,2) dans le groupe traitement standard. À ce moment, 141 patients (51 %) du groupe osimertinib et 64 (23 %) du groupe traitement standard recevaient encore leur traitement. Dans le groupe osimertinib, 136 patients (49 %) ont connu une progression de la maladie ou un décès contre 206 (74 %) dans groupe traitement standard.
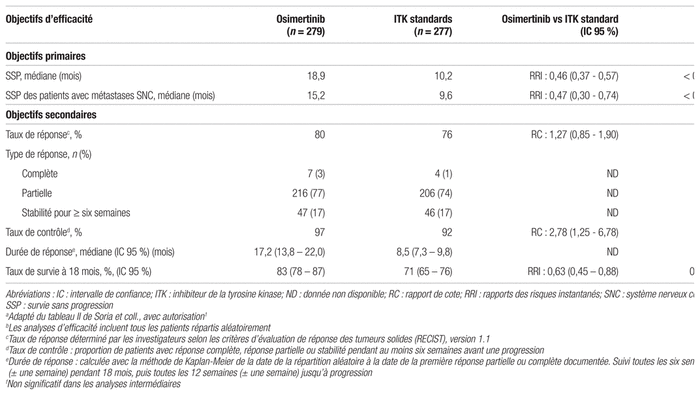
La durée médiane de SSP était de 18,9 mois (intervalle de confiance à 95 % [IC 95 %] 15,2–21,4) avec l’osimertinib comparativement à 10,2 mois (IC 95 % : 9,6–11,1) avec la thérapie standard. La SSP était significativement plus longue dans le groupe osimertinib avec une diminution de 54 % du risque de progression ou de décès (rapports de risque instantané [RRI] : 0,46; IC 95 % : 0,37–0,57, p < 0,001) ainsi que dans tous les sous-groupes prédéfinis, y compris les patients présentant des métastases cérébrales (RRI : 0,47; IC 95 % : 0,30 – 0,74, p < 0,001). Dès la première évaluation à six semaines, l’analyse Kaplan-Meier a démontré une différence entre les deux groupes.
Concernant les objectifs secondaires, le taux de réponse au traitement était de 80 % (IC 95 % : 75–85) avec l’osimertinib comparativement à 76 % (IC 95 % : 70–81) avec la thérapie standard, ce qui ne représente pas une différence significative (rapport de cote [RC] : 1,27; IC 95 % : 0,85–1,90, p = 0,24). Le taux de contrôle de la maladie était de 97 % (IC 95 % : 94–99) dans le groupe osimertinib et de 92 % (IC 95 % : 89–95) dans le groupe traitement standard (RC : 2,78; IC 95 % : 1,25–6,78, p = 0,01). La durée médiane de réponse au traitement était plus longue dans le groupe osimertinib, soit 17,2 mois (IC 95 % : 13,8–22,0) comparativement à 8,5 mois (IC 95 % : 7,3–9,8) avec la thérapie standard. Le nombre de patients du groupe osimertinib ayant entrepris une autre thérapie anticancéreuse à la suite de la progression de la maladie est de 82 (29 %) et de 129 (47 %) dans le groupe traitement standard. Des 129 patients du groupe traitement standard, 55 (43 %) ont reçu l’osimertinib en deuxième ligne (48 en cross-over et sept en dehors de l’étude).
La SG n’a pas pu être calculée, les données n’étant qu’à 25 % de maturité. À 18 mois, le taux de survie était de 83 % dans le groupe osimertinib contre 71 % dans le groupe traitement standard. Au moment de l’analyse des données, 58 patients (21 %) du groupe osimertinib étaient décédés et 83 patients (30 %) du groupe traitement standard (RRI de décès : 0,63; IC 95 % : 0,45–0,88, p = 0,007). Cette différence n’est pas significative, étant donné que le seuil de significativité des analyses intermédiaires avait été fixé à 0,0015. Les principaux résultats d’efficacité sont présentés dans le tableau II.
Tableau II Principaux résultats d’efficacitéa,b
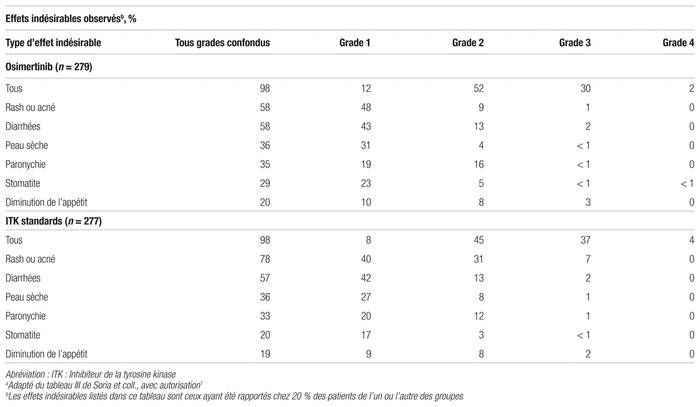
Concernant l’innocuité, l’incidence de toxicité de grade trois ou plus était moindre sous l’effet de l’osimertinib (34 %) qu’avec la thérapie standard (45 %). Les effets indésirables les plus fréquents étaient l’érythème ou l’acné, la diarrhée et la xérose. Un nombre supérieur de patients du groupe osimertinib ont eu un allongement du QTc comparativement aux ITK de l’EGFR standards. Cette prolongation du QTc était le principal effet indésirable cardiaque ayant affecté 28 patients (10 %) du groupe osimertinib contre 11 (4 %) sous ITK de l’EGFR standard. Aucun cas d’arythmie n’a été rapporté dans le groupe osimertinib comparativement à un cas sous thérapie standard. Huit patients (3 %) du groupe osimertinib et six (2 %) du groupe ITK de l’EGFR standard ont nécessité une diminution de la dose du médicament. Cinq patients (2 %) sous osimertinib ont dû interrompre leur traitement et un (moins de 1 %) sous ITK de l’EGFR standard. Concernant les maladies pulmonaires interstitielles, 11 patients (4 %) sous osimertinib et six (2 %) sous ITK de l’EGFR standard ont développé cet effet indésirable. Aucun cas de décès secondaire à cet effet indésirable n’a été rapporté. L’arrêt du traitement en raison d’effets indésirables était moins fréquent dans le groupe osimertinib que dans le groupe traitement standard (13 % c. 18 %), alors que la fréquence d’interruption du traitement et la réduction de dose étaient similaires dans les deux groupes. Les principaux résultats d’innocuité sont présentés dans le tableau III.
Tableau III Principaux résultats de sécuritéa
Grille d’évaluation critique

Discussion
Les résultats de l’étude FLAURA démontrent la supériorité de l’osimertinib en première ligne de traitement pour la SSP des patients atteints d’un CPNPC localement avancé ou métastatique avec une mutation de l’EGFR. Bien que les résultats de SG ne soient pas à maturité, les résultats préliminaires sont très prometteurs. De plus, le profil d’innocuité de cette molécule semble favorable par rapport aux autres ITK de l’EGFR.
L’augmentation de quelques mois de la SSP obtenue dans cette étude sous l’effet de l’osimertinib est intéressante dans le contexte où le CPNPC est une maladie à pronostic très limité. Les ITK de l’EGFR standards, qui constituaient le groupe comparateur dans l’étude FLAURA, ont eux-mêmes démontré, dans des études précédentes, une amélioration très appréciable de la SSP comparativement à la chimiothérapie. En effet, une des études ayant mené à l’utilisation du géfitinib en première ligne de traitement du CPNPC localement avancé ou métastatique avec une mutation de l’EGFR a démontré une SSP de 10,8 mois dans le groupe géfitinib comparativement à 5,5 mois dans le groupe chimiothérapie (RRI : 0,36; IC 95 % : 0,25–0,51, p < 0,001)15. Les résultats obtenus avec l’erlotinib sont semblables. Dans l’étude EURTAC, la SSP était de 9,4 mois dans le groupe erlotinib comparativement à 5,2 mois dans le groupe chimiothérapie (RRI 0,42; IC 95 % : 0,27–0,64, p < 0,0001)16. L’osimertinib démontre donc un avantage par rapport à la thérapie standard qui avait elle-même démontré d’importants avantages sur le plan de la SSP par rapport à la chimiothérapie.
L’étude FLAURA comporte plusieurs forces. En effet, avant la répartition aléatoire, les patients ont été stratifiés selon leur ethnie et le type de mutation, ce qui limite le biais de confusion. De plus, l’utilisation d’outils standardisés (critères RECIST version 1.1 par exemple) et l’analyse à l’aveugle de la SSP par des investigateurs indépendants ont permis de réduire le risque de biais d’information. La SSP observée par l’étude FLAURA dans le groupe de traitement standard correspond à ce qui a déjà été observé par d’autres études15–21. De plus, les avantages pour la SSP sont également présents avec la même ampleur dans tous les sous-groupes à l’étude, ce qui laisse croire à son utilité pour notre population. L’étude FLAURA a démontré l’efficacité de l’osimertinib pour les patients présentant des métastases cérébrales. Certains auteurs affirment maintenant que l’osimertinib représente le premier choix de traitement par rapport aux autres traitements en raison de la prolongation de la SSP des patients avec des métastases cérébrales22. Les résultats de cette analyse concordent également avec les données issues de modèles animaux qui témoignent d’une pénétration de l’osimertinib et d’une exposition du SNC au médicament supérieures par rapport aux autres ITK23. De plus, les auteurs décrivent comme une force de l’étude la possibilité pour les sujets du groupe contrôle de passer à l’osimertinib. Si les résultats finaux confirment l’amélioration de la SG observée lors de l’analyse intermédiaire, l’impact sur l’utilisation future de l’osimertinib sera important. Dans un contexte où environ la moitié des patients sous ITK de première génération sont passés à l’osimertinib, l’avantage de celui-ci en première ligne plutôt qu’en deuxième ligne de traitement se préciserait.
La validité externe de l’étude est suffisamment bonne pour permettre la généralisation des résultats à la population québécoise. En effet, l’étude présente peu de critères d’exclusion, et les caractéristiques des participants sont représentatives des patients présentant un CPNPC avec une mutation de l’EGFR. De plus, il s’agit d’une étude internationale dont certains sites étaient situés au Canada, ce qui permet d’appliquer les résultats à notre population.
Par contre, la généralisation des résultats est limitée à cause des patients présentant une mutation du gène de l’EGFR autre que L858R et Ex19del, notamment les mutations d’insertion de l’exon 20, qui peuvent représenter jusqu’à 10 % des mutations du gène de l’EGFR24. Les lignes directrices du National Comprehensive Cancer Network (NCCN) spécifient d’ailleurs que la plupart de ces mutations sont résistantes aux ITK25. Des études in vitro ont tout de même démontré une plus grande activité de l’osimertinib sur les cellules exprimant une mutation d’insertion de l’exon 20 que celle des ITK de première génération et aussi une moins grande affinité pour l’EGFR de type sauvage que l’afatinib24,26. Des études cliniques devront bien évidemment confirmer l’activité de l’osimertinib pour ce groupe de patients.
L’étude FLAURA comporte certaines limites. Les auteurs mentionnent que, du fait que tous les patients n’avaient pas subi d’imagerie cérébrale de routine, certains d’entre eux avaient peut-être des métastases cérébrales asymptomatiques qui n’ont pas été détectées. Toutefois, cette façon de procéder correspond à la pratique générale. L’absence de l’afatinib dans le groupe comparateur est une autre limite que mentionnent les auteurs. Cet ITK de l’EGFR n’a pas été inclus, puisqu’il ne s’agissait pas d’un traitement standard et qu’il n’était pas disponible à travers le monde au début de l’étude. Par ailleurs, les auteurs soulignent que son inclusion dans l’étude n’aurait de toute façon eu que peu ou pas d’impact en raison des données d’une méta-analyse n’ayant pas démontré de différences sur la SSP entre les trois ITK de l’EGFR de première et de deuxième génération27. De plus, l’afatinib est généralement associé à une moins bonne tolérance comparativement à l’erlotinib et au géfitinib, ce qui en fait une molécule moins utilisée en clinique. En effet, les ITK de 2e génération, soit l’afatinib et le dacomitinib, se sont tous deux démontrés supérieurs au géfitinib pour la SSP avec respectivement des RRI de 0,73 et de 0,59, mais au prix d’effets indésirables plus fréquents28,29.
L’utilisation d’inducteurs ou d’inhibiteurs du CYP3A4 était contre-indiquée, puisqu’ils interagissent avec l’élimination des ITK de l’EGFR1,9. Toutefois, les médicaments augmentant le pH gastrique, par exemple les inhibiteurs de la pompe à protons (IPP), n’étaient pas interdits et leur prise ne semble pas avoir été documentée. Cela a pu avoir un impact sur les résultats, étant donné que les IPP diminuent les concentrations des ITK de l’EGFR de première et de deuxième génération30,31. Or la monographie de l’osimertinib mentionne l’absence d’impact significatif des IPP ou d’autres agents modifiant le pH gastrique sur la pharmacocinétique du médicament. Ainsi, cette interaction, si elle a eu lieu, n’a pas le même effet dans les deux groupes9,32.
Le commanditaire de l’étude FLAURA est la compagnie qui commercialise l’osimertinib. En effet, AstraZeneca a participé à plusieurs étapes de l’étude, dont l’analyse et l’interprétation des données. Cette collaboration constitue donc une autre limite de l’étude, puisqu’il y a apparence de conflit d’intérêts.
Avant la publication des résultats de l’étude FLAURA, l’osimertinib était réservé en deuxième ligne de traitement des patients dont le cancer avait progressé sous un ITK de l’EGFR standard et exprimait la mutation T790M. C’est une recommandation que le NCCN avait émise à la suite de la parution des résultats de l’étude AURA3, qui démontrait la supériorité de l’osimertinib comparativement à la chimiothérapie pour ces patients11,25. Depuis la publication de l’étude FLAURA, le NCCN a ajouté l’osimertinib comme option de traitement de première ligne, au même titre que le géfitinib, l’erlotinib et l’afatinib25.
En juillet 2018, l’osimertinib a obtenu un avis de conformité de Santé Canada pour son utilisation en première ligne de traitement du CPNPC. En novembre 2018, à la suite de la publication des résultats de l’étude FLAURA, l’Institut national d’excellence en santé et services sociaux a recommandé au ministre d’ajouter l’osimertinib à la liste des médicaments d’exception pour le traitement de première intention du CPNPC localement avancé ou métastatique33. L’osimertinib a donc été ajouté à la liste des médicaments d’exception de la Régie de l’assurance maladie du Québec en date du 15 novembre 2018, à la suite de la décision du ministre de la Santé34. L’osimertinib a été approuvé uniquement pour les patients dont le cancer a progressé pendant un traitement avec un ITK de l’EGFR standard et présentant la mutation T790M34. L’osimertinib n’est donc toujours pas remboursé pour le traitement de première intention du CPNPC34.
Le pan-Canadian Oncology Drug Review (PCODR) estime le prix de l’osimertinib à environ 8250 $ pour un cycle de 28 jours35. D’ailleurs, la recommandation initiale du PCODR (publiée le 1er novembre 2018) préconisait d’appuyer le remboursement de l’osimertinib à condition que son rapport coût-efficacité soit ramené à un niveau acceptable et qu’une analyse de faisabilité budgétaire soit réalisée35.
Son utilisation en première ligne risque donc d’entraîner une augmentation importante des coûts pour le système de santé, puisque son prix est supérieur à celui des autres ITK de l’EGFR, qui s’élève autour de 600 à 1900 $ par mois35.
L’utilisation de l’osimertinib en première intention rend certains professionnels inconfortables puisque cela élimine la possibilité d’offrir aux patients une autre thérapie orale en deuxième ligne. Toutefois, la majorité des patients ne bénéficient pas de l’osimertinib en deuxième ligne, car l’identification de la mutation T790M n’est pas facile en clinique. En effet, la condition clinique ou l’impossibilité d’accéder au site de progression de la maladie empêchent plusieurs patients de subir des biopsies36. Dans ce contexte, l’utilisation de l’osimertinib en première ligne permettrait à un plus grand nombre de patients d’en profiter. Certains auteurs soulignent d’ailleurs que, étant donné l’ampleur des avantages de l’osimertinib pour la SSP, sa forte tendance d’amélioration de la SG, son efficacité pour les patients ayant des métastases cérébrales et le fait qu’environ 40 % des patients ne sont pas admissibles à recevoir l’osimertinib en deuxième ligne, cet agent serait l’option à favoriser pour les patients atteints d’un CPNPC EGFR non traité37,38. D’autres sources soulignent que le manque d’informations concernant la séquence optimale du traitement, l’émergence de mécanismes de résistance à l’osimertinib (p. ex. : mutation C797s) ainsi que le fardeau financier associé à ce médicament font en sorte qu’il est nécessaire d’attendre avant de positionner l’osimertinib comme traitement de choix en première ligne39–41. Des auteurs s’intéressent actuellement à la stratégie de traitement favorisant une plus longue SSP. En effet, l’étude APPLE permettra de comparer la SSP des patients recevant l’osimertinib en première ligne à ceux recevant la thérapie séquentielle de géfitinib puis d’osimertinib lors du développement de la mutation T790M42.
Conclusion
L’étude FLAURA démontre la supériorité de l’osimertinib sur les ITK de l’EGFR standards pour la SSP dans le traitement de première intention du CPNPC localement avancé ou métastatique avec une mutation de l’EGFR. En effet la SSP était de 18,9 mois dans le groupe osimertinib comparativement à 10,2 dans le groupe de traitement standard (RRI : 0,46; IC 95 % : 0,37–0,57, p < 0,001). L’avantage absolu pour la SSP est donc de 8,7 mois dans le groupe osimertinib par rapport au groupe comparateur. De plus, le profil d’effets indésirables de l’osimertinib est similaire à celui des ITK de l’EGFR de première et de deuxième génération et ce médicament semble même causer moins d’effets indésirables de grade trois ou plus. Cet aspect permet d’anticiper un impact positif sur la qualité de vie des patients traités à l’osimertinib. C’est pour ces raisons que Santé Canada a accordé un avis de conformité à l’osimertinib comme traitement de première intention. Les instances gouvernementales devront également revoir les considérations pharmacoéconomiques afin de décider de l’inscription ou non de l’osimertinib sur la liste des médicaments couverts par la Régie de l’assurance maladie du Québec. Par ailleurs, il faudra obtenir des résultats d’études cliniques portant sur la séquence de traitement afin de positionner avec plus de confiance l’osimertinib dans l’arsenal thérapeutique.
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Remerciements
Cet article a été rédigé dans le cadre du cours Communication scientifique en pharmacie II de l’Université Laval. Les auteurs en remercient la responsable. Une autorisation écrite a été obtenue de cette personne.
Références
1. Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH et coll. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018;378:113–25.

2. Société canadienne du cancer. Tumeurs cancéreuses du poumon. [en ligne] http://www.cancer.ca/fr-ca/cancer-information/cancer-type/lung/lung-cancer/cancerous-tumours/?region=qc (site visité le 23 décembre 2018).
3. Institut national d’excellence en santé et services sociaux (INESSS). Tagrisso — Cancer du poumon non à petites cellules. Avis de refus d’inscription aux listes des médicaments. [en ligne] http://www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/Juin_2017/Tagrisso_2017_06.pdf (site visité le 9 juin 2018).
4. Barlesi F, Mazieres J, Merlio J-P, Debieuvre D, Mosser J, Lena H et coll. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet 2016;387:1415–26.


5. Midha A, Dearden S, McCormack R. EGFR mutation incidence in non-small-cell lung cancer of adenocarcinoma histology: a systematic review and global map by ethnicity (mutMapII). Am J Cancer Res 2015;5:2892–911.


6. Sun JM, Park K. Can we define the optimal sequence of epidermal growth factor receptor tyrosine kinase inhibitors for the treatment of epidermal growth factor receptor-mutant non-small cell lung cancer? Curr Opin Oncol 2017;29:89–96.

7. Sullivan I, Planchard D. Osimertinib in the treatment of patients with epidermal growth factor receptor T790M mutation-positive metastatic non-small cell lung cancer: clinical trial evidence and experience. Ther Adv Respir Dis 2016;10:549–65.



8. Kuiper JL, Heideman DAM, Thunnissen E, Paul MA, van Wijk AW, Postmus PE et coll. Incidence of T790M mutation in (sequential) rebiopsies in EGFR-mutated NSCLC patients. Lung Cancer 2014;85:19–24.


9. AstraZeneca. Monographie de produit : TAGRISSOMD (osimertinib). [en ligne] https://www.astrazeneca.ca/content/dam/azca/downloads/productinformation/tagrisso-product-monograph-fr.pdf (site visité le 2 juin 2018).
10. AstraZeneca. Approbation par Santé Canada de TAGRISSOMD (osimertinib) pour le traitement des patients atteints d’un cancer du poumon non à petites cellules localement avancé ou métastatique porteur de la mutation T790M de l’EGFR. [en ligne] https://www.astrazeneca.ca/fr/mediacontacts/press-releases/2016/approbation-parsanté-canada-de-tagrisso.html# (site visité le 2 juin 2018).
11. Mok TS, Wu YL, Ahn MJ, Garassino MC, Kim HR, Ramalingam SS et coll. Osimertinib or platinum-pemetrexed in EGFR T790M-positive lung cancer. N Engl J Med 2017;376:629–40.

12. Ramalingam SS, Yang JC, Lee CK, Kurata T, Kim DW, John T et coll. Osimertinib as first-line treatment of EGFR mutation-positive advanced non-small-cell lung cancer. J Clin Oncol 2018;36:841–9.

13. Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH et coll. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer—Supplementary Appendix. [en ligne] https://www.nejm.org/doi/full/10.1056/NEJ-Moa1713137#article_supplementary_material (site visité le 9 juin 2018).
14. Soria JC, Ohe Y, Vansteenkiste J, Reungwetwattana T, Chewaskulyong B, Lee KH et coll. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer—Protocol. [en ligne] https://www.nejm.org/doi/suppl/10.1056/NEJMoa1713137/suppl_file/nejmoa1713137_protocol.pdf (site visité le 9 juin 2018).
15. Maemondo M, Inoue A, Kobayashi K, Sugawara S, Oizumi S, Isobe H et coll. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR. N Engl J Med 2010;362:2380–8.


16. Rosell R, Carcereny E, Gervais R, Vergnenegre A, Massuti B, Felip E et coll. Erlotinib versus standard chemotherapy as first-line treatment for European patients with advanced EGFR mutation-positive non-small-cell lung cancer (EURTAC): a multicentre, open-label, randomised phase 3 trial. Lancet Oncol 2012;13:239–46.


17. Mok TS, Wu Y-L, Thongprasert S, Yang CH, Chu DT, Saijo N et coll. Gefitinib or carboplatin-paclitaxel in pulmonary adenocarcinoma. N Engl J Med 2009;361:947–57.


18. Sequist LV, Yang JC, Yamamoto N, O’Byrne K, Hirsh V, Mok T et coll. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations. J Clin Oncol 2013;31:3327–34.


19. Mitsudomi T, Morita S, Yatabe Y, Negoro S, Okamoto I, Tsurutani J et coll. Gefitinib versus cisplatin plus docetaxel in patients with non-small-cell lung cancer harbouring mutations of the epidermal growth factor receptor (WJTOG3405): an open label, randomised phase 3 trial. Lancet Oncol 2010;11:121–8.

20. Zhou C, Wu YL, Chen G, Feng J, Liu XQ, Wang C et coll. Erlotinib versus chemotherapy as first-line treatment for patients with advanced EGFR mutation-positive non-small-cell lung cancer (OPTIMAL, CTONG-0802): a multicentre, openlabel, randomised, phase 3 study. Lancet Oncol 2011;12:735–42.


21. Wu YL, Zhou C, Liam CK, Wu G, Liu X, Zhong Z et coll. First-line erlotinib versus gemcitabine/cisplatin in patients with advanced EGFR mutation-positive non-small-cell lung cancer: analyses from the phase III, randomized, open-label, ENSURE study. Ann Oncol 2015;26:1883–9.


22. Kelly WJ, Shah NJ, Subramaniam DS. Management of brain metastases in epidermal growth factor receptor mutant non-small-cell lung cancer. Front Oncol 2018;8:208.



23. Ballard P, Yates JW, Yang Z, Kim DW, Yang JC, Cantarini M et coll. Preclinical comparison of osimertinib with other EGFR-TKIs in EGFR-Mutant NSCLC brain metastases models, and early evidence of clinical brain metastases activity. Clin Cancer Res 2016;22:5130–40.


24. Hirano T, Yasuda H, Tani T, Hamamoto J, Oashi A, Ishioka K et coll. In vitro modeling to determine mutation specificity of EGFR tyrosine kinase inhibitors against clinically relevant EGFR mutants in non-small-cell lung cancer. Oncotarget 2015;6:38789–803.



25. National Comprehensive Cancer Network. NCCN practice guidelines in oncology: non-small cell lung cancer (version 2.2019). [en ligne] https://www.nccn.org/professionals/physician_gls/pdf/nscl.pdf (site visité le 23 décembre 2018).
26. Floc’h N, Martin MJ, Riess JW, Orme JP, Staniszewska AD, Ménard L et coll. Antitumor activity of osimertinib, an irreversible mutant-selective EGFR tyrosine kinase inhibitor, in NSCLC harboring EGFR exon 20 insertions. Mol Cancer Ther 2018;17:885–96.

27. Batson S, Mitchell SA, Windisch R, Damonte E, Munk VC, Reguart N Tyrosine kinase inhibitor combination therapy in first-line treatment of non-small-cell lung cancer: systematic review and network meta-analysis. Onco Targets Ther 2017;10:2473–82.



28. Park K, Tan EH, O’Byrne K, Zhang L, Boyer M, Mok T et coll. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial. Lancet Oncol 2016;17:577–89.


29. Wu YL, Cheng Y, Zhou X, Lee KH, Nakagawa K, Niho S et coll. Dacomitinib versus gefitinib as first-line treatment for patients with EGFR-mutation-positive non-small-cell lung cancer (ARCHER 1050): a randomised, open-label, phase 3 trial. Lancet Oncol 2017;18:1454–66.


30. AstraZeneca. Monographie de produit : IressaMD (gefitinib). [en ligne] https://www.astrazeneca.ca/content/dam/az-ca/frenchassets/Ourmedicines/iressa-product-monograph-fre.pdf (site visité le 2 juin 2018).
31. Hoffmann-La Roche. Monographie de produit : TarcevaMD (erlotinib). [en ligne] http://www.rochecanada.com/content/dam/roche_canada/fr_CA/documents/Research/ClinicalTrialsForms/Products/ConsumerInformation/Monograph-sandPublicAdvisories/Tarceva/Tarceva_PM_F.pdf (site visité le 2 juin 2018).
32. Vishwanathan K, Dickinson PA, Bui K, Cassier PA, Greystoke A, Lisbon E et coll. The effect of food or omeprazole on the pharmacokinetics of osimertinib in patients with non-small-cell lung cancer and in healthy volunteers. J Clin Pharmacol 2018;58:474–84.

33. Institut national d’excellence en santé et services sociaux (INESSS). Tagrisso — Cancer du poumon non à petites cellules. Avis transmis à la ministre en novembre 2018. [en ligne] https://www.inesss.qc.ca/fileadmin/doc/INESSS/Inscription_medicaments/Avis_au_ministre/Decembre_2018/Tagrisso_2018_11.pdf?sword_list%5B0%5D=comprime&sword_list%5B1%5D=longue&no_cache=1 (site visité le 28 décembre 2018).
34. Régie de l’assurance maladie du Québec. Liste des médicaments en vigueur le 15 novembre 2018. [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/liste_med/liste_med_2018_11_15_fr.pdf (site visité le 29 décembre 2018).
35. PAN-CANADIAN Oncology Drug Review. Initial recommendation for Osimertinib (Tagrisso) for advanced of advanced or metastatic non-small cell lung cancer pERC meeting : 18 octobre 2018. 2018. [en ligne] https://www.cadth.ca/sites/default/files/pcodr/pcodr_osimertinib_tagrisso_nsclc_1stln_in_rec.pdf (site visité le 29 décembre 2018).
36. Popat S. Osimertinib as first-line treatment in EGFR-mutated Non-Small-Cell Lung cancer. N Engl J Med 2018;378:192–3.


37. Passiglia F, Raez LE, Rolfo C. Moving osimertinib to first-line: the right “strategy” in the chessboard of epidermal growth factor receptor-mutated non-small cell lung cancer? J Thorac Dis 2018;(suppl. 9):S1076–80.

38. Ricciuti B, Chiari R. First line osimertinib for the treatment of patients with advanced EGFR-mutant NSCLC. Transl Lung Cancer Res 2018;7(suppl. 2):S127–30.



39. Yoon S, Kang J, Lee DH. Osimertinib, the winner, but cannot yet take it all. Ann Transl Med 2018;6:61.



40. Cadranel J. Osimertinib in first-line treatment-is a comparison not proof? Ann Transl Med 2018;6:57.



41. Barrón F, Zatarain-Barrón ZL, Cardona AF, Arrieta O. Extending the curve: survival of EGFR-mutated lung cancer patients in the 21st century. J Thorac Dis 2018;10:1265–8.

42. Remon J, Menis J, Hasan B, Peric A, De Maio E, Novello S et coll. The APPLE trial: feasibility and activity of AZD9291 (Osimertinib) treatment on positive plasma T790M in EGFR-mutant NSCLC patients. EORTC 1613. Clin Lung Cancer 2017;18:583–8.


Pour toute correspondance : Marie-Soleil Roy, Centre intégré universitaire de santé et de services sociaux de la Capitale-Nationale, Centre d’hébergement Christ-Roi, 900, boulevard Wilfrid-Hamel, Québec (Québec) G1M 2R9, CANADA; Courriel : marie-soleil.roy.ciussscn@ssss.gouv.qc.ca
(Return to Top)
PHARMACTUEL, Vol. 52, No. 2, 2019







