
Camille Dufort-Rouleau1, Pharm.D., M.Sc., Alex Carignan2, MD, M.Sc., Bianca Beloin-Jubinville1,3, B.Pharm., M.Sc., BCPS, Audrey-Anne Longpré1,3, Pharm.D., M.Sc., Jocelyn Dion1,3, B.Pharm., M.Sc., Lorraine Legeleux1,3, Pharm.D., M.Sc., Mélanie Gilbert1,3, B.Pharm., M.Sc.
Reçu le 22 septembre 2018: Accepté après révision le 15 octobre 2019
Résumé
Objectif : Décrire les effets de la substitution de la gentamicine par la tobramycine sur le développement de résistance bactérienne pour lutter contre différentes entérobactéries et le Pseudomonas aeruginosa.
Mise en contexte : La pénurie de gentamicine de septembre 2014 à juin 2016 a entraîné sa substitution par la tobramycine pour tous les patients à partir de l’âge d’un an, excepté lors d’une utilisation synergique pour le traitement des endocardites, de la tularémie et de la brucellose au Centre intégré universitaire de santé et de services sociaux de l’Estrie – Centre hospitalier universitaire de Sherbrooke, installations Hôpital Fleurimont et Hôtel-Dieu.
Résultats : Le nombre d’isolats bactériens à Gram négatif pour la période précédant la pénurie (P1) est de 169 comparativement à 287 pour celle suivant la pénurie (P2). Lors de l’analyse par microorganisme, on ne note aucun changement statistiquement significatif de la sensibilité à la gentamicine et à la tobramycine entre les deux périodes.
Conclusion : Tant les entérobactéries que le Pseudomonas aeruginosa ne semblent pas augmenter leur résistance aux deux antibiotiques mentionnés ci-après lors du remplacement de la gentamicine par la tobramycine pendant 24 mois.
Mots clés : Gentamicine, néphrotoxicité, ototoxicité, résistance bactérienne, tobramycine
Abstract
Objective : To describe the impact of substituting gentamicin with tobramycin on the development of bacterial resistance to fight different enterobacteria and Pseudomonas aeruginosa.
Background : Shortage of gentamicin from September 2014 to June 2016 resulted in it being substituted for tobramycin for all patients from the age of one year, except when used synergistically for the treatment of endocarditis, tularemia and brucellosis at the Hôpital Fleurimont and the Hôpital Hôtel-Dieu of the Centre intégré universitaire de santé et de services sociaux de l’Estrie - Centre hospitalier universitaire de Sherbrooke.
Results : The number of Gram-negative bacterial isolates for the period before the shortage (P1) was 169 compared to 287 for the period after the shortage (P2). The analysis by microorganism did not show a statistically significant change in susceptibility to gentamicin or tobramycin between the two periods.
Conclusion : When gentamicin was substituted with tobramycin for 24 months, there did not appear to be any increased resistance to these two antibiotics by either enterobacteria or Pseudomonas aeruginosa.
Keywords : Bacterial resistance, gentamicin, nephrotoxicity, ototoxicity, tobramycin
Dans le contexte de la pénurie de gentamicine qui a sévi de septembre 2014 à juin 2016, des mesures ont été mises en place afin d’en limiter son utilisation au Centre intégré universitaire de santé et de services sociaux de l’Estrie – Centre hospitalier universitaire de Sherbrooke (CIUSSS de l’Estrie-CHUS), installations Fleurimont et Hôtel-Dieu. La gentamicine a été automatiquement remplacée par une dose équivalente de tobramycine pour tous les patients dès l’âge d’un an, sauf lors d’une utilisation synergique pour le traitement des endocardites, de la tularémie et de la brucellose.
Une révision des mécanismes de résistance aux aminosides a été effectuée dans le but d’anticiper les effets potentiels de cette mesure. Cette résistance se produit sous l’action de plusieurs mécanismes, dont la présence d’une résistance intrinsèque. Afin de pénétrer dans la cellule bactérienne, l’aminoside nécessite une chaîne de transport actif d’électrons dépendante de l’oxygène. Ainsi, toutes les bactéries anaérobies strictes seront résistantes aux aminosides. Les pathogènes ayant un métabolisme anaérobie facultatif, tels que les entérocoques, présentent une résistance intrinsèque variable1,2.
Le mécanisme de résistance acquise aux aminosides le plus commun est la modification de la structure chimique de l’antibiotique par des enzymes bactériennes. Le pathogène produit des enzymes qui modifient l’aminoside par adénylation, phosphorylation ou acétylation. Ces modifications entraînent une diminution de l’affinité des aminosides pour leur site de liaison à la sous-unité 30S du ribosome. Ce mécanisme de résistance serait plus fréquent en présence de la tobramycine et la gentamicine que pour les autres aminosides1–6. Plus spécif iquement, un variant du gène aac(6’)-Ib est responsable de la production de l’acétyltransférase, qui engendre une résistance à la tobramycine, à l’amikacine et à la kanamycine. Le variant aac(6’)-Ib-cr (pour ciprofloxacin resistance), capable d’acétyler la norfloxacine et la ciprofloxacine, peut aussi induire une résistance aux aminosides. Ce gène peut être transmis par plasmide et se retrouve dans une variété d’entérobactéries et même dans le Pseudomonas aeruginosa. Il est toutefois beaucoup plus fréquent dans l’Escherichia coli7.
D’autres mécanismes de résistance aux aminosides existent, tels que la modification du site de liaison de l’aminoside. Cette altération est possible par la méthylation de l’ARN 16S, qui entraîne une diminution du contact entre l’aminoside et le site aminoacyl de l’ARN 16S31–3. Une mutation de la protéine S12 de la sous-unité ribosomale 30S est également possible2–5. Finalement, la résistance peut se traduire par la présence de pompes à efflux de la famille RND (Résistance-Nodulation-Division) présentes dans la membrane cytoplasmique des bactéries à Gram négatif2,3. Dans l’ensemble, la similarité des mécanismes de résistance ne laissait pas supposer que la substitution de la gentamicine par la tobramycine entrainerait des différences relatives à la résistance bactérienne.
L’introduction de cette mesure s’appuie également sur les spectres d’activité similaires de la gentamicine et de la tobramycine. Les deux molécules sont actives contre les infections causées par des bactéries aérobies à Gram négatif. Cependant, quelques différences sont notées dans les spectres d’activité respectifs des deux molécules. On recommande la gentamicine pour le traitement de seconde ligne contre le Bartonella sp. et les Campylobacter fetus et jejuni8–10. Pour ce qui est de la gentamicine, elle constitue le premier choix de traitement de la tularémie, mais la tobramycine pourrait également être efficace11. Quant à la tobramycine, elle a montré une activité in vitro deux à quatre fois plus élevée que la gentamicine contre le Pseudomonas aeruginosa12,13. Des données canadiennes de 2017 démontrent une sensibilité du Pseudomonas aeruginosa à la gentamicine de 89,8 % comparativement à 95,2 % à la tobramycine14.
La gentamicine et la tobramycine sont des antibiotiques également connus pour être actifs contre les bactéries à Gram positif en raison de leur effet synergique lorsqu’elles sont combinées aux bêta-lactamines. Les deux molécules peuvent être utilisées en synergie, mais la gentamicine est l’agent synergique de premier choix pour le traitement des endocardites présumées ou confirmées aux Enterococcus spp., à Streptococcus viridans ou bovis en présence de matériel prothétique ou de résistance à la pénicilline, à Bartonella sp., à Staphylococcus sp. en présence de matériel prothétique ou sans pathogène identifié15. Ce choix repose notamment sur une plus grande résistance confirmée des Enterococcus spp. à la tobramycine par une modification enzymatique et possiblement aux autres pathogènes nommés précédemment13. Les lignes directrices de l’Infectious Disease Society of America ne recommandent pas la tobramycine pour ces indications15.
Enfin, les effets indésirables rapportés en présence de la tobramycine et de la gentamicine sont très semblables. Des différences existent cependant entre les molécules concernant les atteintes rénales et auditives. Les aminosides entraînent fréquemment une insuffisance rénale réversible en raison d’un effet toxique direct sur les tubules rénaux, notamment lorsque d’autres facteurs de risque sont présents (dose élevée, durée de traitement prolongée, patients âgés, atteinte rénale préexistante, etc.)16. Certaines études cliniques notent l’apparition plus fréquente de néphrotoxicité sous l’effet de la gentamicine par rapport à la tobramycine, mais les études ayant comparé les deux molécules ne constatent pas toutes cette différence1,17,19–22. L’ototoxicité est un effet indésirable moins commun, mais généralement irréversible. L’atteinte auditive peut être de deux types : soit vestibulaire (4 à 6 %) soit cochléaire (3 à 14 %). L’incidence de cette dernière est plus grande sous l’effet de la gentamicine que de la tobramycine1,23. De ce fait, l’utilisation privilégiée de la tobramycine n’exposait pas les patients à un risque d’effets indésirables supplémentaires.
Avec le retour de la gentamicine à un coût d’acquisition supérieur, nous souhaitions conserver cette mesure de contingence et l’étendre aux autres installations du CIUSSS de l’Estrie – CHUS. Après une période de 24 mois pendant laquelle la tobramycine a remplacé la gentamicine, nous avons voulu vérifier le développement potentiel de résistance bactérienne. Rares sont les études qui rapportent les conséquences d’une pénurie d’un antimicrobien sur la résistance bactérienne dans la littérature scientifique24–25.
Afin d’évaluer les effets de la substitution de la gentamicine par la tobramycine sur la sensibilité d’un groupe d’entérobactéries et du Pseudomonas aeruginosa, nous avons mené une étude de cohorte rétrospective. Nous avons commencé par dresser la liste des infections pour lesquelles la gentamicine et la tobramycine sont utilisées en pratique. Puis nous avons identifié les microorganismes pouvant être la cause de ces infections et avons déterminé les sites de prélèvement pertinents. Seuls les isolats provenant de la patientèle adulte ont été pris en considération.
Tableau I Microorganismes et sites de prélèvements recherchés
Par la suite, nous avons convenu de deux périodes, déterminées par la disponibilité des données sur le logiciel Antimicrobial Prescription Surveillance System (APSSMD)26. Ce logiciel utilisé dans le cadre des activités quotidiennes d’antibiogouvernance permet l’accès à des données continuellement mises à jour sur la sensibilité des bactéries isolées chez les patients hospitalisés aux installations Hôpital Fleurimont et Hôtel-Dieu. Ces données sont anonymisées et ne permettent pas l’identification des patients.
La première période se situe avant la pénurie (du 1er juin 2014 au 31 août 2014) et la deuxième après 24 mois d’utilisation privilégiée de la tobramycine (du 1er juin 2016 au 31 août 2016). Les versions du logiciel APSSMD ayant varié en 2014, l’analyse des données sur une période différente ou sur une plus longue période précédant la pénurie de gentamicine était impossible. Des obstacles à l’exportation des données de sensibilité de 2014 vers le logiciel APSSMD par rapport à la deuxième période à l’étude ont restreint le nombre de souches disponibles pour l’analyse de la première période.
Nous avons ensuite été en mesure d’obtenir les données de sensibilité relatives aux microorganismes identifiés pour des patients âgés de plus de 18 ans à chacun des sites de prélèvement pendant les deux périodes choisies. La comparaison des résultats de chacune des périodes a permis d’obtenir un profil de sensibilité de la gentamicine, de la tobramycine et de la ciprofloxacine avant et après l’instauration des mesures de remplacement de la gentamicine par la tobramycine.
Le logiciel APSSMD a également servi à déterminer les days of therapy (DOT), une mesure de consommation exprimée en nombre de jours individuels/1000 jours hospitalisation, relatifs à la gentamicine, à la tobramycine et aux quinolones durant les deux périodes à l’étude. L’appareil d’identification automatisé Vitek 2MD (Biomérieux, Marcy-L’Étoile, France) a permis de réaliser l’identification bactérienne de même que les antibiogrammes nécessaires. La résistance aux antimicrobiens a été déterminée à l’aide des critères du Clinical and Laboratory Standards Institute (CLSI) de 2014 et de 2016. Les critères établis par le CLSI pour déterminer la sensibilité des pathogènes étudiés n’ont pas varié entre 2014 et 2016, ce qui a permis de comparer les deux périodes à l’étude27,28.
Les données ont été analysées avec Stata 14.2MD pour MAC (StataCorp, College Station, TX, USA). Les proportions ont été comparées à l’aide du test du chi-carré ou du test exact de Fisher, selon la nécessité.
Le nombre d’isolats obtenu pour tous les sites de prélèvements pendant la période 1 (P1) est de 169 comparativement à 287 isolats pendant la période 2 (P2). Le tableau II présente la distribution des isolats de chacun des microorganismes durant les deux périodes. Le nombre d’ isolats par microorganisme de chacune des périodes est inférieur à 30, sauf pour l’Escherichia coli. Le nombre d’isolats testés pour mesurer la sensibilité à la gentamicine et à la tobramycine est identique, puisque le laboratoire des installations Fleurimont et Hôtel-Dieu fournit d’emblée les sensibilités à ces molécules.
Tableau II Évolution de la sensibilité à la gentamicine et à la tobramycine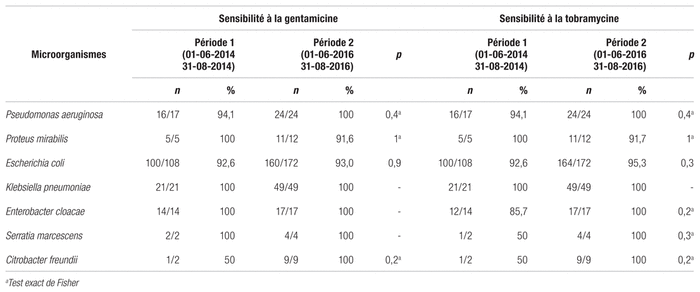
Le tableau II montre l’évolution de la sensibilité à la gentamicine et à la tobramycine entre les deux périodes. Lors de l’analyse par microorganisme, on ne note aucun changement statistiquement significatif de sensibilité à la gentamicine et à la tobramycine entre la P1 et la P2.
Le tableau III montre l’évolution de la sensibilité à la ciprofloxacine entre la P1 et la P2. L’analyse par microorganisme ne révèle aucune différence statistiquement significative de sensibilité à la ciprofloxacine entre les périodes étudiées.
Tableau III Évolution de la sensibilité des microorganismes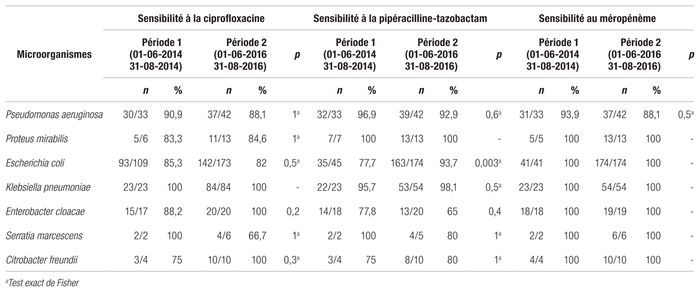
Les données de consommation (DOT) témoignent d’une diminution de la consommation de la gentamicine pendant la P2 comparativement à la P1. Quant à la tobramycine, sa consommation a été supérieure pendant la deuxième période à l’étude. Les données de consommation témoignent également d’une diminution de la consommation des quinolones pendant la P2 comparativement à la P1.
Tableau IV Données de consommation (DOT)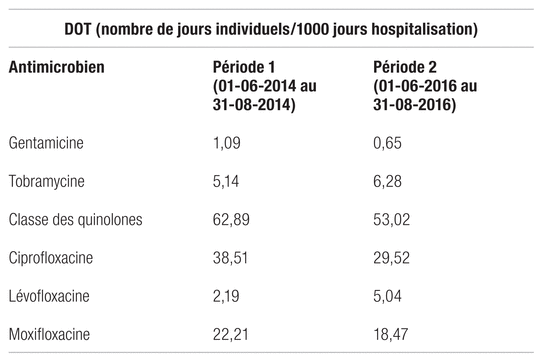
L’analyse par microorganisme ne démontre pas de changement statistiquement significatif de la sensibilité à la gentamicine et à la tobramycine entre les deux périodes. La mesure de substitution automatique ne semble donc pas avoir entraîné d’effets délétères sur les pathogènes étudiés du point de vue de la sensibilité bactérienne.
On observe toutefois une diminution non statistiquement significative de la sensibilité du Proteus mirabilis de 8,4 % (p = 1) entre les deux périodes. Il est à noter que le nombre d’isolats bactériens relatifs au Proteus mirabilis est bien plus faible à la P1 qu’à la P2. De plus, cette diminution de la sensibilité ne peut être liée à la mesure de substitution, car elle se manifeste autant sous l’effet de la gentamicine que de la tobramycine. Enfin, la sensibilité du Proteus mirabilis à la gentamicine, qui était de 91,6 % à la P2, est similaire à celle mentionnée au niveau canadien en 2016, soit 90 %14.
La sensibilité du Pseudomonas aeruginosa à la gentamicine et à la tobramycine est élevée à la P1 (94 %). Ce résultat correspond aux données de sensibilité à la tobramycine collectées en 2011 par le laboratoire de microbiologie de notre centre hospitalier (données internes disponibles sur demande). À cette époque, on notait une sensibilité du Pseudomonas aeruginosa à la tobramycine de plus de 90 %. Malgré cette sensibilité bactérienne élevée à la P1, les données obtenues à la P2 démontrent une augmentation non statistiquement significative de la sensibilité du Pseudomonas aeruginosa de 5,9 % (p = 0,4) à la gentamicine et à la tobramycine. Ce résultat repose toutefois sur un faible nombre d’isolats. Bien que cette tendance à une augmentation de la sensibilité du Pseudomonas aeruginosa à la gentamicine ne se retrouve pas au niveau québécois (sensibilité de 92,8 %) et canadien (sensibilité de 90,4 %) pour l’année 2016, les résultats de la présente étude semblent néanmoins indiquer que la mesure de substitution automatique n’a pas entrainé d’effets indésirables relatifs à la sensibilité du Pseudomonas aeruginosa14.
Tel que nous l’avions prévu, les résultats de DOT concernant la tobramycine démontrent une augmentation de la consommation de 22 % entre les deux périodes. La consommation de tobramycine était toutefois élevée à la P1, avant la rupture d’approvisionnement de la gentamicine ce qui a pu diminuer l’impact de la mesure de substitution sur la sensibilité bactérienne.
Parallèlement, pendant ces deux mêmes périodes, on a noté une diminution de 15,4 % de la consommation des quinolones, dont une diminution de 25 % de la consommation de ciprofloxacine. Cette donnée est intéressante à souligner en raison du gène aac(6’)-Ib-cr, induisant la production de l’acétyltransférase, responsable d’une émergence de résistance à la tobramycine, à l’amikacine et à la kanamycine ainsi qu’à la norfloxacine et à la ciprofloxacine7. Une diminution de la consommation de ciprofloxacine pourrait donc théoriquement diminuer le risque de transmission d’un plasmide responsable d’une corésistance aux fluoroquinolones et aux aminoglycosides. En raison de la transmission de ce plasmide, les entérobactéries résistantes aux fluoroquinolones sont également souvent résistantes aux céphalosporines de troisième génération, aux aminoglycosides et au triméthoprime-sulfaméthoxazole29. Toutefois, on ne remarque pas d’augmentation de la sensibilité à la ciprofloxacine entre les deux périodes à l’étude.
La littérature scientifique ne décrit pas le temps nécessaire aux différents pathogènes pour développer une résistance aux aminosides. Des données récentes ont démontré que la rotation des antibiotiques n’a pas diminué la prévalence des bactéries à Gram négatif résistantes chez les patients admis aux soins intensifs, ce qui correspond aux résultats obtenus dans la présente étude, démontrant des taux de sensibilité semblables entre les deux périodes à l’étude30.
D’autres facteurs peuvent limiter l’interprétation des résultats et moduler leur impact. Dans un premier temps, le nombre d’isolats obtenus pour la P1 est moindre que celui obtenu à la P2. Cette différence est attribuable aux restrictions d’exportation des données de sensibilité de 2014 vers le logiciel APSSMD par rapport à la deuxième période à l’étude. De plus, la majorité des isolats sont issus de prélèvements urinaires. Les aminoglycosides étant des molécules éliminées de façon inchangée dans l’urine, la gentamicine et la tobramycine atteignent de fortes concentrations dans le cortex rénal16. L’extrapolation des données à d’autres sites de prélèvements, tels que les expectorations ou les sécrétions trachéales, est peut-être plus difficile en raison de la pénétration moindre de ces molécules dans les sécrétions bronchiques16.
Enfin, le nombre d’isolats bactériens concernant six des sept microorganismes étudiés étant inférieur à 30, seule une tendance peut être établie lors de l’interprétation des différences de sensibilité. Selon les critères du CLSI, un antibiogramme ne devrait être établi que pour les microorganismes comptant au moins 30 isolats27,28. Ainsi, en raison de ce manque de puissance de notre étude, on ne peut exclure qu’il existe des changements réels de sensibilité aux antimicrobiens. Enfin, le choix de la période à l’étude a certainement influencé le nombre d’isolats étudiés et il aurait certainement été supérieur en saison hivernale.
La substitution de la gentamicine par la tobramycine sur une période de 24 mois ne semble pas associée à une émergence de résistance des pathogènes sélectionnés. Les indications pour lesquelles on privilégie la gentamicine se justifient et les données sur le profil d’innocuité de la tobramycine sont rassurantes. Ainsi, il semble sûr d’utiliser de préférence la tobramycine pour limiter les coûts engendrés par une utilisation à grande échelle de la gentamicine. Il faudrait entreprendre une réévaluation de l’utilisation de la gentamicine pour les enfants de même que pour le traitement du Campylobacter fetus et jejuni. Une étude semblable qui serait répétée dans 12 mois permettrait de suivre l’évolution des sensibilités à la suite du maintien de cette mesure.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Les auteurs tiennent à remercier Mélanie Lafrance, coordonnatrice technique du laboratoire de microbiologie au Centre intégré de santé et de services sociaux de l’Estrie – Centre hospitalier universitaire de Sherbrooke pour sa précieuse collaboration. Une autorisation écrite a été obtenue de cette personne.
1. Mandell G, Bennett J, Dolin R. Mandell, Douglas and Bennett’s principles and practice of infectious diseases. 7e éd. Philadelphia : Churchill livingstone Elsevier;2010. 4028 p.
2. Jana S, Deb K. Molecular understanding of aminoglycoside action and resistance. Appl Microbiol Biotechnol 2006;70:140–50.
3. Shakil S, Khan R, Zarrilli R, Khan A. Aminoglycosides versus bacteria – a description of the action, resistance mechanism, and nosocomial background. J Biomed Sci 2008;15:5–14.
4. Davies J, Wright G. Bacterial resistance to aminoglycoside antibiotics. Trends Microbiol 1997;5:234–40.
5. Katzung G, Trevor A. Basic and clinical pharmacology. 13e éd. McGraw-Hill Education;2015. 1216 p.
6. Kasper D, Fauci A, Hauser S, Longo D, Jameson J, Loscalzo J. Harrison’s principles of internal medicine. 19e éd. McGraw-Hill Education;2015. 3000 p.
7. Jacoby GA, Strahilevitz J, Hooper DC. Plasmid-mediated quinolone resistance. Microbiol Spectr 2014;2:1–24.
8. Rolain JM, Brouqui P, Koehler JE, Maguina C, Dolan MJ, Raoult D. Recommendations for treatment of human infections caused by Bartonella species. Antimicrob Agents Chemother 2004;48:1921–33.

9. Vanhoof R, Gordts B, Dierickx R, Coignau H, Butzler JP. Bacterostatic and bactericidal activities of 24 antimicrobial agents against Campylobacter fetus subsp. jejuni. Antimicrob Agents and Chemother 1980;18:118–21.
10. Shane AL, Mody RK, Crump JA, Tarr PI, Steiner TS, Kotloff K. 2017 Infectious Diseases Society of America clinical practice guidelines for the diagnosis and management of infectious diarrhea. Clin Infect Dis 2017;65:e45–80.

11. Caspar Y, Maurin M. Francisella tularensis susceptibility to antibiotics: a comprehensive review of the data obtained in vitro and in animal models. Front Cell Infect Microbiol 2017;7:1–18.
12. Carroll K, Hobden J, Miller S, Morse S, Mietzner T, Detrick Betcoll. Jawetz, Melnick and Adelberg’s medical microbiology. 27e éd. McGraw-Hill Education;2013. 877 p.
13. Moellering R. In vitro antibacterial activity of the aminoglycosides antibiotics. Rev Infect Dis 1983; 5(suppl.2):S212–32.
14. CARA. Canadian antimicrobial resistance alliance. [en ligne] http://www.can-r.com (site visité le 12 septembre 2019).
15. Infectious Disease Society of America. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications (AHA) 2015. [en ligne] http://www.idsociety.org/uploadedFiles/IDSA/Guidelines-Patient_Care/IDSA_Practice_Guidelines/Fever_and_Infections/AHA%20Infective%20Endo.pdf (site visité le 8 février 2017).
16. Sandoz. Monographie de la tobramycine. Boucherville, Québec. Octobre 2011.
17. Schentag JJ, Plaut ME, Cerra FB. Comparative nephrotoxicity of gentamicin and tobramycin, pharmacokinetic and clinical studies in 201 patients. Antimicrob Agents Chemother 1981; 19:859–66.

18. Kumin GD: Clinical nephrotoxicity of tobramycin and gentamicin: a prospective study. JAMA 1980;244:1808–10.
19. Smith DR, Lipsky JL, Laskin OL, Hellmann DB, Mellits ED, Longstreth J et coll. Double-blind comparison of the nephrotoxicity and auditory toxicity of gentamicin and tobramycin. N Engl J Med 1980;302:1106–9.
20. Kahlmeter G, Dahlager JI. Aminoglycoside toxicity – a review of clinical studies published between 1975 and 1982. J Ant imicrob Chemother 1984;13:9–22.
21. Pancorbo S, Compty C, Heissler J. Comparison of gentamicin and tobramycin nephrotoxicity in patients receiving individualized pharmacokinetic dosing regimens. Biopharm Drug Dispos 1982;3:83–8.
22. Hailemeskel B, Namanny M, Wutoh A. Frequency of nephrotoxicity with vancomycin and aminoglycoside antibiotic therapy. Hosp Pharm 1999; 34:1417–20.
23. Fee WE. Gentamicin and tobramycin: comparison of ototoxicity. Rev Infect Dis 1983; (suppl.5): S304–13.
24. Mendez MN, Gibbs L, Jacobs RA, McCulloch CE, Winston L, Guglielmo BJ. Impact of a piperacillin-tazobactam shortage on antimicrobial prescribing and the rate of vancomycin-resistant enterococci and Clostridium difficile infections. Pharmacotherapy 2006;26:61–7.
25. Plüss-Suard C, Pannatier A, Ruffieux C, Kronenberg A, Mühlemann K, Zanetti G. Changes in the use of broad-spectrum antibiotics after cefepime shortage: a time series analysis. Antimicrob Agents Chemother 2012;56: 989–94.

26. Beaudoin M, Kabanza F, Nault V, Valiquette L. Evaluation of a machine learning capability for a clinical decision support system to enhance antimicrobial stewardship programs. Artif Intell Med 2016;68:29–36.
27. Clinical and Laboratory Standards Institute (CLSI) (2014) Performance Standards for Antimicrobial Susceptibility Testing; Twenty-Fourth Informational Supplement. CLSI Document M100-S24, Wayne, PA.
28. Clinical and Laboratory Standards Institute (CLSI) (2016): Performance standards for antimicrobial susceptibility testing; Twenty-sixth informational supplement. CLSI document M100-S26. Wayne, PA.
29. Karlowsky JA, Jones ME, Thornsberry C, Friedland IR, Sahm DF. Trends in antimicrobial susceptibilities among Entrobacteriaceae isolated from hospitalized patients in the United States from 1998 to 2001. Antimicrob Agents Chemother 2003;47:1672–80.

30. Van Duïjn PJ, Verbrugghe W, Jorens PG, Spöhr F, Schedler D, Deja Metcoll. The effects of antibiotic cycling and mixing on antibiotic resistance in intensive care units: a cluster-randomised crossover trial. Lancet Infect Dis 2018;18:401–9.
PHARMACTUEL, Vol. 53, No. 1, 2020