Isabelle St-Jean1, M.Sc., Christyan Bonilla Bautista2,3, Pharm.D., Georges Étienne Rivard4, MD, Jean-Marc Forest5, B.Pharm., DPH, M.Sc., Grégoire Leclair6, B.Pharm., Ph.D.
Reçu le 20 novembre 2018: Accepté après révision par les pairs le 18 janvier 2019
Résumé
Objectif : Il existe quatre préparations magistrales d’acide tranexamique, dont trois avec ce seul ingrédient et une combinée à la thrombine alpha pour le traitement oral, nasal et topique de saignements superficiels, comme l’épistaxis. L’évaluation de ces formulations a porté sur leur stabilité ainsi que leur utilisation.
Méthode : Trois des quatre préparations sont des hydrogels contenant de l’acide tranexamique en combinaison ou non avec la thrombine alpha et la quatrième est une suspension d’acide tranexamique. L’évaluation de la stabilité des formulations porta sur 90 jours. Les investigateurs ont mesuré la concentration en acide tranexamique et évalué l’activité de la thrombine alpha en fonction du temps de thrombine. Ils ont également réalisé une revue d’utilisation de ces préparations au Centre hospitalier universitaire Sainte-Justine.
Résultats : Les préparations d’acide tranexamique seul sont demeurées stables pendant au moins 90 jours entreposées à 22 °C. La préparation contenant la thrombine alpha est demeurée stable sept jours à 22 °C et 90 jours à 5 °C ainsi qu’à −20 °C. La revue d’utilisation a révélé une préférence à l’utilisation de la suspension par voie orale quand les comprimés d’acide tranexamique ne peuvent donner la dose requise pour contrôler les saignements superficiels ou encore lors de problèmes de déglutition. Les hydrogels se sont montrés efficaces dans 91 % des dossiers étudiés.
Conclusion : Les formulations topiques ont été efficaces dans la majorité des traitements des saignements, dont l’épistaxis. De plus, la stabilité des formulations permet leur préparation et leur entreposage pour une utilisation au besoin.
Mots clés : Acide tranexamique, épistaxis, hématologie, préparation magistrale, thrombine alpha
Abstract
Objective : There are four compounded preparations of tranexamic acid, three with this ingredient alone and one with this ingredient in combination with alpha-thrombin, for the oral, nasal or topical treatment of superficial bleeding, such as epistaxis. These formulations were evaluated with regard to their stability and use.
Method : Three of the four preparations are hydrogels containing tranexamic acid with or without alpha-thrombin, the fourth being a tranexamic acid suspension. The stability of these formulations was evaluated over a 90-day period. The investigators measured the tranexamic acid concentration and evaluated alpha-thrombin activity as a function of the thrombin time. They also conducted a utilization review of these preparations at the Centre hospitalier universitaire Sainte-Justine.
Results : The preparations containing tranexamic acid alone remained stable for at least 90 days when stored at 22 °C. The preparation containing alpha-thrombin remained stable for 7 days at 22 °C and for 90 days both at 5 °C and −20 °C. The utilization review revealed a preference for using the oral suspension when tranexamic acid tablets cannot provide the dose required to control superficial bleeding or in patients with swallowing problems. The hydrogels were found to have been effective in 91 % of the charts examined.
Conclusion : The topical formulations were effective in most of the instances of treating bleeding, including epistaxis. Furthermore, the stability of the formulations permits their preparation and storage for as-needed use.
Keywords : Alpha-thrombin, compounded preparation, epistaxis, hematology, tranexamic acid
L’absence de formulation topique rend difficile l’utilisation de l’acide tranexamique par voie externe. C’est pourquoi quatre formulations magistrales ont été développées, dont trois avec un seul ingrédient et une combinée à la thrombine alpha, dans le but d’avoir à disposition un traitement simple et rapide pour la prise en charge primaire de l’épistaxis et d’autres types de saignements superficiels. La stabilité de ces préparations magistrales ont en outre fait l’objet d’une évaluation et d’une revue de leur utilisation au sein du Centre hospitalier universitaire (CHU) Sainte-Justine.
L’épistaxis désigne une hémorragie qui s’écoule par la cavité nasale, une affection commune dans la population générale. Ce saignement peut être causé par de nombreuses conditions pathologiques sous-jacentes et par des facteurs autant chimiques que physiques1. La majorité des épistaxis sont bénignes et n’entrainent pas de grandes pertes de sang. Toutefois, les personnes souffrant de troubles de la coagulation peuvent connaître des épisodes de saignements abondants, persistants et récurrents, qui causent du stress et des désagréments en plus des risques de pertes de sang cliniquement significatives2. Les traitements existants, soit la cautérisation, le tamponnement, la ligature ou l’embolisation impliquent une intervention chirurgicale mineure1,2. Les préparations à base d’acide tranexamique avec ou sans thrombine alpha, développées dans cette étude, sont utilisées comme options de traitement de l’épistaxis et d’autres saignements superficiels.
La thrombine alpha est une protéine de 33 à 36 kDa, identique à la thrombine humaine, qui agit entre autres dans la cascade de coagulation pour transformer le fibrinogène soluble en brins de fibrine insolubles, ce qui engendre la formation du caillot sanguin3. Ce mécanisme régit le rôle de la thrombine alpha, qui est de produire la coagulation. D’autre part, l’acide tranexamique est un antifibrinolytique analogue de la lysine, qui agit en inhibant de façon compétitive la liaison du plasminogène et de la plasmine aux sites lysine du fibrinogène/fibrine. Il favorise donc le maintien du caillot de coagulation en empêchant la dégradation du brin de fibrine insoluble4. Ces deux agents thérapeutiques ont donc un effet synergique qui favorise l’hémostase, d’une part en activant la coagulation et, d’autre part, en la stabilisant.
Trois préparations magistrales ont été développées à partir de l’acide tranexamique utilisé seul comme principe actif et une en combinaison avec la thrombine alpha. La première préparation consiste en un gel topique d’acide tranexamique (1 %) et de thrombine alpha (120 UI/g) dans la gelée KYMD. La deuxième et la troisième préparation sont des gels topiques d’acide tranexamique (1 %) dans la gelée KYMD et dans l’IntrasiteMD. Puis la dernière préparation est une suspension d’acide tranexamique (100 mg/mL) dans le sirop simple pour une administration orale ou un usage comme rince-bouche.
Le gel d’acide tranexamique (1 %) et de thrombine alpha (120 UI/g) dans le KYMD est formulé à partir de 5 mL d’une solution injectable d’acide tranexamique (CyklokapronMD, 100 mg/mL, Pfizer, Lot : Z01311) et de 5 mL d’une solution de thrombine alpha reconstituée (RecothromMD, 1200 UI/mL, Bayer, Lot : ZAC1110). Ces deux solutions sont mélangées dans un mortier, et la gelée KYMD (K-Y Canada, Lot : 055ZC) y est ajoutée par dilution géométrique jusqu’à l’atteinte d’une masse totale de 50 grammes. Le gel d’acide tranexamique (1 %) dans le KYMD est formulé de la même façon sans ajout de la thrombine alpha. Et le dernier gel d’acide tranexamique (1 %) est formulé à partir d’un comprimé d’acide tranexamique (CyklokapronMD, 500 mg, Pfizer, Lot : P192A) broyé auquel on ajoute de la gelée IntrasiteMD (Smith and Nephew Canada, Lot : 123422) par dilution géométrique jusqu’à l’atteinte d’une masse de 50 grammes. Ces gels ainsi formulés sont reconditionnés en seringues orales de 3 mL à raison de 1 mL par seringue. Enfin, la suspension (100 mg/mL) est formulée à partir de 20 comprimés d’acide tranexamique (Cyklokapron 500 mg) broyés et de sirop simple (88 % USP, Galenova, Lot : 11EL), pour atteindre un volume final de 100 mL. Toutes les formulations ont été préparées en triplicata pour l’étude de stabilité.
Les échantillons de gel d’acide tranexamique combiné à la thrombine alpha dans le KYMD sont conservés à trois températures différentes, soit 22 ± 2 °C, 5 ± 2 °C, et −20 ± 2 °C. Les échantillons à 22 °C seront évalués pendant 60 jours et ceux à 5 °C et à −20 °C, pendant 90 jours. Les échantillons des différentes préparations de gel d’acide tranexamique seul dans le KYMD ou l’IntrasiteMD et la suspension d’acide tranexamique sont conservés à 22 ± 2 °C pendant 90 jours. Tous les échantillons sont conservés à l’abri de la lumière.
La thrombine alpha est une protéine nécessitant une certaine conformation pour exercer son activité5. Pour cette raison, un test bioanalytique fonctionnel a servi à mesurer l’activité de la thrombine alpha. Ce test, nommé temps de thrombine, consiste à mesurer le temps de coagulation du plasma après l’ajout de thrombine et est effectué à l’aide d’un analyseur de coagulation (Diagnostica Stago STart 4 Hemostasis Analyzer, Toronto, ON, Canada).
À chaque temps prévu d’analyse, les échantillons de gel contenant de la thrombine alpha (1 mL) sont dilués dans un tampon phosphate 0,1 M, pH 7,4 (24 mL) pour obtenir une concentration théorique de 5,28 UI/mL. Un contrôle négatif de gel d’acide tranexamique sans thrombine alpha a eu lieu au moyen de ce même processus de dilution. Ces solutions ainsi formées sont utilisées comme réactif dans le test de temps de thrombine. Lors du test, 100 μL de cette solution est ajouté à 100 μL de plasma normal (CryocheckMD, Precision Biologic, Darmouth, NC, Canada) à 37 °C, et l’appareil mesure le temps de coagulation. Chaque échantillon est analysé en triplicata.
Les temps de thrombine obtenus par ce test d’activité sont rapportés sur la courbe de calibration pour déterminer la concentration active associée avec le temps mesuré. La courbe de calibration est préparée avec la thrombine alpha (RecothromMD 1200 UI/mL) fraichement reconstituée, diluée dans le tampon phosphate enrichi d’acide tranexamique et de gelée KYMD, à des concentrations entre 3,6 et 7,2 UI/mL (r2 = 0,997). Les résultats de l’activité de la thrombine alpha sont rapportés en pourcentage par rapport au temps zéro, associés à leur intervalle de confiance à 95 %. Le seuil de stabilité est déterminé par une rétention d’au moins 90 % de la concentration initiale.
La stabilité de l’acide tranexamique dans les préparations magistrales est évaluée par une analyse quantitative par chromatographie liquide couplée au spectromètre de masse en tandem (LC-MS/MS). L’instrument comportait un HPLC (Agilent 1260 series, Agilent technologies USA) couplé à un spectromètre de masse (G6410B triple quadrupole, Agilent technologies USA) en mode positif et avec ionisation par électronébuliseur (ESI) une colonne de chromatographie liquide à interaction hydrophile (HILIC) BETASILMD silica (taille de particules : 5 μm; 50 × 3,0 mm I.D, Thermo Scientific). La phase mobile était composée d’eau ultra pure (Milli-Q ultrapure water system de Millipore, Bedford, MA, États-Unis) avec 5 mM d’ammonium formate et 0,1 % d’acide formique (A) et d’acétonitrile et 0,1 % d’acide formique (B) à un débit de 0,7 mL/min. La durée totale de l’analyse était de 4,5 minutes par échantillon, le tout en mode gradient avec, au départ, 95 % B, diminuant graduellement à 40 % B en 3,5 minutes, puis un retour à 95 % B en 0,5 minute. Le temps de rétention de l’acide tranexamique est de 3,1 minutes et celui de la carnitine (standard interne) est de 3,7 minutes. Le mode MRM (Multiple Reaction Monitoring) a servi à sélectionner les paires d’ions parents et d’ions produits : pour l’acide tranexamique m/z 158,2 → 95,1 (14 V) et pour la carnitine (standard interne) m/z 162,6 → 103 (18 V).
En préparation de l’analyse par LC-MS/MS, les gels et la suspension (1 mL) sont dilués avec de l’eau ultra pure (100 mL). De cette solution, 50 μL sont dilués avec un mélange d’acétonitrile et d’eau (75 %/25 %, 450 μL) ainsi que de la solution de standard interne (carnitine, 1 μg/mL, 500 μL) pour une concentration théorique finale de 5 μg/mL. Neuf standards d’acide tranexamique pour la courbe de calibration et quatre contrôles de la qualité ont été préparés de la même façon pour couvrir les concentrations attendues des échantillons (2 à 10 μg/mL, r2 = 0,995). La stabilité de l’acide tranexamique dans les différents gels et dans la suspension est déterminée par le calcul du pourcentage de la concentration initiale restante à chaque temps d’analyse et son intervalle de confiance à 95 %. Le seuil de stabilité est déterminé par une rétention d’au moins 90 % de la concentration initiale.
À la suite du développement et de l’évaluation de la stabilité de ces formulations, ces préparations sont utilisées au sein du CHU Sainte-Justine. L’utilisation de ces formulations a été évaluée de façon rétrospective entre le premier janvier 2013 et le 4 avril 2017. Ce processus a été approuvé par la direction des services professionnels et du comité d’éthique de la recherche du CHU Sainte-Justine. La thrombine n’étant plus offerte commercialement à la fin de cette période, la revue d’utilisation a couvert seulement l’acide tranexamique. Ces informations pertinentes ont été recueillies dans les dossiers des patients : les dates de la prescription originale, l’âge du patient, le poids, les indications, les doses administrées, la durée de traitement et la tolérance au médicament ainsi que les différentes formulations prescrites lors de la même hospitalisation. La liste des patients ayant reçu de l’acide tranexamique durant la période étudiée a été établie par le logiciel GesPharX8MD (CGSI@SOLUTIONS-TI INC., Québec, QC, Canada) du Département de pharmacie. Par la suite, le logiciel ChartMaxxMD (Quest Diagnostics, Secaucus, NJ, États-Unis) a permis de visualiser les dossiers informatiques des patients et de rechercher les informations pertinentes pour l’étude. Notons que la durée moyenne d’utilisation a été déterminée par la moyenne des périodes d’utilisation prescrites. Il ne s’agit pas de la durée du saignement, mais bien de la période pendant laquelle le médicament était offert et qu’un risque de saignement était encore possible.
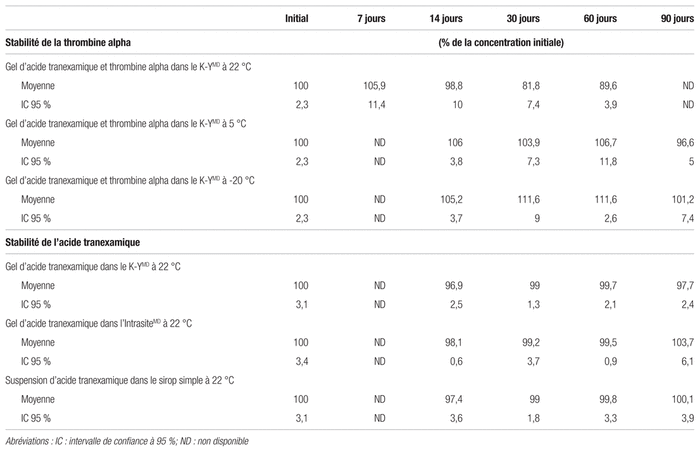
L’activité de la thrombine alpha des préparations entreposées à 22 °C est demeurée stable pendant un maximum de sept jours, puisque l’intervalle de confiance le plus bas après 14 jours d’entreposage dépassait la limite de 90 % de concentration active initiale (voir le tableau I). L’activité de la thrombine alpha des préparations entreposées à 5 °C ainsi qu’à −20 °C, a été conservée pendant toute la durée de l’étude, soit 90 jours. De plus, l’observation humaine n’a constaté aucun changement organoleptique de cet hydrogel lors de l’étude.
Tableau I Stabilité de la thrombine alpha et de l’acide tranexamique dans les préparations magistrales
L’acide tranexamique est demeuré stable pendant toute la durée de l’étude, soit 90 jours, dans les préparations d’hydrogel à 1 % dans le KYMD et dans l’IntrasiteMD ainsi que pour la suspension à 100 mg/mL dans le sirop simple, entreposé à 22 °C (voir tableau I). La limite la plus basse de l’intervalle de confiance à 95 % était toujours supérieure à 90 % de la concentration initiale. Après 90 jours, les pourcentages de concentration initiale de l’hydrogel dans le KYMD, dans l’IntrasiteMD et dans la suspension étaient respectivement de 97,7 % [95,3–100,1], 103,7 % [97,6–109,9] et 100,1 % [96,2–104]. Un test de stabilité de l’acide tranexamique dans la formulation en combinaison avec la thrombine alpha a été effectué sur cinq échantillons après 570 jours d’entreposage à 5 °C, dans le but d’évaluer l’effet possible de l’interaction entre les deux composantes. Ces échantillons ont démontré un pourcentage de concentration nominale d’acide tranexamique de 98,5 % [94,9–102]. De plus, aucun changement organoleptique des préparations n’a été observé.
Parmi toutes les prescriptions d’acide tranexamique répertoriées au CHU Sainte-Justine à l’aide du logiciel GesPharxMD et dans l’intervalle de temps étudié, les formulations magistrales en constituent 28 % (tableau II). L’analyse des dossiers démontre qu’on tend à privilégier l’administration de la formulation orale dans les cas où le patient doit subir une procédure chirurgicale où les risques de saignements sont élevés et qu’il présente une déficience héréditaire en facteur de coagulation. Pendant la période étudiée, il y a eu 186 ordonnances de préparations magistrales orales. Sur ce nombre, 101 ordonnances (54 %) ne pouvaient pas être exécutées autrement que par formule magistrale, car il était impossible d’obtenir la dose prescrite au moyen des comprimés de 500 mg d’acide tranexamique. Les 20 dossiers analysés ont démontré que, dans 30 % des cas, la solution orale magistrale à 100 mg/mL a nécessité son remplacement par une autre forme pharmaceutique en raison de l’échec du traitement qui s’est traduit par la persistance du saignement. Dans un seul cas, des crampes intestinales ont imposé une diminution de dose, ce qui démontre une bonne tolérance générale à la formulation magistrale orale.
Tableau II Répartition des prescriptions des différentes formulations d’acide tranexamique du 1er janvier 2013 au 3 avril 2017
Les observations ont montré que les formulations à usage topique servent surtout aux épistaxis, aux saignements de gencives ou aux saignements cutanés. Parmi les 101 patients ayant reçu une prescription d’acide tranexamique topique, 31 ordonnances mentionnaient des formulations magistrales à usage topique. Dans 91 % des cas, le traitement avec une préparation magistrale en gel a été efficace et a duré en moyenne 1,6 jour, comme l’illustre le tableau III. Notons que la première colonne de ce tableau indique le nombre de prescriptions exécutées, dont les informations paraissaient dans les dossiers des patients. En revanche, un grand nombre de dossiers comportait des prescriptions d’acide tranexamique, mais sans notes explicatives. Il n’a donc pas été possible de déterminer si le médicament prescrit avait été administré et s’il avait été efficace.
Tableau III Usage des formulations topiques d’acide tranexamique en hydrogel ou en solution injectable sur compresse
Dans un seul cas, une note précisait que le gel n’était pas parvenu à stopper le saignement et que l’administration d’une dose par voie orale avait été nécessaire. Dans deux autres situations, une administration par voie orale pour l’une et par voie intraveineuse pour l’autre avait été prescrite en même temps que le gel. Mais l’efficacité du gel a rendu caduques les deux autres formes d’administration.
La revue d’utilisation du médicament a révélé une autre procédure à base d’acide tranexamique utilisée au préalable et toujours en usage au CHU Sainte-Justine. Cette manœuvre consiste simplement en l’application d’une compresse de solution injectable d’acide tranexamique. Cette procédure a été répertoriée dans 65 % des cas de saignement externe et a permis l’arrêt des saignements dans 90 % des cas. Dans deux situations, l’efficacité de cette procédure n’était pas optimale. Elles ont nécessité le remplacement des compresses de solution injectable par des comprimés d’acide tranexamique.
La stabilité des préparations contenant la thrombine alpha obtenue à la température ambiante surpasse les attentes, qui étaient d’à peine quelques jours. Il était anticipé que la thrombine se dégraderait rapidement à la température de la pièce, puisque dans la monographie du RecothromMD, il est indiqué qu’une fois reconstituée, elle demeure stable 24 heures à cette température3. La thrombine étant une protéase, elle est en mesure de cliver différentes protéines et également de se cliver elle-même. Ce processus d’auto-clivage limite donc sa stabilité. De plus, cette activité protéolytique peut varier en fonction de la température. À la température corporelle (37 °C), elle possède une activité maximale, qui diminue avec l’abaissement de la température6. Ceci explique pourquoi est obtenue une plus grande stabilité de la thrombine sous réfrigération ou congélation. Par contre, à la température ambiante et amalgamée dans le gel, cette protéase est demeurée stable particulièrement longtemps. Il est possible que le gel puisse augmenter la stabilité de la thrombine. Des observations ont montré que plusieurs additifs (sels, surfactants, tampon, etc.) pouvaient stabiliser la conformation de la thrombine en diminuant sa capacité d’auto-clivage7. Parmi ces additifs, les polyols ajoutés à la formulation pouvaient particulièrement la stabiliser7. Il est donc possible que la présence de glycérol, qui est un polyol, dans la gelée KYMD participe à cette stabilité. De plus, la forte viscosité que procure l’hydroxyéthylcellulose à la gelée KYMD pourrait empêcher la proximité des protéines en se plaçant à leur pourtour, ce qui contrerait leur clivage. Ces éléments pourraient expliquer en partie pourquoi est obtenu une si bonne stabilité de la solution à la température de la pièce, ce qui facilite grandement l’entreposage et le transport des gels. Les utilisateurs pourront ainsi les conserver au réfrigérateur ou les laisser à la température de la pièce pendant quelques jours selon les besoins. Les épisodes d’épistaxis étant souvent imprévus, cette facilité de conservation représente un avantage non négligeable.
De son côté, l’acide tranexamique est une molécule très stable. La FDA Center for Drug Evaluation and Research a mené des études de dégradation forcée dans des conditions acides, alcalines, à une température élevée (67 °C) et à l’exposition à la lumière, qui n’ont démontré aucune dégradation du composé8. Ces études ont été répétées dans le cadre du présent travail et arrivent aux mêmes conclusions. C’est pourquoi il n’est pas étonnant d’avoir constaté une stabilité d’au moins 90 jours de toutes les formulations d’acide tranexamique et même une stabilité de 570 jours des formulations avec une combinaison de thrombine alpha.
La revue d’utilisation du médicament porte exclusivement sur les préparations d’acide tranexamique, puisque la production de la thrombine alpha a été interrompue dans l’année qui a suivi le développement des préparations magistrales. Seules quelques utilisations sporadiques ont pu être relevées dans les dossiers. Toutefois, une préparation contenant de la thrombine alpha serait peut-être encore plus efficace que l’acide tranexamique seul si le produit était à nouveau disponible. Si tel devait être le cas, il serait également intéressant d’évaluer son utilisation. Pour ce qui est des préparations d’acide tranexamique seul, la revue d’utilisation a révélé que le recours à la suspension est plus fréquent pour l’administration d’une dose non fractionnable en comprimés ou pour faciliter la prise du médicament par les patients présentant des troubles de la déglutition.
Quant aux formulations topiques sous forme d’hydrogel, elles se sont révélées efficaces surtout pour contrôler les saignements superficiels. Par ailleurs, cette étude démontre qu’il n’y a pas de réelle différence d’efficacité ou de tolérance entre les deux formulations topiques d’acide tranexamique, soit l’injectable sur compresse encore utilisée au sein du CHU Sainte-Justine et les gels. Il est important de mentionner que la simple compression physique peut également contribuer à l’arrêt du saignement et que ce facteur pourrait jouer un rôle dans le contrôle du saignement lors de l’application de la solution injectable sur compresse. De plus, la bonne viscosité des hydrogels rend leur application topique simple et pratique pour des saignements localisés, comme dans la cavité nasale ou sur les hémorroïdes.
Les raisons pour lesquelles deux gelées différentes ainsi que la solution injectable et les comprimés ont été utilisés dans les préparations magistrales sont les suivantes. D’abord, la gelée KYMD a été choisie pour son pouvoir lubrifiant qui, à lui seul, aide à prévenir les épisodes d’épistaxis causés par la sécheresse nasale. La combinaison de ces agents thérapeutiques avec cette gelée est donc optimale pour la prise en charge de l’épistaxis. Ensuite, comme la RAMQ rembourse la gelée IntrasiteMD mais non le KYMD, la première fut utilisée pour que les préparations magistrales puissent être formulées en pharmacie communautaire9.
Quatre formulations pour usage topique ou oral ont été développées, soit un hydrogel d’acide tranexamique (1 %) et de thrombine alpha (120 UI/g) dans le KYMD, un hydrogel d’acide tranexamique (1 %) dans le KYMD et un autre dans l’IntrasiteMD puis une suspension d’acide tranexamique (100 mg/mL). Les formulations d’acide tranexamique seul se sont révélées stables pendant 90 jours lorsqu’elles étaient entreposées à la température ambiante, et la formulation contenant la thrombine alpha s’est montrée tout aussi stable si elle était entreposée au réfrigérateur ou au congélateur. Les formulations topiques d’acide tranexamique ont été efficaces dans la majorité des cas de prise en charge primaire des saignements, dont l’épistaxis. Toutefois, la petite taille de l’échantillon examiné lors de la revue d’utilisation et la faible quantité d’information clinique disponible dans les dossiers des patients ne permettent pas de démontrer l’efficacité comparative de ces préparations, mais elles permettent tout au plus de souligner les possibilités d’utilisation de ces différentes formulations de l’acide tranexamique. De plus, la stabilité des formulations permet leur préparation et leur entreposage pour une utilisation au besoin. De nombreux autres travaux sur le sujet devrait être réalisés pour faire progresser nos connaissances sur ces questions.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs. Les produits utilisés ont été généreusement fournis par le Département de pharmacie du CHU Sainte-Justine.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Szeto C, Tewfik YN, Tewfik TL. L’épistaxis : un signe à ne pas négliger. Le clinicien. [en ligne] http://www.stacommunications.com/journals/pdfs/clinicien/cliniciennov2003/drtewfikepistaxis.pdf (site visité le 10 novembre 2018).
2. Pope LER, Hobbs CGL. Epistaxis: an update on current management. Postgrad Med J 2005;81:309–14.

3. Bayer Inc. Monographie de la thrombine alpha recombinante (RecothromMD). Toronto, Ontario. Décembre 2009.
4. Pfizer inc. Monographie de l’acide tranexamique (CyklokapronMD). Kirkland, Québec. Juin 2013.
5. Gasper PM, Fuglestad B, Komives EA, Markwick PRL, McCammon JA. Allosteric networks in thrombin distinguish procoagulant vs. anti-coagulant activities. Proc Natl Acad Sci U.S.A. 2012;109:21216–22.
6. Wolberg AS, Meng ZH, Monroe DM 3rd, Hoffman M. A systematic evaluation of the effect of temperature on coagulation enzyme activity and platelet function. J Trauma 2004;56:1221–8.
7. Kolodzeiskaia MV, Volkov GL. Interrelation between thrombin structure and its stability. Ukr Biokhim Zh 2003;75:17–27.
8. Food and Drug Administration. Center for drug evaluation and research. Environmental assessment; application number 22–430. [en ligne] www.accessdata.fda.gov/drugsatfda_docs/nda/2009/022430s000ea.pdf (site visité le 12 novembre 2018).
9. Régie de l’assurance maladie du Québec. Liste des médicaments, mise à jour du 7 mars 2019. [en ligne] http://www.ramq.gouv.qc.ca/SiteCollectionDocuments/liste_med/2019/liste_med_2019_03_07_fr.pdf (site visité le 8 mars 2019).
PHARMACTUEL, Vol. 52, No. 2, 2019