Mélina Bellemare1,2, Pierre-André Dubé3,4, B.Pharm., Pharm.D., M.Sc., DESS, C.Clin.Tox., FOPQ, Louise Mallet5,6, B.Sc.Pharm., Pharm.D., BCGP, FESCP, FOPQ, DHC
Reçu le 11 février 2019: Accepté après révision le 27 mai 2019
Alors qu’en 2002 les Canadiens d’âge égal ou supérieur à 65 ans représentaient 0,2 % des personnes ayant consommé du cannabis au cours de l’année précédente, ce chiffre s’élève à 0,8 % en 2012 et à 1,6 % en 20151,2. En 2018, dans le cadre de l’Enquête nationale sur le cannabis de Santé Canada, visant à évaluer la consommation du cannabis dans les trois mois précédents, les personnes de cette tranche d’âge représentaient 4 % des consommateurs, tandis que la proportion des gens de 15 à 24 ans et de 25 à 34 ans s’élevait respectivement à 23 % et 26 %, celle des tranches d’âge de 35 à 44 ans à 16 %, de 45 à 54 ans à 8 % et de 55 à 64 ans à 9 %3. Malgré cette hausse de la prévalence dans la tranche d’âge des personnes de plus de 65 ans, on note une tendance générale à la baisse de la consommation de cannabis au fur et à mesure qu’elles avancent en âge3.
Un certain nombre de personnes âgées d’aujourd’hui, définies dans cet article comme ayant 65 ans et au-delà, avaient déjà consommé du cannabis dans le passé. En effet, en 1969, les Canadiens de 15 à 24 ans représentaient jusqu’à 44 % des consommateurs de cannabis4. Ainsi, les personnes dont l’âge actuel est égal ou supérieur à 65 ans ont été exposées au cannabis lorsqu’elles étaient étudiantes au niveau secondaire ou à l’université4. Notons aussi qu’en ce temps-là, la teneur moyenne du cannabis en delta-9-tétrahydrocannabinol (THC), qui est la principale substance psychoactive du cannabis, était bien moindre qu’aujourd’hui, soit moins de 1 % en 1960 alors qu’elle s’élevait à plus de 12 % en 20143–5. On pouvait s’attendre qu’à la suite de la légalisation du cannabis au Canada à des fins non thérapeutiques, en octobre 2018, la consommation de cette population augmente, puisque cette dernière possède déjà un certain bagage d’utilisation, qu’elle soit à des fins thérapeutiques ou non6.
Le cannabis est un produit qui contient plus de 500 composés organiques différents, dont 120 phytocannabinoïdes8,9. De ceux-ci, les plus étudiés sont le THC ainsi que le cannabidiol (CBD)8. Le cannabis peut servir à traiter ou à soulager plusieurs problèmes de santé pouvant affecter les personnes âgées, entre autres l’anorexie, la perte de poids, la maladie de Parkinson, les troubles de comportement associés à la démence, l’anxiété, l’insomnie, la douleur et l’arthrite rhumatoïde10–12.
Au Canada, le nabilone (analogue synthétique du THC) est indiqué pour la prévention des nausées et des vomissements réfractaires, induits par la chimiothérapie7. Le nabiximols, un mélange de THC et de CBD, est quant à lui autorisé par vaporisateur buccal pour le traitement de la douleur d’origine cancéreuse et de la douleur ou de la spasticité associée à la sclérose en plaques7.
Dans un contexte où les personnes âgées présentent des modifications de la pharmacocinétique, de la pharmacodynamie, de l’homéostasie, en plus de présenter plusieurs syndromes gériatriques, tels que les chutes, le délirium et la perte de poids, la consommation de cannabis par cette population peut entraîner des effets néfastes12. Cet article abordera les propriétés pharmacocinétiques et pharmacodynamiques du THC et du CBD, ainsi que les préoccupations liées à l’utilisation de cannabis en gériatrie.
La personne âgée subit diverses modifications physiologiques qui influencent le processus pharmacocinétique des médicaments et des drogues. On constate par exemple que l’absorption est affectée par l’augmentation du pH gastrique, la réduction de la motilité gastro-intestinale, la diminution de l’apport sanguin splanchnique et la surface de la muqueuse intestinale13. Quant à la distribution, on observe une augmentation de la masse adipeuse, soit de 18 à 36 % chez l’homme et de 33 à 45 % chez la femme. Cet accroissement de la masse adipeuse augmente le volume de distribution et allonge le temps de demi-vie des molécules liposolubles13. On note en outre une diminution d’environ 10 à 15 % de la quantité totale d’eau corporelle, ce qui entraîne une diminution du volume de distribution. Il en résulte une augmentation de la concentration des médicaments hydrosolubles pouvant entraîner une toxicité13. Les personnes âgées dont le poids est faible, soit moins de 45 kg, et qui présentent une diminution de la masse musculaire et une augmentation de la masse lipidique risquent davantage de subir des effets toxiques des médicaments dont la posologie n’a pas été ajustée14.
Il est fréquent de constater une diminution de l’albumine sérique chez les patients âgés dits « fragiles » et malnutris15. Quand les personnes souffrant d’hypoalbuminémie prennent des médicaments liés à plus de 90 % à l’albumine, comme la sertraline, la warfarine, la phénytoïne et l’acide valproïque, on observe une augmentation de la fraction libre de ces médicaments qui mène à l’apparition d’effets indésirables ou toxiques si les posologies ne sont pas ajustées15.
Sur le plan hépatique, le vieillissement entraîne une diminution du volume du foie de l’ordre de 40 % et une diminution de l’apport sanguin hépatique13. Avec la diminution du premier passage hépatique, il se produit une augmentation de l’effet systémique des molécules dont le premier passage hépatique est important13. En ce qui concerne le métabolisme des médicaments, les réactions de phase I, comme l’oxydation, la réduction ou l’hydrolyse, sont aussi réduites chez les personnes âgées14. Ce ralentissement métabolique de phase I serait encore plus important chez la personne âgée et fragile. En revanche, le processus de vieillissement normal ne modifie pas les réactions de phase II, phase de glucurono-conjugaison. Pourtant, il existe des écrits rapportant que les patients fragiles subissent aussi des changements dans cette phase en présence de certains médicaments, dont l’acétaminophène et le métoclopramide14.
Sur le plan rénal, les changements sont les suivants : diminution de la masse rénale, du débit sanguin rénal, du taux de filtration glomérulaire et du taux de sécrétion tubulaire13. Par contre, la créatinine sérique demeure dans les valeurs normales malgré une diminution de la masse musculaire. Il existe différentes formules pour estimer la clairance de la créatinine dans cette population13. Les patients âgés dont le poids est faible et la masse musculaire a diminué présentent souvent des valeurs de créatinine sérique inférieures aux valeurs normales13. La clairance de la créatine calculée à l’aide des différentes formules est souvent surestimée, ce qui augmente le risque que ces patients subissent des effets indésirables et toxiques13–15. Il est donc nécessaire de faire intervenir le jugement clinique lors de l’ajustement des doses de médicaments éliminés par voie rénale.
On constate que le vieillissement entraîne une augmentation de la perméabilité de la barrière hématoencéphalique, donc une augmentation de la pénétration des médicaments dans le système nerveux central16. Par conséquent, les personnes âgées courent plus le risque de subir des effets indésirables sous l’effet des benzodiazépines et des médicaments aux propriétés anticholinergiques17. Diverses altérations font que la perméabilité de la barrière hématoencéphalique augmente chez les personnes âgées et les patients atteints de maladies neurodégénératives, telles que la maladie d’Alzheimer, la sclérose en plaques et la maladie de Parkinson16.
Il existe différentes voies d’administration du cannabis. La pharmacocinétique des préparations de cannabis sera différente selon la voie d’administration, soit par inhalation, par voie orale ou par vaporisateur buccal. Cette section présente les propriétés pharmacocinétiques du THC et du CBD administrés par voie orale et buccale et par inhalation.
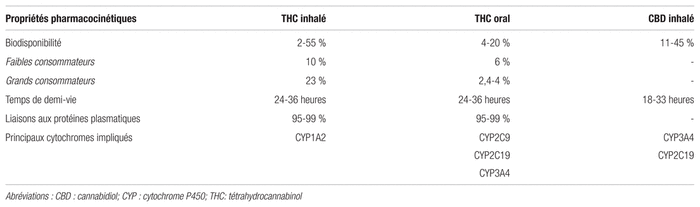
L’absorption du THC par voie orale est lente et erratique. En effet, la biodisponibilité de la molécule est d’environ 4 à 20 % et il faut 120 minutes pour observer une concentration maximale (Cmax). Quand le THC et le CBD sont pris par vaporisation buccale, la Cmax est atteinte en deux à quatre heures. Le THC subit alors un important effet de premier passage hépatique. L’acidité gastrique de l’estomac et de l’intestin le dégrade. Étant une molécule très liposoluble, le THC se distribue très rapidement dans les organes hautement vascularisés (coeur, foie, poumons, cerveau, muscle) et il passe facilement la barrière hématoencéphalique. Le THC est lié de 95 à 99 % aux protéines plasmatiques, principalement aux lipoprotéines, puis à l’albumine18–20.
Le métabolisme du THC se fait principalement par voie hépatique, par les cytochromes CYP2D9, CYP2C19 et CYP3A421. Toutefois, les études décrivant les interactions médicamenteuses avec le THC et le CBD sont peu nombreuses. L’une d’elles porte sur 13 enfants qui avaient reçu du CBD pour le traitement de l’épilepsie réfractaire. Elle rapporte une inhibition du métabolisme du clobazam par les CYP3A4 et CYP219, ce qui a mené à une augmentation des concentrations sériques du clobazam de 60 ± 80 % et de 500 ± 300 % pour le métabolite du clobazam, le n-desméthylclobazam22. Dans une étude de phase 1 portant sur des sujets sains, l’utilisation concomitante du kétoconazole, un inhibiteur du CYP3A4, et du vaporisateur buccal, ayant pour principe actif le nabiximols, a respectivement augmenté la Cmax plasmatique maximale du THC et du CBD de 25 % et 96 % et l’aire sous la courbe du THC et du CBD de 77 % et 171 %23. Après l’utilisation de la rifampicine, un inducteur du CYP3A4, et du vaporisateur buccal de nabiximols pour ces mêmes sujets sains, on note une diminution de la Cmax plasmatique du THC de 36 % et de l’aire sous la courbe du THC de 52 %23.
Le THC est métabolisé en 11-hydroxy-THC (11-OH-THC), un métabolite avec des propriétés psychoactives similaires au THC, qui est par la suite oxydé en 11-carboxy-THC (11-COOH-THC). Le 11-COOH-THC n’a pas de propriétés psychoactives, mais aurait probablement des propriétés analgésiques et anti-inflammatoires18–20. L’élimination du THC est diphasique avec une demi-vie initiale d’une à deux heures et une demi-vie d’élimination de 24 à 36 heures. Certains auteurs mentionnent que la demi-vie du THC serait plus longue et durerait jusqu’à sept jours en lien avec une séquestration tissulaire et une recirculation entérohépatique24. Quant aux métabolites du THC, la littérature rapporte des temps de demi-vie de 12 à 36 heures pour le 11-OH-THC et de 25 à 55 heures pour le 11-COOH-THC19. Environ 30 % du THC est éliminé dans l’urine et le reste dans les fèces18. Le CBD est principalement métabolisé par les CYP219 et les CYP3A420. Cependant, il existe peu d’études sur l’activité pharmacologique des métabolites du CBD chez l’humain20.
Quand le cannabis est pris par inhalation, l’absorption et la distribution du THC dans les tissus et le système nerveux central sont rapides18. En effet, on constate que le THC met entre trois et neuf minutes pour atteindre la Cmax et que sa biodisponibilité moyenne varie entre 2 et 55 %18. Cette variabilité résulte de nombreux facteurs, entre autres : le degré de consommation (utilisateurs occasionnels ou grands consommateurs), la méthode d’inhalation, la grosseur des particules, le nombre, la durée, l’espacement et le temps de rétention des inhalations25. L’inhalation permet d’éviter l’effet de premier passage hépatique. La littérature scientifique rapporte aussi un effet inducteur possible du CYP1A2, qui résulte de l’exposition à la fumée lorsque le cannabis est consommé par inhalation26. Elle rapporte également une augmentation de 48 % de la clairance de la théophylline (substrat du CYP1A2) quand l’inhalation de cannabis est bihebdomadaire27,28. Elle décrit en outre une toxicité à la clozapine et à l’olanzapine ayant affecté deux patients à la suite de l’arrêt du tabac et de la prise de cannabis en inhalation29. Dans le premier cas, le patient recevait une dose quotidienne de 700 mg de clozapine et a décidé de cesser abruptement la consommation de tabac et l’inhalation de cannabis. L’arrêt du cannabis a été objectivé par un test de dépistage par analyse d’urine. Un mois plus tard, le patient présentait des symptômes qui se sont aggravés durant les deux mois suivants, soit une agitation importante, des hallucinations auditives et des idées paranoïdes ainsi qu’une confusion croissante. Trois mois et demi après l’arrêt de la consommation de tabac et de l’inhalation de cannabis, les concentrations plasmatiques de la clozapine étaient de 1328 ng/mL et celles de la norclozapine, de 715 ng/mL29. Dans le deuxième cas, le patient prenait une dose quotidienne de 30 mg d’olanzapine. Cinq semaines après la première prise de l’olanzapine, le patient a diminué sa consommation de tabac de 40 cigarettes/jour à 10 cigarettes/jour. Quatre jours plus tard, il a commencé à présenter un syndrome parkinsonien se manifestant entre autres par de la bradykinésie, une démarche à petits pas, de la rigidité, le signe de la roue dentée. Dix jours après la diminution de sa consommation de tabac, le patient a consulté le médecin pour un syndrome parkinsonien. La dose d’olanzapine a ensuite été réduite à 20 mg/jour. Dans ce deuxième cas, le patient ne consommait pas de cannabis29. Cette interaction peut s’expliquer par une induction enzymatique du CYP1A2 de la clozapine et de l’olanzapine avec l’inhalation de cannabis ou la prise de tabac29. Quant au CBD, il est métabolisé principalement par le CYP2C19 et le CYP3A4. Après son inhalation, le CBD a une biodisponibilité de 31 % (11 à 45 %)18. Sa demi-vie est de 24 heures (18 à 33 heures)18. Le tableau I présente les propriétés pharmacocinétiques du THC et du CBD1,22.
Tableau I Propriétés pharmacocinétiques du THC et du CBD1,22
Il existe deux types de récepteurs cannabinoïdes chez l’humain, les récepteurs CB1 et CB28,9. Les récepteurs CB1 sont principalement situés au système nerveux central, dans le cerveau, alors que les récepteurs CB2 se trouvent en périphérie, principalement dans les cellules du système immunitaire8. Les effets psychoactifs du THC résultent de sa liaison aux récepteurs CB1 centraux8.
Les effets psychoactifs du THC et de son métabolite actif (11-OH-THC) sont issus d’un passage important de la barrière hématoencéphalique. Étant donné l’augmentation de la perméabilité de cette barrière chez les personnes âgées, il serait possible que ces dernières soient plus vulnérables aux effets du THC16,17. Selon ce raisonnement, les personnes âgées risqueraient davantage de présenter des effets indésirables liés à la consommation de cannabis.
Les interactions pharmacodynamiques doivent également être prises en considération. La consommation concomitante de cannabis et de dépresseurs du système nerveux central (par exemple les antidépresseurs, les anxiolytiques, les anticholinergiques, les antihistaminiques, les benzodiazépines, les relaxants musculaires et les opioïdes) peut accroître le risque de dépression du système nerveux central (somnolence, sédation), de dépression du centre respiratoire ou d’atteinte des fonctions cognitives (la mémoire, l’attention, les fonctions psychomotrices)30–32. Les agents anticholinergiques, la cocaïne ainsi que les sympathomimétiques, entrent en interaction synergique avec le cannabis pour produire des effets cardiovasculaires (augmentation de la pression artérielle et de la fréquence cardiaque)30–32. Ces risques seraient probablement plus importants chez les personnes âgées présentant déjà des problèmes cardiaques et une atteinte cognitive.
En raison des changements pharmacocinétiques que présentent les personnes âgées, plusieurs précautions doivent être envisagées face à la consommation de cannabis. En effet, étant donné la diminution de l’effet de premier passage chez les aînés, le THC consommé par voie orale pourrait avoir une biodisponibilité plus élevée et, par conséquent, accroître les concentrations plasmatiques. L’augmentation de la masse adipeuse pourrait accroître la séquestration du THC dans les tissus adipeux, en plus de prolonger le temps de demi-vie de la molécule. Chez les personnes âgées fragiles ou dénutries qui présentent une diminution de l’albumine sérique, la forte liaison du THC aux lipoprotéines et à l’albumine pourrait augmenter la fraction libre du THC et donc, les concentrations plasmatiques de THC.
La fonction rénale des personnes âgées étant plus faible, l’élimination d’environ 30 % des métabolites inactifs du THC par cette voie pourrait diminuer. Toutefois, comme l’élimination rénale concerne des métabolites inactifs du THC, l’impact de la diminution de la fonction rénale n’est pas cliniquement significatif chez la personne âgée.
Concernant les interactions, les cytochromes impliqués sont le CYP3A4, CYP2C9, CYP2C19. Si le cannabis est inhalé, le CYP1A2 s’ajoute aux précédents. En gériatrie, les interactions avec les inhibiteurs, les inducteurs et les substrats de ces cytochromes doivent être prises en considération quand il y a absorption de THC ou de CBD. Les personnes âgées consomment de nombreux médicaments avec ou sans prescription et risquent davantage de présenter des interactions pharmacocinétiques ou pharmacodynamiques cliniquement significatives.
Van den Elsen et coll. ont effectué une revue systématique de cinq études regroupant 267 participants âgés entre 48 et 78 ans, qui avaient consommé par ingestion du THC seul (n = 3 études) ou du THC combiné au CBD (n = 2 études). Les effets indésirables les plus fréquents étaient la somnolence et la fatigue30.
Dans une étude observationnelle portant sur des personnes âgées, dont l’âge moyen était de 74,5 ans, qui étaient suivies dans une clinique médicale ambulatoire spécialisée et à qui on avait prescrit du cannabis pour des douleurs associées au cancer (36,6 %) et des douleurs et la bouche sèche (7,1 %) représentaient les effets indésirables le plus souvent rapportés31. Une proportion de 53,4 % de patients avait également rapporté au moins une chute dans les six mois précédant le début du traitement au cannabis. Lors de l’évaluation de ce même paramètre six mois après le début du traitement, seulement 21,9 % des patients ont rapporté être tombés. Fait intéressant, à l’issue des six mois d’observation, 18,1 % des patients ont rapporté avoir diminué ou arrêté complètement leur prise d’opioïdes, molécule entraînant un risque élevé d’étourdissements et de chutes31.
Dans une étude croisée, menée à double insu, avec répartition aléatoire et contrôlée par placebo, van den Elsen et coll. ont évalué l’efficacité et l’innocuité de deux posologies différentes de THC dans un essai en chassé-croisé (0,75 mg et 1,5 mg deux fois par jour)32. Dix-huit personnes âgées demeurant à domicile, dont l’âge moyen était de 77 ans, et présentant des symptômes psychologiques et comportementaux associés à la démence ont été réparties aléatoirement dans le groupe THC et placebo. Aucune différence n’a été rapportée dans les tests d’équilibre et de la démarche et aucune chute n’est survenue32. Notons qu’il s’agit d’une étude exploratoire portant sur des patients demeurant à domicile et présentant des symptômes psychologiques et comportementaux associés à la démence.
Tel que le mentionnent Volkow et coll., les personnes âgées subissent d’importantes modifications de la plasticité du cerveau, ce qui pourrait influencer leur vulnérabilité au cannabis, comme nous l’avons expliqué précédemment au sujet des modifications de la barrière hématoencéphalique. Cependant, des études sont nécessaires afin d’infirmer ou de confirmer cette hypothèse33.
En ce qui concerne les risques liés à la consommation de cannabis dans la population générale, la littérature scientifique rapporte une augmentation de l’incidence de blessures, de problèmes respiratoires, de syndromes métaboliques, de malnutrition et de troubles de la santé mentale, tels que la dépression majeure, des troubles anxieux, un syndrome de stress post-traumatique et des troubles bipolaires34. Elle mentionne aussi une hausse de la prévalence de maladies cardiovasculaires, telles qu’infarctus du myocarde, accident vasculaire cérébral, angine, augmentation de la pression artérielle systolique, augmentation de la fréquence cardiaque35.
En ce qui a trait aux personnes âgées, plusieurs de ces risques pourraient théoriquement être exacerbés en raison des changements associés au vieillissement. La revue exploratoire de Lloyd aborde l’augmentation des risques de malnutrition, de blessures et de problèmes de santé mentale36. Du côté de la nutrition, les investigateurs extrapolent les résultats obtenus auprès des consommateurs de cannabis âgés de 20 à 59 ans, qui rapportent un apport accru, entre autres, en alcool et en sodium au détriment de fruits et de légumes, comparativement aux non-consommateurs36. À ce sujet, on s’inquiète d’une tendance semblable dans une population plus âgée où diabète et maladies cardiovasculaires sont fréquents.
Par ailleurs, il a été établi que les personnes plus âgées qui recourent au cannabis seraient plus sujettes aux risques de blessures37. Il serait possible que le risque d’accidents de voiture augmente parmi les personnes âgées, en raison de la diminution avec l’âge de la vivacité cognitive et des aptitudes visuelles37. Cette revue mentionne aussi que la dépression et la schizophrénie sont fortement associées à la consommation de cannabis dans la population générale. Chez les aînés, les consommateurs actuels et passés de cannabis étaient plus enclins à rapporter des troubles de santé mentale au cours de la dernière année ou de leur vie que les personnes âgées n’ayant jamais consommé de cannabis37. Notons que la plupart de ces effets indésirables sont liés à la prise de THC. La prise de CBD n’occasionnerait pas les mêmes effets indésirables.
Chez les personnes âgées fragiles, déjà plus sujettes aux chutes, à de la confusion ou à un délirium, la consommation de cannabis pourrait causer davantage d’effets indésirables. Le risque d’interactions médicamenteuses avec les différents cytochromes impliqués dans le métabolisme du THC ou du CBD doit être pris en considération, étant donné les nombreux médicaments que consomme cette population. Dans l’éventualité d’une consommation de cannabis en gériatrie, il serait approprié de commencer par des doses plus faibles, d’assurer un suivi étroit des effets indésirables et d’analyser les interactions potentielles avec les autres médicaments pris par le patient.
La littérature concernant simultanément le cannabis et les personnes âgées est peu étoffée pour le moment. De plus, les quelques études réalisées ont des limites, dont le faible nombre de sujets, le type d’études (peu d’études à répartition aléatoire, contrôlées, à double insu) et la durée des études, en plus des limites abordées précédemment.
Actuellement, Santé Canada ne prend pas position sur la consommation de cannabis à des fins thérapeutiques par les personnes âgées. Il évoque le manque de données disponibles portant sur l’innocuité et l’efficacité de cette substance pour cette population36. Toutefois, étant donné les profils pharmacocinétiques et pharmacodynamiques particuliers de la personne âgée, des précautions s’imposent quant à la consommation de cannabis par cette population : une dose de départ plus faible que pour l’adulte, une titration plus lente des doses, une surveillance étroite de la manifestation d’effets secondaires, ainsi qu’une analyse systématique par un pharmacien des interactions potentielles avec la médication du patient (que le cannabis soit prescrit ou non).
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Louise Mallet est rédactrice adjointe de Pharmactuel. Les autres auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Gouvernement du Canada SC. Prévalence et corrélats de la consommation de marijuana au Canada, 2012. Tableau 3 Prévalence de la consommation de marijuana au cours de la vie et au cours de la dernière année, selon le sexe et le groupe d’âge, population à domicile de 15 ans et plus, Canada, les territoires non compris, 2002 et 2012. 2015. [en ligne] https://www150.statcan.gc.ca/n1/pub/82-003-x/2015004/article/14158/tbl/tbl3-fra.htm (site visité le 11 décembre 2018).
2. Gouvernement du Canada SC. Le Quotidien — Rapports sur la santé : Analyse des tendances de la prévalence de consommation de cannabis au Canada, 1985 à 2015. 2018. [en ligne] https://www150.statcan.gc.ca/n1/daily-quotidien/180221/dq180221a-fra.htm (site visité le 11 décembre 2018).
3. Gouvernement du Canada SC. Consommateurs de cannabis au cours des trois derniers mois, par tranche d’âge. 2018. [en ligne] https://www150.statcan.gc.ca/n1/daily-quotidien/180418/cg-b002-fra.htm (site visité le 11 décembre 2018).
4. Gouvernement du Canada SC. Estimations expérimentales de la consommation de cannabis au Canada, de 1960 à 2015. 2017. [en ligne] https://www150.statcan.gc.ca/n1/pub/11-626-x/11-626-x2017077-fra.htm (site visité le 20 décembre 2018).
5. Gouvernement du Québec. Le cannabis. Encadrement du cannabis au Québec. [en ligne] https://encadrementcannabis.gouv.qc.ca/lecannabis/ (site visité le 20 décembre 2018).
6. Gouvernement du Canada. Loi et réglementation sur le cannabis. [en ligne] https://www.canada.ca/fr/sante-canada/services/droguesmedicaments/cannabis/lois-reglementation.html (site visité le 21 janvier 2019).
7. Direction québécoise de cancérologie. Prévention et traitement des nausées et vomissements induits par la chimiothérapie ou la radiothérapie chez l’adulte. [en ligne] http://www.msss.gouv.qc.ca/inc/documents/ministere/lutte-contre-le-cancer/guides-cepo-pdf/CEPO-Anti%C3%A9m%C3%A9tiques_MAJ_(2012-11-08.pdf) (site visité le 18 décembre 2018).
8. ElSohly MA, Radwan MM, Gul W, Chandra S, Galal A. Phytochemistry of cannabis sativa L. Dans : Kinghorn AD, Falk H, Gibbons S, Kobayashi J, rédacteurs. Phytocannabinoids: Unraveling the complex chemistry and pharmacology of Cannabis sativa. Switzerland: Springer Nature; 2017. p.1–36.
9. Casajuana C, López-Pelayo H, Balcells MM, Colom J, Gual A. Psychoactive constituents of cannabis and their clinical implications: a systematic review. Adicciones 2018;30:140–51.
10. Beauchet O. Medical cannabis use in older patient: Update on medical knowledge. Maturitas 2018;118:56–9.
11. Ben Amar M. Potentiel thérapeutique du cannabis et des cannabinoïdes. Dans : Le Cannabis: Pharmacologie et toxicologie. Centre québécois de lutte aux dépendances; Québec. 2018. p. 251–512.
12. Katz I, Katz D, Shoenfeld Y, Porat-Katz BS. Clinical evidence for utilizing cannabinoids in the elderly. IMAJ 2017;19:715.
13. Mallet L. Pharmacology of drugs in aging. Dans : Huang AR, Mallet L, rédacteurs. Medication-related falls in older people: Causative factors and management strategies. 1re éd. ADIS; 2016. p. 55–66.
14. McLachlan AJ, Hilmer SN, Le Couteur DG. Dosing Errors: Age-related changes in pharmacokinetics. Dans : Koch S, Gloth FM, Nay R, rédacteurs. Medication Management in Older Adults: A concise guide for clinicians. New York: Springer New York; 2010. p.127–35.
15. Elliot A, Mallet L, Dubé PA. Prise en charge de la thérapie médicamenteuse chez la personne âgée fragile | Toxicologie clinique. INSPQ. 2016. [en ligne] https://www.inspq.qc.ca/toxicologieclinique/prise-en-charge-de-la-therapie-medicamenteuse-chez-la-personne-ageefragile (site visité le 13 décembre 2018).
16. Erdo F, Denes L, de Lange E. Age-associated physiological and pathological changes at the blood–brain barrier: A review. J Cereb Blood Flow Metab 2017;37:424.
17. Zeevi N, Pachter J, McCullough LD, Wolfson L, Kuchel GA. The blood-brain barrier: Geriatric relevance of a critical brain-body interface. J Am Geriatr Soc 2010;58:1749–57.

18. Grotenhermen F. Pharmacokinetics and pharmacodynamics of cannabinoids. Clin Pharmacokinet 2003;42:327–60.
19. Huestis MA. Human cannabinoid pharmacokinetics. Chem Biodivers 2007;4:1770–804.

20. Millar S, Stone NL, Yates AS, O’Sullivan E. A systematic review on the pharmacokinetics of cannabidiol in humans. Front Pharmacol 2018;9:135.
21. Lucas CL, Galettis P, Schneider J. The pharmacokinetics and the pharmacodynamics of cannabinoids. Br J Clin Pharmacol 2018; 84:2477–82.

22. Geffrey AL, Pollack SF, Bruno PL, Thiele EA. Drug-drug interaction between clobazam and cannabidiol in children with refractory epilepsy. Epilepsia 2015;56:1246–51.
23. Stott C, White L. Wright S, Wilbraham D, Guy G. A phase I, open-label, randomized, crossover study of three parallel groups to evaluate the effect of rifampicin, ketoconazole, and omeprazole on the pharmacokinetics of THC/CBD oromucosal spray in healty volunteers. Springerplus 2013;2:236.
24. Douville M, Dubé PA. Les effets du cannabis sur la conduite automobile. [en ligne] https://www.inspq.qc.ca/pdf/publications/2044_effets_cannabis_conduite_automobile.pdf (site visité le 14 avril 2019).
25. Lindgren JE, Ohlsson A, Agurell S, Hollister L, Gillespie H. Clinical effects and plasma levels of delta 9-tetrahydrocannabinol (delta 9-THC) in heavy and light users of cannabis. Psychopharmacology (Berl) 1981;74:208–12.
26. Ohlsson A, Lindgren JE, Wahlen A, Agurell S, Hollister LE, Gillespie HK. Plasma delta-9 tetrahydrocannabinol concentrations and clinical effects after oral and intravenous administration and smoking. Clin Pharmacol Ther 1980;28:409–16.
27. Jusko WJ, Schentag JJ, Clark JH, Gardner M, Yurchak AM. Enhanced biotransformation of theophylline in marihuana and tobacco smokers. Clin Pharmacol Ther 1978;24:405–10. 28.
28. Horn JR. Drug interactions with marijuana. [en ligne] https://www.pharmacytimes.com/publications/issue/2014/december2014/drug-interactions-with-marijuana (site visité le 21 janvier 2019).
29. Zullino DF, Delessert D, Eap CB, Preisig M, Baumann P. Tobacco and cannabis smoking cessation can lead to intoxication with clozapine or olanzapine. Int Clin Psychopharmacol 2002;17:141–3.
30. van den Elsen GAH, Ahmed AIA, Lammers M, Kramers C, Verkes RJ, van der Marck MA et coll. Efficacy and safety of medical cannabinoids in older subjects: A systematic review. Ageing Res Rev 2014;14:56–64.
31. Abuhasira R, Schleider LBL, Mechoulam R, Novack V. Epidemiological characteristics, safety and efficacy of medical cannabis in the elderly. Eur J Intern Med 2018;49:44–50.
32. van den Elsen GA, Tobben L, Ahmed AI, Verkes RJ, Kramers C, Marijnissen RM et coll. Effects of tetrahydrocannabinol on balance and gait in patients with dementia: A randomised controlled crossover trial. J Psychopharmacol 2017;31:184–91.
33. Volkow ND, Swanson JM, Evins AE, DeLisi LE, Meier MH, Gonzalez R et coll. Effects of cannabis use on human behavior, including cognition, motivation, and psychosis: A review. JAMA Psychiatry 2016;73:292–7.
34. Lloyd SL, Striley CW. Marijuana use among adults 50 years or older in the 21st century. Gerontol Geriatr Med 2018;4:1–14.
35. Alshaarawy O, Elbaz HA. Cannabis use and blood pressure levels: United States national health and nutrition examination survey, 2005–2012. J Hypertens 2016;34:1507–12.

36. Gouvernement du Canada SC. Renseignements destinés aux professionnels de la santé : Le cannabis (marihuana, marijuana) et les cannabinoïdes. 2018. [en ligne] https://www.canada.ca/content/dam/hc-sc/documents/services/drugs-medication/cannabis/information-medical-practitioners/information-health-care-professionals-cannabis-cannabinoids-fra.pdf (site visité le 14 décembre 2018).
37. Monitoring health concerns related to marijuana in Colorado: 2016 : Changes in marijuana use patterns, systematic literature review, and possible marijuana-related health effects. [en ligne] https://drive.google.com/file/d/0B0tmPQ67k3NVQlFnY3VzZGVmdFk/view (site visité le 26 janvier 2019).
PHARMACTUEL, Vol. 52, No. 3, 2019