Étude ASPREE : Quel est l’effet de l’aspirine en prévention primaire sur la survie sans invalidité de la personne âgée en bonne santé?
Caroline Bernard1,2,3*, Pharm.D., M.Sc., François Bourdeau1,4,5*, Pharm.D., M.Sc., Marjolaine Giroux1,6,7*, Pharm.D., M.Sc., Stevenson Ly1,8,9*, Pharm.D., M.Sc., Louise Mallet3,10, B.Sc.Pharm., Pharm.D., FESP, FOPQ
1Candidat à la maîtrise en pharmacothérapie avancée au moment de la rédaction, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
2Résidente en pharmacie au moment de la rédaction, Centre universitaire de santé McGill, Montréal (Québec) Canada;
3Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
4Résident en pharmacie au moment de la rédaction, Centre hospitalier de l’Université de Montréal, Montréal (Québec) Canada;
5Pharmacien, Centre universitaire de santé McGill, Montréal (Québec) Canada;
6Résidente en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, Montréal (Québec) Canada;
7Pharmacienne, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Montréal (Québec) Canada;
8Résident en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux du Centre-Ouest-de-l’Île-de-Montréal, site Hôpital général juif, Montréal (Québec) Canada;
9Pharmacien, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, site Hôpital Santa Cabrini Ospedale, Montréal (Québec) Canada;
10Professeure titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada
Reçu le 24 avril 2019: Accepté après révision par les pairs le 22 décembre 2019
Titre de l’article : Effect of aspirin on disability-free survival in the healthy elderly. N Engl J Med 2018;379:1499-5081.
Auteurs : McNeil JJ, Woods RL, Nelson MR, Reid CM, Kirpach B, Wolfe R et coll. pour le groupe d’étude ASPREE.
Commanditaires: Cette étude a été financée par des bourses de National Institutes of Health, du National Health and Medical Research Council of Australia, de Monash University, de Victorian Cancer Agency et une bourse éducative de Bayer Schering Pharma. Ce dernier a aussi fourni les comprimés d’acide acétylsalicylique (AAS) et de placebo, sans aucune autre participation à l’étude.
Cadre de l’étude : De grandes études cliniques ont démontré les avantages de l’AAS à faible dose en prévention secondaire des maladies cardiovasculaires (MCV)2–4. Toutefois, son utilisation en prévention primaire est controversée5,6. En effet, des données tendent à montrer un effet bénéfique en prévention primaire sur l’incidence des MCV (infarctus, angine, accident vasculaire cérébral, décès d’origine cardiovasculaire) ainsi que sur le cancer7–9. La population gériatrique pourrait en bénéficier en raison du risque cardiovasculaire plus élevé auquel elle est exposée10,11. Cependant, peu de données probantes démontrent que les avantages de l’AAS dépassent les risques en prévention primaire des MCV pour cette population, notamment en raison de l’augmentation du risque de saignements12,13.
Certains auteurs recommandent l’AAS en prévention primaire des MCV si le risque vasculaire dépasse le risque de saignements6,14. Les lignes directrices de Thrombose Canada de 2017 font également cette recommandation15. Toutefois, il n’existe pas de recommandations particulières pour les patients âgés. Les études ARRIVE et ASCEND ont comparé l’utilisation d’AAS à faible dose à un placebo en prévention primaire de MCV, respectivement pour les patients non diabétiques dès l’âge de 55 ans et pour les patients diabétiques de plus de 40 ans16,17. Dans l’étude ARRIVE, les auteurs concluent qu’il n’y avait pas d’avantage sur le plan cardiovasculaire mais que le risque de saignements avait doublé16. L’étude ASCEND a démontré une diminution des événements cardiovasculaires de 12 % parmi les patients diabétiques17. Toutefois, cet avantage est contrebalancé par l’augmentation du risque de saignement majeur de 29 %17. L’utilisation de l’AAS à faible dose en prévention primaire pour la personne âgée demeure encore un sujet controversé et nécessite une évaluation complexe des avantages et des risques. La présente étude évalue la pertinence de son utilisation pour les personnes âgées en bonne santé, demeurant à domicile.
Protocole de recherche : ASPREE est une étude à répartition aléatoire, multicentrique, à double aveugle, contrôlée qui comparait deux groupes de traitement en parallèle: un groupe sous l’AAS et un groupe sous placebo. Le recrutement a été effectué dans 16 sites en Australie et 34 sites aux États-Unis.
Patients : Les patients inclus provenaient d’Australie et des États-Unis et devaient être âgés d’au moins 70 ans ou d’au moins 65 ans s’ils étaient d’origine afro-américaine et hispanique aux États-Unis. Les patients devaient résider dans la communauté et être exempts de MCV, maladies cérébrovasculaires ou de fibrillation auriculaire. Les critères d’exclusion étaient les suivants: présence d’un diagnostic de démence, d’un score inférieur à 78 au Modified Mini-Mental State (3MS) examination d’une invalidité physique (score de quatre ou cinq à au moins une des six activités quotidiennes du Katz Index of Independence in Activities of Daily Living), d’une condition active menant à un risque élevé de saignement, d’anémie (hémoglobine inférieure à 120 g/L pour les hommes et à 110 g/L pour les femmes), d’une condition sévère rendant la survie à cinq ans peu probable, d’une utilisation continue d’AAS en prévention secondaire, d’une prise continue d’antiplaquettaire ou d’anticoagulant, d’une hypertension artérielle non contrôlée (tension supérieure ou égale à 180/105 mmHg), du refus de cesser l’AAS en prévention primaire ou d’une adhésion au traitement inférieure à 80 % durant la période préliminaire de l’étude. La fragilité des patients était évaluée avec un outil validé, soit le Fried Frailty Criteria18.
Interventions : Les patients ont été répartis aléatoirement à la suite de la période préliminaire avec placebo pendant quatre semaines pour permettre l’évaluation de leur adhésion au traitement médicamenteux. À la fin de cette période, les patients qui avaient démontré une adhésion d’au moins 80 % étaient répartis de manière aléatoire dans un ratio 1:1 pour recevoir 100 mg d’AAS à enrobage entérique ou le placebo administré une fois par jour. Cette répartition aléatoire a été stratifiée selon le centre et l’âge (65 à 79 ans et plus de 80 ans). Le suivi comprenait une visite annuelle en personne ainsi que des appels téléphoniques tous les trois mois.
Points évalués : L’objectif principal était un composite de décès toutes causes confondues, de démence et d’incapacité physique persistante. Le diagnostic de démence était défini selon les critères du Diagnostic and Statistical Manual of Mental Disorders IV. L’invalidité physique persistante était rapportée par le patient et était définie comme étant une incapacité, persistant pendant au moins six mois, à effectuer au moins une des six activités de la vie quotidienne de l’index de Katz. Seul le premier événement de la variable composite était comptabilisé dans l’analyse de l’objectif primaire. Les objectifs secondaires rapportés étaient les composantes individuelles de l’objectif primaire ainsi que les MCV fatales et non fatales, un cancer fatal et non fatal (sauf les cancers de la peau qui n’étaient pas de type mélanome), le trouble cognitif léger, la dépression et les hémorragies majeures (y compris les saignements cliniquement significatifs et les accidents vasculaires cérébraux hémorragiques). L’état cognitif était évalué par des tests de la fonction cognitive, dont le 3MS. Le diagnostic de dépression était évalué par le questionnaire Center for Epidemiologic Studies – Depression (CES-D). Contrairement à l’objectif primaire, tous les événements survenus pendant la période de suivi étaient comptabilisés. Les sous-groupes inclus dans le plan d’analyse statistique de l’objectif primaire comprenaient le sexe, l’âge (plus jeune que l’âge médian ou l’âge médian et au-delà), le pays d’origine (Australie ou États-Unis), le groupe ethnique (caucasien, afro-américain, hispanique ou autres), le diabète (présence ou absence au début de l’étude), l’hypertension artérielle (patients sous thérapie antihypertensive ou patients avec une tension artérielle supérieure à 140/90 mmHg au début de l’étude) et le statut tabagique (fumeurs ou non-fumeurs/anciens fumeurs)19.
Résultats : Le recrutement s’est déroulé de mars 2010 à décembre 2014. Sur 83 376 patients potentiellement admissibles à l’étude, 23 163 patients (27,8 %) ont participé à la phase préliminaire et 19 114 (22,9 %) ont été inclus dans la répartition aléatoire dont 16 703 (87,4 %) en Australie et 2 411 (12,6 %) aux États-Unis. Parmi ceux-ci, 9 525 ont été attribués au groupe AAS et 9 589 au groupe placebo. Un suivi d’une durée médiane de 4,7 ans a été effectué. Dans la dernière année de suivi, 82 % des patients poursuivaient toujours leur suivi annuel, 9,7 % étaient suivis régulièrement par téléphone ou par dossier clinique, 1,6 % ont été perdus au suivi, 1,2 % s’étaient retirés de l’étude et 5,5 % sont décédés. Il est à noter que le comité de surveillance a arrêté précocement l’étude, c’est-à-dire neuf mois avant la fin prévue, puisqu’il était improbable qu’un résultat significatif émerge pour l’objectif primaire.
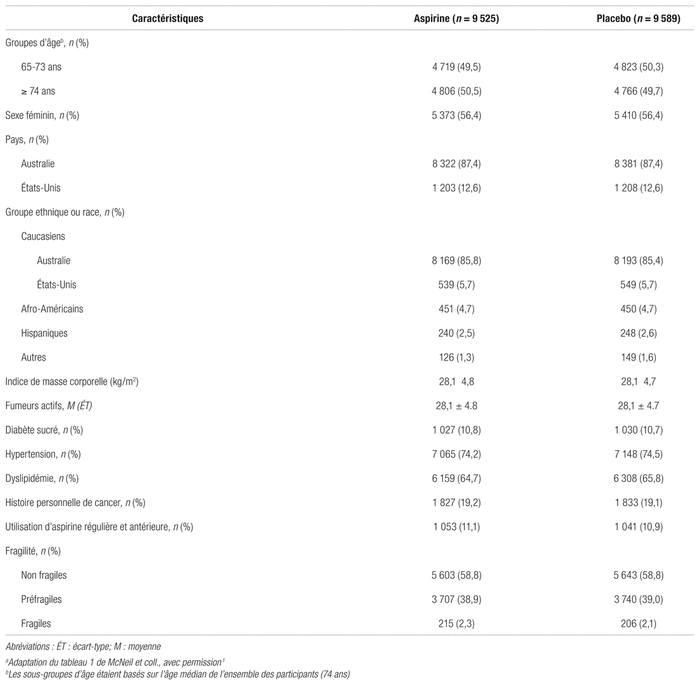
À la fin de l’étude, 62,1 % des patients du groupe AAS et 64,1 % du groupe placebo poursuivaient l’intervention dans leur groupe respectif. Les caractéristiques des patients entre les deux groupes étaient similaires (tableau I). L’âge médian était de 74 ans, 56,4 % étaient des femmes, 8,7 % des patients n’étaient pas caucasiens et 2,2 % étaient considérés comme fragiles. Dans l’ensemble, 98 % des participants australiens et 45 % des participants américains étaient de race blanche non hispanique.
Tableau I Caractéristiques de base des patients lors de l’entrée dans l’étudea
Concernant l’objectif primaire, les investigateurs ont dénombré 921 événements dans le groupe AAS et 914 dans le groupe placebo, ce qui correspond respectivement à 21,5 et 21,2 événements pour 1000 personnes-année (tableau II). La différence entre les groupes n’était pas statistiquement significative (rapport de risques instantanés [RRI]: 1,01; intervalle de confiance à 95 % [IC 95 %]: 0,92–1,11, p = 0,79). Parmi les éléments composant l’objectif primaire, le décès toutes causes confondues est apparu le plus fréquemment (50 % de tous les événements), suivi de la démence (30 %) puis de l’incapacité physique (20 %). Aucune interaction significative de sous-groupe n’a été observée à l’exception de la fragilité. Les patients qui n’étaient pas fragiles avaient subi un plus grand nombre d’événements en présence d’AAS comparativement au placebo (RRI: 1,17; IC 95 %: 1,01–1,36).
Tableau II Résultats des objectifs primaires et secondaires concernant la mortalité, la démence, l’invalidité physique persistante et l’hémorragie majeurea,b
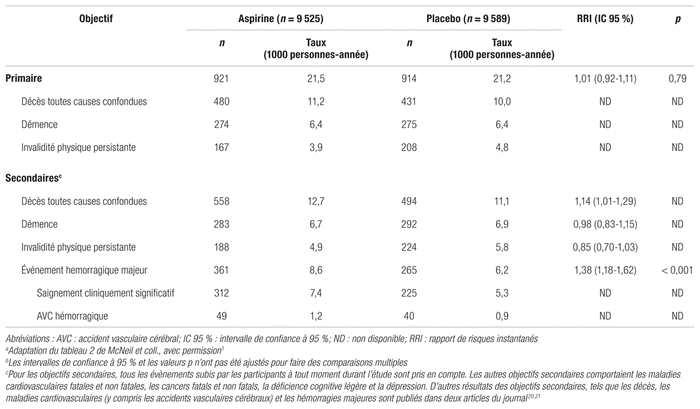
Quant aux objectifs secondaires, la différence du nombre de décès toutes causes confondues et des hémorragies majeures entre les deux groupes étaient statistiquement significatives. En effet, il y a eu 558 décès toutes causes confondues dans le groupe AAS (12,7 événements pour 1000 personnes-année) et 494 dans le groupe placebo (11,1 événements pour 1000 personnes-année) (RRI: 1,14; IC 95 %: 1,01–1,29). Concernant les hémorragies majeures, il y a eu 361 cas dans le groupe AAS et 265 cas dans le groupe placebo (RRI: 1,38; IC 95 %: 1,18–1,62, p < 0,001). En ce qui concerne la démence et l’incapacité physique, les différences n’étaient pas statistiquement significatives.
Grille d’évaluation critique


Discussion
L’étude ASPREE a démontré que l’AAS à faible dose en prévention primaire vasculaire n’apporte pas d’avantage sur le plan de la survie sans invalidité aux personnes âgées en bonne santé. De plus, l’étude a démontré une augmentation significative de saignements majeurs. Ces résultats concordent avec les données de la littérature scientifique. En effet, l’étude ASCEND n’avait démontré aucune différence significative du nombre de décès toutes causes confondues en comparant l’AAS à faible dose au placebo parmi des patients diabétiques sans MCV17. Toutefois, les patients prenant l’AAS subissaient une augmentation significative des saignements majeurs de 29 %17. Par ailleurs, l’étude ARRIVE a comparé l’effet de l’AAS à faible dose au placebo pour les patients exposés à un risque modéré d’événements cardiovasculaires16. Il n’y avait pas de différence significative sur le plan du nombre de décès toutes causes confondues, mais le risque de saignement gastro-intestinal avait augmenté de 2,11 fois16.
Une méta-analyse d’essais cliniques, ayant inclus l’étude ASPREE, a évalué l’efficacité et l’innocuité de l’AAS en prévent ion primaire cardiovasculaire et a obtenu des résultats semblables22. En effet, la mortalité toutes causes confondues n’avait pas statistiquement diminué22. Les risques de saignements majeurs et d’hémorragies intracrâniennes avaient augmenté respectivement de 47 % et 33 %22. Une autre méta-analyse a démontré une diminution significative d’un composite d’événements cardiovasculaires (RRI: 0,89; IC 95 %: 0,84–0,94)23. Toutefois, cet avantage est limité par l’augmentation de saignements majeurs (RRI: 1,43; IC 95 %: 1,30–1,56)23. Une méta-analyse a analysé l’effet de l’AAS en prévention primaire dans tous les types de démence. Tout comme ASPREE, il n’y a pas eu d’impact significatif sur la démence parmi les patients âgés24.
La validité interne et la qualité méthodologique de l’étude semblent adéquates. En effet, l’étude était à répartition aléatoire, multicentrique, à double aveugle et stratifiée selon l’âge et les centres. Le biais de confusion est peu probable, car la répartition aléatoire a permis d’équilibrer les variables confondantes entre les deux groupes. Les pertes au suivi sont faibles et similaires entre les deux groupes, ce qui diminue le risque de biais de sélection. La présence du double aveugle diminue le biais d’information. L’analyse de cette étude a été effectuée en ITT. Ceci est adéquat, puisque les bienfaits de la répartition aléatoire sont conservés.
Cependant, cette étude a certaines limites. En effet, 83 376 patients ont été contactés par téléphone, mais seulement 23 163 patients (27,8 %) ont été inclus dans la phase préliminaire. Les raisons des refus de participer à l’étude ne sont pas connues et peuvent refléter une difficulté de recrutement de la population âgée. Les patients hispaniques et afro-américains des États-Unis étaient sélectionnés selon leur âge pour que le risque cardiovasculaire et de maladie d’Alzheimer puisse être pris en compte (à partir de 65 ans)25,26. Or les patients vivant en Australie n’étaient pas sélectionnés de la même façon (à partir de 70 ans). La sélection de patients plus âgés augmente les probabilités de démence, d’invalidité et de MCV11,27,28. Bien que cela soit méthodologiquement discutable, les patients d’origine ethnique autre que caucasienne représentent seulement 8,7 % de la population à l’étude. Il est donc peu probable que ceci ait un impact significatif sur les résultats. Il faut aussi noter qu’un suivi plus long aurait probablement permis de déceler plus d’événements liés à la maladie d’Alzheimer.
Il existe des divergences dans le suivi des patients australiens et américains. Selon le protocole, les médicaments concomitants des patients d’Australie ont été déterminés au moyen des dossiers médicaux des médecins de famille. Aux États-Unis, les patients devaient apporter leurs médicaments aux suivis annuels. Ainsi, ceci peut causer un biais d’information, puisque différents professionnels aux États-Unis ont pu effectuer l’histoire médicamenteuse, tels un pharmacien ou une infirmière. Malgré cette mention dans le protocole, les médicaments concomitants ne sont pas rapportés à l’exception des statines. Il aurait été intéressant de connaître ces médicaments, puisqu’ils peuvent être considérés comme des variables confondantes et ainsi biaiser les résultats. Par exemple, selon les critères de Beers, plusieurs médicaments, dont les anticholinergiques, pourraient augmenter le risque de démence29. Certains médicaments permis pendant l’étude peuvent influencer le risque de saignements (inhibiteurs de la pompe à protons, anti-inflammatoires non stéroïdiens, AAS achetée sans prescription).
Concernant les critères d’évaluation secondaire, il n’y avait pas de plan d’ajustement pour procéder à des comparaisons multiples. Ceci peut donc limiter les conclusions à tirer sur ces critères d’évaluation. Malgré cela, il faut faire attention lors de l’interprétation des données statistiquement significatives concernant la mortalité toutes causes confondues et les saignements majeurs.
Les auteurs évaluent la mortalité toutes causes confondues, mais les raisons spécifiques des décès ne sont pas rapportées dans l’étude. Toutefois, celles-ci sont rapportées dans deux autres articles20,21. La cause de décès la plus fréquente était liée au cancer chez 49,6 % des patients27. Il aurait été intéressant d’inclure les causes spécifiques de décès. Pour la validité externe, il pourrait être difficile de généraliser ces résultats à une population plus large. En effet, l’adhésion des patients au traitement a été évaluée durant la période préliminaire. Les sujets ayant adhéré à plus de 80 % au traitement ont été sélectionnés, ce qui n’est pas représentatif des patients dans la pratique courante. De plus, la majorité des patients étaient caucasiens, ce qui rend les résultats peu applicables aux pays dont les patients sont d’origine ethnique différente.
La stratification selon l’âge diffère pour la répartition aléatoire et les analyses statistiques. En effet, la stratification effectuée pour la répartition aléatoire est de 65 à 74 ans et plus de 80 ans tandis que pour l’analyse statistique, cette stratification est plutôt de 65 à 73 ans et de plus de 74 ans. Les auteurs ne justifient pas cette différence. Il est difficile de déterminer les impacts de ces changements sur les résultats.
Conclusion
L’étude ASPREE a démontré que l’usage de l’AAS à faible dose en prévention primaire n’offre aucun avantage sur la survie sans invalidité aux patients âgés et en bonne santé, mais il augmente le risque de saignements majeurs. Ainsi, il faudrait envisager l’ajout d’un protecteur gastrique lors de l’utilisation de l’AAS en prévention primaire pour les patients âgés de plus de 70 ans. Il faut noter que ces résultats ne s’appliquent pas aux patients qui ont une indication nécessitant la prise d’AAS, entre autres un accident cérébrovasculaire. De plus, cette étude ne porte pas sur l’utilisation de l’AAS par les personnes de moins de 65 ans. Dans cette étude, seulement 11 % des participants prenaient régulièrement une faible dose d’AAS avant de participer à l’étude. Présentement, la pratique au Québec consiste à éviter l’utilisation d’AAS pour les patients sans maladies vasculaires5. En effet, le risque de saignements démontré en présence d’AAS doit être pris en considération par rapport à ses avantages mitigés en prévention primaire. Les résultats de cette étude ne font que renforcer la pratique actuelle. Toutefois, la question suivante n’a pas reçu de réponse : les patients âgés de plus de 70 ans et en bonne santé, qui prennent de l’AAS régulièrement depuis plusieurs années en prévention primaire, devraient-ils continuer ou cesser la prise d’AAS?
Financement
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs.
Conflits d’intérêts
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Louise Mallet est rédactrice adjointe de Pharmactuel. Les autres auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
Remerciements
Cet article a été rédigé dans le cadre du cours de communication scientifique de la maîtrise en pharmacothérapie avancée de l’Université de Montréal. Les auteurs en remercient les responsables. Une autorisation écrite a été obtenue de ces personnes.
Références
1. McNeil JJ, Woods RL, Nelson MR, Reid CM, Kirpach B, Wolfe R et coll. Effect of aspirin on disability-free survival in the healthy elderly. N Engl J Med 2018;379:1499–508.



2. Antithrombotic Trialists Collaboration. Aspirin in the primary and secondary prevention of vascular disease: collaborative meta-analysis of individual participant data from randomised trials. Lancet 2009;373:1849–60.



3. Berger JS, Brown DL, Becker RC. Low-dose aspirin in patients with stable cardiovascular disease: a meta-analysis. Am J Med 2008;121: 43–9.


4. Rothwell PM, Algra A, Chen Z, Diener HC, Norrving B, Mehta Z. Effects of aspirin on risk and severity of early recurrent stroke after transient ischaemic attack and ischaemic stroke: time-course analysis of randomised trials. Lancet 2016;388:365–75.



5. Bell AD, Roussin A, Cartier R, Chan WS, Douketis JD, Gupta A et coll. The use of antiplatelet therapy in the outpatient setting: Canadian Cardiovascular Society guidelines. Can J Cardiol 2011; 27:1–59.

6. Sanmuganathan PS, Ghahramani P, Jackson PR, Wallis EJ, Ramsay LE. Aspirin for primary prevention of coronary heart disease: safety and absolute benefit related to coronary risk derived from meta-analysis of randomised trials. Heart 2001;85:265–71.



7. Rothwell PM, Price JF, Fowkes FG, Zanchetti A, Roncaglioni MC, Tognoni G et coll. Short-term effects of daily aspirin on cancer incidence, mortality, and non-vascular death: analysis of the time course of risks and benefits in 51 randomised controlled trials. Lancet 2012;379:1602–12.


8. Rothwell PM. Aspirin in prevention of sporadic colorectal cancer: current clinical evidence and overall balance of risks and benefits. Recent Results Cancer Res 2013;191:121–42.

9. Sutcliffe P, Connock M, Gurung T, Freeman K, Johnson S, Kandala NB et coll. Aspirin for prophylactic use in the primary prevention of cardiovascular disease and cancer: a systematic review and overview of reviews. Health Technol Assess 2013;17:1–253.



10. Mozaffarian D, Benjamin EJ, Go AS, Arnett DK, Blaha MJ, Cushman M et coll. Heart disease and stroke statistics-2016 update: a report from the American Heart Association. Circulation 2016;133:e38–360.
11. Yazdanyar A, Newman AB. The burden of cardiovascular disease in the elderly: morbidity, mortality, and costs. Clin Geriatr Med 2009;25: 563–77.



12. Whitlock EP, Burda BU, Williams SB, Guirguis-Blake JM, Evans CV. Bleeding risks with aspirin use for primary prevention in adults: a systematic review for the U.S. Preventive Services Task Force. Ann Intern Med 2016;164:826–35.


13. Li L, Geraghty OC, Mehta Z, Rothwell PM. Age-specific risks, severity, time course, and outcome of bleeding on long-term antiplatelet treatment after vascular events: a population-based cohort study. Lancet 2017;390:490–9.



14. Truong C. Low-dose acetylsalicylic acid for primary prevention of cardiovascular disease: do not misinterpret the recommendations. Can Fam Physician 2015;61:971–5.


15. Thrombosis Canada. Clinical Guide: Acetylsalicylic Acid (ASA). [en ligne] http://thrombosiscanada.ca/wp-content/uploads/2017/07/Acetylsalycyclic-Acid-2017Jun29-FINAL-1.pdf (site visité le 7 décembre 2019).
16. Gaziano JM, Brotons C, Coppolecchia R, Cricelli C, Darius H, Gorelick PB et coll. Use of aspirin to reduce risk of initial vascular events in patients at moderate risk of cardiovascular disease (ARRIVE): a randomised, double-blind, placebo-controlled trial. Lancet 2018;392: 1036–46.



17. Bowman L, Mafham M, Wallendszus K, Stevens W, Buck G, Bar ton J. Ef fects of aspirin for primary prevention in persons with diabetes mellitus. N Engl J Med 2018;379:1529–39.


18. McNeil JJ, Woods RL, Nelson MR, Murray AM, Reid CM, Kirpach B et coll. Baseline characteristics of participants in the ASPREE (ASPirin in Reducing Events in the Elderly) Study. J Gerontol A Bio Sci Med Sci 2017;72:1586–93.

19. Wolfe R, Murray AM, Woods RL, Kirpach B, Shah RC, Nelson MR et coll. The aspirin in reducing events in the elderly trial: Statistical analysis plan. Int J Stroke 2018;13:355–8.

20. McNeil JJ, Wolfe R, Woods RL, Tonkin AM, Donnan GA, Nelson MR et coll. Effect of aspirin on cardiovascular events and bleeding in the healthy elderly. N Engl J Med 2018;379:1509–18.



21. McNeil JJ, Nelson MR, Woods RL, Lockery JE, Wolfe R, Reid CM et coll. Effect of aspirin on all-cause mortality in the healthy elderly. N Engl J Med 2018;379:1519–28.



22. Mahmoud AN, Gad MM, Elgendy AY, Elgendy IY, Bavry AA. Efficacy and safety of aspirin for primary prevention of cardiovascular events: a meta-analysis and trial sequential analysis of randomized controlled trials. Eur Heart J 2019; 40:607–17.

23. Zheng SL, Roddick AJ. Association of aspirin use for primary prevention with cardiovascular events and bleeding events: a systematic review and meta-analysis. JAMA 2019;321:277–87.



24. Veronese N, Stubbs B, Maggi S, Thompson T, Schofield P, Muller C et coll. Low-dose aspirin use and cognitive function in older age: a systematic review and meta-analysis. J Am Geriatr Soc 2017;65:1763–8.



25. Chin AL, Negash S, Hamilton R. Diversity and disparity in dementia: the impact of ethnoracial differences in Alzheimer disease. Alzheimer Dis Assoc Disord 2011;25:187–95.



26. Carnethon MR, Pu J, Howard G, Albert MA, Anderson CAM, Bertoni AG et coll. Cardiovascular health in African Americans: a scientific statement from the American Heart Association. Circulation 2017;136:e393–e423.


27. Webber SC, Porter MM, Menec VH. Mobility in older adults: a comprehensive framework. Gerontologist 2010;50:443–50.


28. Barnes DE, Covinsky KE, Whitmer RA, Kuller LH, Lopez OL, Yaffe K. Predicting risk of dementia in older adults: The late-life dementia risk index. Neurology 2009;73:173–9.



29. American Geriatrics Society Beers criteria update expert panel. American Geriatrics Society 2019 updated AGS Beers criteria® for potentially inappropriate medication use in older Adults. J Am Geriatr Soc 2019;0:1–21.
30. Antman EM, Bennett JS, Daugherty A, Furberg C, Roberts H, Taubert KA et coll. Use of non-steroidal antiinflammatory drugs: an update for clinicians: a scientific statement from the American Heart Association. Circulation 2007; 115:1634–42.


Pour toute correspondance: Caroline Bernard, Centre universitaire de santé McGill, 1001, boulevard Décarie, Montréal (Québec), H4A 3J1, CANADA; Téléphone: 514 934-1934; Courriel: caroline.bernard.3@umontreal.ca
*Caroline Bernard, François Bourdeau, Marjolaine Giroux et Stevenson Ly ont contribué de façon équivalente à la rédaction de cet article (
Return to Text
)
(Return to Top)
PHARMACTUEL, Vol. 53, No. 2, 2020






