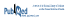Sandrine Gobeil1,2*, Pharm.D., Maude Gobeil1,3*, Pharm.D., Olivier Turcotte1,4*, Pharm.D., Louise Mallet5,6,7, B.Sc. Pharm., Pharm.D., FESCP, FOPQ
2Résidente en pharmacie au moment de la rédaction, Uniprix François P. Turgeon, Laval (Québec) Canada;
3Résidente en pharmacie au moment de la rédaction, Jean Coutu Nirvishi Jawaheer, Montréal (Québec) Canada;
4Résident en pharmacie au moment de la rédaction, Hôpital Charles-Le Moyne, Greenfield Park (Québec) Canada;
5Pharmacienne, Centre universitaire de santé McGill, Montréal (Québec) Canada;
6Professeure titulaire de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
7Rédactrice adjointe, Pharmactuel, Montréal (Québec) Canada
Reçu le 4 mai 2019: Accepté après révision par les pairs le 19 septembre 2019
Titre de l’article : Effect of aspirin on all cause mortality in the healthy elderly. N Engl J Med 2018;379:1519-281.
Auteurs : McNeil JJ, Nelson MR, Woods RL, Lockery JE, Wolfe R, Reid CM et coll., pour le groupe d’investigateurs ASPREE (Aspirin in Reducing Events in the Elderly).
Commanditaires : L’étude a été soutenue financièrement par des subventions du National Institute on Aging, du National Cancer Institute, du National Health, du Medical Research Council of Australia, du Monash University et du Victorian Cancer Agency. La compagnie Bayer Schering Pharma (Germany) a fourni le composé actif, soit l’acide acétylsalicylique (AAS) et le placébo1–3.
Cadre de l’étude : Il existe peu de données dans la littérature scientifique portant sur le risque de mortalité chez les personnes âgées en bonne santé, associé à la prise continue d’AAS à faible dose en prévention primaire1. On peut se demander si cette population en retire des avantages ou si, au contraire, elle s’expose à un risque accru de décès. Dans cet article, une sous-étude de l’étude ASPREE menée par McNeil et collaborateurs se penche spécifiquement sur la mortalité pouvant être associée à cet antiplaquettaire. Elle fait suite aux résultats de l’étude de référence ASPREE qui n’a pas démontré d’avantages statistiquement significatifs d’une prise continue d’AAS à faible dose sur la survie sans incapacité pour une population âgée en santé (rapport de risques instantanés [RRI]: 1,01; intervalle de confiance à 95 % [IC 95 %] 0,92–1,11, p = 0,79)2. Contre toute attente, les chercheurs ont plutôt observé une augmentation du risque de décès dans le groupe AAS.
Protocole de recherche : L’étude ASPREE est une étude à répartition aléatoire (ratio 1:1), multicentrique, à double aveugle, comprenant deux groupes de traitement en parallèle et dont la répartition a été réalisée entre mars 2010 et décembre 2014. Le groupe expérimental recevait 100 mg d’AAS et le groupe témoin un placébo. Le recrutement s’est fait en Australie (16 sites) et aux États-Unis (34 sites), principalement les États du centre-est américain du nord au sud4. La durée prévue de l’étude était de cinq ans. L’analyse des données statistiques a été réalisée en intention de traiter.
Patients : Les patients admissibles d’Australie et des États-Unis étaient en bonne santé et d’âge égal ou supérieur à 70 ans. Cependant, les Afro-Américains et les Hispaniques des États-Unis étaient admissibles dès l’âge de 65 ans. Les critères d’exclusion comprenaient les problèmes cardiovasculaires, la fibrillation auriculaire, tout patient à risque élevé de saignements et l’anémie (hémoglobine inférieure à 120 g/L pour les hommes et inférieure à 110 g/L pour les femmes). L’étude excluait également les patients ayant une contre-indication ou une allergie à la prise d’AAS, ceux qui participaient à un autre projet de recherche, qui prenaient de l’AAS en prévention secondaire et qui prenaient déjà un autre antiplaquettaire ou un anticoagulant. Étaient également exclus les sujets qui avaient une pression artérielle non contrôlée (systolique supérieure ou égale à 180 mmHg, ou diastolique supérieure ou égale à 105 mmHg), des antécédents de démence ou un résultat au test Modified Mini-Mental State Examination de moins de 78 à la première visite ainsi qu’une difficulté ou une incapacité grave à effectuer l’une des six tâches du Katz Activities of Daily Living. Finalement, les sujets dont l’observance au traitement était inférieure à 80 % lors de la phase sans médicament et ceux ayant des problèmes de santé susceptibles de causer la mort dans les cinq prochaines années ne pouvaient pas participer à l’étude5. Le Fried Frailty Criteria a été utilisé pour évaluer la fragilité des patients.
Interventions : Les participants ont été répartis aléatoirement pour recevoir l’AAS à 100 mg ou le placébo à l’aide d’un programme de répartition aléatoire généré par ordinateur2. La répartition en blocs de taille variable (2, 4 ou 6) a été stratifiée en fonction du site aux États-Unis ou de la clinique de médecine générale en Australie ainsi qu’en fonction de l’âge des participants (65 à 79 ans ou 80 ans et plus)2. Les comprimés d’AAS et de placébo étaient blancs, à enrobage entérique, non sécables et d’apparence identique5. Des appels téléphoniques étaient prévus chaque trimestre, et les patients étaient invités à des visites annuelles en personne pour limiter les pertes au suivi et pour encourager le respect de la répartition aléatoire2.
Points évalués : Les auteurs rapportent les résultats du paramètre d’évaluation secondaire de décès, toutes causes confondues, de l’étude ASPREE2. Deux sources indépendantes ont confirmé les décès, soit un membre de la famille, un médecin ou un avis de décès public1. Plusieurs informations ont été compilées avant l’évaluation des causes des décès, tels les rapports d’autopsie, les notes d’évolution et les notes de sortie d’hôpital ainsi que les informations rapportées par la famille1. Deux évaluateurs, à l’aveugle quant à l’affectation des patients aux groupes, ont classé les décès selon la cause sous-jacente, soit cancer, maladie cardiovasculaire, hémorragie majeure, autres et informations insuffisantes. Les désaccords ont été résolus par consensus1.
Résultats : Les investigateurs de l’étude ont recruté les 19 000 patients qui leur étaient nécessaires de répartir aléatoirement pour obtenir une puissance statistique de 90 % pour le paramètre d’évaluation primaire composite (décès toutes causes confondues, démence ou incapacité physique persistante)5. Parmi les 19 114 participants répartis, la majorité provenait d’Australie (87 %). Seuls 2411 participants provenaient des États-Unis (13 %). Au début de l’étude, l’âge médian se situait à 74 ans, et 58 % des patients se trouvaient dans la tranche d’âge de 65 à 74 ans. Les femmes comptaient pour 56 % de l’échantillon4. Il est à noter que, parmi les 9 % de patients issus des minorités ethniques, 80 % provenaient des États-Unis, la plupart étant d’origine hispanique ou afro-américaine4. Les caractéristiques démographiques et les antécédents médicaux des participants étaient similaires entre les deux groupes.
Décès toutes causes confondues
Concernant le paramètre d’évaluation secondaire des décès toutes causes confondues, 1052 décès (5,5 %) sont survenus au cours d’une période médiane de 4,7 ans (558 dans le groupe AAS contre 494 dans le groupe placébo)1. Le taux de mortalité, toutes causes confondues, s’est élevé à 12,7 pour 1000 personnes-année dans le groupe AAS et à 11,1 pour 1000 personnes-année dans le groupe placébo, ce qui donne une différence de 1,6 décès de plus par 1000 personnes-année au sein du groupe AAS (RRI: 1,14; IC 95 %: 1,01–1,29). La cause sous-jacente de décès était dans 49,6 % des cas le cancer (295 dans le groupe AAS contre 227 dans le groupe placébo; RRI: 1,31; IC 95 %: 1,10–1,56), 19,3 % les maladies cardiovasculaires (MCV) (91 dans le groupe AAS contre 112 dans le groupe placébo; RRI: 0,82; IC 95 %: 0,62–1,08) et 5 % les hémorragies majeures (28 dans le groupe AAS contre 25 dans le groupe placébo; RRI: 1,13; IC 95 %: 0,66–1,94). Les autres causes, telles la septicémie, les maladies pulmonaires chroniques, la démence ou l’insuffisance cardiaque comptaient pour 24,9 % des décès (140 dans le groupe AAS contre 122 dans le groupe placébo; RRI: 1,16; IC 95 %: 0,91–1,48). L’information concernant 1,14 % des décès était insuffisante pour permettre de déterminer une cause sous-jacente (4 pour le groupe AAS contre 8 pour le groupe placébo).
Décès liés au cancer
L’étude rapporte que, parmi les décès toutes causes confondues, le cancer était la cause sous-jacente la plus importante avec 49,6 % des décès. Plus précisément, le taux de mortalité attribuable au cancer était de 6,7 pour 1000 personnes-année dans le groupe AAS et de 5,1 pour 1000 personnes-année dans le groupe placébo (RRI: 1,31; IC 95 %: 1,10–1,56). Le cancer colorectal a contribué en majeure partie à cette différence (RRI: 1,77; IC 95 %: 1,02–3,06). Aucune différence statistiquement significative n’a été trouvée pour les autres types de cancer. Selon la courbe d’incidence cumulée de décès liés aux cancers, c’est seulement à partir de la troisième année de l’étude que la différence du nombre de décès entre les deux groupes s’est manifestée. Il en a été autrement des courbes de décès liés à d’autres causes majeures (cardiovasculaire, hémorragie majeure et autres causes), qui se sont révélées similaires entre les deux groupes de traitement à l’étude. Les décès liés au cancer, dans le groupe expérimental, ont été remarqués chez les sujets qui avaient des antécédents de cancer à leur entrée dans l’étude (94 dans le groupe AAS contre 88 dans le groupe placébo) ainsi que parmi ceux dont le cancer avait été diagnostiqué pour la première fois suite à la répartition aléatoire (198 dans le groupe AAS contre 138 dans le groupe placébo).
Analyses de sous-groupes
Parmi les analyses de sous-groupes, il faut noter que l’effet de l’AAS sur les décès, toutes causes confondues, se limite de façon statistiquement significative à la population australienne (RRI: 1,21; IC 95 %: 1,06–1,37). Quant à la population américaine, aucune différence statistiquement significative n’a été observée (RRI: 0,79; IC 95 %: 0,57–1,11). Les autres analyses de sous-groupes n’ont révélé aucune différence en fonction du sexe, de l’âge, du groupe ethnique, du diabète, de l’hypertension artérielle, de la dyslipidémie, de l’indice de masse corporelle, du statut tabagique, de la prise régulière d’AAS, de la fragilité et des antécédents personnels de cancer. Les statistiques n’avaient pas été ajustées pour permettre les comparaisons multiples de toutes les analyses, ce qui restreint l’interprétation du lien de causalité des paramètres secondaires.
Comparaison de la mortalité de la population générale et de la population à l’étude
À titre de référence, le taux de mortalité, toutes causes confondues, de la cohorte simulant la population générale appariée à la population à l’étude (selon l’âge, le sexe, le pays d’origine ainsi que le groupe ethnique) était de 34,9 comparativement à 11,1 par 1000 personnes-année dans la population étudiée. Concernant le taux de mortalité lié au cancer, il était respectivement de 10,5 contre 5,1 par 1000 personnes-année.