Karine Côté1, Florence Correal1, Marie-Élaine Metras2, Pharm.D., M.Sc., Mihaela Friciu3, B.Pharm., M.Sc., Jean-Marc Forest2, B.Pharm., DPH, M.Sc., Grégoire Leclair4, B.Pharm., Ph.D.
Reçu le 17 mai 2019: Accepté après révision par les pairs le 26 juin 2019
Résumé
Objectif : Déterminer la compatibilité physique de divers mélanges de médicaments, en particulier la dexmédétomidine, le lévosimendan et la kétamine, administrés en Y aux soins intensifs pédiatriques.
Méthode : Des échantillons, ainsi qu’une réplique de chacun d’eux, ont été produits avec les médicaments testés à leur concentration maximale et en proportions égales. Un examen visuel a eu lieu au temps initial, puis après 15 minutes, une heure et quatre heures. En l’absence de précipités visibles, l’échantillon était soumis au compteur de particules au temps initial et après quatre heures. Les combinaisons devaient réussir l’examen visuel et le décompte de particules pour être qualifiées de compatibles. Le nombre de particules acceptable repose sur la norme USP <788> 1.B, norme qui s’applique aux solutions parentérales ou injectables, dont le volume est inférieur à 100 mL, ce qui est le cas dans la présente étude.
Résultats : Des 23 combinaisons incluant la dexmédétomidine, seule celle avec la micafungine s’est montrée incompatible. Parmi les 41 mélanges incluant la kétamine, 21 ont été jugés incompatibles alors que ceux effectués avec le lévosimendan se sont tous révélés compatibles. Pour ce qui est des 21 mélanges réalisés avec divers médicaments, neuf d’entre eux ont été classés incompatibles et un mélange, soit la combinaison d’imipénem-cilastatine et de céfoxitine, n’a pas pu être analysé par le compteur de particules vu son opacité dès le départ.
Conclusion : Des 92 combinaisons testées, 28 ont été classées physiquement incompatibles. Le compteur de particules s’est révélé utile pour valider les conclusions tirées de l’examen visuel.
Mots clés : Administration en Y, compatibilité, dexmédétomidine, kétamine, lévosimendan
Abstract
Objective : To determine the physical compatibility of various combinations of drugs, in particular, dexmedetomidine, levosimendan and ketamine, administered via a Y-site connector in pediatric intensive care.
Method : Samples, and copies of each of them, were produced with the tested drugs at their maximum concentration and in equal proportions. A visual inspection was performed at baseline and then after 15 minutes, 1 hour and 4 hours. If there were no visible precipitates, the sample was run through a particle counter at baseline and after 4 hours. The combinations had to pass the visual inspection and the particle count in order to be deemed compatible. The acceptable particle count was based on USP standard <788>, Test 1.B, which applies to parenteral or injectable solutions with a volume of less than 100 mL, which was the case in this study.
Results : Of the 23 combinations including dexmedetomidine, only the one containing micafungin was found to be incompatible. Of the 41 combinations including ketamine, 21 were found to be incompatible, while all those with levosimendan were found to be compatible. As for the 21 combinations made with various drugs, nine were deemed incompatible and one, the combination of imipenem-cilastatin and cefoxitin, could not be analyzed by the particle counter because of its opacity from the outset.
Conclusion : Of the 92 combinations tested, 28 were deemed physically incompatible. The particle counter was useful for confirming the conclusions drawn from the visual inspection.
Keywords : Compatibility, dexmedetomidine, ketamine, levosimendan, Y administration
Dans un contexte de soins intensifs, divers médicaments doivent être administrés par voie intraveineuse. Selon les accès veineux disponibles, le recours à l’administration en Y de divers médicaments peut s’avérer nécessaire. Toutefois, certaines données manquent sur la compatibilité de certains médicaments lorsqu’ils sont administrés simultanément en Y1. Afin d’assurer la sécurité des soins prodigués au patient, il est donc nécessaire d’évaluer leur compatibilité physique. Dans le cadre du présent projet, la compatibilité de plusieurs combinaisons de médicaments s’est confirmée, principalement celle du chlorhydrate de dexmédétomidine, du chlorhydrate de kétamine et du lévosimendan, médicaments sur lesquels peu de données de compatibilité sont disponibles dans la littérature scientifique1,2. La compatibilité physique de 92 mélanges a été évaluée à l’aide d’un examen visuel et d’un passage au compteur de particules.
Cette étude de compatibilité concernant des produits intraveineux portait principalement sur trois médicaments courants aux soins intensifs pédiatriques du Centre hospitalier universitaire (CHU) Sainte-Justine et fait suite à des demandes de l’équipe des pharmaciens oeuvrant dans cette unité de soins. L’étude fut réalisée en deux temps soit au mois d’octobre 2017 et au mois de février 2018. Tous les médicaments provenaient du département de pharmacie du CHU Sainte-Justine.
Les trois principaux médicaments utilisés pour effectuer les tests sont le chlorhydrate de dexmédétomidine à 100 μg/mL en fioles de 2 mL (Hospira; Lots 71-317-DK et 75-375-DK; Expiration 01-11-2018 et 01-03-2019), le chlorhydrate de kétamine à 50 mg/mL en fioles de 10 mL (Sandoz; Lots HC6514, HE0302, GZ9275 et HH1157; Expiration 04-2020, 05-2020, 03-2020 et 07-2020) et le lévosimendan à 2,5 mg/mL en fioles de 5 mL (Orion Pharma; Lot 1605380; Expiration 31-03-2017). Ce dernier médicament seulement était expiré depuis quelques mois au moment de l’étude mais sa rareté incita son utilisation dans ce contexte. Les mélanges ont tous été réalisés à la demande des pharmaciens des soins intensifs.
Parmi les médicaments testés, ceux nécessitant une reconstitution ont été dissous à l’aide d’eau stérile pour injection USP, selon les recommandations en vigueur au CHU Sainte-Justine afin d’obtenir les concentrations indiquées dans les tableaux I à IV. Les médicaments n’ont pas subi de dilution subséquente afin qu’ils soient testés à leur concentration maximale. L’eau stérile utilisée pour effectuer les reconstitutions était testée au compteur de particules en début de journée afin d’assurer sa qualité et de confirmer le bon fonctionnement du compteur de particules. Des aiguilles stériles 20G × 1 ont été utilisées pour prélever les médicaments en proportions égales dans une seringue stérile de 30 mL en polypropylène. Le prélèvement des médicaments dispensés en ampoules de verre a été fait à l’aide d’une aiguille stérile 20G × 1-1/2 dotée d’un filtre de 5 μm afin d’éviter l’introduction de particules de verre pouvant fausser les résultats des différents tests.
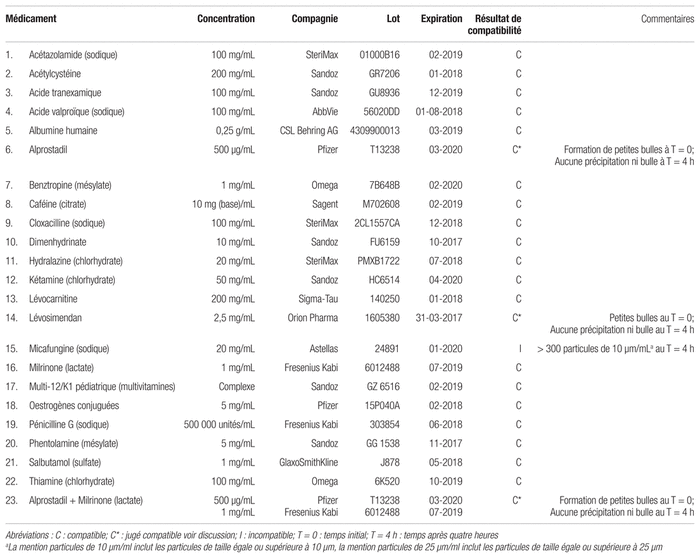
Tableau I Résultats de compatibilité de divers médicaments avec le chlorhydrate de dexmédétomidine à 100 μg/mL pour une administration en Y (selon la norme USP <788> 1.B)
Tableau II Résultats de compatibilité de divers médicaments avec le chlorhydrate de kétamine à 50 mg/mL pour une administration en Y (selon la norme USP <788> 1.B)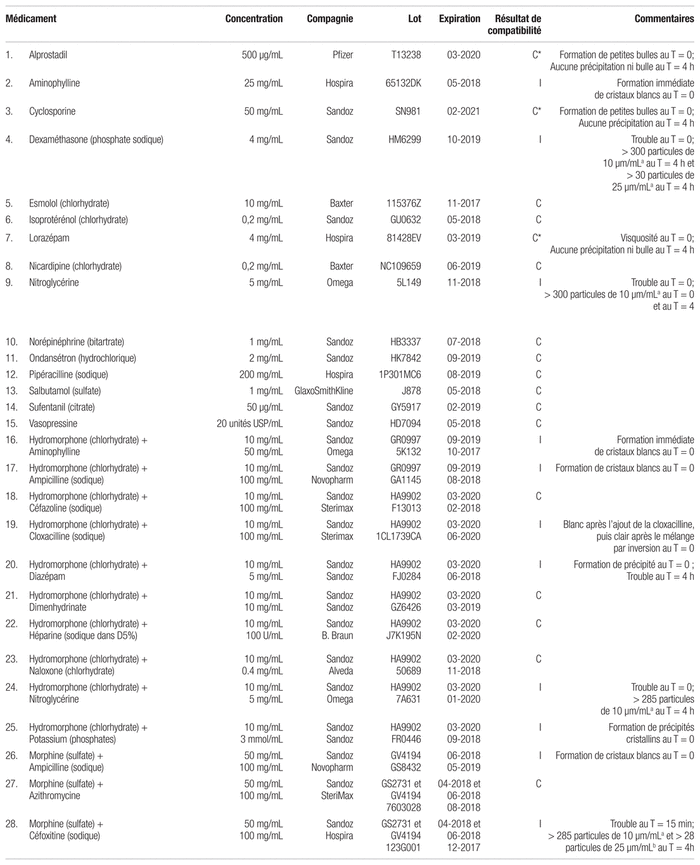
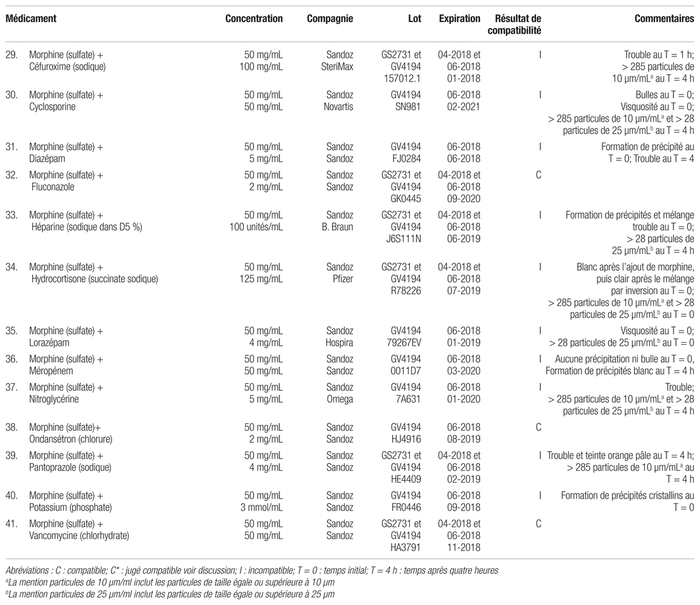
Tableau III Résultats de compatibilité de divers médicaments avec le lévosimendan à 2,5 mg/mL pour une administration en Y (selon la norme USP <788> 1.B)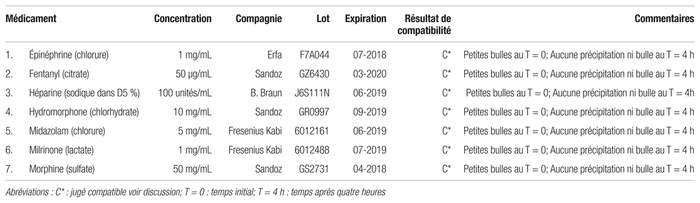
Tableau IV Résultats de compatibilité de divers mélanges de médicaments pour administration en Y (selon la norme USP <788> 1.B)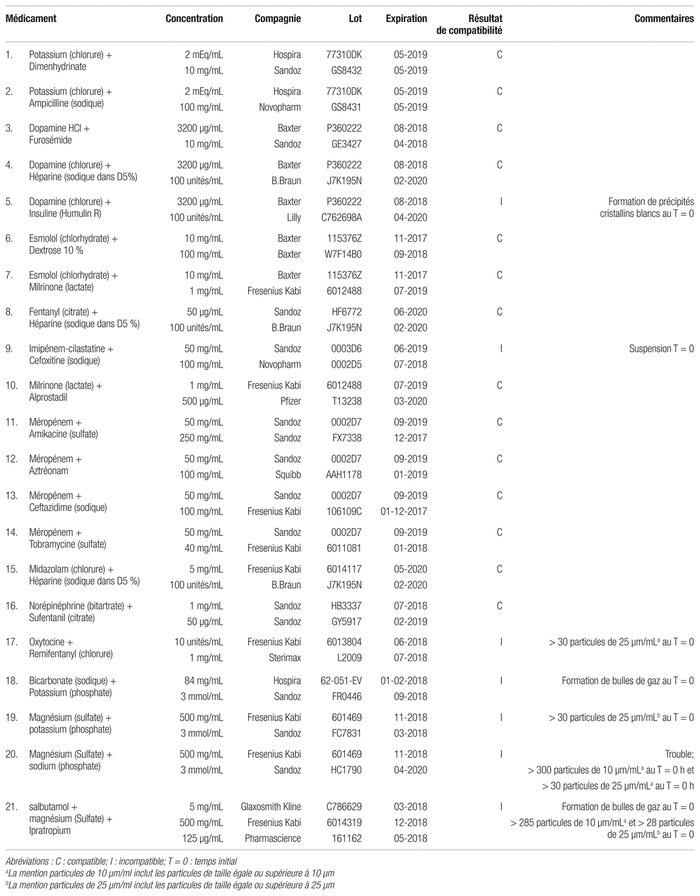
Les divers mélanges de médicaments listés dans les tableaux I à IV ont été effectués par un prélèvement en proportions égales des composés ciblés de sorte à totaliser un volume de 20 ou 21 mL. Dans le cas d’un mélange de deux médicaments, on prélevait 10 mL de chacun pour un total de 20 mL, alors qu’on prélevait 7 mL de chacun des mélanges de trois médicaments pour totaliser 21 mL. Tel que mentionné, les médicaments ont été testés à leur concentration maximale, puisqu’il est peu probable, mais pas impossible, qu’ils soient incompatibles physiquement à des concentrations inférieures1. Une fois le tout mélangé par inversion, un examen visuel à l’oeil nu sur fond blanc puis noir était effectué au temps initial, puis après 15 minutes, une heure et quatre heures. Les mélanges étaient aussi soumis au compteur de particules au temps initial et après quatre heures, d’où la nécessité de réaliser une réplique de chaque mélange, la première copie servant aux tests au temps initial et la seconde, quatre heures plus tard. Ces tests visuels et de dénombrement des particules permettaient de déceler des signes laissant supposer une incompatibilité physique. Les échantillons qui précipitaient n’étaient pas soumis au compteur de particules. L’attente de quatre heures avant de soumettre le second échantillon au compteur de particules permettait de simuler le temps de contact des médicaments au sein du cathéter lors d’une administration de médicaments en Y et à faible débit. On observe généralement une durée maximale de contact d’environ trois heures. Par conséquent le délai de quatre heures servait à garantir une sécurité1. Le type de simulation d’administration en Y dans la présente étude s’apparente à ce que font plusieurs autres études de compatibilité2,3. Les manipulations ont été effectuées à la température ambiante ainsi que sous une lumière fluorescente et naturelle. Les manipulations conduisant l’échantillon au compteur de particules ont été effectuées sous hotte à flux laminaire avec filtre HEPA afin de réduire le risque d’introduction de particules dans les mélanges lors des manipulations. L’appareil utilisé pour effectuer le dénombrement de particules des divers mélanges est le LS-20 Liquid Particule Counter (Lighthouse Worlwide Solutions, Medford, OR, USA). Il a permis l’analyse des résultats selon la norme USP <788> 1.B4. L’appareil procède au comptage des particules au moyen de l’intensité lumineuse d’un laser passant à travers l’échantillon. Le logiciel relié au compteur de particules associe ensuite l’intensité lumineuse à un nombre de particules de taille définie selon une courbe de calibration. Selon les recommandations du fabricant, le compteur de particules a été programmé par le personnel pour qu’il prélève 4 mL du mélange, qui étaient rejetés, puis pour qu’il analyse trois échantillons de 5 mL5. Cela permettait d’obtenir trois échantillons identiques dont les particules étaient dénombrées séquentiellement au moment fixé, ce qui simplifiait les manipulations. La quantité résiduelle du mélange, soit un ou deux mL, était jetée. Elle évitait l’entrée de bulles d’air dans le compteur de particules lors de la succion de la solution, ce qui aurait eu pour effet de fausser les résultats.
Les tests de compatibilité physique comportaient l’examen visuel de l’échantillon. Ce dernier était jugé incompatible lors de l’examen visuel lorsqu’il présentait un précipité, des bulles de gaz persistantes ou encore un changement de couleur, de turbidité ou de viscosité. Les mélanges n’ayant pas précipité ont été soumis au compteur de particules afin que les investigateurs puissent évaluer avec précision le nombre et la taille des particules présentes qui auraient échappé à l’examen visuel. Ceux dont le précipité était visuellement observable ont toutefois été à nouveau examinés optiquement seulement aux temps ultérieurs afin d’observer leur évolution dans le temps. Afin d’être considérés comme compatibles lors du dénombrement de particules, les mélanges devaient respecter la norme USP <788> 1.B s’appliquant aux solutions ayant un volume inférieur à 100 mL. Cette norme mentionne que les solutions pour perfusion parentérale ou injectables d’un volume inférieur à 100 mL sont considérées comme conformes à condition que le nombre moyen de particules contenues dans l’échantillon total ne dépasse pas 6000 particules égales ou supérieures à 10 μm et n’excède pas 600 particules de taille égale ou supérieure à 25 μm4. Dans le cas présent, cela signifie donc que l’échantillon ne devait pas contenir plus de respectivement 300 ou 285 particules/mL égales ou supérieures à 10 μm et 30 ou 28 particules/mL égales ou supérieures à 25 μm.
Vingt-deux (22) des 23 combinaisons de chlorhydrate de dexmédétomidine mélangé aux autres médicaments se sont révélées compatibles lors de la simulation d’une administration en Y (voir tableau I). Seul le mélange de micafungine sodique et de chlorhydrate de dexmédétomidine, bien qu’il ait été visuellement compatible, contenait 322,2 particules/mL égales ou supérieures à 10 μm après un délai de quatre heures. Les autres mélanges comprenant du chlorhydrate de dexmédétomidine n’ont pas démontré de signes d’incompatibilité tant à l’examen visuel que lors du dénombrement de particules.
Pour ce qui est des 41 mélanges comportant du chlorhydrate de kétamine, 20 d’entre eux ont été qualifiés de compatibles (voir tableau II). Les 21 mélanges jugés incompatibles ont tous échoué à l’examen visuel, soit en précipitant, en devenant troubles ou très visqueux. Certaines incompatibilités ont été observées au temps initial alors que d’autres seulement après le délai de quatre heures. C’est le passage de l’échantillon au compteur de particules qui a confirmé les incompatibilités sans précipitation cristalline. Parmi celles-ci on trouve la cyclosporine, médicament ayant une grande viscosité et formant de petites bulles à la suite de son prélèvement. Une fois l’échantillon analysé au compteur de particules, la cyclosporine a été jugée compatible avec le chlorhydrate de kétamine.
L’évaluation visuelle de huit mélanges comportant du lévosimendan a déterminé leur compatibilité (voir tableau I et III). Le lévosimendan formait de petites bulles après son prélèvement, même lorsqu’il était seul dans la seringue. La présence de petites bulles, qui diminuait avec le temps, n’a donc pas été considérée comme une incompatibilité à l’examen visuel, mais plutôt comme un artéfact causé par la viscosité de cette préparation. De plus, le compteur de particules a confirmé la compatibilité de tous les mélanges après un contact de quatre heures.
En ce qui a trait aux 21 autres combinaisons diverses de médicaments demandées par les pharmaciens de l’équipe des soins intensifs, quatorze d’entre elles ont réussi le test visuel et le dénombrement de particules, alors que six se sont révélées incompatibles (voir tableau IV). Aucun résultat de la combinaison de l’imipénem-cilastatin sodique avec le céfoxitine sodique n’a pu être tiré, l’imipénem-cilastatin sodique étant trop opaque pour être lu par le compteur de particules.
Cette étude de compatibilité démontre beaucoup de convergence, mais aussi certaines divergences entre ses résultats et ceux mentionnés dans la littérature scientifique. Dans la présente étude, certaines combinaisons de médicaments formaient de petites bulles observables au temps initial, puis leur nombre diminuait avec le temps, de sorte qu’après une attente de quatre heures, il n’y avait plus aucune bulle. Ces petites bulles, présentes surtout au temps initial, ont pu causer un biais lors du dénombrement de particules, ce qui a peut-être entraîné une surestimation du nombre initial de particules. C’est le cas notamment de deux mélanges comportant le lévosimendan, soit celui avec le lactate de milrinone et avec le sulfate de morphine, qui excédaient légèrement la limite supérieure définie par la norme USP <788> 1.B pour les particules égales ou supérieures à 25 μm au temps initial. Aucun autre changement de ces mélanges n’a été remarqué visuellement, et lorsqu’ils ont été soumis au compteur de particules, ils respectaient la norme USP <788> 1.B4. Ils ont donc été jugés comme étant compatibles vu la nature du produit, la compatibilité ayant aussi été confirmée par le compteur de particules après un délai de quatre heures.
La combinaison du chlorhydrate de kétamine avec la cyclosporine s’est révélée compatible au décompte de particules selon le ratio de 1:1. La cyclosporine est un médicament présentant une grande viscosité. Un bain à ultrasons pour éliminer les plus petites bulles a été tenté, mais il n’a pas réussi à les éliminer. Une dilution plus importante de la cyclosporine serait nécessaire pour permettre un décompte de particules qui ne soit pas influencé par la viscosité du médicament.
Il est à noter que la date de péremption du lévosimendan utilisé pour réaliser les tests de compatibilité était dépassée depuis environ sept mois. De plus, le produit n’avait pas été conservé au réfrigérateur, comme le recommande la monographie et il avait pris une couleur orange. Le lévosimendan est habituellement de couleur jaune pâle, bien qu’une teinte orangée puisse être normale selon la monographie6. En raison de la difficulté de se procurer le lévosimendan, puisqu’il n’est disponible que par le Programme d’accès spécial de Santé Canada, les investigateurs ont convenu qu’il était acceptable d’utiliser du lévosimendan périmé pour effectuer les tests. L’impact du dépassement de la date de péremption du lévosimendan sur les observations et les résultats des tests de compatibilité est inconnu. Le fabricant mentionne que le produit a toutefois pu se dégrader du fait qu’il était périmé, bien que les produits potentiels de dégradation soient indéterminés7. Il aurait été intéressant d’analyser le produit pour déterminer ces facteurs de dégradation, mais la quantité limitée de lévosimendan disponible et les ressources nécessaires pour le faire ont rendu impossible ce complément de recherche. Il est donc possible que la concentration du lévosimendan utilisé pour effectuer les tests ait été inférieure à 2,5 mg/mL. On peut logiquement penser que l’utilisation de ce produit périmé pour les différents tests est raisonnable et réaliste dans le sens où la compatibilité d’un produit qui a dépassé la date de péremption ne devrait pas être meilleure que celle d’un produit dont la date n’est pas échue, sauf si la concentration de l’agent est si faible que l’interaction avec son environnement en solution n’est plus significative.
Certains résultats obtenus dans le cadre de la présente étude sont différents de ceux mentionnés dans la littérature scientifique. La présente étude a déterminé la compatibilité de certains produits, alors que la littérature indique leur incompatibilité. C’est le cas notamment du mélange de lactate de milrinone avec le chlorhydrate d’esmolol, ainsi que de l’association du chlorhydrate de kétamine et du sulfate de morphine mélangée à l’azithromycine, au fluconazole et au chlorhydrate de vancomycine8,9. En revanche, certaines associations jugées incompatibles dans la présente étude sont présentées comme compatibles dans la littérature. Ce sont les mélanges de chlorhydrate de kétamine, de sulfate de morphine et d’héparine sodique dans du dextrose à 5 %, qui ont été jugés incompatibles dans cette étude, ainsi que l’association de dexaméthasone et de chlorhydrate de kétamine9. Il faut toutefois noter que le phosphate de dexaméthasone sodique utilisé dans la littérature était bien plus dilué (71 mcg/mL) que la concentration utilisée dans la présente étude (4 mg/mL)10.
D’autres résultats ont permis de clarifier des compatibilités incertaines mentionnées dans la littérature. La compatibilité de la combinaison du sulfate de salbutamol et du chlorhydrate de kétamine a été qualifiée d’incertaine dans la littérature, alors que dans la présente étude, cette combinaison s’est révélée compatible11. La littérature qualifie aussi d’incertaine la compatibilité de l’association de chlorhydrate de kétamine, de chlorhydrate d’hydromorphone et d’ampicilline sodique, alors que la présente étude la juge incompatible à la suite des tests9.
Ces résultats divergents peuvent provenir, entre autres d’un fabricant de médicament différent et donc de concentrations et d’excipients différents, comme les tampons, de la présence ou de l’absence d’agent de conservation, de la température à laquelle les tests ont été réalisés, des véhicules de dilution ou encore de l’ordre dans lequel se font les ajouts ainsi que des compagnies ayant participé à la fabrication du produit ou encore de différences dans les tests, certaines données de la littérature reposant sur des tests strictement visuels12.
La combinaison d’hydrocortisone succinate sodique avec le chlorhydrate de kétamine mélangé au sulfate de morphine a été qualifiée d’incompatible en raison d’un nombre de particules de 10 μm et de 25 μm par mL supérieur à la limite établie au temps initial. Le mélange, devenu blanc au temps initial puis redevenu clair en quelques secondes, n’a présenté aucun autre signe d’incompatibilité à l’examen visuel et lors des différents temps d’observation. De plus, l’échantillon soumis au compteur de particules après un délai d’attente de quatre heures respectait les limites fixées pour le dénombrement de particules. Il serait donc intéressant de suivre l’évolution du décompte de particules dans le temps pour déterminer après combien de temps la combinaison de médicaments serait jugée compatible selon les critères de la présente étude. Le mélange du trio de chlorhydrate de kétamine, de chlorhydrate d’hydromorphone et de cloxacilline est lui aussi devenu immédiatement blanc à l’ajout de la cloxacilline sodique pour ensuite perdre cette couleur à la suite de l’augmentation du volume jusqu’à un ratio de 1:1:1 des trois médicaments. Le mélange n’a présenté aucun autre signe d’incompatibilité visuel et malgré qu’il respecte la norme USP <788> 1.B au décompte de particules, il a été classé comme incompatible en raison d’un doute qui subsiste. Une analyse chimique serait nécessaire pour confirmer l’efficacité et la sécurité clinique de ce mélange.
La présente étude démontre l’utilité du compteur de particules pour la réalisation des tests de compatibilité servant à confirmer des résultats qui étaient difficiles à établir par l’analyse visuelle ou qui étaient imperceptibles à l’oeil. Par exemple, il a été difficile d’évaluer visuellement le mélange de chlorhydrate de kétamine, de sulfate de morphine et de nitroglycérine, qui semblait quelque peu trouble au temps initial. Le décompte de particules a permis de confirmer l’incompatibilité physique de la combinaison qui présentait un compte de 426,8 particules/mL de 10 μm et de 52,1 particules/mL de 25 μm après un délai de quatre heures. Le mélange de rémifentanyl hydrochlorique et d’oxytocine, pour sa part, semblait visuellement compatible, mais avait un décompte de particules de 38,1 particules/mL de 25 μm au temps initial, ce qui le rend incompatible selon les critères de la présente étude.
Parmi les 92 combinaisons de médicaments évaluées, dont celles comportant du chlorhydrate de dexmédétomidine, du lévosimendan et du chlorhydrate de kétamine, 28 se sont révélées incompatibles lorsque le ratio du mélange était 1:1. Le compteur de particules s’est montré essentiel pour évaluer les échantillons de manière objective et juste lorsque l’examen visuel était normal ou incertain. Les tests de compatibilité réalisés dans le cadre du présent projet portent uniquement sur la compatibilité physique. La compatibilité chimique et pharmacodynamique ne peut donc pas être garantie avec les moyens utilisés dans cette étude.
Aucun financement en relation avec le présent article n’a été déclaré par les auteurs. La totalité des médicaments étudiés provenait du département de pharmacie du CHU Sainte-Justine.
Tous les auteurs ont rempli et soumis le formulaire de l’ICMJE pour la divulgation de conflits d’intérêts potentiels. Les auteurs n’ont déclaré aucun conflit d’intérêts en relation avec le présent article.
1. Trissel LA. Trissel’s tables of physical compatibility. 1ère éd. Lake Forest: Multimatrix;1996. 590 p.
2. Sullivan T, Forest JM, Leclair G. Compatibility of cloxacillin sodium with selected intravenous drugs during simulated Y-site administration. Hosp Pharm 2015;50:214–20.

3. Audet MA, Forest E, Friciu M, Forest JM, Leclair G. Compatibilité du citrate de caféine injectable avec plusieurs autres médicaments. Pharmactuel 2017;50:27–33.
4. <788> Particulate matter in injections. In: United States Pharmacopeia. USP 36. Rockville, MD; United States Pharmacopeia; 2012. p. 350–3.
5. Manuel d’instruction de l’appareil du LS-20 Liquid Particle Counter (Lighthouse Worldwide Solutions, Medford, OR); 2008. 52 p.
6. Orion Pharma. Monographie de produit : Simdax. [en ligne] https://www.simdax.com/contentas-sets/abbb7f8455ae4db2921e29456193200d/simdax-monograph-2018_final-1--low-resolution-page-wise.pdf (site visité le 26 juin 2019).
7. Rytilä P. Communication écrite personnelle par courriel. Orion Pharma, novembre 2017.
8. Trissel LA. Milrinone lactate compatibility with selected parenteral medications. Compatibility data: 2007. 9: TriPharma.
9. Pelletier É, Forest JM, Hildgen P. Compatibilité des mélanges de morphine et de kétamine ou d’hydromorphone et de kétamine injectables lors de leur administration en dérivé avec d’autres médicaments usuels. Pharmactuel 2007;40(suppl. 2):23–7.
10. Watson DG, Lin M, Morton A, MacArthur DA. Compatibility and stability of dexamethasone sodium phosphate and ketamine hydrochloride subcutaneous infusions in polypropylene syringes. J Pain Symptom Manage 2005;30:80–6.
11. Pelletier É, Forest JM, Hildgen P. Compatibilité de la kétamine injectable lors de l’administration de dérivés avec d’autres médicaments usuels. Pharmactuel 2006;39:71–5.
12. American Society of Health-System Pharmacist. Handbook on injectable drugs. 18e ed. Bethesda: American Society of Health-System Pharmacist; 2015. 1254 p.
PHARMACTUEL, Vol. 52, No. 4, 2019