Van Anh Sylvie Tran1,2*, Pharm.D., Lindsay Hoffman1,3*, B.Sc, Pharm.D., Yu Shan Zhang1,4*, Pharm.D., Lydjie Tremblay5,6, B.Pharm., M.Sc.
2Résidente en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux de l’Est-de-l’Île-de-Montréal, Hôpital Maisonneuve-Rosemont, Montréal (Québec) Canada;
3Résidente en pharmacie au moment de la rédaction, Centre intégré universitaire de santé et de services sociaux du Centre-Ouest-de-l’Île-de-Montréal, Hôpital général juif, Montréal (Québec) Canada;
4Résidente en pharmacie au moment de la rédaction, Centre universitaire de santé McGill, Montréal (Québec) Canada;
5Professeure agrégée de clinique, Faculté de pharmacie, Université de Montréal, Montréal (Québec) Canada;
6Pharmacienne, Centre hospitalier universitaire de Montréal, Montréal (Québec) Canada
Reçu le 13 mai 2019: Accepté après révision par les pairs le 20 septembre 2019
Titre de l’article : Pantoprazole in patients at risk for gastrointestinal bleelding in the ICU. N Engl J Med 2018;379:2199-2081.
Auteurs : Krag M, Marker S, Perner A, Wetterslev J, Wise MP, Schefold JC et coll.
Commanditaires : Cette étude a été financée par Innovation Fund Denmark, qui n’a participé ni au protocole de recherche, ni à l’analyse des résultats, ni à la conduite de l’étude. L’étude n’a pas reçu de soutien financier commercial.
Cadre de l’étude : L’ulcère de stress est une lésion gastrique pouvant se développer en contexte de stress physiologique chez les patients aux soins intensifs (SI)2. En 2002, l’incidence de signes endoscopiques de dommages à la muqueuse est élevée chez ces patients (75 à 100 %), mais la prévalence de saignements gastro-intestinaux (GI) cliniquement significatifs associés à cette complication est beaucoup plus basse2,3. Une étude d’envergure publiée par Cook et coll. en 1994 a montré une incidence de saignements GI cliniquement significatifs de 1,5 %4. Plus récemment, en 2015, Krag et coll. ont montré une prévalence de 2,6 % de saignements GI cliniquement significatifs dans une population de patients admis aux SI5.
Les patients des SI sont exposés à un risque de développer des saignements GI cliniquement significatifs secondaires à l’ulcère de stress. Ces saignements peuvent se produire à la suite d’une dysfonction des mécanismes de défense et d’une ischémie de la muqueuse gastrique secondaires à un stress physiologique3. Un saignement GI cliniquement significatif se décrit comme un saignement manifeste, compliqué par des changements hémodynamiques (hypotension, tachycardie ou chute de l’hémoglobine de plus de 20 g/L) ou par le besoin de transfusions4,6. Ces complications pèsent lourdement sur la morbidité du patient. Une étude effectuée auprès de 1666 patients ventilés mécaniquement pendant au moins 48 heures a montré que la survenue d’un saignement GI cliniquement significatif prolongeait la durée de séjour aux SI de huit jours et augmentait le risque de mortalité de quatre fois par rapport aux patients n’ayant pas présenté de saignement7.
L’étude prospective multicentrique d’envergure de Cook et coll., effectuée en 1994, a déterminé deux facteurs de risque importants et indépendants: l’insuffisance respiratoire et la coagulopathie4. Parmi les patients ayant présenté un facteur de risque ou les deux, 3,7 % ont subi un saignement GI cliniquement significatif comparativement à 0,1 % parmi ceux n’ayant aucun de ces facteurs de risque4. Toutefois, il est à noter que dans l’étude de Cook et coll., l’usage d’une prophylaxie de l’ulcère de stress n’était recommandée que chez les patients ayant subi un trauma crânien, les grands brûlés et les transplantés. Depuis 1999, les lignes directrices de l’American Society of Hospital Pharmacists recommandent une prophylaxie de l’ulcère de stress pour les patients qui nécessitent une ventilation mécanique pendant plus de 48 heures et pour ceux ayant une coagulopathie8. De plus petites études ont déterminé d’autres facteurs de risque, tels que l’insuffisance hépatique, l’insuffisance rénale, les traumas crâniens et multiples, les dommages à la moelle épinière et les brûlures sur plus de 35 % de la surface corporelle8.
Selon une méta-analyse de 2019, la prophylaxie de l’ulcère de stress diminue de 37 % les saignements cliniquement significatifs9. Cependant, l’avantage sur la mortalité n’a pas été prouvé, ce qui remet en question l’usage des inhibiteurs de la pompe à protons (IPP) utilisés habituellement pour les patients des SI9. La supériorité des IPP par rapport aux antagonistes des récepteurs H2 (anti-H2) ou par rapport au placébo n’a pas été démontrée9. Une étude prospective à répartition aléatoire effectuée en chassé-croisé en grappe, Proton pump inhibitors versus histamine-2 receptor blockers for ulcer prophylaxis therapy in the intensive care unit (PEPTIC), est en cours et compare l’efficacité des IPP et des anti-H2 pour la prophylaxie de l’ulcère de stress. Elle aidera à déterminer la supériorité de l’un ou de l’autre de ces agents10.
La méta-analyse de Alhazzani et coll. publiée en 2018 a remis en question l’innocuité des IPP après avoir observé une augmentation possible du taux de pneumonies secondaires à la prophylaxie de l’ulcère de stress11. Les liens indirects établis entre les études de cette méta-analyse en réseau ont mené à des conclusions basées sur des résultats de qualité modérée11. Ensuite, en 2019, Reynolds et coll. ont publié une méta-analyse standard qui réévaluait la pertinence de la prophylaxie de l’ulcère de stress pour les patients des SI12. L’analyse de 34 études à répartition aléatoire contrôlées a démontré une réduction significative de tous les types des saignements12. Aucune réduction de la mortalité n’a pu être démontrée et, contrairement aux résultats d’Alhazzani et coll., il n’y avait pas d’augmentation d’événements infectieux12. Notons que les différences de définition clinique de la pneumonie dans les études incluses dans ces deux méta-analyses a possiblement diminué la qualité des résultats présentés et leur signification clinique. Le manque d’études de bonne qualité méthodologique laisse planer un doute sur le risque d’iatrogénisme lié à la prophylaxie de l’ulcère de stress.
L’étude Pantoprazole in patients at risk for gastrointestinal bleeding in the ICU (SUP-ICU) portait sur l’évaluation de la pertinence de la prophylaxie des saignements digestifs avec le pantoprazole par rapport à un placébo et l’impact des IPP sur la mortalité, un point déterminant pour la pratique.
Protocole de recherche : Il s’agit d’un essai clinique à répartition aléatoire contrôlé à double insu en groupes parallèles portant sur les patients admis aux SI et exposés à un risque élevé de saignements GI. Cette étude multicentrique a été menée au Danemark, en Finlande, aux Pays-Bas, en Norvège, en Suisse et au Royaume-Uni. Des analyses en intention de traiter (ITT) et per protocole ont été effectuées. Pour permettre à l’étude d’atteindre une puissance de 90 % avec une valeur alpha de 5 %, on a estimé que 3350 sujets étaient requis pour détecter une différence de 20 % du risque relatif de décès à 90 jours. Ceci correspond à une réduction de 5 % de la mortalité en différence absolue, fondée sur la supposition qu’elle serait de 25 % dans le groupe placébo.
Patients : Les critères d’inclusion pour effectuer la sélection des participants à l’étude étaient les suivants: âge d’au moins 18 ans, admission aux SI pour une condition aiguë et au moins un facteur de risque cliniquement significatif pour les saignements GI (choc, utilisation d’anticoagulants, thérapie de remplacement rénal, ventilation mécanique [durée prévue d’au moins 24 heures], antécédent de maladie hépatique et coagulopathie).
Les principaux critères d’exclusion étaient : une contre-indication aux IPP, un traitement quotidien avec un IPP ou un anti-H2, un saignement actif d’origine GI haute ou basse durant l’hospitalisation, un ulcère peptique confirmé par endoscopie ou par une autre méthode durant l’hospitalisation, une transplantation d’organe pendant l’hospitalisation, un arrêt des traitements actifs, une grossesse ou un consentement qui n’a pas été obtenu.
Interventions : Les sujets ont été répartis de façon aléatoire dans un ratio 1:1 avec des blocs permutés de tailles variables pour recevoir le pantoprazole ou le placébo. La répartition aléatoire a été stratifiée selon les sites et selon la présence de cancer hématologique actif. Les sujets ont reçu une dose intraveineuse de pantoprazole à 40 mg ou un placébo une fois par jour pendant l’hospitalisation jusqu’au départ des SI ou au décès.
Points évalués : L’objectif primaire de l’étude consistait à évaluer la mortalité à 90 jours après la répartition aléatoire. Pour ce faire, les investigateurs prenaient directement contact avec les sujets ou consultaient les registres régionaux ou nationaux. Les objectifs secondaires comprenaient un ensemble de variables composites d’événements cliniquement importants, définis par des saignements GI cliniquement significatifs, une nouvelle pneumonie, une infection à Clostridium difficile ou une ischémie cardiaque. Les pneumonies étaient définies par la présence d’infiltrat, de consolidation ou de cavitation décelée par deux radiographies thoraciques (ou une radiographie si le patient n’était pas atteint de maladie pulmonaire ou cardiaque) ainsi qu’à l’aide de l’un des signes suivants: fièvre sans autre cause possible ou une leucopénie ou leucocytose et au moins deux des signes ou symptômes suivants: augmentation des sécrétions respiratoires, apparition ou aggravation de la toux, dyspnée ou tachypnée, râles, bruits bronchiques ou détérioration des échanges gazeux. Les infections à Clostridium difficile étaient définies par la prise d’un antibiotique (vancomycine orale, métronidazole orale ou intraveineuse ou fidaxomicine orale) pour une suspicion de Clostridium difficile ou une infection prouvée à cette bactérie. Les autres objectifs secondaires impliquent chaque élément du composite considéré séparément. Les saignements GI cliniquement significatifs ont été définis par des saignements GI évidents accompagnés d’au moins une des caractéristiques suivantes survenues dans les 24 heures après le saignement sans preuve de l’existence d’une autre cause: une diminution spontanée de la pression artérielle (systolique, moyenne, ou diastolique) d’au moins 20 mmHg, le début d’un traitement avec un vasopresseur ou une augmentation d’au moins 20 % de la dose de vasopresseur, une diminution de l’hémoglobine d’au moins 20 g/L ou la transfusion de deux ou de plusieurs unités de globules rouges.
Résultats : Les caractéristiques des sujets à l’étude sont rapportées au tableau I. Une différence statistiquement significative a été observée entre les deux groupes pour la prévalence des maladies pulmonaires chroniques et des coagulopathies qui étaient plus élevées dans le groupe pantoprazole et la prévalence de chirurgie d’urgence qui était plus élevée dans le groupe placébo. L’étude comprenait 3298 sujets, dont 1645 recevant le traitement de pantoprazole et 1653 le placébo. Lors du suivi à 90 jours, 99,5 % des participants faisaient encore partie de l’étude. La durée médiane du séjour aux SI était de six jours et les groupes ont reçu le traitement qui leur avait été prescrit pendant une durée médiane de quatre jours. La fréquence de la nutrition entérale rapportée au premier jour dans le groupe pantoprazole et celui du placébo était respectivement de 58,2 % et 56,4 %.
Tableau I Caractéristiques de base des patientsᵃ
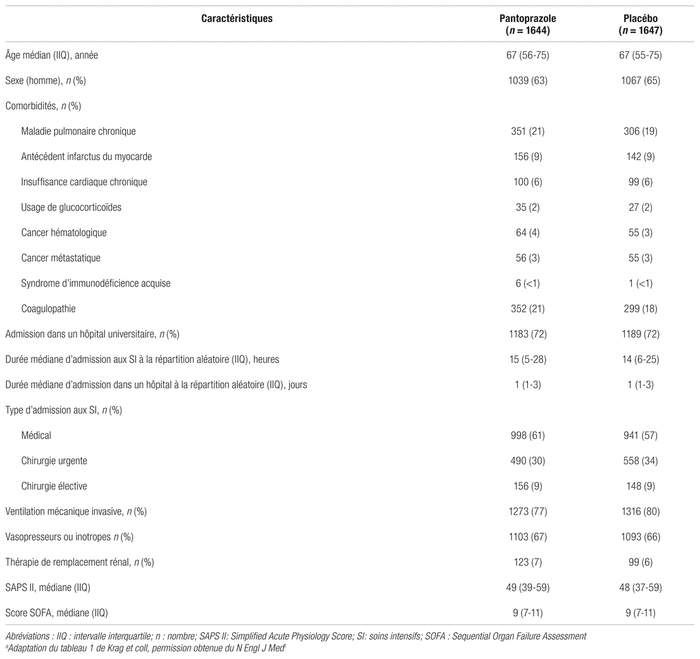
Aucune différence statistiquement significative relative à la mortalité à 90 jours n’est apparue entre le groupe traitement (31,1 %) et le groupe placébo (30,4 %) (risque relatif [RR]:1,02; intervalle de confiance à 95 % [IC 95 %] 0,91–1,13, p = 0,76), comme le montre le tableau II. Dans les analyses de sous-groupe, aucune hétérogénéité n’a été décelée quant à l’effet sur la mortalité à 90 jours parmi les sujets avec ou sans pathologie hépatique, coagulopathie, choc, avec ventilation mécanique ou selon les raisons d’admission aux SI. Or un taux de mortalité plus important a été observé parmi les sujets du groupe pantoprazole ayant un Simplified Acute Physiology Score II (SAPS II) plus élevé (supérieur à 53) comparativement à ceux ayant un score faible (inférieur ou égal à 53) (RR: 1,13; IC 95 %: 0,99–1,30).
Tableau II Mesure des résultats primaires et secondairesᵃ
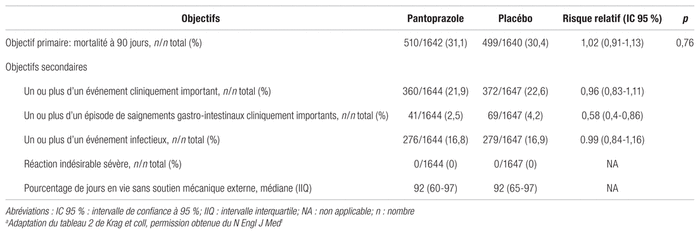
Concernant les objectifs secondaires, le nombre total d’événements cliniquement importants aux SI était de 360 sur 1644 (21,9 %) dans le groupe pantoprazole et de 372 sur 1647 (22,6 %) dans le groupe placébo (RR: 0,96; IC 95 %: 0,83–1,11), comme l’illustre le tableau II. L’incidence de saignements GI importants du groupe pantoprazole était significativement plus faible (2,5 %) que celle du groupe placébo (4,2 %) (RR: 0,58; IC 95 %: 0,40–0,86) avec un nombre nécessaire à traiter (NNT) de 59. Les autres objectifs secondaires ont démontré des résultats similaires entre les deux groupes. La survenue d’infections majeures, telles que les pneumonies et les infections à Clostridium difficile, n’était pas significativement plus élevée comparativement au groupe placébo (RR: 0,99; IC 95 %: 0,84–1,16). Il n’y avait pas de valeurs p calculées en absence d’ajustement de comparaisons multiples.
